两种以上抗-c5抗体的组合与使用方法
1.本技术是申请日为2016年1月22日、发明名称为“两种以上抗-c5抗体的组合与使用方法”的中国专利申请no.201680016079.4的分案申请。
技术领域
2.本发明涉及两种以上抗-c5抗体的组合及使用其的方法。
背景技术:
3.补体系统在免疫复合物的清除和对传染物,外源抗原,病毒感染的细胞和肿瘤细胞的免疫应答中起关键作用。存在约25-30种补体蛋白,其被发现是血浆蛋白和膜辅因子的复合物集合。补体组分通过在一系列复杂的酶切和膜结合事件中相互作用而实现其免疫防御功能。所产生的补体级联导致产生具有调理素、免疫调节和溶菌功能的产物。
4.目前,被广泛接受的是,补体系统可以通过三种不同的途径被激活:经典途径,凝集素途径和旁路途径。这些途径共有许多组分,并且虽然其初始步骤有不同,但其会聚并共有相同的负责激活和摧毁靶细胞的末端补体组分(c5至c9)。
5.经典途径通常通过形成抗原-抗体复合物而被激活。独立地,凝集素途径激活的第一步是特定凝集素如甘露聚糖-结合凝集素(mbl)、h-ficolin、m-ficolin、l-ficolin和c-型凝集素cl-11的结合。相反,旁路途径自发进行低水平的回转激活,这可以容易地在外源或其他异常表面(细菌,酵母,病毒感染的细胞,或损伤的组织)上被放大。这些途径会聚于一点,在该点处补体组分c3被活性蛋白酶切割从而产生c3a和c3b。
6.c3a是一种过敏毒素。c3b结合细菌和其他细胞,以及某些病毒和免疫复合物,并且将其标记用于从循环中除去(已知为调理素的作用)。c3b还与其他组分形成复合物从而形成c5转化酶,该酶将c5切割成c5a和c5b。
7.c5是在正常血清中以约80μg/ml(0.4μm)存在的190kda的蛋白。c5中的约1.5-3%的归于碳水化合物的质量被糖基化。成熟的c5是二硫键连接的115kdaα链和75kdaβ链的异源二聚体。c5被合成为1676个氨基酸的单链前体蛋白(pro-c5前体)(见,例如,ptl1和ptl2)。pro-c5前体被切割从而产生作为氨基端片段的β链和作为羧基端片段的α链。α链和β链多肽片段经由二硫键彼此连接并且构成成熟的c5蛋白。
8.成熟的c5在补体途径的激活期间被切割成c5a和c5b片段。c5a被c5转化酶自c5的α链切割,其是作为包含α链的前74个氨基酸的氨基端片段。成熟的c5的剩余部分是片段c5b,其含有经二硫键连接的剩余的α链和β链。c5a的11kda分子量中的约20%归于碳水化合物。
9.c5a是另一种过敏毒素。c5b与c6、c7、c8和c9组合而在靶细胞表面处形成膜攻击复合物(mac,c5b-9,最终补体复合物(terminal complement complex,tcc))。当足够数量的mac插入靶细胞膜中时,形成mac小孔从而介导靶细胞的快速渗透性溶胞作用。
10.如以上提及的,c3a和c5a是过敏毒素。其可以触发肥大细胞脱粒,这释放组胺和其他炎症介质,导致平滑肌收缩,血管透性增加,白细胞激活,及其他炎性现象,包括导致细胞过多的细胞增殖。c5a还充当趋化肽,其用于吸引粒细胞如嗜中性粒细胞、嗜曙红细胞、嗜碱
性粒细胞和单核细胞至补体激活位点。
11.c5a的活性由血浆酶羧肽酶n调节,所述酶自c5a除去羧基端精氨酸,从而形成c5a-des-arg衍生物。c5a-des-arg显示仅为未修饰的c5a的1%的过敏性活性和多形核趋化活性。
12.功能正常的补体系统提供有力的针对感染微生物的防御,而补体的不适当的调节或激活牵涉多种病症的发病,所述病症包括,例如,类风湿性关节炎(rheumatoid arthritis,ra);狼疮性肾炎(lupus nephritis);缺血再灌注损伤(ischemia-reperfusion injury);阵发性夜间血红蛋白尿(paroxysmal nocturnal hemoglobinuria,pnh);非典型溶血性尿毒症综合征(atypical hemolytic uremic syndrome,ahus);致密沉积物病(dense deposit disease,ddd);黄斑变性(例如,年龄相关性黄斑变性(age-related macular degeneration,amd));溶血(hemolysis),肝酶升高(elevated liver enzymes),和低血小板(hellp)综合征;血栓性血小板减少性紫癜(thrombotic thrombocytopenic purpura,ttp);自发性流产(spontaneous fetal loss);微量免疫脉管炎(pauci-immune vasculitis);大疱性表皮松解(epidermolysis bullosa);再发性流产(recurrent fetal loss);多发性硬化(multiple sclerosis,ms);外伤性脑损伤(traumatic brain injury);和由心肌梗死(myocardial infarction)、心肺分流术(cardiopulmonary bypass)和血液透析(hemodialysis)导致的损伤(见,例如,npl1)。因此,抑制过度的或不受控的补体级联激活可以为患有所述病症的患者提供临床益处。
13.阵发性夜间血红蛋白尿(paroxysmal nocturnal hemoglobinuria,pnh)是一种不常见的血液疾病,其中红血球受损并且因此比正常红血球更快地被破坏。pnh是由于具有位于x染色体上的pig-a(磷脂酰肌醇聚糖a型)基因的体突变的造血干细胞的克隆扩增所致。pig-a的突变导致糖基磷脂酰肌醇(gpi)合成的早期阻断,该分子是许多蛋白锚定到细胞表面所需要的。因此,pnh血细胞缺少gpi-锚定的蛋白,所述蛋白包括补体-调节蛋白cd55和cd59。在正常条件下,这些补体-调节蛋白阻断细胞表面上mac的形成,由此阻止红血球溶胞。在pnh中,不存在这些蛋白导致补体-介导的溶血。
14.pnh被表征为溶血性贫血(红血球数量减少),血红蛋白尿(尿中存在血红蛋白,睡眠后尤其明显),和血红蛋白血症(在血流中存在血红蛋白)。已知受pnh所扰的个体具有突然发作(paroxysms),其在此处被定义为深色尿的发生。溶血性贫血是由于通过补体组分的红血球的血管内破坏所致。其他已知的症状包括言语障碍症,疲劳,勃起功能障碍,血栓形成和复发性腹痛。
15.依库珠单抗(eculizumab)是针对补体蛋白c5的人源化单克隆抗体,并且是第一种被批准用于治疗阵发性夜间血红蛋白尿(pnh)和非典型溶血性尿毒症综合征(ahus)的疗法(见,例如,npl2)。依库珠单抗抑制c5转化酶将c5切割成c5a和c5b,这防止产生最终的补体复合物c5b-9。c5a和c5b-9都导致表征为pnh和ahus的晚期补体介导的事件(也见,ptl3,ptl4,ptl5和ptl6)。
16.若干报道已经描述了抗-c5抗体。例如,ptl7描述了结合c5的α链但是不结合c5a并且阻断c5的活化的抗-c5抗体,而ptl8描述了抑制c5a形成的抗-c5单克隆抗体。另一方面,ptl9描述了识别c5的α链上的c5转化酶的蛋白水解位点并抑制c5向c5a和c5b转化的抗-c5抗体。ptl10描述了亲和力常数为至少1x10
7 m-1
的抗-c5抗体。
17.抗体(igg)结合新生儿fc受体(fcrn),并且具有长的血浆保留时间。仅在酸性条件(例如,ph 6.0)下观察到igg与fcrn的结合,但是在中性条件(例如,ph 7.4)下几乎观察不到。典型地,igg经由胞吞作用非特异性地进入到细胞中,并且通过在酸性条件下结合内体中的内体fcrn而回到细胞表面。然后,在血浆中在中性条件下igg与fcrn解离。没有结合fcrn的igg在溶酶体中被分解。当通过向igg的fc区中引入突变来消除酸性条件下其fcrn结合能力时,igg不从内体再循环到血浆中,这导致igg的血浆保留的显著损害。为了提高igg的血浆保留,增强其在酸性条件下的fcrn结合的方法已被报道。所述方法在下文还称为“fcrn-介导的再循环机制”。当通过向igg的fc区引入氨基酸置换来提高其在酸性条件下的fcrn结合时,igg更有效地从内体再循环到血浆,并且由此显示提高的血浆保留。同时,还报道了,在中性条件下具有增强的fcrn结合的igg在血浆中在中性条件下不与fcrn解离,甚至是在其经由其在内体中在酸性条件下与fcrn结合而返回细胞表面时,并且之后其血浆保留保持不变,或者相反地变差(见,例如,npl3;npl4;npl5)。
18.最近,以ph依赖性方式结合抗原的抗体已被报道(见,例如,ptl11和ptl12)。这些抗体在血浆中性条件下强烈地结合抗原并且在内体酸性条件下与抗原解离。在与抗原解离后,所述抗体在经由fcrn再循环至血浆时变得能够再次结合抗原。因此,单个抗体分子可以重复地结合多个抗原分子。通常,抗原的血浆保留比具有上述fcrn介导的再循环机制的抗体的血浆保留短得多。因此,当抗原与抗体结合时,抗原通常显示延长的血浆保留,从而导致抗原血浆浓度的增加。另一方面,已经报道了,与典型的抗体相比,上述以ph依赖性方式结合抗原的抗体更快速地将抗原从血浆中消除,因为其在fcrn介导的再循环过程期间在内体内与抗原解离。另外,ptl13公开了,与典型抗体相比,当可能促进以ph依赖性方式结合抗原并且形成包含两个以上的抗体的免疫复合物的抗体时,能够促进抗原从血浆的消除。在ptl13中,提议在这样的复合物中包含两个以上fc区可以允许所述复合物通过抗体与具有抗体亲抗原性的fc受体结合而结合在细胞中并且导致抗原从血浆增加的消除。ptl14还记载了计算机建模分析,所述分析显示具有针对c5的ph依赖性结合的抗体可以延长抗原敲减(knockdown)。
19.引用列表
20.专利文献
21.[ptl1]美国专利号6,355,245
[0022]
[ptl2]美国专利号7,432,356
[0023]
[ptl3]wo 2005/074607
[0024]
[ptl4]wo 2007/106585
[0025]
[ptl5]wo 2008/069889
[0026]
[ptl6]wo 2010/054403
[0027]
[ptl7]wo 95/29697
[0028]
[ptl8]wo 02/30985
[0029]
[ptl9]wo 2004/007553
[0030]
[ptl10]wo 2010/015608
[0031]
[ptl11]wo 2009/125825
[0032]
[ptl12]wo 2011/122011
[0033]
[ptl13]wo 2013/081143
[0034]
[ptl14]wo2011/111007
[0035]
非专利文献
[0036]
[npl1]holers等人.(2008)immunological reviews 223:300-316
[0037]
[npl2]dmytrijuk等人(2008)the oncologist 13(9):993-1000
[0038]
[npl3]yeung等人(2009)j immunol 182(12):7663-7671
[0039]
[npl4]datta-mannan等人(2007)j biol chem 282(3):1709-1717
[0040]
[npl5]dall'acqua等人(2002)j immunol 169(9):5171-5180
[0041]
发明概述
[0042]
技术问题
[0043]
本发明的目的是提供两种以上抗-c5抗体的组合与使用其的方法。
[0044]
问题的解决方案
[0045]
本发明提供两种以上抗-c5抗体的组合与使用其的方法。
[0046]
在一些实施方案中,在本发明的两种以上分离的或纯化的抗-c5抗体的组合中包含的分离的或纯化的抗-c5抗体结合c5的β链(seq id no:1)或α链(seq id no:10)内的表位。在一些实施方案中,在本发明的两种以上分离的或纯化的抗-c5抗体的组合中包含的分离的或纯化的抗-c5抗体结合c5的β链的mg1(seq id no:2)、mg2(seq id no:3)、mg3(seq id no:4)、mg4(seq id no:5)、mg5(seq id no:6)、mg6(seq id no:7)、mg1-mg2(seq id no:8)或mg3-mg6(seq id no:9)结构域内或c5的α链的过敏毒素结构域(seq id no:11)或c5-c345c/ntr结构域(seq id no:12)内的表位。在一些实施方案中,在本发明的两种以上分离的或纯化的抗-c5抗体的组合中包含的分离的或纯化的抗-c5抗体结合在由c5的β链(seq id no:1)的氨基酸33-124组成的片段内或由α链(seq id no:10)的氨基酸1-999组成的片段内的表位。在其他实施方案中,与在酸性ph下相比,抗体在中性ph下以更高的亲和力结合c5。在其他实施方案中,与在较低的钙浓度下相比,抗体在更高的钙浓度下以更高的亲和力结合c5。在另一个实施方案中,在本发明的两种以上分离的或纯化的抗-c5抗体的组合中包含的分离的或纯化的抗-c5抗体与表2所述的任一种参比抗体结合相同的表位。在另一个实施方案中,在本发明的两种以上分离的或纯化的抗-c5抗体的组合中包含的分离的或纯化的抗-c5抗体与表2所述的任一种参比抗体竞争结合c5。本发明所述的分离的或纯化的抗-c5抗体可以调节、抑制、阻断或中和c5的生物学功能。在一些实施方案中,包含在本发明的两种以上分离的或纯化的抗-c5抗体的组合中的分离的或纯化的抗-c5抗体是单克隆抗体,所述分离的或纯化的抗-c5抗体结合选自[i]至[iii]中任一项的表位:[i]c5的β链(seq id no:1)或α链(seq id no:10),[ii]c5的β链的mg1(seq id no:2),mg2(seq id no:3),mg3(seq id no:4),mg4(seq id no:5),mg5(seq id no:6),mg6(seq id no:7),mg1-mg2(seq id no:8)或mg3-mg6(seq id no:9)结构域,或c5的α链的过敏毒素结构域(seq id no:11)或c5-c345c/ntr结构域(seq id no:12),或[iii]由c5的β链(seq id no:1)的氨基酸33-124组成的片段或由α链(seq id no:10)的氨基酸1-999组成的片段。在一些实施方案中,包含在本发明的两种以上分离的或纯化的抗-c5抗体的组合中的分离的或纯化的抗-c5抗体是人抗体、人源化抗体或嵌合抗体,所述分离的或纯化的抗-c5抗体结合选自[i]至[iii]中任一项的表位:[i]c5的β链(seq id no:1)或α链(seq id no:10),[ii]c5的β链的
mg1(seq id no:2),mg2(seq id no:3),mg3(seq id no:4),mg4(seq id no:5),mg5(seq id no:6),mg6(seq id no:7),mg1-mg2(seq id no:8)或mg3-mg6(seq id no:9)结构域,或c5的α链的过敏毒素结构域(seq id no:11)或c5-c345c/ntr结构域(seq id no:12),或[iii]由c5的β链(seq id no:1)的氨基酸33-124组成的片段或由α链(seq id no:10)的氨基酸1-999组成的片段。在一些实施方案中,包含在本发明的两种以上分离的或纯化的抗-c5抗体的组合中的分离的或纯化的抗-c5抗体是全长igg1或igg4抗体,所述分离的或纯化的抗-c5抗体结合选自[i]至[iii]中任一项的表位:[i]c5的β链(seq id no:1)或α链(seq id no:10),[ii]c5的β链的mg1(seq id no:2),mg2(seq id no:3),mg3(seq id no:4),mg4(seq id no:5),mg5(seq id no:6),mg6(seq id no:7),mg1-mg2(seq id no:8)或mg3-mg6(seq id no:9)结构域,或c5的α链的过敏毒素结构域(seq id no:11)或c5-c345c/ntr结构域(seq id no:12),或[iii]由c5的β链(seq id no:1)的氨基酸33-124组成的片段或由α链(seq id no:10)的氨基酸1-999组成的片段。
[0047]
在一些实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是结合c5的β链(seq id no:1)或α链(seq id no:10)内至少两个彼此不同的表位的分离的或纯化的多特异性抗体,其中所述分离的或纯化的多特异性抗体的结合位点不彼此竞争结合所述表位。在一些实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是结合c5的β链的mg1(seq id no:2),mg2(seq id no:3),mg3(seq id no:4),mg4(seq id no:5),mg5(seq id no:6),mg6(seq id no:7),mg1-mg2(seq id no:8)或mg3-mg6(seq id no:9)结构域内或c5的α链的过敏毒素结构域(seq id no:11)或c5-c345c/ntr结构域(seq id no:12)内的至少两个表位的分离的或纯化的多特异性抗体,其中所述分离的或纯化的多特异性抗体的结合位点不彼此竞争结合所述表位。在一些实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是结合在由c5的β链(seq id no:1)的氨基酸33-124组成的片段或由α链(seq id no:10)的氨基酸1-999组成的片段内的至少两个表位的分离的或纯化的多特异性抗体,其中所述分离的或纯化的多特异性抗体的结合位点不彼此竞争结合所述表位。在其他实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是结合在c5内的至少两个表位的分离的或纯化的多特异性抗体,其中,与在酸性ph下相比,所述分离的或纯化的多特异性抗体的一个或多个结合位点在中性ph下以更高的亲和力结合c5,并且其中所述分离的或纯化的多特异性抗体的结合位点不彼此竞争结合所述表位。在其他实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是结合在c5内的至少两个表位的分离的或纯化的多特异性抗体,其中,与在较低钙浓度下相比,所述分离的或纯化的多特异性抗体的一个或多个结合位点在较高钙浓度下以更高的亲和力结合c5,并且其中所述分离的或纯化的多特异性抗体的结合位点不彼此竞争结合所述表位。在另一个实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是结合由表2所述的参比抗体所结合的至少两个表位的分离的或纯化的多特异性抗体,其中所述分离的或纯化的多特异性抗体的结合位点不彼此竞争结合所述表位。在另一个实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是与表2所述的至少两种参比抗体竞争结合c5的分离的或纯化的多特异性抗体,其中所述分离的或纯化的多特异性抗体的结合位点不彼此竞争结合所述表位。本发明所述的分离的或纯化的多特异性抗体的一个或多个结合位点可以调节、抑制、阻断或中和c5的生物学功能。在一些实施方案中,本发明的
分离的或纯化的抗-c5多特异性抗体是单克隆抗体,所述分离的或纯化的抗-c5多特异性抗体结合至少两个选自[i]至[iii]中任一项的表位:[i]c5的β链(seq id no:1)或α链(seq id no:10),[ii]c5的β链的mg1(seq id no:2),mg2(seq id no:3),mg3(seq id no:4),mg4(seq id no:5),mg5(seq id no:6),mg6(seq id no:7),mg1-mg2(seq id no:8)或mg3-mg6(seq id no:9)结构域,或c5的α链的过敏毒素结构域(seq id no:11)或c5-c345c/ntr结构域(seq id no:12),或[iii]由c5的β链(seq id no:1)的氨基酸33-124组成的片段或由α链(seq id no:10)的氨基酸1-999组成的片段,其中所述分离的或纯化的多特异性抗体的结合位点不彼此竞争结合所述表位。在一些实施方案中,本发明的分离的或纯化的多特异性抗-c5抗体是人抗体、人源化抗体或嵌合抗体,所述分离的或纯化的多特异性抗-c5抗体结合至少两个选自[i]至[iii]中任一项的表位:[i]c5的β链(seq id no:1)或α链(seq id no:10),[ii]c5的β链的mg1(seq id no:2),mg2(seq id no:3),mg3(seq id no:4),mg4(seq id no:5),mg5(seq id no:6),mg6(seq id no:7),mg1-mg2(seq id no:8)或mg3-mg6(seq id no:9)结构域,或c5的α链的过敏毒素结构域(seq id no:11)或c5-c345c/ntr结构域(seq id no:12),或[iii]由c5的β链(seq id no:1)的氨基酸33-124组成的片段或由α链(seq id no:10)的氨基酸1-999组成的片段,其中所述分离的或纯化的多特异性抗体的结合位点不彼此竞争结合所述表位。在一些实施方案中,本发明的分离的或纯化的抗-c5多特异性抗体是全长igg1或igg4抗体,所述分离的或纯化的抗-c5多特异性抗体结合至少两个选自[i]至[iii]中任一项的表位:[i]c5的β链(seq id no:1)或α链(seq id no:10),[ii]c5的β链的mg1(seq id no:2),mg2(seq id no:3),mg3(seq id no:4),mg4(seq id no:5),mg5(seq id no:6),mg6(seq id no:7),mg1-mg2(seq id no:8)或mg3-mg6(seq id no:9)结构域,或c5的α链的过敏毒素结构域(seq id no:11)或c5-c345c/ntr结构域(seq id no:12),或[iii]由c5的β链(seq id no:1)的氨基酸33-124组成的片段或由α链(seq id no:10)的氨基酸1-999组成的片段,其中所述分离的或纯化的多特异性抗体的结合位点不彼此竞争结合所述表位。
[0048]
在一些实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是两种以上分离的或纯化的抗-c5抗体的组合,其中一种本发明的分离或纯化的抗体结合c5的β链(seq id no:1)或α链(seq id no:10)内的表位,并且其中要组合的所述分离的或纯化的抗-c5抗体不彼此竞争结合所述表位。在一些实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是两种以上分离的或纯化的抗-c5抗体的组合,其中一种分离的或纯化的抗体结合c5的β链的mg1(seq id no:2),mg2(seq id no:3),mg3(seq id no:4),mg4(seq id no:5),mg5(seq id no:6),mg6(seq id no:7),mg1-mg2(seq id no:8)或mg3-mg6(seq id no:9)结构域或c5的α链的过敏毒素结构域(seq id no:11)或c5-c345c/ntr结构域(seq id no:12)内的表位,并且其中要组合的所述分离的或纯化的抗-c5抗体不彼此竞争结合所述表位。在一些实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是两种以上分离的或纯化的抗-c5抗体的组合,其中一种分离的或纯化的抗体结合在由c5的β链(seq id no:1)的氨基酸33-124组成的片段或由α链(seq id no:10)的氨基酸1-999组成的片段内的表位,并且其中要组合的所述分离的或纯化的抗-c5抗体不彼此竞争结合所述表位。在一些实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是两种以上分离的或纯化的抗-c5抗体的组合,其中一种分离的或纯化的抗体结合
在由c5的β链(seq id no:1)的氨基酸33-124组成的片段或由α链(seq id no:10)的氨基酸1-999组成的片段内的表位,并且其中要组合的所述分离的或纯化的抗-c5抗体不彼此竞争结合所述表位。在一些实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是两种以上结合c5的β链(seq id no:1)或α链(seq id no:10)内的表位的分离的或纯化的抗-c5抗体的组合,并且其中要组合的所述分离的或纯化的抗-c5抗体不彼此竞争结合所述表位。在一些实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是两种以上这样的分离的或纯化的抗-c5抗体的组合,所述抗体结合在c5的β链的mg1(seq id no:2),mg2(seq id no:3),mg3(seq id no:4),mg4(seq id no:5),mg5(seq id no:6),mg6(seq id no:7),mg1-mg2(seq id no:8)或mg3-mg6(seq id no:9)结构域或c5的α链的过敏毒素结构域(seq id no:11)或c5-c345c/ntr结构域(seq id no:12)内的表位,并且其中要组合的所述分离的或纯化的抗-c5抗体不彼此竞争结合所述表位。在一些实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是两种以上这样的分离的或纯化的抗-c5抗体的组合,所述抗体结合在由c5的β链(seq id no:1)的氨基酸33-124组成的片段或由α链(seq id no:10)的氨基酸1-999组成的片段内的表位,并且其中要组合的所述分离的或纯化的抗-c5抗体不彼此竞争结合所述表位。在其他实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以包含一种或多种这样的要组合的分离的或纯化的抗-c5抗体,所述抗体在中性ph下与c5结合的亲和力高于在酸性ph下的亲和力,其中要组合的分离的或纯化的抗-c5抗体不彼此竞争结合所述表位。在其他实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以包含一种或多种这样的要组合的分离的或纯化的抗-c5抗体,所述抗体在较高钙浓度下与c5结合的亲和力高于在较低钙浓度下的亲和力,其中要组合的分离的或纯化的抗-c5抗体不彼此竞争结合所述表位。在另一个实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是两种以上分离的或纯化的抗-c5抗体的组合,其中要组合的一种或多种抗体结合由表2所述的参比抗体所结合的表位,其中要组合的分离的或纯化的抗-c5抗体不彼此竞争结合所述表位。在另一个实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是两种以上这样的分离的或纯化的抗-c5抗体的组合,所述抗体结合两个以上由表2所述的参比抗体所结合的表位,其中要组合的分离的或纯化的抗-c5抗体不彼此竞争结合所述表位。在另一个实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是两种以上分离的或纯化的抗体的组合,其中要组合的一种或多种抗体与表2所述的参比抗体竞争结合c5,其中要组合的分离的或纯化的抗-c5抗体不彼此竞争结合所述表位。在另一个实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是两种以上这样的分离的或纯化的抗体的组合,所述抗体与至少两种表2所述的参比抗体竞争结合c5,其中要组合的分离的或纯化的抗-c5抗体不彼此竞争结合所述表位。包含在本发明所述的至少两个分离的或纯化的抗体的组合中的一种或多种所述分离的或纯化的抗-c5抗体中可以调节、抑制、阻断或中和c5的生物学功能。
[0049]
在一些实施方案中,包含在本发明的组合中的分离的或纯化的抗体中的一种或多种是单克隆抗体,其中要组合的所述分离的或纯化的抗-c5抗体不彼此竞争结合所述表位,并且其中所述表位中的一种或多种选自[i]至[iii]中任一项:[i]c5的β链(seq id no:1)或α链(seq id no:10),[ii]c5的β链的mg1(seq id no:2),mg2(seq id no:3),mg3(seq id no:4),mg4(seq id no:5),mg5(seq id no:6),mg6(seq id no:7),mg1-mg2(seq id no:8)
或mg3-mg6(seq id no:9)结构域,或c5的α链的过敏毒素结构域(seq id no:11)或c5-c345c/ntr结构域(seq id no:12),或[iii]由c5的β链(seq id no:1)的氨基酸33-124组成的片段或由α链(seq id no:10)的氨基酸1-999组成的片段。在一些实施方案中,包含在本发明的组合中的分离的或纯化的抗体中的一种或多种是人抗体、人源化抗体或嵌合抗体,其中要组合的所述分离的或纯化的抗-c5抗体不彼此竞争结合所述表位,并且其中所述表位中的一种或多种选自[i]至[iii]中任一项:[i]c5的β链(seq id no:1)或α链(seq id no:10),[ii]c5的β链的mg1(seq id no:2),mg2(seq id no:3),mg3(seq id no:4),mg4(seq id no:5),mg5(seq id no:6),mg6(seq id no:7),mg1-mg2(seq id no:8)或mg3-mg6(seq id no:9)结构域,或c5的α链的过敏毒素结构域(seq id no:11)或c5-c345c/ntr结构域(seq id no:12),或[iii]由c5的β链(seq id no:1)的氨基酸33-124组成的片段或由α链(seq id no:10)的氨基酸1-999组成的片段。在一些实施方案中,包含在本发明的组合中的分离的或纯化的抗体是全长igg1或igg4抗体,其中要组合的所述分离的或纯化的抗-c5抗体不彼此竞争结合所述表位,并且其中所述表位中的一种或多种选自[i]至[iii]中任一项:[i]c5的β链(seq id no:1)或α链(seq id no:10),[ii]c5的β链的mg1(seq id no:2),mg2(seq id no:3),mg3(seq id no:4),mg4(seq id no:5),mg5(seq id no:6),mg6(seq id no:7),mg1-mg2(seq id no:8)或mg3-mg6(seq id no:9)结构域,或c5的α链的过敏毒素结构域(seq id no:11)或c5-c345c/ntr结构域(seq id no:12),或[iii]由c5的β链(seq id no:1)的氨基酸33-124组成的片段或由α链(seq id no:10)的氨基酸1-999组成的片段。在其他实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是至少两种这样的分离的或纯化的抗-c5抗体的组合,所述分离的或纯化的抗-c5抗体在中性ph下结合c5的亲和力高于在酸性ph下的亲和力,其中要组合的所述分离的或纯化的抗-c5抗体不彼此竞争结合所述表位。在其他实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以包含一种或多种要组合的这样的分离的或纯化的抗-c5抗体,所述分离的或纯化的抗-c5抗体在较高钙浓度下结合c5的亲和力高于在较低钙离子下的亲和力,其中要组合的所述分离的或纯化的抗-c5抗体不彼此竞争结合所述表位。在另一个实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是两种以上这样的分离的或纯化的抗-c5抗体的组合,所述分离的或纯化的抗-c5抗体结合表2所述的参比抗体所结合的两个以上的表位,其中要组合的所述分离的或纯化的抗-c5抗体不彼此竞争结合所述表位。在另一个实施方案中,本发明的两种以上分离的或纯化的抗-c5抗体的组合可以是两种以上这样的分离的或纯化的抗体的组合,所述分离的或纯化的抗体与至少两个表2所述的参比抗体竞争结合c5,其中要组合的所述分离的或纯化的抗-c5抗体不彼此竞争结合所述表位。包含在本发明的至少两种分离的或纯化的抗体的组合中的一种或多种分离的或纯化的抗-c5抗体可以调节、抑制、阻断或中和c5的生物学功能。
[0050]
本发明还提供包含本发明的两种以上抗-c5抗体的组合和药用载体的药物制剂。
[0051]
本发明的两种以上抗-c5抗体的组合可以用作药物。本发明的两种以上抗-c5抗体的组合可以用于治疗涉及过量或不受控制的c5活化的补体-介导的疾病或病症。本发明的两种以上抗-c5抗体的组合可以用于提高c5从血浆的清除。
[0052]
本发明的两种以上抗-c5抗体的组合可以用于制备药物。在一些实施方案中,所述药物用于治疗涉及过量或不受控制的c5活化的补体-介导的疾病或病症。在一些实施方案
中,所述药物用于提高c5从血浆的清除。
[0053]
本发明还提供治疗患有涉及过量的或不受控制的c5活化的补体-介导的疾病或病症的个体的方法。在一些实施方案中,所述方法包括向所述个体施用有效量的本发明的两种以上抗-c5抗体的组合。本发明还提供提高c5从个体血浆中的清除的方法。在一些实施方案中,所述方法包括向所述个体施用有效量的本发明的两种以上的抗-c5抗体的组合,从而提高c5从血浆的清除。
[0054]
具体地,本发明涉及下述:
[0055]
[1]两种以上分离的或纯化的抗-c5抗体的组合,其中所述分离的或纯化的抗-c5抗体结合c5的β链(seq id no:1)或α链(seq id no:10),并且其中要组合的所述分离的或纯化的抗-c5抗体不彼此竞争结合所述表位。
[0056]
[2]根据[1]所述的组合,其中所述表位选自在c5的β链的mg1(seq id no:2),mg2(seq id no:3),mg3(seq id no:4),mg4(seq id no:5),mg5(seq id no:6),mg6(seq id no:7),mg1-mg2(seq id no:8)或mg3-mg6(seq id no:9)结构域或c5的α链的过敏毒素结构域(seq id no:11)或c5-c345c/ntr结构域(seq id no:12)内的表位。
[0057]
[3]根据[1]或[2]所述的组合,其中所述表位选自由c5的β链(seq id no:1)的氨基酸33-124组成的片段或由α链(seq id no:10)的氨基酸1-999组成的片段内部。
[0058]
[4]根据[1]至[3]中任一项所述的组合,其中,与在酸性ph下相比,所述抗-c5抗体中的一种或多种在中性ph下以更高的亲和力结合c5。
[0059]
[5]根据[1]至[4]中任一项所述的组合,其中所述分离的或纯化的抗-c5抗体中的一种或多种与表2所述的任一种参比抗体结合相同的表位。
[0060]
[6]根据[1]至[5]中任一项所述的组合,其中所述分离的或纯化的抗-c5抗体中的一种或多种与表2所述的任一种参比抗体竞争结合c5。
[0061]
[7]根据[1]至[5]中任一项所述的组合,其中所述分离的或纯化的抗-c5抗体中的一种或多种包含表2所述的任一种参比抗体的6个hvr。
[0062]
[8]根据[1]至[7]中任一项所述的组合,其中所述分离的或纯化的抗-c5抗体中的一种或多种调节、抑制、阻断或中和c5的生物学功能。
[0063]
[9]根据[1]至[8]中任一项所述的组合,其中所述分离的或纯化的抗-c5抗体中的一种或多种是单克隆抗体。
[0064]
[10]根据[1]至[9]中任一项所述的组合,其中所述分离的或纯化的抗-c5抗体中的一种或多种是人抗体、人源化抗体或嵌合抗体。
[0065]
[11]根据[1]至[10]中任一项所述的组合,其中所述分离的或纯化的抗-c5抗体中的一种或多种是全长igg1或igg4抗体。
[0066]
[12]根据[1]至[11]中任一项所述的组合,其中所述分离的或纯化的抗-c5抗体的组合是分离的或纯化的多特异性抗体。
[0067]
[13]一种药物组合物,其包含[1]至[12]中任一项的组合和药用载体。
[0068]
[14][1]至[11]中任一项的组合,其用作药物。
[0069]
[15][1]至[11]中任一项的组合,其用于治疗涉及过量的或不受控制的c5活化的补体-介导的疾病或病症。
[0070]
[16][1]至[11]中任一项的组合,其用于提高c5从血浆的清除。
[0071]
[17][1]至[11]中任一项的组合在制备用于治疗涉及过量的或不受控制的c5活化的补体-介导的疾病或病症的药物中的应用。
[0072]
[18][1]至[11]中任一项的组合在制备用于提高c5从血浆的清除的药物中的应用。
[0073]
[19]治疗患有涉及过量的或不受控制的c5活化的补体-介导的疾病或病症的个体的方法,所述方法包括向所述个体施用有效量的[1]至[11]中任一项的组合。
[0074]
[20]提高c5从个体血浆中清除的方法,所述方法包括向所述个体施用有效量的[1]至[11]中任一项的组合,从而提高c5从血浆的清除。
[0075]
附图简述
[0076]
[图1-1]图1-1显示所选的25种[二十五种]ph依赖性和/或钙依赖性的抗原结合克隆的octet传感图(sensorgrams)。
[0077]
[图1-2]图1-2是图1-1的继续。
[0078]
[图2-1]图2-1显示包含抗-c5双特异性抗体和抗-c5单克隆抗体的免疫复合物之间的mfcrn结合的比较。
[0079]
[图2-2]图2-2是图2-1的继续。
[0080]
[图3a]图3a显示在包含在抗-c5双特异性抗体中的两条轻链之间的hvr的序列比较。残基位置按照kabat编号方式指定。
[0081]
[图3b]图3b是图3a的继续。
[0082]
[图4]图4显示包含亲本或共同轻链的克隆20和18与c5的biacore结合传感图。
[0083]
[图5]图5显示注射抗-c5双特异性抗体后在人fcrn转基因小鼠中总c5的血浆浓度的时间曲线。
[0084]
[图6]图6显示20//18个变体与c5的调整的biacore结合传感图。实线显示在ph 7.4与人c5的缔合和与人c5的解离。虚线显示在ph 7.4与人c5的缔合和在ph 5.8与人c5的解离。
[0085]
[图7]图7显示在注射优化的20//18的fc变体后在食蟹猴中c5的总血浆浓度的时间曲线。
具体实施方案
[0086]
本文中描述或引用的技术和方法是本领域技术人员使用常规方法学通常很好理解并且常规使用的,如,例如,以下中所述的广泛使用的方法:sambrook等人,molecular cloning:a laboratory manual(分子克隆:实验室手册)第3版(2001)cold spring harbor laboratory press,cold spring harbor,n.y.;current protocols in molecular biology(现代分子生物学方法)(f.m.ausubel,等人编,(2003));系列methods in enzymology(酶学方法)(academic press,inc.):pcr 2:a practical approach(pcr 2:实践方法)(m.j.macpherson,b.d.hames和g.r.taylor编(1995)),harlow和lane,编(1988)antibodies,a laboratory manual,and animal cell culture(抗体,实验室手册和动物细胞培养)(r.i.freshney,编(1987));oligonucleotide synthesis(寡核苷酸合成)(m.j.gait,编,1984);methods in molecular biology(分子生物学方法),humana press;cell biology:a laboratory notebook(细胞生物学:实验室笔记)(j.e.cellis,编,1998)
academic press;animal cell culture(动物细胞培养)(r.i.freshney),编,1987);introduction to cell and tissue culture(细胞和组织培养介绍)(j.p.mather和p.e.roberts,1998)plenum press;cell and tissue culture:laboratory procedures(细胞和组织培养:实验室方法)(a.doyle,j.b.griffiths,和d.g.newell,编,1993-8)j.wiley和sons;handbook of experimental immunology(实验免疫性手册)(d.m.weir和c.c.blackwell,编);gene transfer vectors for mammalian cells(用于哺乳动物细胞的基因转移载体)(j.m.miller和m.p.calos,编,1987);pcr:the polymerase chain reaction(pcr:聚合酶链式反应),(mullis等人,编,1994);current protocols in immunology(现代免疫性方法)(j.e.coligan等人,编,1991);short protocols in molecular biology(分子生物学的短流程)(wiley和sons,1999);immunobiology(免疫生物学)(c.a.janeway和p.travers,1997);antibodies(抗体)(p.finch,1997);antibodies:a practical approach(抗体:实践方法)(d.catty.,编,irl press,1988-1989);monoclonal antibodies:apractical approach(单克隆抗体:实践方法)(p.shepherd和c.dean,编,oxford university press,2000);using antibodies:a laboratory manual(使用抗体:实验室手册)(e.harlow和d.lane(cold spring harbor laboratory press,1999);the antibodies(抗体)(m.zanetti和j.d.capra,编,harwood academic publishers,1995);和cancer:principles and practice of oncology(癌症:肿瘤学原理和实践)(v.t.devita等人,编,j.b.lippincott company,1993)。
[0087]
i.定义
[0088]
除非另外限定,本文中使用的技术和科学术语具有与本发明所属技术领域普通技术人员的通常理解相同的含义。singleton等人,dictionary of microbiology and molecular biology(微生物学和分子生物学词典)第2版,j.wiley&sons(new york,n.y.1994),和march,advanced organic chemistry reactions,mechanisms and structure(高等有机化学反应、机理和结构)第4版,john wiley&sons(new york,n.y.1992)给本领域技术人员提供了对本技术中所用众多术语的一般指导。本文中引用的所有文献(包括专利申请和出版物)通过引用完整地结合。
[0089]
为了解释本技术,以下定义将适用并且当合适时,单数使用的术语也将包括复数并且反之亦然。要理解的是,本文中使用的技术仅是为了描述特别的实施方案,并且不意在是限制性的。如果以下给出的任何定义与通过引用结合在本文中的任何文献有冲突,以以下给出的定义为准。
[0090]
用于本文中的目的的"接受体人框架"是包含来源于人免疫球蛋白框架或人共有框架的轻链可变结构域(vl)框架或重链可变结构域(vh)框架的氨基酸序列的框架,如以下所限定。"来源于"人免疫球蛋白框架或人共有框架的接受体人框架可以包含其相同的氨基酸序列,或其可以含有氨基酸序列变化。在一些实施方案中,氨基酸变化的数目是10以下,9以下,8以下,7以下,6以下,5以下,4以下,3以下,或2以下。在一些实施方案中,vl接受体人框架的序列与vl人免疫球蛋白框架序列或人共有框架序列相同。
[0091]
"亲和力"是指分子(例如,抗体)的单个结合位点及其结合配偶体(例如,抗原)之间非共价相互作用总和的强度。除非另外指出,如本文中使用的,"结合亲和力"是指固有结合亲和力,其反映结合对的成员(例如,抗体和抗原)之间的1:1相互作用。分子x对其配偶体
y的亲和力通常可以由解离常数(kd)代表。亲和力可以通过本领域中已知的常规方法测量,所述方法包括本文中所述的那些。以下描述测量结合亲和力的具体的说明性和示例性实施方案。
[0092]
"亲和力成熟"抗体是指在一个或多个高变区(hvr)中具有一个或多个改变的抗体,相比于不具有此种改变的亲本抗体,此种改变导致抗体对抗原的亲和力提高。
[0093]
术语"抗-c5抗体"和"结合c5的抗体"是指这样的抗体,所述抗体能够以足够的亲和力结合c5以致所述抗体可用作用于靶向c5的诊断剂和/或治疗剂。在一个实施方案中,抗-c5抗体与不相关的、非c5蛋白的结合程度小于所述抗体与c5结合的约10%,如例如通过放射性免疫测定(ria)测量的。在某些实施方案中,结合c5的抗体的解离常数(kd)≤1μm,≤100nm,≤10nm,≤1nm,≤0.1nm,≤0.01nm,或≤0.001nm(例如,10-8
m以下,例如,10-8
m至10-13
m,例如,10-9
m至10-13
m)。在某些实施方案中,抗c5抗体结合c5的表位,所述表位在来源于不同物种的c5之间是保守的。
[0094]
术语"抗体"在本文中以最广义使用并且包括各种抗体结构,包括但不限于单克隆抗体,多克隆抗体,多特异性抗体(例如,双特异性抗体),和抗体片段,只要其显示所需的抗原结合活性即可。
[0095]
"抗体片段"是指不同于完整抗体的分子,其包含完整抗体结合完整抗体所结合的抗原的部分。抗体片段的实例包括但不限于fv,fab,fab',fab'-sh,f(ab')2;双抗体;线性抗体;单链抗体分子(例如,scfv);和由抗体片段形成的多特异性抗体。
[0096]
与参比抗体"结合相同表位的抗体"是指这样的抗体,所述抗体在竞争测定中阻断参比抗体与其抗原的结合,和/或相反地,参比抗体在竞争测定中阻断所述抗体与其抗原的结合。示例性的竞争测定提供在本文中。
[0097]
术语"嵌合"抗体是指这样的抗体,其中重链和/或轻链的一部分来源于特定来源或物种,而重链和/或轻链的剩余部分来源于不同的来源或物种。
[0098]
抗体的"分类"是指其重链所具有的恒定结构域或恒定区的类型。主要有五类抗体:iga,igd,ige,igg,和igm,并且这些中的一些可以被进一步划分成亚类(同种型),例如,igg1,igg2,igg3,igg4,iga1,和iga2。对应于不同的类型的免疫球蛋白的重链恒定结构域被分别称为α,δ,ε,γ,和μ。
[0099]
如本文中使用的,术语"细胞毒性剂"是指抑制或阻止细胞功能和/或导致细胞死亡或毁坏的物质。细胞毒性剂包括但不限于放射性同位素(例如,at
211
,i
131
,i
125
,y
90
,re
186
,re
188
,sm
153
,bi
212
,p
32
,pb
212
和lu的放射性同位素);化疗剂或药物(例如,甲氨蝶呤(methotrexate),阿霉素(adriamycin),长春花生物碱(vinca alkaloids)(长春新碱(vincristine),长春碱(vinblastine),依托泊甙(etoposide)),多柔比星(doxorubicin),美法仑(melphalan),丝裂霉素c(mitomycin c),苯丁酸氮芥(chlorambucil),柔红霉素(daunorubicin)或其他嵌合剂);生长抑制剂;酶及其片段如核酸水解酶;抗生素;毒素如小分子毒素或细菌、真菌、植物或动物来源的酶学活性毒素,包括其片段和/或变体;以及以下公开的各种抗肿瘤剂或抗癌剂。
[0100]
"效应子功能"是指可归因于抗体fc区的那些生物学活性,其随抗体同种型而变化。抗体效应子功能的实例包括:c1q结合和补体依赖性细胞毒性(cdc);fc受体结合;抗体依赖性细胞介导性细胞毒性(adcc);吞噬作用;细胞表面受体(例如,b细胞受体)的下调;以
及b细胞活化。
[0101]
试剂(例如,药物制剂)的"有效量"是指有效实现所需的治疗或预防结果所需要的在剂量和时间期间方面的量。
[0102]
术语"表位"包括任何能够被抗体结合的决定簇。表位是抗原的被靶向所述抗原的抗体结合的区域,并且包括与抗体直接接触的特定氨基酸。表位决定簇可以包括分子如氨基酸、糖侧链、磷酰基或磺酰基的化学活性表面簇集,并且可以具有特定的三维结构特征,和/或特定的电荷特征。通常,对于特别的靶抗原具有特异性的抗体将优先识别蛋白和/或大分子的复合物混合物中的靶抗原上的表位。
[0103]
在本文中,术语"fc区"被用于限定含有恒定区的至少一部分的免疫球蛋白重链的c-端区域。该术语包括天然序列fc区和变体fc区。在一个实施方案中,人igg重链fc区从cys226或pro230延伸至重链的羧基端。然而,fc区的c-端赖氨酸(lys447)可能存在也可能不存在。除非本文中另外指出,fc区或恒定区中的氨基酸残基编号是根据eu编号系统,其也被称为eu索引,如在kabat等人,sequences of proteins of immunological interest(免疫学感兴趣的蛋白序列),第5版.public health service,national institutes of health,bethesda,md,1991中所述。
[0104]
"框架"或"fr"是指不同于高变区(hvr)残基的可变结构域残基。可变结构域的fr通常由四个fr结构域组成:fr1,fr2,fr3和fr4。因此,在vh(或vl)中hvr和fr序列通常以以下顺序出现:fr1-h1(l1)-fr2-h2(l2)-fr3-h3(l3)-fr4。
[0105]
术语"全长抗体"、"完整抗体"和"全抗体"在本文中被互换地用于指示这样的抗体,所述抗体具有与天然抗体结构基本类似的结构或具有含有如本文中所限定的fc区的重链。
[0106]
术语"宿主细胞"、"宿主细胞系"和"宿主细胞培养物"被互换地用于指示被引入外源核酸的细胞,包括此种细胞的后代。宿主细胞包括"转化体"和"转化的细胞",其包括转化的原代细胞及来源于其的后代(不考虑传代次数)。后代的核酸内容物可以与亲本细胞不完全相同,并且可以含有突变。本文中包括具有与针对原始转化的细胞中筛选或选择的相同的功能或生物学活性的突变体后代。
[0107]
"人抗体"是这样的抗体,其具有的氨基酸序列对应于由人或人细胞产生的抗体或来源于利用人抗体库或其他人抗体编码序列的非人来源的抗体的氨基酸序列。人抗体的该定义明确排除了包含非人抗原结合残基的人源化抗体。
[0108]
"人共有框架"是这样的框架,其代表人免疫球蛋白vl或vh框架序列的选择中最常见的氨基酸残基。通常,人免疫球蛋白vl或vh序列的选择来自可变结构域序列的亚组。通常,序列的亚组是如kabat等人,sequences of proteins of immunological interest(免疫学感兴趣的蛋白序列),第五版,nih publication 91-3242,bethesda md(1991),卷1-3中的亚组。在一个实施方案中,对于vl,所述亚组是如以上kabat等人中的亚组κi。在一个实施方案中,对于vh,所述亚组是如以上kabat等人中那样的亚组iii。
[0109]
"人源化"抗体是指一种嵌合抗体,其包含来自非人hvr的氨基酸残基和来自人fr的氨基酸残基。在某些实施方案中,人源化抗体将包含基本上全部的至少一个(并且典型地,两个)可变结构域,其中所有或基本上所有的hvr(例如,cdr)对应于非人抗体的hvr,并且所有或基本上所有的fr对应于人抗体的fr。人源化抗体任选地可以包含来源于人抗体的
抗体恒定区的至少一部分。抗体的"人源化形式",例如,非人抗体,是指已经进行人源化的抗体。
[0110]
如本文中使用的术语"高变区"或"hvr"是指抗体可变结构域中序列高变("互补决定区"或"cdr")和/或形成结构确定的环("高变环")和/或含有与抗原接触的残基("抗原触点")的各区域。通常,抗体包含六个hvr:vh中的三个(h1,h2,h3)和vl中的三个(l1,l2,l3)。本文中示例性hvr包括:
[0111]
(a)出现在氨基酸残基26-32(l1),50-52(l2),91-96(l3),26-32(h1),53-55(h2),和96-101(h3)处的高变环(chothia和lesk,j.mol.biol.196:901-917(1987));
[0112]
(b)出现在氨基酸残基24-34(l1),50-56(l2),89-97(l3),31-35b(h1),50-65(h2),和95-102(h3)处的cdr(kabat等人,sequences of proteins of immunological interest(免疫学感兴趣的蛋白序列),第5版.public health service,national institutes of health,bethesda,md(1991));
[0113]
(c)出现在氨基酸残基27c-36(l1),46-55(l2),89-96(l3),30-35b(h1),47-58(h2),和93-101(h3)处的抗原触点(maccallum等人j.mol.biol.262:732-745(1996));和
[0114]
(d)(a)、(b)和/或(c)的组合,包括hvr氨基酸残基46-56(l2),47-56(l2),48-56(l2),49-56(l2),26-35(h1),26-35b(h1),49-65(h2),93-102(h3),和94-102(h3)。
[0115]
除非另外指出,在本文中,hvr残基和可变结构域中的其他残基(例如,fr残基)依据以上kabat等人编号。
[0116]
"免疫缀合物"是与一个或多个包括但不限于细胞毒性剂的异源分子缀合的抗体。
[0117]
"个体"或"受试者"是哺乳动物。哺乳动物包括但不限于家养动物(例如,牛,绵羊,猫,狗和马),灵长类动物(例如,人和非人灵长类动物如猴子),兔,和啮齿类动物(例如,小鼠和大鼠)。在某些实施方案中,个体或受试者是人。
[0118]“分离的”或“纯化的”抗体是已经与其天然环境的组分分离的抗体。在一些实施方案中,抗体被纯化至大于95%或99%的纯度,如由例如电泳(例如,sds-page,等电聚焦(ief),毛细管电泳)或层析(例如,离子交换或反相hplc)方法确定的。对于用于评估抗体纯度的方法的综述,参见,例如,flatman等人,j.chromatogr.b 848:79-87(2007)。
[0119]“分离的”或“纯化的”核酸是指已经与其天然环境的组分分离的核酸分子。分离的核酸包括这样的核酸分子,所述核酸分子被包含在通常含有所述核酸分子的细胞中,但是所述核酸分子存在于染色体外或存在于不同于其天然染色体位置的染色体位置处。
[0120]
"分离的编码抗-c5抗体的核酸"或“纯化的编码抗-c5抗体的核酸”是指一个或多个编码抗体重链和轻链(或其片段)的核酸分子,包括在单个载体或在分开的载体中的此种核酸分子,以及存在于宿主细胞中的一个或多个位置处的此种核酸分子。
[0121]
如本文中使用的术语"单克隆抗体"是指获自基本上均质的抗体的群体的抗体,即,包括所述群体的个体抗体是相同的和/或结合相同的表位,除可能的变体抗体以外,例如,含天然存在的突变或在单克隆抗体制备物的制备过程中产生,此种变体通常少量存在。对比于多克隆抗体制备物(通常包括针对不同的决定簇(表位)的不同抗体),单克隆抗体制备物中的各单克隆抗体是针对抗原上的单个决定簇。因此,定语"单克隆"指示抗体的性质为获得自基本上均质的抗体群体,并且不视为要求通过任何特定的方法制备所述抗体。例如,根据本发明使用的单克隆抗体可以通过多种技术制备,包括但不限于杂交瘤方法,重组
dna法,噬菌体展示法,以及利用含有所有或部分的人免疫球蛋白基因座的转基因动物的方法,本文中描述了这样的方法以及其他用于制备单克隆抗体的示例性方法。
[0122]
"裸抗体"是指不与异源部分(例如,细胞毒性部分)或放射性标记缀合的抗体。裸抗体可以存在于药物制剂中。
[0123]
"天然抗体"是指天然存在的具有多种结构的免疫球蛋白分子。例如,天然igg抗体是约150,000道尔顿的异源四聚糖蛋白,由通过二硫键键合的两个相同的轻链和两个相同的重链组成。从n端到c端,各重链具有可变区(vh),其也被称为可变重链结构域或重链可变结构域,之后是三个恒定结构域(ch1,ch2和ch3)。类似地,从n端到c端,各轻链具有可变区(vl),其也被称为可变轻链结构域或轻链可变结构域,之后是轻链恒定(cl)结构域。抗体的轻链基于其恒定结构域的氨基酸序列可以被分配至两种类型之一,被称为κ(kappa)和λ(lambda)。
[0124]
术语"包装插页"用于指通常包含在治疗产品的商业包装中的使用说明,其含有关于此种治疗产品的适应证,用途,剂量,给药,组合疗法,禁忌证和/或使用警告的信息。
[0125]
相对于参比多肽序列的"百分比(%)氨基酸序列同一性"被定义为在对序列进行比对并且在必要时引入空隙(gap)以实现最大百分比序列同一性,而不将任何保守置换认为是序列同一性的一部分后,候选序列中与参比多肽序列中的氨基酸残基相同的氨基酸残基的百分比。为了确定百分比氨基酸序列同一性的比对可以以在本领域中的技术内的多种方式实现,例如,使用公众可获得的计算机软件如blast,blast-2,align或megalign(dnastar)软件。本领域技术人员可以确定用于比对序列的合适参数,包括在比较的序列的全长上实现最大比对所需的任何算法。然而,对于本文的目的来说,%氨基酸序列同一性值使用序列比较计算机程序align-2产生。align-2序列比较计算机程序的作者是genentech,inc.,并且源代码已经与用户文件一起被提交于美国版权局(washington d.c.,20559),其以美国版权登记号txu510087被登记。公众可自genentech,inc.(south san francisco,california)获得align-2程序,或者所述程序可自源代码编译。align-2程序应当被编译为用于unix操作系统,包括数字unix v4.0d。所有序列比较参数由align-2程序设定并且不需要改变。
[0126]
在将align-2用于氨基酸序列比较的情况中,给定氨基酸序列a针对、与或相对给定氨基酸序列b的%氨基酸序列同一性(其可以备选地表述为给定氨基酸序列a针对、与或相对给定氨基酸序列b具有或包含特定%氨基酸序列同一性)计算如下:
[0127]
100乘以分数x/y
[0128]
其中x是在a和b的程序比对中由序列比对程序align-2评分为相同匹配的氨基酸残基的数目,并且y是b中氨基酸残基的总数。要理解的是,当氨基酸序列a的长度不等于氨基酸序列b的长度时,a对b的%氨基酸序列同一性将不等于b对a的%氨基酸序列同一性。除非另外明确指出,本文中使用的所有%氨基酸序列同一性值都是如上一段中所述使用align-2计算机程序获得的。
[0129]
术语"药物制剂"是指这样的制剂,其具有的形式允许包含在其中的活性成分的生物学活性是有效的,并且其不含对将被施用所述制剂的受试者具有不可接受的毒性的其他组分。
[0130]
"药用载体"是指药物制剂中除活性成分以外的成分,其对受试者是无毒性的。药
用载体包括但不限于缓冲剂,赋形剂,稳定剂或防腐剂。
[0131]
除非另外指出,如本文中使用的术语"c5"包括来自任何脊椎动物来源,包括哺乳动物如灵长类(例如,人和猴)和啮齿类(例如,小鼠和大鼠)的任何天然c5。该术语包括"全长"未加工的c5以及来源于细胞中的加工的任何形式的c5。该术语还包括天然存在的c5的变体,例如,剪接变体或等位变体。示例人c5的氨基酸序列显示在seq id no:13中。人c5的示例的β链的氨基酸序列显示在seq id no:1中。人c5的β链的示例的mg1,mg2,mg3,mg4,mg5,mg6,mg1-mg2和mg3-mg6结构域的氨基酸序列分别显示在seq id nos:2,3,4,5,6,7,8和9中。人c5的α链的示例性的氨基酸序列显示在seq id no:10中。人c5的α链的示例性的过敏毒素结构域和c5-c345c/ntr结构域的氨基酸序列分别显示在seq id no:11和12中。示例的食蟹猴和鼠c5的氨基酸序列分别显示在seq id no:14和62中。
[0132]
如本文中使用的,"治疗(treatment)"(及其语法上的变体如"治疗(treat)"或"治疗(treating)")是指尝试改变受治疗的个体的自然过程的临床干预,并且可以为了预防或在临床病程期间进行。治疗的理想效果包括但不限于防止疾病发生或复发,减轻症状,消除疾病的任何直接或间接的病理结果,防止转移,降低疾病进展的速率,改善或减轻疾病状态,以及消除或改善预后。在一些实施方案中,本发明的抗体被用于延迟疾病的发展或用于减缓疾病的进展。
[0133]
术语"可变区"或"可变结构域"是指参与抗体与抗原结合的抗体重链或轻链的结构域。天然抗体的重链和轻链可变结构域(分别为vh和vl)通常具有相似的结构,其中各结构域包含四个保守的框架区(fr)和三个高变区(hvr)。(参见,例如,kindt等人kuby immunology,第6版,w.h.freeman&co.,第91页(2007))。单个vh或vl结构域可足以给予抗原结合特异性。此外,结合特定抗原的抗体可以分别使用来自与所述抗原结合的抗体的vh或vl结构域筛选互补vl或vh结构域的文库来分离。参见,例如,portolano等人,j.immunol.150:880-887(1993);clarkson等人,nature352:624-628(1991)。
[0134]
如本文中使用的,术语"载体"是指能够使与其相连的另一个核酸增殖的核酸分子。该术语包括作为自我复制的核酸结构的载体以及结合到引入其的宿主细胞的基因组中的载体。某些载体能够指导与其可操作相连的核酸的表达。此种载体在本文中被称为"表达载体"。
[0135]
ii.组合物和方法
[0136]
在一个方面,本发明部分基于抗-c5抗体及其用途。在某些实施方案中,提供结合c5的抗体。本发明的抗体可用于例如涉及过量的或不受控制的c5活化的补体介导的疾病或病症的诊断或治疗。
[0137]
a.示例的抗-c5抗体
[0138]
在一个方面,本发明提供结合c5的分离的抗体。在某些实施方案中,本发明的抗-c5抗体结合c5的β链(seq id no:1)或α链(seq id no:10)内的表位。在某些实施方案中,抗-c5抗体结合c5的β链的mg1(seq id no:2),mg2(seq id no:3),mg3(seq id no:4),mg4(seq id no:5),mg5(seq id no:6),mg6(seq id no:7),mg1-mg2(seq id no:8)或mg3-mg6(seq id no:9)结构域或c5的α链的过敏毒素结构域(seq id no:11)或c5-c345c/ntr结构域(seq id no:12)内的表位。在某些实施方案中,抗-c5抗体结合由c5的β链的氨基酸19-180组成的片段或由c5的α链(seq id no:10)的氨基酸1-999组成的片段内的表位。
[0139]
在另一个方面,本发明提供抗-c5抗体,所述抗体显示ph依赖性结合性质或钙依赖性结合性质。如本文中使用的,表述"ph依赖性结合"表示抗体"在酸性ph显示的与c5的结合与其在中性ph的结合相比减小"(对于本公开,两种表达可以互换地使用)。例如,"具有ph依赖性的结合性质"的抗体包括在中性ph下结合c5的亲和力比在酸性ph下更高的抗体。在某些实施方案中,本发明的抗体在中性ph下结合c5的亲和力是在酸性ph的至少2,3,5,10,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95,100,200,400,1000,10000倍以上高。用于本文时,表述“钙依赖性结合或钙浓度结合”意指抗体“在较低的钙浓度下与c5的结合与其在更高的钙浓度下的结合相比减小”(对于本公开,两种表达可以互换地使用)。例如,“具有钙依赖性结合性质”的抗体包括在较高钙浓度下结合c5的亲和力比在较低钙浓度下更高的抗体。在某些实施方案中,本发明的抗体在较高钙浓度下结合c5的亲和力是在较低钙浓度下的至少2,3,5,10,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95,100,200,400,1000,10000被以上高。
[0140]
对于本公开,抗体对c5的"亲和力"以抗体的kd表示。抗体的kd是指抗体-抗原相互作用的平衡解离常数。抗体结合其抗原的kd值越大,其对所述具体抗原的结合亲和力越弱。因此,如本文中使用的,表述"在中性ph的亲和力比在酸性ph下更高"(或等价表述"ph依赖性的结合")是指在酸性ph抗体结合c5的kd高于在中性ph抗体结合c5的kd。例如,在本发明的情形中,如果在酸性ph抗体结合c5的kd是在中性ph抗体结合c5的kd的至少2倍高,则认为抗体在中性ph下结合c5的亲和力比在酸性ph下更高。因此,本发明包括这样的抗体,所述抗体在酸性ph结合c5的kd是所述抗体在中性ph下结合c5的kd至少2,3,5,10,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95,100,200,400,1000,10000倍以上高。相应地,用于本文时,表述“在较高钙浓度下的亲和力比在较低钙浓度下更高”(或等价表述"钙依赖性的结合或钙浓度依赖性的结合")意指在较低钙浓度下抗体结合c5的kd高于在较高钙浓度下抗体结合c5的kd。例如,在本发明的情形中,如果在较低钙浓度下抗体结合c5的kd是在较高钙浓度下抗体结合c5的kd的至少2倍高,则认为抗体在较高钙浓度下结合c5的亲和力比在较低钙浓度下更高。因此,本发明包括这样的抗体,所述抗体在较低钙浓度下结合c5的kd是所述抗体在较高钙浓度下结合c5的kd的至少2,3,5,10,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95,100,200,400,1000,10000倍以上高。
[0141]
抗体对特定抗原的结合性质也可以表示为抗体的kd。抗体的kd是指抗体关于特定抗原的解离速率常数并且以秒的倒数(即,sec-1
)为单位表示。kd值的增加指示抗体与其抗原的结合较弱。本发明因此包括这样的抗体,所述抗体在酸性ph结合c5的kd值比在中性ph更高。本发明包括这样的抗体,所述抗体在酸性ph结合c5的kd是所述抗体在中性ph下结合c5的kd的至少2,3,5,10,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95,100,200,400,1000,10000倍以上高。本发明因此包括在较低钙浓度下结合c5的kd值比在较高钙浓度下高的抗体。
[0142]
在某些情况中,"在酸性ph与c5的结合与其在中性ph的结合相比减小"被表示为抗体在酸性ph结合c5的kd值与抗体在中性ph下结合c5的kd值之比(或反之亦然)。例如,对于本发明,如果抗体显示2以上的酸性/中性kd比,则可以认为所述抗体显示"在酸性ph与c5的结合与其在中性ph的结合相比减小"。在某些示例性实施方案中,本发明的抗体的酸性/中性kd可以为2,3,5,10,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95,100,
200,400,1000,10000以上。
[0143]
在某些情况中,"在较低钙浓度下与c5的结合与其在较高钙浓度下的结合相比减小"被表示为抗体在较低钙浓度下结合c5的kd值与抗体在较高钙浓度下结合c5的kd值之比(或反之亦然)。例如,对于本发明,如果抗体显示2以上的较低钙浓度/较高钙浓度kd比,则可以认为所述抗体显示"在较低钙浓度下与c5的结合与其在较高钙浓度下的结合相比减小"。在某些示例性实施方案中,本发明的抗体的较低钙浓度/较高钙浓度kd比可以为2,3,5,10,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95,100,200,400,1000,10000以上。
[0144]
在某些情况中,"在酸性ph与c5的结合与其在中性ph的结合相比减小"被表示为抗体在酸性ph结合c5的kd值与抗体在中性ph下结合c5的kd值之比(或反之亦然)。例如,对于本发明,如果抗体显示2以上的酸性/中性kd比,则可以认为所述抗体显示"在酸性ph与c5的结合与其在中性ph的结合相比减小"。在某些示例性实施方案中,本发明的抗体的酸性/中性kd比可以为2,3,5,10,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95,100,200,400,1000,10000以上。
[0145]
在某些情况中,"在较低钙浓度下与c5的结合与其在较高钙浓度下的结合相比减小"被表示为抗体在较低钙浓度下结合c5的kd值与抗体在较高钙浓度下结合c5的kd值之比(或反之亦然)。例如,对于本发明,如果抗体显示2以上的较低钙浓度/较高钙浓度kd比,则可以认为所述抗体显示"在较低钙浓度下与c5的结合与其在较高钙浓度下的结合相比减小"。在某些示例性实施方案中,本发明的抗体的较低钙浓度/较高钙浓度kd比可以为2,3,5,10,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95,100,200,400,1000,10000以上。
[0146]
如本文中使用的,表述"酸性ph"是指4.0至6.5的ph。表述"酸性ph"包括4.0,4.1,4.2,4.3,4.4,4.5,4.6,4.7,4.8,4.9,5.0,5.1,5.2,5.3,5.4,5.5,5.6,5.7,5.8,5.9,6.0,6.1,6.2,6.3,6.4和6.5的ph值。用于本文时,表述“较低钙浓度”意指0.1μm至30μm的钙浓度。表述“较低钙浓度”包括0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0,1.5,2.0,2.5,3.0,3.5,4.0,4.5,5.0,5.5,6.0,6.5,7.0,7.5,8.0,8.5,9.0,9.5,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29和30μm的钙浓度。
[0147]
如本文中使用的,表述"中性ph"是指6.7至约10.0的ph。表述"中性ph"包括6.7,6.8,6.9,7.0,7.1,7.2,7.3,7.4,7.5,7.6,7.7,7.8,7.9,8.0,8.1,8.2,8.3,8.4,8.5,8.6,8.7,8.8,8.9,9.0,9.1,9.2,9.3,9.4,9.5,9.6,9.7,9.8,9.9和10.0的ph值。如本文中使用的,表述“较高钙浓度”意指0.1mm至约10mm的钙浓度。表述“较高钙浓度”包括0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0,1.5,2.0,2.5,3.0,3.5,4.0,4.5,5.0,5.5,6.0,6.5,7.0,7.5,8.0,8.5,9.0,9.5和10.0.mm的钙浓度。
[0148]
如本文中表示的,kd值以及kd值可以使用基于表面等离子共振的生物传感器来确定以表征抗体-抗原相互作用。(参见,例如,本文中的实施例3)。kd值和kd值可以在25℃或37℃确定。
[0149]
在本发明中已经发现,两种以上分离的或纯化的抗-c5抗体的组合在将所述组合施用给受试者后从血浆中消除抗原[例如c5],其中一种分离的或纯化的抗-c5抗体结合c5的β链(seq id no:1)或α链(seq id no:10)内的表位,并且其中要组合的所述分离的或纯
l2,其包含seq id nos:38-41中任一项的氨基酸序列;和(c)hvr-l3其包含seq id nos:42-48中任一项的氨基酸序列。
[0155]
在另一个方面,包含在本发明的组合中的抗体包含:(a)vh结构域,其包含至少一个、至少两个或全部三个选自下述的vh hvr序列:(i)hvr-h1,其包含seq id nos:63-66中任一项的氨基酸序列,(ii)hvr-h2,其包含seq id nos:67-71中任一项的氨基酸序列,和(iii)hvr-h3,其包含seq id nos:72-78中任一项的氨基酸序列;和(b)vl结构域,其包含至少一个、至少两个或全部三个选自下述的vl hvr序列:(i)hvr-l1,其包含seq id nos:36-37中任一项的氨基酸序列,(ii)hvr-l2,其包含seq id nos:38-41中任一项的氨基酸序列,和(c)hvr-l3,其包含seq id nos:42-48中任一项的氨基酸序列。
[0156]
在另一个方面,本发明提供两种以上抗-c5抗体的组合,其中一种或多种抗-c5抗体包含:(a)hvr-h1,其包含seq id nos:63-66中任一项的氨基酸序列;(b)hvr-h2,其包含seq id nos:67-71中任一项的氨基酸序列;(c)hvr-h3,其包含seq id nos:72-78中任一项的氨基酸序列;(d)hvr-l1,其包含seq id nos:36-37中任一项的氨基酸序列;(e)hvr-l2,其包含seq id nos:38-41中任一项的氨基酸序列;和(f)hvr-l3,其包含seq id nos:42-48中任一项的氨基酸序列。
[0157]
在另一个方面,包含在本发明的组合中的一种或多种抗-c5抗体包含与seq id nos:15,17,19,21,23,25,27,29,31,52和54中的任一个的氨基酸序列具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%或100%序列同一性的重链可变结构域(vh)序列。在某些实施方案中,相对于参比序列,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%或99%同一性的vh序列包含置换(例如,保守置换)、插入或缺失,但是包含所述序列的抗-c5抗体保持结合c5的能力。在某些实施方案中,在seq id nos:15,17,19,21,23,25,27,29,31,52和54任一个中,总计1-10个氨基酸被置换、插入和/或缺失。在某些实施方案中,置换,插入,或缺失发生在hvr外的区域中(即,在fr中)。任选地,抗-c5抗体包含seq id nos:15,17,19,21,23,25,27,29,31,52和54中任一个中的vh序列,包括所述序列的翻译后修饰。在特别的实施方案中,vh包含一个、两个或三个选自以下的hvr:(a)hvr-h1,其包含seq id nos:63-66中任一个的氨基酸序列,(b)hvr-h2,其包含seq id nos:67-71中任一个的氨基酸序列,和(c)hvr-h3,其包含seq id nos:72-77中任一个的氨基酸序列。
[0158]
在另一个方面,提供两种以上抗-c5抗体的组合,其中一种或多种抗体包含与seq id nos:16,18,20,22,24,26,28,30,32,35和53中任一个具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的轻链可变结构域(vl)。在某些实施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%或99%同一性的vl序列相对于参比序列包含置换(例如,保守置换)、插入或缺失,但是包含所述序列的抗-c5抗体保持结合c5的能力。在某些实施方案中,在seq id nos:16,18,20,22,24,26,28,30,32,35和53中的任一个中,总计1至10个氨基酸被置换、插入和/或缺失。在某些实施方案中,所述置换、插入或缺失发生在hvr外的区域中(即,在fr中)。任选地,抗-c5抗体包含seq id nos:16,18,20,22,24,26,28,30,32,35和53中的任一个中的vl序列,包括所述序列的翻译后修饰。在特别的实施方案中,vl包含一个、两个或三个选自以下的hvr:(a)hvr-l1,其包含seq id nos:36-37中任一个的氨基酸序列;(b)hvr-l2,其包含seq id nos:38-41中任一个的氨基酸序列;和(c)hvr-l3,其包含seq id nos:42-48中任一个的氨基酸序列。
[0159]
在另一个方面,提供两种以上抗-c5抗体的组合,其中一种或多种抗体包含如在前文提供的任一实施方案中的vh和如在前文提供的任一实施方案中的vl。在一个实施方案中,所述抗体分别包含seq id nos:15,17,19,21,23,25,27,29,31,52和54中的任一个和seq id nos:16,18,20,22,24,26,28,30,32,35和53中的任一个中的vh和vl序列,包括所述序列的翻译后修饰。
[0160]
在另一个方面,本发明提供两种以上抗-c5抗体的组合,其中要组合的一种或多种抗体与本文提供的抗-c5抗体结合相同的表位。例如,在某些实施方案中,提供与表2中所述的抗体结合相同表位的抗体。如下文的工作实施例所证明的,表2所述的全部抗-c5抗体都被分组到c5的相同的表位框中并且显示ph依赖性结合特征。
[0161]
在本发明的另一个方面,任意以上实施方案所述的抗-c5抗体是单克隆抗体,包括嵌合抗体、人源化抗体或人抗体。在一个实施方案中,抗-c5抗体是抗体片段,例如,fv,fab,fab',scfv,双抗体或f(ab')2片段。在另一个实施方案中,所述抗体是全长抗体,例如,完整的igg1或igg4抗体或本文中限定的其他抗体类别或同种型。
[0162]
在另一个方面,任意以上实施方案所述的抗-c5抗体可以结合以下1-7节中所述的任意特征(单独地或组合地)。
[0163]
1.抗体亲和力
[0164]
在某些实施方案中,本文中提供的抗体具有的解离常数(kd)≤1μm,≤100nm,≤10nm,≤1nm,≤0.1nm,≤0.01nm,或≤0.001nm(例如,10-8
m以下,例如,10-8
m至10-13
m,例如,10-9
m至10-13
m)。
[0165]
在一个实施方案中,kd通过放射性标记的抗原结合测定(ria)测量。在一个实施方案中,利用目的抗体的fab形式及其抗原进行ria。例如,fab对抗原的溶液结合亲和力通过以下方式测量:在存在未标记抗原的滴定系列的情况下用最小浓度的(
125
i)标记的抗原平衡fab,然后用抗-fab抗体包被的平板捕获结合的抗原(参见,例如,chen等人,j.mol.biol.293:865-881(1999))。为了确定测定条件,将microtiter(注册商标)多孔板(thermo scientific)用在50mm碳酸钠(ph9.6)中的5μg/ml的捕获抗-fab抗体(cappel labs)过夜包被,并且随后用在pbs中的2%(w/v)胎牛血清清蛋白在室温(约23℃)封闭二至五小时。在非吸附性平板(nunc#269620)中,将100pm或26pm[
125
i]-抗原与目的fab的连续稀释液混合(例如,与presta等人,cancer res.57:4593-4599(1997)中的抗-vegf抗体,fab-12的评估一致)。然后将目的fab孵育过夜;然而,孵育可以持续更长的时间(例如,约65小时)以保证实现平衡。其后,将混合物转移至捕获平板用于室温孵育(例如,持续一小时)。然后除去溶液并将平板用在pbs中的0.1%聚山梨醇酯20(tween-20(注册商标))洗涤八次。当平板已经干燥时,添加150μl/孔的闪烁体(microscint-20
tm
;packard),并将平板在topcount
tm
γ计数仪(packard)上计数十分钟。选择导致小于或等于20%的最大结合的各fab的浓度用于竞争性结合测定。
[0166]
根据另一个实施方案,kd使用biacore(注册商标)表面等离子共振测定测量。例如,在25℃利用固定化抗原cm5芯片以~10响应单位(ru)进行使用biacore(注册商标)-2000或biacore(注册商标)-3000(biacore,inc.,piscataway,nj)的测定。在一个实施方案中,根据供应商的使用说明,将羧甲基化的葡聚糖生物传感器芯片(cm5,biacore,inc.)用n-乙基-n'-(3-二甲基氨基丙基)-碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺(nhs)活化。
将抗原用10mm乙酸钠ph 4.8稀释至5μg/ml(~0.2μm),之后以5μl/分钟的流速注入以得到约10个响应单位(ru)的偶联蛋白。在注入抗原后,注入1m乙醇胺以封闭未反应的基团。为了动力学测量,在25℃以约25μl/分钟的流速将fab的两倍连续稀释液(0.78nm至500nm)注射到具有0.05%聚山梨醇酯20(tween-20
tm
)表面活性剂的pbs(pbst)中。使用简单一对一(one-to-one)朗缪尔(langmuir)结合模型(biacore(注册商标)evaluation software版本3.2)通过同时拟合结合和解离感应图来计算结合速率(k
on
)和解离速率(k
off
)。作为k
off
/k
on
之比计算平衡解离常数(kd)。参见,例如,chen等人,j.mol.biol.293:865-881(1999)。如果通过以上表面等离子共振测定测量的结合速率超过106m-1
s-1
,则可以通过以下方式确定结合速率:如在分光计如配备有截流装置(stop-flow)的分光光度计(aviv instruments)或具有搅拌室的8000-系列slm-aminco
tm
分光光度计(thermospectronic)中测量的,使用在存在增加浓度的抗原的情况下,测量在25℃,在pbs,ph 7.2中的20nm抗-抗原抗体(fab形式)的荧光发射强度的增加或减小的荧光猝灭技术(激发=295nm;发射=340nm,16nm带通)。
[0167]
2.抗体片段
[0168]
在某些实施方案中,本文中提供的抗体是抗体片段。抗体片段包括但不限于fab,fab',fab'-sh,f(ab')2,fv和scfv片段,以及以下描述的其他片段。对于特定抗体片段的综述,参见hudson等人nat.med.9:129-134(2003)。对于scfv片段的综述,参见,例如,pluckthun,在the pharmacology of monoclonal antibodies(单克隆抗体的药理学)中,卷113,rosenburg和moore编,(springer-verlag,new york),第269-315页(1994);还参见wo 93/16185;以及美国专利号5,571,894和5,587,458。对于包含补救受体结合表位残基并具有增加的体内半衰期的fab和f(ab')2片段的讨论,参见美国专利号5,869,046。
[0169]
双抗体是具有两个抗原结合位点的抗体片段,其可以是二价的或双特异性的。参见,例如,ep 404,097;wo 1993/01161;hudson等人,nat.med.9:129-134(2003);和hollinger等人,proc.natl.acad.sci.usa 90:6444-6448(1993)。hudson等人,nat.med.9:129-134(2003)中也描述了三元抗体和四元抗体。
[0170]
单结构域抗体是这样的抗体片段,其包含抗体的全部或部分的重链可变结构域或全部或部分的轻链可变结构域。在某些实施方案中,单结构域抗体是人单结构域抗体(domantis,inc.,waltham,ma;参见,例如,美国专利号6,248,516b1)。
[0171]
抗体片段可以通过多种技术制备,所述技术包括但不限于完整抗体的蛋白水解消化以及通过重组宿主细胞(例如,大肠杆菌或噬菌体)的制备,如本文中所述。
[0172]
3.嵌合和人源化抗体
[0173]
在某些实施方案中,本文中提供的抗体是嵌合抗体。某些嵌合抗体被描述于例如美国专利号4,816,567;和morrison等人,proc.natl.acad.sci.usa,81:6851-6855(1984))中。在一个实例中,嵌合抗体包含非人可变区(例如,来源于小鼠,大鼠,仓鼠,兔或非人灵长类动物如猴的可变区)和人恒定区。在另外的实例中,嵌合抗体是"类型转换"抗体,其中类型或亚类已经由亲本抗体的类型或亚类改变。嵌合抗体包括其抗原结合片段。
[0174]
在某些实施方案中,嵌合抗体是人源化抗体。典型地,将非人抗体人源化以降低对人的免疫原性,同时保留亲本非人抗体的特异性和亲和力。通常,人源化抗体包含一个或多个可变结构域,其中hvr,例如,cdr(或其部分)来源于非人抗体,和fr(或其部分)来源于人抗体序列。人源化抗体任选地还包含至少一部分的人恒定区。在一些实施方案中,人源化抗
体中的一些fr残基被置换成来自非人抗体(例如,hvr残基所来源于的抗体)的相应残基,例如,以恢复或提高抗体特异性或亲和力。
[0175]
人源化抗体及其制备方法被综述于例如almagro和fransson,front.biosci.13:1619-1633(2008)中,并且被进一步描述于例如riechmann等人,nature 332:323-329(1988);queen等人,proc.nat'l acad.sci.usa86:10029-10033(1989);美国专利号5,821,337,7,527,791,6,982,321,和7,087,409;kashmiri等人,methods 36:25-34(2005)(描述了特异性决定区(sdr)移植);padlan,mol.immunol.28:489-498(1991)(描述了"表面再建(resurfacing)");dall'acqua等人,methods 36:43-60(2005)(描述了"fr改组(shuffling)");和osbourn等人,methods 36:61-68(2005)与klimka等人,br.j.cancer,83:252-260(2000)(描述了用于fr改组的"定向选择"方法)中。
[0176]
可用于人源化的人框架区包括但不限于:使用"最佳匹配(best-fit)"方法选择的框架区(参见,例如,sims等人j.immunol.151:2296(1993));来源于具有特定亚组的轻链或重链可变区的人抗体的共有序列的框架区(参见,例如,carter等人proc.natl.acad.sci.usa,89:4285(1992);和presta等人j.immunol.,151:2623(1993));人成熟(体突变)框架区或人生殖系框架区(参见,例如,almagro和fransson,front.biosci.13:1619-1633(2008));和来源于fr文库筛选的框架区(参见,例如,baca等人,j.biol.chem.272:10678-10684(1997)和rosok等人,j.biol.chem.271:22611-22618(1996))。
[0177]
4.人抗体
[0178]
在某些实施方案中,本文中提供的抗体是人抗体。人抗体可以使用本领域中已知的多种技术制备。人抗体被一般性地描述于van dijk和van de winkel,curr.opin.pharmacol.5:368-74(2001)以及lonberg,curr.opin.immunol.20:450-459(2008)中。
[0179]
人抗体可以通过向已被改良成响应抗原攻击生产完整人抗体或具有人可变区的完整抗体的转基因动物施用免疫原来制备。此种动物典型地含有全部或部分的人免疫球蛋白基因座,其替代内源性免疫球蛋白基因座,或其存在于染色体外部或被随机整合到动物的染色体中。在此种转基因小鼠中,内源性免疫球蛋白基因座通常已被失活。对于由转基因动物获得人抗体的方法的综述,参见lonberg,nat.biotech.23:1117-1125(2005)。还参见,例如,美国专利号6,075,181和6,150,584,其描述了xenomouse
tm
技术;美国专利号5,770,429,其描述了humab(注册商标)技术;美国专利号7,041,870,其描述了k-m mouse(注册商标)技术,和美国专利申请公布号us 2007/0061900,其描述了velocimouse(注册商标)技术)。来自由此种动物产生的完整抗体的人可变区可以被进一步修饰,例如,通过与不同的人恒定区组合。
[0180]
人抗体还可以通过基于杂交瘤的方法制备。用于制备人单克隆抗体的人骨髓瘤和小鼠-人杂交骨髓瘤细胞系已被描述。(参见,例如,kozbor j.immunol.,133:3001(1984);brodeur等人,monoclonal antibody production techniques and applications(单克隆抗体制备技术和应用),第51-63页(marcel dekker,inc.,new york,1987);和boerner等人,j.immunol.,147:86(1991).)经由人b-细胞杂交瘤技术制备的人抗体也被描述于li等人,proc.natl.acad.sci.usa,103:3557-3562(2006)中。另外的方法包括在例如美国专利
号7,189,826(描述了由杂交瘤细胞系制备单克隆人igm抗体)和ni,现代免疫学,26(4):265-268(2006)(描述了人-人杂交瘤)中描述的那些。人杂交瘤技术(trioma技术)也被描述于vollmers和brandlein,histology and histopathology,20(3):927-937(2005)以及vollmers和brandlein,methods and findings in experimental and clinical pharmacology,27(3):185-91(2005)中。
[0181]
人抗体也可以通过分离选自人源噬菌体展示文库的fv克隆可变结构域序列来产生。此种可变结构域序列然后可以与所需的人恒定结构域组合。以下描述用于由抗体文库选择人抗体的技术。
[0182]
5.来源于文库的抗体
[0183]
本发明的抗体可以通过筛选具有所需一种或多种活性的抗体的组合文库来分离。例如,本领域中已知多种方法用于生成噬菌体展示文库并且针对具有所需结合性质的抗体筛选所述文库。此种方法被综述于例如hoogenboom等人,在methods in molecular biology 178:1-37(o'brien等人,编,human press,totowa,nj,2001)中并被进一步描述于例如mccafferty等人,nature 348:552-554;clackson等人,nature 352:624-628(1991);marks等人,j.mol.biol.222:581-597(1992);marks和bradbury,在methods in molecular biology 248:161-175(lo,编,human press,totowa,nj,2003)中;sidhu等人,j.mol.biol.338(2):299-310(2004);lee等人,j.mol.biol.340(5):1073-1093(2004);fellouse,proc.natl.acad.sci.usa 101(34):12467-12472(2004);以及lee等人,j.immunol.methods284(1-2):119-132(2004)中。
[0184]
在某些噬菌体展示方法中,vh和vl基因库通过聚合酶链反应(pcr)分别克隆并且在噬菌体文库中随机重组,然后可以针对结合抗原的噬菌体筛选所述文库,如winter等人,ann.rev.immunol.,12:433-455(1994)中所述。噬菌体典型地将抗体片段展示为单链fv(scfv)片段或fab片段。来自被免疫的来源的文库提供对免疫原的高亲和力的抗体而不需要构建杂交瘤。备选地,可以(例如,从人)克隆天然(naive)库从而提供针对多种非自身抗原以及自身抗原的单一来源的抗体而不需要进行任何免疫,如griffiths等人,embo j,12:725-734(1993)所述。最后,也可以通过以下方式合成制备天然文库:自干细胞克隆未重排的v-基因区段,并且使用含随机序列的pcr引物以编码高变cdr3区并且在体外实现重排,如hoogenboom和winter,j.mol.biol.,227:381-388(1992)所述。描述人抗体噬菌体文库的专利公开包括,例如:美国专利号5,750,373,和美国公布号2005/0079574,2005/0119455,2005/0266000,2007/0117126,2007/0160598,2007/0237764,2007/0292936,和2009/0002360。描述钙浓度依赖性和/或ph依赖性抗体噬菌体文库的专利公布包括,例如:pct专利公布号wo 2013/046722。
[0185]
在本文中,分离自人抗体文库的抗体或抗体片段被认为是人抗体或人抗体片段。
[0186]
6.多特异性抗体
[0187]
在某些实施方案中,本文中提供的抗体是多特异性抗体,例如,双特异性抗体。多特异性抗体是这样的单克隆抗体,其对至少两个不同的位点具有结合特异性。在某些实施方案中,双特异性抗体可以结合c5的两个不同的表位。双特异性抗体可以作为全长抗体或抗体片段被制备。
[0188]
用于制备多特异性抗体的技术包括但不限于具有不同特异性的两个免疫球蛋白
重链-轻链对的重组共表达(参见milstein和cuello,nature 305:537(1983)),wo 93/08829,以及traunecker等人,embo j.10:3655(1991)),和"凸起-入-孔洞(knob-in-hole)"工程改造(参见,例如,美国专利号5,731,168)。多特异性抗体也可以通过工程改造用于制备抗体fc-异源二聚分子的静电导向作用来制备(wo 2009/089004a1);交联两个以上抗体或片段(参见,例如,美国专利号4,676,980和brennan等人,science,229:81(1985));使用亮氨酸拉链以制备双特异性抗体(参见,例如,kostelny等人,j.immunol.,148(5):1547-1553(1992));使用"双抗体"技术以用于制备双特异性抗体片段(参见,例如,hollinger等人,proc.natl.acad.sci.usa,90:6444-6448(1993));和使用单链fv(scfv)二聚体(参见,例如,gruber等人,j.immunol.,152:5368(1994));以及制备三特异性抗体,如例如tutt等人j.immunol.147:60(1991)中所述。用于制备双特异性抗体的技术包括,但不限于,所用的体外制备后过程,其中将igg1半分子与其他igg1半分子重组,产生双特异性igg1抗体(参见,例如labrijn等人,j immunol.,187:3238(2011))。
[0189]
本文中还包括具有三个以上功能抗原结合位点的经改造的抗体,包括"章鱼抗体"(参见,例如,us 2006/0025576a1)。
[0190]
本文中的抗体或片段还包括
″
双重作用fab
″
或
″
daf
″
,其包含结合c5以及另一种不同的抗原的抗原结合位点(例如参见,us 2008/0069820)。
[0191]
7.抗体变体
[0192]
在某些实施方案中,考虑本文中提供的抗体的氨基酸序列变体。例如,理想的是提高抗体的结合亲和力和/或其他生物学性质。抗体的氨基酸序列变体可以通过向编码所述抗体的核苷酸序列引入合适的修饰或通过肽合成来制备。此种修饰包括,例如,自抗体氨基酸序列的缺失,和/或向抗体氨基酸序列中的插入和/或置换抗体氨基酸序列内的残基。可以进行缺失、插入和置换的任意组合以获得最终的构建体,前提是最终的构建体具有所需的特征,例如,抗原-结合。
[0193]
a)置换,插入和缺失变体
[0194]
在某些实施方案中,提供具有一个或多个氨基酸置换的抗体变体。置换诱变的目的位点包括hvr和fr。保守置换显示在表1中的
″
优选的置换
″
的标题下。更多的改变被提供在表1中的
″
示例性的置换
″
的标题下并且如以下关于氨基酸侧链分类进一步所述。氨基酸置换可以被引入目的抗体和进行所需活性(例如,保持的/提高的抗原结合,降低的免疫原性或提高的adcc或cdc)筛选的产品中。
[0195]
[表1]
[0196]
原始残基示例性的置换优选的置换ala(a)val;leu;ilevalarg(r)lys;gln;asnlysasn(n)gln;his;asp,lys;argglnasp(d)glu;asnglucys(c)ser;alasergln(q)asn;gluasnglu(e)asp;glnaspgly(g)alaala
his(h)asn;gln;lys;argargile(i)leu;val;met;ala;phe;正亮氨酸leuleu(l)正亮氨酸;ile;val;met;ala;pheilelys(k)arg;gln;asnargmet(m)leu;phe;tleleuphe(f)trp;leu;val;lle;ala;tyrtyrpro(p)alaalaser(s)thrthrthr(t)val;sersertrp(w)tyr;phetyrtyr(y)trp;phe;thr;serpheval(v)ile;leu;met;phe;ala;正亮氨酸leu
[0197]
根据共有侧链性质可以将氨基酸分组为:
[0198]
(1)疏水性:正亮氨酸,met,ala,val,leu,ile;
[0199]
(2)中性亲水性:cys,ser,thr,asn,gln;
[0200]
(3)酸性:asp,glu;
[0201]
(4)碱性:his,lys,arg;
[0202]
(5)影响链取向的残基:gly,pro;
[0203]
(6)芳香性:trp,tyr,phe。
[0204]
非保守置换需要将这些组之一的成员换成另一组的成员。
[0205]
一种类型的置换变体包括置换亲本抗体(例如,人源化抗体或人抗体)的一个或多个高变区残基。通常,被选择用于进一步研究的所得的变体相对于亲本抗体将具有某些生物学性质(例如,增加的亲和力,减小的免疫原性)的改变(例如,提高)和/或将基本上保持亲本抗体的某些生物学性质。示例性的置换变体是亲和力成熟抗体,其可以例如,使用基于噬菌体展示的亲和力成熟技术(如本文中描述的那些)常规制备。简言之,将一个或多个hvr残基突变并将变体抗体展示在噬菌体上并且筛选特定的生物学活性(例如,结合亲和力)。
[0206]
改变(例如,置换)可以在hvr中进行,例如,以提高抗体亲和力。此种改变可以在hvr"热点"中进行,所述hvr"热点"即在体细胞成熟过程期间以高频率进行突变的密码子编码的残基(参见,例如,chowdhury,methods mol.biol.207:179-196(2008)),和/或接触抗原的残基,测试所得的变体vh或vl的结合亲和力。通过构建二级文库并自其进行再选择的亲和力成熟已被描述于例如hoogenboom等人,methods in molecular biology 178:1-37(o'brien等人,编,human press,totowa,nj,(2001).)中。在亲和力成熟的一些实施方案中,通过多种方法中的任一种(例如,易错pcr,链改组,或寡核苷酸定向诱变)将多样性引入选择用于成熟的可变基因中。然后产生二级文库。然后筛选所述文库以鉴定任何具有所需亲和力的抗体变体。引入多样性的另一种方法包括hvr定向方法,其中若干hvr残基(例如,同时4-6个残基)被随机化。可以例如使用丙氨酸扫描诱变或建模,具体鉴定参与抗原结合的hvr残基。特别地,cdr-h3和cdr-l3通常被靶向。
[0207]
在某些实施方案中,置换、插入或缺失可以发生在一个或多个hvr内,只要这样的改变不显著减小抗体结合抗原的能力。例如,不显著减小结合亲和力的保守改变(例如,本
文中所述的保守置换)可以在hvr中进行。此种改变可以例如在hvr中接触抗原的残基的外部。在上述提供的变体vh和vl序列的某些实施方案中,各hvr是未改变的,或含不超过一个、两个或三个氨基酸置换。
[0208]
可用于鉴定可被靶向用于诱变的抗体残基或区域的方法被称为"丙氨酸扫描诱变",如cunningham和wells(1989)science,244:1081-1085所述。在该方法中,一个残基或一组目标残基(例如,带电荷的残基如arg,asp,his,lys和glu)被鉴定并被中性或带负电的氨基酸(例如,丙氨酸或聚丙氨酸)替代以确定是否影响抗体与抗原的相互作用。可以在对初始置换显示功能敏感性的氨基酸位置处引入其他的置换。备选地,或另外地,抗原-抗体复合物的晶体结构以确定抗体和抗原之间的接触点。此种接触残基及相邻残基可以被靶向或被排除作为用于置换的候选物。可以筛选变体以确定其是否具有所需的性质。
[0209]
氨基酸序列插入包括长度为一个残基至含一百个以上残基的多肽的氨基端和/或羧基端融合,以及单个或多个氨基酸残基的序列内插入。末端插入的实例包括具有n-端甲硫氨酰残基的抗体。抗体分子的其他插入变体包括将抗体的n端或c端与增加抗体血清半衰期的酶(例如,对于adept)或多肽融合。
[0210]
b)糖基化变体
[0211]
在某些实施方案中,本文中提供的抗体被改变成增加或减小抗体被糖基化的程度。向抗体添加糖基化位点或使其缺失糖基化位点可以通过改变氨基酸序列以致产生或除去一个或多个糖基化位点来容易实现。
[0212]
当抗体包含fc区时,可以改变与其连接的碳水化合物。由哺乳动物细胞产生的天然抗体典型地包含支链的、分两支的(biantennary)寡糖,所述寡糖通常通过n-连接连接至fc区的ch2结构域的asn297。参见,例如,wright等人tibtech 15:26-32(1997)。寡糖可以包括多种碳水化合物,例如,甘露糖,n-乙酰葡糖胺(glcnac),半乳糖和唾液酸,以及与分两支的寡糖结构的“茎”中的glcnac相连的岩藻糖。在一些实施方案中,可以进行本发明抗体中的寡糖的修饰以产生具有特定改善的性质的抗体变体。
[0213]
在一个实施方案中,提供抗体变体,其具有缺少与fc区(直接或间接)相连的岩藻糖的碳水化合物结构。例如,此种抗体中岩藻糖的量可以为1%至80%,1%至65%,5%至65%或20%至40%。岩藻糖的量通过计算相对于与asn 297相连的所有糖结构(例如复合物,杂合物和高甘露糖结构)的总和的asn297处的糖链内的岩藻糖的平均量来确定,如通过maldi-tof质谱法测量的,例如,如wo 2008/077546中所述。asn297是指位于fc区的位置297(fc区残基的eu编号)附近的天冬氨酸残基;然而,由于抗体中小的序列变异,asn297也可以位于位置297的上游或下游的约+/-3个氨基酸处,即,在位置294和300之间。此种岩藻糖基化变体可以具有提高的adcc功能。参见,例如,美国专利公布号us 2003/0157108(presta,l.);us 2004/0093621(kyowa hakko kogyo co.,ltd)。涉及"去岩藻糖基化"或"岩藻糖缺陷型"抗体变体的公开的实例变体包括:us 2003/0157108;wo 2000/61739;wo 2001/29246;us 2003/0115614;us 2002/0164328;us 2004/0093621;us 2004/0132140;us 2004/0110704;us 2004/0110282;us 2004/0109865;wo 2003/085119;wo 2003/084570;wo 2005/035586;wo 2005/035778;wo2005/053742;wo2002/031140;okazaki等人j.mol.biol.336:1239-1249(2004);yamane-ohnuki等人biotech.bioeng.87:614(2004)。能够制备去岩藻糖基化抗体的细胞系的实例包括蛋白岩藻糖基化缺陷型lec13 cho细胞
(ripka等人arch.biochem.biophys.249:533-545(1986);美国专利申请号us 2003/0157108a1,presta,l;和wo 2004/056312a1,adams等人,特别是实施例11),以及敲除的细胞系,如α-1,6-岩藻糖基转移酶基因fut8敲除的cho细胞(参见,例如,yamane-ohnuki等人biotech.bioeng.87:614(2004);kanda,y.等人,biotechnol.bioeng.,94(4):680-688(2006);和wo2003/085107)。
[0214]
还提供具有被二等分的寡糖的抗体变体,例如,其中与抗体fc区相连的分两支的寡糖被glcnac二等分。此种抗体变体可以具有减少的岩藻糖基化和/或提高的adcc功能。此种抗体变体的实例被描述于例如wo 2003/011878(jean-mairet等人);美国专利号6,602,684(umana等人);和us 2005/0123546(umana等人)中。还提供在与fc区相连的寡糖中具有至少一个半乳糖残基的抗体变体。此种抗体变体可以具有提高的cdc功能。此种抗体变体被描述于例如wo 1997/30087(patel等人);wo 1998/58964(raju,s.);和wo 1999/22764(raju,s.)中。
[0215]
c)fc区变体
[0216]
在某些实施方案中,可以将一个或多个氨基酸修饰引入到本文中提供的抗体的fc区中,由此产生fc区变体。fc区变体可以包含在一个或多个氨基酸位置处包含氨基酸修饰(例如,置换)的人fc区序列(例如,人igg1,igg2,igg3或igg4 fc区)。
[0217]
在某些实施方案中,本发明考虑这样的抗体变体,其具有一些但非全部效应子功能,这使其对于抗体体内半衰期是重要的而某些效应子功能(如补体和adcc)非必要或有害的应用是理想的候选物。可以进行体外和/或体内细胞毒性测定以确认cdc和/或adcc活性的减小/消除。例如,可以进行fc受体(fcr)结合测定以保证抗体缺少fcγr结合(因此可能缺少adcc活性),但是保持fcrn结合能力。介导adcc的主要细胞,nk细胞,仅表达fcγriii,而单核细胞表达fcγri,fcγrii和fcγriii。造血细胞上的fcr表达被概述于ravetch和kinet,annu.rev.immunol.9:457-492(1991)第464页上的表3中。用于评估目的分子的adcc活性的体外测定的非限制性实例被描述于美国专利号5,500,362(参见,例如,hellstrom,i.等人proc.nat'l acad.sci.usa 83:7059-7063(1986))和hellstrom,i等人,proc.nat'l acad.sci.usa 82:1499-1502(1985);5,821,337(参见bruggemann,m.等人,j.exp.med.166:1351-1361(1987))中。备选地,可以使用非放射性测定法(参见,例如,用于流式细胞术的acti
tm
非放射性细胞毒性测定(celltechnology,inc.mountain view,ca;和cytotox 96(注册商标)非放射性细胞毒性测定(promega,madison,wi)。可用于此种测定的效应器细胞包括外周血单核细胞(pbmc)和天然杀伤(nk)细胞。备选地,或另外地,可以在体内,例如在如clynes等人proc.nat'l acad.sci.usa95:652-656(1998)中所公开的动物模型中评估目的分子的adcc活性。也可以进行c1q结合测定以确认抗体不能结合c1q并且因此缺少cdc活性。参见,例如,wo 2006/029879和wo 2005/100402中的c1q和c3c结合elisa。为了评估补体激活,可以进行cdc测定(参见,例如,gazzano-santoro等人,j.immunol.methods 202:163(1996);cragg,m.s.等人,blood 101:1045-1052(2003);和cragg,m.s.与m.j.glennie,blood 103:2738-2743(2004))。也可以使用本领域中已知的方法进行fcrn结合和体内清除/半衰期测定(参见,例如,petkova,s.b.等人,int'l.immunol.18(12):1759-1769(2006))。
[0218]
具有减小的效应子功能的抗体包括具有fc区残基238,265,269,270,297,327和
329中的一个或多个的置换的抗体(美国专利号6,737,056)。此种fc突变体包括在氨基酸位置265,269,270,297和327中的两个以上处具有置换的fc突变体,包括所谓的残基265和297置换为丙氨酸的"dana"fc突变体(美国专利号7,332,581)。
[0219]
描述了具有提高的或减少的与fcr的结合的某些抗体变体。(参见,例如,美国专利号6,737,056;wo 2004/056312,和shields等人,j.biol.chem.9(2):6591-6604(2001)。)
[0220]
在某些实施方案中,抗体变体包含fc区,所述fc区具有一个或多个提高adcc的氨基酸置换,例如,fc区的位置298,333和/或334(残基的eu编号)处的置换。
[0221]
在一些实施方案中,在fc区中进行改变,所述改变导致改变的(即,提高的或减小的)c1q结合和/或补体依赖性细胞毒性(cdc),例如,如美国专利号6,194,551,wo 99/51642,和idusogie等人j.immunol.164:4178-4184(2000)中所述。
[0222]
us2005/0014934a1(hinton等人)中描述了这样的抗体,其具有增加的半衰期和提高的与负责将母体igg转送至胎儿的新生儿fc受体(fcrn)(guyer等人,j.immunol.117:587(1976)和kim等人,j.immunol.24:249(1994))的结合。这些抗体包含具有其中的一个或多个置换的fc区,所述置换提高fc区与fcrn的结合。此种fc变体包括在以下一个或多个fc区残基处具有置换的那些:238,256,265,272,286,303,305,307,311,312,317,340,356,360,362,376,378,380,382,413,424或434,例如,fc区残基434的置换(美国专利号7,371,826)。
[0223]
也参见,duncan&winter,nature 322:738-40(1988);美国专利号5,648,260;美国专利号5,624,821;以及涉及fc区变体的其他实例的wo 94/29351。
[0224]
d)半胱氨酸工程改造抗体变体
[0225]
在某些实施方案中,可能理想的是制备半胱氨酸工程改造抗体,例如,"thiomab",其中抗体的一个或多个残基被置换成半胱氨酸残基。在特别的实施方案中,置换的残基出现在抗体的接入位点处。通过将所述残基置换成半胱氨酸,反应性硫醇基团由此被置于抗体的接入位点处并且可以用于将抗体缀合至其他部分,如药物部分或接头-药物部分,从而产生免疫缀合物,如本文中进一步所述。在某些实施方案中,以下残基中的任意一个或多个可以被置换成半胱氨酸:轻链的v205(kabat编号);重链的a118(eu编号);和重链fc区的s400(eu编号)。半胱氨酸工程改造抗体可以如例如美国专利号7,521,541中所述产生。
[0226]
e)抗体衍生物
[0227]
在某些实施方案中,本文中提供的抗体可以被进一步修饰从而含有本领域中已知的并且可容易获得的另外的非蛋白部分。适用于抗体衍生化的部分包括但不限于水溶性聚合物。水溶性聚合物的非限制性实例包括但不限于聚乙二醇(peg),乙二醇/丙二醇共聚物,羧甲基纤维素,葡聚糖,聚乙烯醇,聚乙烯吡咯烷酮,聚-1,3-二氧杂环戊烷,聚-1,3,6-三烷,乙烯/马来酸酐共聚物,聚氨基酸(均聚物或无规共聚物),和葡聚糖或聚(n-乙烯基吡咯烷酮)聚乙二醇,聚丙二醇均聚物,聚氧化丙烯/氧化乙烯共聚物,聚氧乙基化多元醇(例如,甘油),聚乙烯醇及其混合物。聚乙二醇丙醛由于其在水中的稳定性而在制备中可以是有利的。聚合物可以具有任意分子量,并且可以是分支的或非分支的。与抗体相连的聚合物的数目可以变化,并且如果连接超过一个聚合物,则其可以是相同或不同的分子。通常,用于衍生化的聚合物的数量和/或种类可以基于以下考虑确定,包括但不限于,要改善的抗体的具体性质或功能,抗体衍生物是否可用于限定条件下的治疗,等等。
[0228]
在另一个实施方案中,提供可以通过暴露于辐射而被选择性加热的抗体与非蛋白
部分的缀合物。在一个实施方案中,非蛋白部分是碳纳米管(kam等人,proc.natl.acad.sci.usa 102:11600-11605(2005))。所述辐射可以具有任意波长,并且包括但不限于这样的波长,所述波长不损害正常细胞,但是将非蛋白部分加热至使邻近抗体-非蛋白部分的细胞被杀死的温度。
[0229]
b.重组方法和组合物
[0230]
抗体可以使用重组方法和组合物制备,例如,如美国专利号4,816,567中所述。在一个实施方案中,提供分离的核酸,其编码本文中所述的抗-c5抗体。此种核酸可以编码包含抗体vl的氨基酸序列和/或包含抗体vh的氨基酸序列(例如,抗体的轻链和/或重链)。在另一个实施方案中,提供一种或多种包含此种核酸的载体(例如,表达载体)。在另一个实施方案中,提供包含此种核酸的宿主细胞。在一个这样的实施方案中,宿主细胞包含(例如,转化有):(1)载体,所述载体包含核酸,所述核酸编码包含抗体vl的氨基酸序列和包含抗体vh的氨基酸序列,或(2)包含编码包含抗体vl的氨基酸序列的核酸的第一载体,和包含编码包含抗体vh的氨基酸序列的核酸的第二载体。在一个实施方案中,宿主细胞是真核的,例如,中国仓鼠卵巢(cho)细胞或淋巴细胞(例如,y0,ns0,sp20细胞)。在一个实施方案中,提供制备抗-c5抗体的方法,其中所述方法包括在适合于表达上文提供的抗体的条件下培养包含编码所述抗体的核酸的宿主细胞,和任选地从宿主细胞(或宿主细胞培养基)回收所述抗体。
[0231]
为了重组制备抗-c5抗体,将例如如上所述的编码抗体的核酸分离并插入到一种或多种载体中用于在宿主细胞中的进一步克隆和/或表达。此种核酸可以使用常规方法容易地分离并测序(例如,通过使用能够特异结合编码抗体重链和轻链的基因的寡核苷酸探针进行)。
[0232]
适用于克隆或表达编码抗体的载体的宿主细胞包括本文中所述的原核或真核细胞。例如,抗体可以在细菌中制备,特别是当不需要糖基化和fc效应子功能时。对于抗体片段和多肽在细菌中的表达,参见,例如,美国专利号5,648,237,5,789,199,和5,840,523。(还参见,charlton,methods in molecular biology,卷248(b.k.c.lo,编,humana press,totowa,nj,2003),第245-254页,其描述了在大肠杆菌中表达抗体片段)。在表达后,抗体可以以可溶级分从细菌细胞糊料分离并且可以被进一步纯化。
[0233]
除了原核生物以外,真核微生物如丝状真菌或酵母对于编码抗体的载体来说也是合适的克隆或表达宿主,包括糖基化途径已被"人源化"从而导致产生具有部分或完全人糖基化模式的抗体的真菌和酵母株系。参见gerngross,nat.biotech.22:1409-1414(2004),和li等人,nat.biotech.24:210-215(2006)。
[0234]
适用于表达糖基化抗体的宿主细胞还来源于多细胞生物(无脊椎动物和脊椎动物)。无脊椎细胞的实例包括植物和昆虫细胞。已经鉴定了多种杆状病毒株,其可以与昆虫细胞一起使用,特别是用于转染草地贪夜蛾(spodoptera frugiperda)细胞。
[0235]
植物细胞培养物也可以被用作宿主。参见,例如,美国专利号5,959,177,6,040,498,6,420,548,7,125,978和6,417,429(其描述了用于在转基因植物中生产抗体的plantibodies
tm
技术)。
[0236]
脊椎动物细胞也可以被用作宿主。例如,适合于悬浮生长的哺乳动物细胞系可以是有用的。有用的哺乳动物宿主细胞系的其他实例是sv40(cos-7)转化的猴肾cv1细胞系;
人胚肾细胞系(293或如例如graham等人,j.gen virol.36:59(1977)中所述的293细胞);幼仓鼠肾细胞(bhk);小鼠塞托利(sertoli)细胞(tm4细胞,如例如mather,biol.reprod.23:243-251(1980)中所述);猴肾细胞(cv1);非洲绿猴肾细胞(vero-76);人宫颈癌细胞(hela);犬肾细胞(mdck);布法罗大鼠肝细胞(brl 3a);人肺细胞(w138);人肝细胞(hep g2);小鼠乳腺肿瘤(mmt 060562);如例如mather等人,annals n.y.acad.sci.383:44-68(1982)中所述的tri细胞;mrc 5细胞;和fs4细胞。其他有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(cho)细胞,包括dhfr-cho细胞(urlaub等人,proc.natl.acad.sci.usa 77:4216(1980));和骨髓瘤细胞系如y0,ns0和sp2/0。对于适用于抗体生产的某些哺乳动物宿主细胞系的综述,参见,例如,yazaki和wu,methods in molecular biology,卷248(b.k.c.lo,编,humana press,totowa,nj),第255-268页(2003)。
[0237]
优选地通过多次皮下(sc)或腹膜内(ip)注射相关抗原和佐剂来在动物中制备多克隆抗体。可能有用的是使用双功能或衍生化试剂,例如,马来酰亚胺基苯甲酸琥珀酰亚胺酯(通过半胱氨酸残基缀合),n-羟基琥珀酰亚胺基(通过赖氨酸残基),戊二醛,琥珀酸酐,socl2,或r1n=c=nr,其中r和r1是不同的烷基,将相关抗原与在要被免疫的物种中具有免疫原性的蛋白(例如,钥孔血蓝蛋白(keyhole limpet hemocyanin),血清清蛋白,牛甲状腺球蛋白,或大豆胰蛋白酶抑制剂)缀合。
[0238]
通过将例如100μg或5μg蛋白或缀合物(分别用于兔或小鼠)与3体积的弗氏完全佐剂合并并将溶液在多个位点进行皮内注射,使动物(通常是非人哺乳动物)针对抗原、免疫原性缀合物或衍生物进行免疫。一个月后,通过在多个位点处的皮下注射,用在弗氏完全佐剂中的1/5至1/10初始量的肽或缀合物对动物进行加强免疫。7至14天后,给动物放血并且测定血清的抗体效价。对动物进行加强免疫直至效价平台。优选地,用与不同蛋白缀合和/或通过不同的交联剂缀合的相同抗原的缀合物对动物进行加强免疫。缀合物也可以作为蛋白融合物在重组细胞培养物中制备。此外,凝集剂如明矾适用于增强免疫应答。
[0239]
单克隆抗体获得自基本上同质的抗体群体,即,构成所述群体的个体抗体除了可能少量存在的可能的天然存在的突变和/或翻译后修饰(例如,异构化,酰胺化)以外是相同的。因此,定语"单克隆"指示不作为分立的抗体的混合物的抗体特征。
[0240]
例如,单克隆抗体可以使用杂交瘤方法制备,所述方法首先由kohler等人(1975)nature 256(5517):495-497描述。在杂交瘤方法中,小鼠或其他合适的宿主动物(如仓鼠)被如上文所述那样免疫以引起产生或能够产生与用于免疫的蛋白特异性结合的抗体的淋巴细胞。备选地,淋巴细胞可以在体外被免疫。
[0241]
免疫试剂将典型地包括抗原蛋白或其融合变体。通常,如果需要人来源的细胞,则使用外周血淋巴细胞(pbl),或如果需要非人哺乳动物来源,则使用脾细胞或淋巴结细胞。然后使用合适的融合试剂(如聚乙二醇)将淋巴细胞与永生的细胞系融合,从而形成杂交瘤细胞(goding,monoclonal antibodies:principles and practice(单克隆抗体:原理和实践),academic press(1986),第59-103页)。
[0242]
永生细胞系通常是转化的哺乳动物细胞,特别是啮齿类、牛和人来源的骨髓瘤细胞。通常,采用大鼠或小鼠骨髓瘤细胞系。将因此制备的杂交瘤细胞在合适的培养基中接种并生长,所述培养基优选地含有一种或多种抑制非融合的亲本骨髓瘤细胞生长或存活的物质。例如,如果亲本骨髓瘤细胞缺乏酶次黄嘌呤鸟嘌呤磷酸核糖基转移酶(hgprt或hprt),
则用于杂交瘤的培养基典型地将包含次黄嘌呤、氨基蝶呤和胸苷(hat培养基),其是阻止hgprt缺陷细胞生长的物质。
[0243]
优选的永生化骨髓瘤细胞是那些细胞,所述细胞有效融合,支持所选择的抗体生产细胞稳定高水平的产生抗体,并且对培养基如hat培养基敏感。其中,优选的是鼠骨髓瘤细胞系,如来源于可获得自沙克研究所细胞分配中心(salk institute cell distribution center,san diego,california usa)的mopc-21和mpc-11小鼠肿瘤的那些,和可获得自美国典型培养物保藏中心(american type culture collection,manassas,virginia usa)的sp-2细胞(及其衍生物,例如,x63-ag8-653)。人骨髓瘤和小鼠-人杂交骨髓瘤细胞系也被描述为用于生产人单克隆抗体(kozbor等人(1984)jimmunol 133(6):3001-3005;brodeur等人,monoclonal antibody production techniques and applications(单克隆抗体制备技术和应用),marcel dekker,inc.,new york(1987),第51-63页)。
[0244]
对于针对抗原的单克隆抗体的生产,测定培养杂交瘤细胞的培养基。优选地,由杂交瘤细胞生产的单克隆抗体的结合特异性通过免疫沉淀或通过体外结合测定,如放射性免疫测定(ria)或酶联免疫吸附测定(elisa)来确定。此种技术和测定是本领域中已知的。例如,结合亲和力可以通过munson和rodbard(1980)anal biochem 107(1):220-239的scatchard分析确定。
[0245]
在鉴定了产生具有所需特异性、亲和力和/或活性的抗体的杂交瘤细胞后,克隆可以通过有限稀释法进行亚克隆并通过标准方法生长(goding,同上)。适用于此目的的培养基包括,例如,d-mem或rpmi-1640培养基。此外,杂交瘤细胞可以作为肿瘤在哺乳动物中体内培养。
[0246]
通过常规免疫球蛋白纯化方法如,例如,蛋白a-sepharose,羟基磷灰石层析,凝胶电泳,透析,或亲和层析合适地将由亚克隆分泌的单克隆抗体与培养基、腹水或血清分离。
[0247]
抗体可以通过针对抗原免疫合适的宿主动物来制备。在一个实施方案中,抗原是包含全长c5的多肽。在一个实施方案中,抗原是包含c5的β链(seq id no:1)或α链(seq id no:10)的多肽。在一个实施方案中,抗原是包含c5的β链的mg1(seq id no:2),mg2(seq id no:3),mg3(seq id no:4),mg4(seq id no:5),mg5(seq id no:6),mg6(seq id no:7),mg1-mg2(seq id no:8)或mg3-mg6(seq id no:9)结构域或c5的α链的过敏毒素结构域(seq id no:11)或c5-c345c/ntr结构域(seq id no:12)的多肽。在一个实施方案中,抗原是包含与c5的β链的位置33-124的氨基酸对应的区域或由c5的α链(seq id no:10)的氨基酸1-999组成的片段的多肽。同样包括在本发明中的是通过针对所述抗原免疫动物制备的抗体。所述抗体可以结合以上"示例的抗-c5抗体"中所述的任何特征(单独地或组合地)。
[0248]
c.测定
[0249]
通过本领域已知的多种测定可以鉴定、筛选本文中提供的抗-c5抗体或表征其物理/化学性质和/或生物学活性。
[0250]
1.结合测定和其他测定
[0251]
在一个方面,例如,通过已知方法如elisa,蛋白质印迹,biacore等来测试本发明的抗体的抗原结合活性。
[0252]
在另一个方面,竞争测定可以用于鉴定与本文中所述的任一种抗-c5抗体竞争或
不竞争结合c5或c5的表位的抗体。在某些实施方案中,当此种竞争抗体过量存在时,其阻断(例如,减少)参比抗体与c5的结合达至少15%,20%,25%,30%,35%,40%,45%,50%,55%,60%,65%,70%,75%或更高。在一些情况中,结合被抑制达至少80%,85%,90%,95%或更高。在某些实施方案中,当非竞争性抗体过量存在时,其阻断(例如,减少)参比抗体与c5的结合至多1%,2%,3%,4%,5%,6%,7%,8%,9%,10%,11%,12%,13%,14%或更少。在某些实施方案中,此种竞争抗体结合的表位(例如,线性或构象表位)与本文中所述的抗-c5抗体(例如,表2中所述的抗-c5抗体)结合的表位相同。用于将抗体结合的表位作图的详细的示例性方法提供在morris(1996)"epitope mapping protocols,"在methods in molecular biology卷66(humana press,totowa,nj)中。
[0253]
在示例性竞争测定中,将固定的c5在溶液中孵育,所述溶液包含第一标记的抗体和第二未标记的抗体,所述第一标记的抗体结合c5,测试所述第二未标记的抗体与第一抗体竞争结合c5的能力。第二抗体可以存在于杂交瘤上清液中。作为对照,将固定的c5在包含第一标记的抗体但不包含第二未标记的抗体的溶液中孵育。在允许第一抗体与c5结合的条件下孵育后,除去过量的未结合的抗体,并测量与固定的c5结合的标记的量。如果相对于对照样品,在测试样品中,与固定的c5结合的标记的量显著减少,则这指示第二抗体与第一抗体竞争结合c5。参见harlow和lane(1988)antibodies:a laboratory manual(抗体:实验室手册)ch.14(cold spring harbor laboratory,cold spring harbor,ny)。
[0254]
在某些实施方案中,可以如下述确定本发明的抗-c5抗体是否结合特定的表位:在293细胞中表达其中c5上的氨基酸(除丙氨酸之外)用丙氨酸置换的c5点突变体,并且通过elisa、蛋白质印迹或biacore检测抗-c5抗体与所述c5突变体的结合;其中相对于所述抗-c5抗体与野生型c5的结合,对其与c5突变体的结合的实质性减少或消除表示所述抗-c5抗体结合包含c5上的所述氨基酸的表位。
[0255]
在另一个实施方案中,可以如下确定具有ph-依赖性结合特征的抗-c5抗体是否结合特定表位:将c5上的组氨酸残基被置换成另一种氨基酸(例如,酪氨酸)的c5点突变体在293细胞中表达,并且经由elisa,蛋白印迹或biacore测试抗-c5抗体与c5突变体的结合;其中抗-c5抗体在酸性ph与野生型c5的结合相对于其在酸性ph与c5突变体的结合实质性减少,指示抗-c5抗体结合c5上包含所述组氨酸残基的表位。在另外的实施方案中,抗-c5抗体与野生型c5在中性ph的结合相对于其与c5突变体在中性ph的结合没有实质性减少。
[0256]
2.活性测定
[0257]
在一个方面,提供测定以用于鉴定具有生物学活性的抗-c5抗体。生物学活性可以包括,例如,抑制c5的活化,阻止c5被切割而形成c5a和c5b,阻止c5转化酶接近c5上的切割位点,阻断由c5的活化引起的溶血活性等。还提供在体内和/或体外具有所述生物学活性的抗体。
[0258]
在某些实施方案中,针对所述生物学活性测试本发明的抗体。
[0259]
在某些实施方案中,通过例如isenman等人(1980)j immunol 124(1):326-331中所述的方法来确定测试抗体是否抑制c5被切割成c5a和c5b。在另一个实施方案中,这通过用于特异性检测切割的c5a和/或c5b蛋白的方法(例如,elisa或蛋白印迹)来确定。当在存在测试抗体的情况下(或在与测试抗体接触后)检测到c5的切割产物(即,c5a和/或c5b)的量减少时,则测试抗体被鉴定为是能够抑制c5切割的抗体。在某些实施方案中,c5a的浓度
journal of biological chemistry(2001)276(9),6591-6604;参见,例如,singh等人,journal of immunological methods(1982)50,109-114;参见,例如suzuki等人,journal of immunology(2010)184(4),1968-1976;参见,例如luo等人,mabs(2009)1(5)491-504)。例如,当通过固定fc受体进行elisa时,通过观察与检测单独的抗原分子或单独的抗体分子相比所检测的信号是否增加而检测免疫复合物的形成。
[0266]
d.免疫缀合物
[0267]
本发明还提供免疫缀合物,所述免疫缀合物包含本文中的抗-c5抗体,所述抗体缀合于一种或多种细胞毒性剂如化疗剂或药物,生长抑制剂,毒素(例如,蛋白毒素,细菌、真菌、植物或动物来源的酶活性毒素,或其片段),或放射性同位素。
[0268]
在一个实施方案中,免疫缀合物是抗体-药物缀合物(adc),其中抗体缀合于一种或多种药物,包括但不限于美坦生类化合物(maytansinoid)(参见美国专利号5,208,020,5,416,064和欧洲专利ep 0 425 235 b1);auristatin如单甲基auristatin(monomethylauristatin)药物部分de和df(mmae和mmaf)(参见美国专利号5,635,483和5,780,588,和7,498,298);多拉司他汀(dolastatin);加利车霉素(calicheamicin)或其衍生物(参见美国专利号5,712,374,5,714,586,5,739,116,5,767,285,5,770,701,5,770,710,5,773,001,和5,877,296;hinman等人,cancer res.53:3336-3342(1993);以及lode等人,cancer res.58:2925-2928(1998));蒽环类抗生素(anthracycline)如道诺霉素(daunomycin)或多柔比星(doxorubicin)(参见kratz等人,current med.chem.13:477-523(2006);jeffrey等人,bioorganic&med.chem.letters 16:358-362(2006);torgov等人,bioconj.chem.16:717-721(2005);nagy等人,proc.natl.acad.sci.usa 97:829-834(2000);dubowchik等人,bioorg.&med.chem.letters 12:1529-1532(2002);king等人,j.med.chem.45:4336-4343(2002);和美国专利号6,630,579);甲氨蝶呤(methotrexate);长春地辛(vindesine);紫杉烷(taxane)如多西他赛(docetaxel),紫杉醇(paclitaxel),拉罗他赛(larotaxel),替司他赛(tesetaxel)和奥他赛(ortataxel);新月毒素(trichothecene);和cc1065。
[0269]
在另一个实施方案中,免疫缀合物包含本文中所述的抗体,所述抗体缀合于酶活性毒素或其片段,包括但不限于白喉a链,白喉毒素的非结合活性片段,外毒素a链(来自铜绿假单胞菌(pseudomonas aeruginosa)),蓖麻毒素a链,相思豆毒素a链,蒴莲根毒素a链,α-八叠球菌,油桐(aleurites fordii)蛋白,石竹素(dianthin)蛋白,美洲商陆(phytolaca americana)蛋白(papi,papii和pap-s),苦瓜(momordica charantia)抑制剂,麻风树毒蛋白,巴豆毒蛋白,肥皂草(sapaonaria officinalis)抑制剂,白树毒素,丝林霉素(mitogellin),局限曲菌素(restrictocin),酚霉素(phenomycin),依诺霉素(enomycin),和单胞霉烯族毒素(tricothecene)。
[0270]
在另一个实施方案中,免疫缀合物包含如本文中所述的抗体,所述抗体缀合于放射性原子从而形成放射性缀合物。多种放射性同位素可用于制备放射性缀合物。实例包括at
211
,i
131
,i
125
,y
90
,re
186
,re
188
,sm
153
,bi
212
,p
32
,pb
212
和lu的放射性同位素。当放射性缀合物用于检测时,其可以包含放射性原子用于闪烁法研究,例如tc99m或i123,或自旋标记用于核磁共振(nmr)成像(也被称为磁共振成像,mri),如碘-123(再一次),碘-131,铟-111,氟-19,碳-13,氮-15,氧-17,钆,锰或铁。
[0271]
抗体和细胞毒性剂的缀合物可以使用多种双功能蛋白偶联剂制备,所述偶联剂如n-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(spdp),琥珀酰亚胺基-4-(n-马来酰亚胺基甲基)环己烷-1-甲酸酯(smcc),亚氨基硫烷盐酸盐(it),亚胺基酯的双功能衍生物(如二甲基己二酸hcl),活性酯(如二琥珀酰亚胺基辛二酸酯),醛(如戊二醛),二叠氮基化合物(如二(对叠氮基苯甲酰基)己二胺),二-重氮基衍生物(如二-(对重氮基苯甲酰基)-乙二胺),二异氰酸酯(如甲苯2,6-二异氰酸酯),和二-活性氟化合物(如1,5-二氟-2,4-二硝基苯)。例如,蓖麻毒素免疫毒素可以如vitetta等人,science 238:1098(1987)中所述制备。碳-14-标记的1-异硫氰酰苄基-3-甲基二亚乙基三胺五乙酸(mx-dtpa)是用于将放射性核素缀合至抗体的示例性螯合剂。参见wo94/11026。接头可以是"可切割的接头",其促进细胞毒性药物在细胞中的释放。例如,可以使用酸不稳定接头,肽酶敏感性接头,光不稳定接头,二甲基接头或含二硫键的接头(chari等人,cancer res.52:127-131(1992);美国专利号5,208,020)。
[0272]
本文中的免疫缀合物或adc明确考虑,但不限于此种利用交联剂试剂制备的缀合物,所述交联剂包括,但不限于,bmps,emcs,gmbs,hbvs,lc-smcc,mbs,mpbh,sbap,sia,siab,smcc,smpb,smph,硫代-emcs,硫代-gmbs,硫代-kmus,硫代-mbs,硫代-siab,硫代-smcc,和硫代-smpb,以及svsb(琥珀酰亚胺基-(4-乙烯基砜)苯甲酸酯),其是市售的(例如,来自pierce biotechnology,inc.,rockford,il.,u.s.a)。
[0273]
e.用于诊断和检测的方法和组合物
[0274]
在某些实施方案中,本文中提供的任一抗-c5抗体都可用于检测生物学样品中c5的存在。如本文中使用的,术语"检测"包括定量检测或定性检测。在某些实施方案中,生物学样品包括细胞或组织,如血清,全血,血浆,组织活检样品,组织样品,细胞悬液,唾液,痰,口腔液,脑脊液,羊水,腹水,乳汁,初乳,乳腺分泌,淋巴液,尿液,汗液,泪液,胃液,滑液,腹膜液,眼晶状体液和黏液。
[0275]
在一个实施方案中,提供用于诊断或检测方法的抗-c5抗体。在另一个方面,提供检测c5在生物学样品中存在的方法。在某些实施方案中,所述方法包括使生物学样品与如本文中所述的抗-c5抗体在允许抗-c5抗体结合c5的条件下接触,并且检测在抗-c5抗体和c5之间是否形成复合物。此种方法可以是体外或体内方法。在一个实施方案中,将抗-c5抗体用于选择适合于利用抗-c5抗体治疗的受试者,例如,其中c5是用于选择患者的生物标志物。
[0276]
可以使用本发明的抗体诊断的示例性的病症包括类风湿性关节炎(ra);系统性红斑狼疮(sle);狼疮性肾炎;缺血再灌注损伤(iri);哮喘(asthma);阵发性夜间血红蛋白尿(pnh);溶血性尿毒症综合征(hemolytic uremic syndrome,hus)(例如,非典型溶血性尿毒症综合征(ahus));致密沉积物病(ddd);视神经脊髓炎(neuromyelitis optica,nmo);多病灶运动神经病(multifocal motor neuropathy,mmn);多发性硬化(multiple sclerosis,ms);系统性硬化病(systemic sclerosis);黄斑变性(macular degeneration)(例如,年龄相关性黄斑变性(amd));溶血,肝酶升高,和低血小板(hellp)综合征;血栓性血小板减少性紫癜(ttp);自发性流产;大疱性表皮松解;再发性流产;妊娠子痫(pre-eclampsia);外伤性脑损伤;重症肌无力(myasthenia gravis);冷凝集素疾病(cold agglutinin disease);舍格伦综合征(sjoegren's syndrome);皮肌炎(dermatomyositis);大疱性类天疱疮
(bullous pemphigoid);光线损害性反应(phototoxic reactions);志贺毒素大肠杆菌相关的溶血性尿毒症综合征(shiga toxin e.coli-related hemolytic uremic syndrome);典型的或感染性溶血性尿毒症综合征(typical or infectious hemolytic uremic syndrome,thus);c3肾小球肾炎;抗中性白细胞细胞质抗体(anca)-相关的脉管炎;体液和血管移植排异(humoral and vascular transplant rejection);急性抗体介导的排异(acute antibody mediated rejection,amr);移植功能障碍(graft dysfunction);心肌梗死(myocardial infarction);同种异体移植物(an allogenic transplant);败血病(sepsis);冠状动脉疾病(coronary artery disease);遗传性血管性水肿(hereditary angioedema);皮肌炎;格雷夫斯病(graves'disease);动脉粥样硬化(atherosclerosis);阿尔茨海默病(alzheimer's disease,ad);亨廷顿病(huntington's disease);克-雅病(creutzfeld-jacob disease);帕金森病(parkinson's disease);癌症;伤口;感染性休克(septic shock);脊髓损伤(spinal cord injury);葡萄膜炎(uveitis);糖尿病性眼病(diabetic ocular diseases);早产儿视网膜病(retinopathy of prematurity);肾小球肾炎;膜性肾炎(membranous nephritis);免疫球蛋白a肾病;成人呼吸窘迫综合征(adult respiratory distress syndrome,ards);慢性阻塞性肺疾病(chronic obstructive pulmonary disease,copd);囊性纤维化(cystic fibrosis);溶血性贫血(hemolytic anemia);阵发性冷性血红蛋白尿症(paroxysmal cold hemoglobinuria);过敏性休克(anaphylactic shock);过敏症(allergy);骨质疏松症(osteoporosis);骨关节炎(osteoarthritis);桥本甲状腺炎(hashimoto's thyroiditis);i型糖尿病;银屑病(psoriasis);天疱疮(pemphigus);自身免疫性溶血性贫血(autoimmune hemolytic anemia,aiha);特发性血小板减少性紫癜(idiopathic thrombocytopenic purpura,itp);古德帕斯丘综合征(goodpasture syndrome);德戈斯病(degos disease);抗磷脂综合征(antiphospholipid syndrome,aps);严重的aps(catastrophic aps,caps);心血管病症(cardiovascular disorder);心肌炎(myocarditis);脑血管障碍(cerebrovascular disorder);外周血管病症(peripheral vascular disorder);肾血管病症(renovascular disorder);肠系膜/肠血管病症(mesenteric/enteric vascular disorder);脉管炎(vasculitis);亨诺赫-舍恩莱茵紫癜肾炎(henoch-schoenlein purpura nephritis);塔卡亚萨病(takayasu's disease);扩张型心肌病(dilated cardiomyopathy);糖尿病性血管疾病(diabetic angiopathy);川畸病(kawasaki's disease)(动脉炎);静脉气栓(venous gas embolus,vge),支架放置后的再狭窄(restenosis following stent placement);旋转斑块切除术(rotational atherectomy);膜状肾病(membraneous nephropathy);吉兰-巴雷综合征(guillain-barre syndrome,gbs);菲希尔综合征(fisher syndrome);抗原诱发关节炎(antigen-induced arthritis);滑膜炎(synovial inflammation);病毒感染;细菌感染;真菌感染;和由心肌梗死、心肺转流术(cardiopulmonary bypass)和血液透析导致的损伤。
[0277]
在某些实施方案中,提供标记的抗-c5抗体。标记包括但不限于直接检测的标记或部分(如荧光标记,发色团标记,电子致密标记,化学发光标记,和放射性标记),以及间接检测(例如,通过酶反应或分子相互作用间接检测)的部分如酶或配体。示例性标记包括但不限于放射性同位素
32
p,
14
c,
125
i,3h,和
131
i,荧光团如稀土螯合物或荧光素及其衍生物,罗丹
明及其衍生物,丹酰,伞形酮,荧光素酶,例如,萤火虫荧光素酶和细菌荧光素酶(美国专利号4,737,456),萤光素,2,3-二氢酞嗪二酮,辣根过氧化物酶(hrp),碱性磷酸酶,β-半乳糖苷酶,葡糖淀粉酶,溶菌酶,糖氧化酶,例如,葡糖氧化酶,半乳糖氧化酶,和葡糖-6-磷酸脱氢酶,杂环氧化酶如尿酸酶和黄嘌呤氧化酶,与利用过氧化氢的酶偶联以氧化染料前体如hrp,乳糖过氧化物酶,或微过氧化物酶,生物素/抗生物素蛋白,自旋标记,噬菌体标记,稳定的自由基等。
[0278]
f.药物制剂
[0279]
如本文中所述的抗-c5抗体的药物制剂通过将具有所需程度的纯度的所述抗体与一种或多种任选的药用载体(remington's pharmaceutical sciences第16版,osol,a.编(1980))混合而被制备成冻干制剂或水溶液的形式。药用载体在使用的剂量和浓度下对于接受者通常是无毒性的,并且包括,但不限于:缓冲剂如磷酸盐,柠檬酸盐,和其他有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(如十八烷基二甲基苄基氯化铵;氯化六甲双铵;苯扎氯铵;苄索氯铵;苯酚,丁基或苄基醇;烷基对羟苯甲酸酯如对羟苯甲酸甲酯或对羟苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(小于约10个残基的)多肽;蛋白,如血清清蛋白,明胶,或免疫球蛋白;亲水性聚合物如聚乙烯吡咯烷酮;氨基酸如甘氨酸,谷氨酰胺,天冬酰胺,组氨酸,精氨酸,或赖氨酸;单糖,二糖,和其他碳水化合物,包括葡萄糖,甘露糖,或糊精;螯合剂如edta;糖如蔗糖,甘露醇,海藻糖或山梨醇;成盐抗衡离子如钠;金属复合物(例如,zn-蛋白复合物);和/或非离子表面活性剂如聚乙二醇(peg)。本文中的示例性药用载体还包括间质药物分散剂如可溶性中性活性透明质酸酶糖蛋白(shasegp),例如,人可溶性ph-20透明质酸酶糖蛋白,如rhuph20(hylenex(注册商标),baxter international,inc.)。某些示例性shasegp和使用方法,包括rhuph20,记载在美国专利公布号2005/0260186和2006/0104968中。在一个方面,将shasegp与一种或多种另外的糖胺聚糖酶如软骨素酶组合。
[0280]
示例性冻干的抗体制剂记载在美国专利号6,267,958中。含水抗体制剂包括美国专利号6,171,586和wo2006/044908中描述的那些,后者的制剂包含组氨酸-乙酸缓冲液。
[0281]
当需要时,本文中的制剂还可以含有超过一种治疗的特定适应证所需要的活性成分,优选地具有相互之间没有不利影响的互补活性的那些。此种活性成分合适地以对目的用途有效的量存在于组合中。
[0282]
活性成分可以被包封在例如通过凝聚技术或通过界面聚合制备的微胶囊中,例如,分别为羟甲基纤维素或明胶微胶囊和聚-(甲基丙烯酸甲酯)微胶囊,在胶体药物递送系统(例如,脂质体,清蛋白微球,微乳液,纳米粒和纳米胶囊)中或在粗乳液中。此种技术被公开在remington's pharmaceutical sciences第16版,osol,a.编(1980)中。
[0283]
可以制备缓释制剂。缓释制剂的合适的实例包括含抗体的固体疏水聚合物的半渗透性基质,所述基质的形式为有形物品,例如,薄膜或微胶囊。
[0284]
可用于体内施用的制剂通常是无菌的。无菌可以例如通过经由无菌过滤膜过滤而容易地实现。
[0285]
g.治疗方法和组合物
[0286]
本文中提供的任一抗-c5抗体组合都可以用于治疗方法中。
[0287]
在一个方面,提供用作药物的两种以上抗-c5抗体的组合。在另外的方面,提供用
于治疗其中涉及过量的或不受控制的c5活化的补体介导的疾病或病症的两种以上抗-c5抗体的组合。在某些实施方案中,提供用于治疗方法的两种以上抗-c5抗体的组合。在某些实施方案中,本发明提供两种以上抗-c5抗体的组合,其用于治疗患有其中涉及过量的或不受控制的c5活化的补体介导的疾病或病症的个体的方法,所述方法包括向个体施用有效量的两种以上抗-c5抗体的组合。在一个这样的实施方案中,所述方法还包括向个体施用有效量的至少一种另外的治疗剂。
[0288]
当抗原是可溶蛋白时,抗体与其抗原的结合可以导致所述抗原在血浆中延长的半衰期(即,所述抗原从血浆中减少的清除),原因在于所述抗体本身在血浆中具有较长的半衰期并且作为载体。这是由于抗原-抗体复合物通过fcrn经由内体途径在细胞内的再循环导致(roopenian和akilesh(2007)nat rev immunol 7(9):715-725)。然而,预测具有ph依赖性结合特征的抗体(其在中性细胞外环境中与其抗原结合,而在进入细胞后在酸性内体区室中将其释放)相对于其以ph不依赖方式结合的对应体在抗原中和和清除方面具有优越的特性(igawa等人(2010)nature biotechnol 28(11);1203-1207;devanaboyina等人(2013)mabs 5(6):851-859;国际专利申请公布号:wo 2009/125825)。
[0289]
在其他实施方案中,本发明提供两种以上抗-c5抗体的组合,其用于提高c5从血浆中的清除。在某些实施方案中,本发明提供两种以上抗-c5抗体的组合,其用于提高c5从个体血浆中清除的方法中,所述方法包括向所述个体施用有效量的所述两种以上抗-c5抗体的组合,以提高c5从血浆中的清除。在一个实施方案中,与不具有ph依赖性结合特征的常规抗-c5抗体相比,两种以上抗-c5抗体的组合提高c5从血浆中的清除。根据任一以上实施方案的"个体"优选是人。
[0290]
在其他实施方案中,本发明提供两种以上抗-c5抗体的组合,其用于抑制c5在血浆中的积聚。在某些实施方案中,本发明提供两种以上抗-c5抗体的组合,其用在抑制c5在个体血浆中的积聚的方法中,所述方法包括向所述个体施用有效量的所述两种以上抗-c5抗体的组合,从而抑制c5在血浆中的积聚。在一个实施方案中,c5在血浆中的积聚是抗原-抗体复合物形成的结果。在另一个实施方案中,与不具有ph依赖性结合特征的常规抗-c5抗体相比,两种以上抗-c5抗体的组合抑制c5在血浆中的组合。根据任一以上实施方案的"个体"优选是人。
[0291]
本发明的两种以上抗-c5抗体的组合可以抑制c5的活化。在其他实施方案中,本发明提供两种以上抗-c5抗体的组合,其用于抑制c5的活化。在某些实施方案中,本发明提供两种以上抗-c5抗体的组合,其用作抑制个体中c5的活化的方法中,所述方法包括向所述个体施用有效量的两种以上抗-c5抗体的组合,从而抑制c5的活化。在一个实施方案中,通过抑制c5的活化而阻抑c5介导的细胞毒性。根据任一以上实施方案的"个体"优选是人。
[0292]
在另一个方面,本发明提供两种以上抗-c5抗体的组合在制备或配制药物中的用途。在一个实施方案中,所述药物用于治疗其中涉及过量的或不受控制的c5活化的补体介导的疾病或病症。在另一个实施方案中,所述药物用于治疗其中涉及过量的或不受控制的c5活化的补体介导的疾病或病症的方法,所述方法包括向患有其中涉及过量的或不受控制的c5活化的补体介导的疾病或病症的个体施用有效量的药物。在一个这样的实施方案中,所述方法还包括向个体施用有效量的至少一种另外的治疗剂。根据任一以上实施方案的"个体"优选是人。
[0293]
在另一个实施方案中,所述药物用于提高c5从血浆中的清除。在另一个实施方案中,所述药物用在提高c5从个体血浆中清除的方法中,所述方法包括向所述个体施用有效量的所述药物,从而提高c5从血浆中的清除。在一个实施方案中,与不具有ph依赖性结合特征的常规抗-c5抗体相比,两种以上抗-c5抗体的组合提高c5从血浆中的清除。根据任一以上实施方案的"个体"可以是人。
[0294]
在另一个实施方案中,所述药物用于抑制c5在血浆中的积聚。在另一个实施方案中,所述药物用在抑制c5在个体血浆中积聚的方法中,所述方法包括向所述个体施用有效量的所述药物,从而抑制c5在血浆中的积聚。在一个实施方案中,c5在血浆中的积聚是形成抗原-抗体复合物的结果。在另一个实施方案中,与不具有ph依赖性结合特征的常规抗-c5抗体相比,两种以上抗-c5抗体的组合抑制c5在血浆中的积聚。根据任一以上实施方案的"个体"可以是人。
[0295]
本发明的两种以上抗-c5抗体的组合可以抑制c5的活化。在另一个实施方案中,所述药物用于抑制c5的活化。在另一个实施方案中,所述药物用在抑制个体中c5的活化的方法中,所述方法包括向所述个体施用有效量的所述药物,以抑制c5的活化。在一个实施方案中,通过抑制c5的活化阻抑由c5介导的细胞毒性。根据任一以上实施方案的"个体"可以是人。
[0296]
在另一方面,本发明提供用于治疗其中涉及过量的或不受控制的c5活化的补体介导的疾病或病症的方法。在一个实施方案中,所述方法包括向具有此类其中涉及过量的或不受控制的c5活化的补体介导的疾病或病症的个体施用有效量的两种以上抗-c5抗体的组合。在一个这样的实施方案中,所述方法还包括向所述个体施用有效量的至少一种另外的治疗剂。根据任一以上实施方案的"个体"可以是人。
[0297]
在另一方面,本发明提供用于提高c5从个体血浆中清除的方法。在一个实施方案中,所述方法包括向所述个体施用有效量的两种以上抗-c5抗体的组合,从而提高c5从血浆中的清除。在一个实施方案中,与不具有ph依赖性结合特征的常规抗-c5抗体相比,两种以上抗-c5抗体的组合提高c5从血浆中的清除。在一个实施方案中,“个体”是人。
[0298]
在另一方面,本发明提供用于抑制c5在个体血浆中的积聚的方法。在一个实施方案中,所述方法包括向所述个体施用有效量的两种以上抗-c5抗体的组合,从而抑制c5在血浆中的积聚。在一个实施方案中,c5在血浆中的积聚是形成抗原-抗体复合物的结果。在另一个实施方案中,与不具有ph依赖性结合特征的常规抗-c5抗体相比,两种以上抗-c5抗体的组合抑制c5在血浆中的积聚。在一个实施方案中,“个体”是人。
[0299]
本发明的两种以上抗-c5抗体的组合可以抑制c5的活化。在另一方面,本发明提供用于抑制个体中c5的活化的方法。在一个实施方案中,所述方法包括向所述个体施用有效量的两种以上抗-c5抗体的组合,从而抑制c5的活化。在一个实施方案中,通过抑制c5的活化而阻抑由c5介导的细胞毒性。在一个实施方案中,“个体”是人。
[0300]
包含在本发明的组合中的两种以上抗-c5抗体可以配制在抑制组合物中或配制在分开的组合物中。包含在本发明的组合中的配制在分开的组合物中的两种以上的抗-c5抗体可以在同一时间点或不同的时间点施用给个体。包含在本发明的组合中的两种以上抗-c5抗体的施用典型地以确定的时间时期(取决于所选的组合,通常为数分数、数小时、数天或数周)进行。本发明的组合旨在包括以顺序方式施用所包含的两种以上的抗-c5抗体,即,
在不同的时间(以任意顺序)施用每种抗-c5抗体,以及以同时(同时发生)的方式施用两种以上的抗-c5抗体。同时施用可以作为分开的药物制剂或作为单一剂型(例如,作为单一药物制剂)。在一些实施方案中,另外一种或多种抗-c5抗体每天施用一次,例如,在早上或在晚上施用。在一些实施方案中,另外一种或多种抗-c5抗体每天在一天中的任意时间施用一次。在一些实施方案中,在第一个960mg剂量(例如,四个240mg的容器)的抗-c5抗体i之后约12小时是第二个960mg剂量(例如,四个240mg的容器)的抗-c5抗体i。在一些实施方案中,抗-c5抗体i在早上施用一次并在晚上施用一次。
[0301]
在另一方面,本发明提供包含本文提供的组合中所包含的两种以上抗-c5抗体中的任一种的药物制剂,例如,以用于上述任一种治疗方法。在一个实施方案中,药物制剂包含本文提供的组合中所包含的两种以上抗-c5抗体中的任一种和药用载体。在另一个实施方案中,药物制剂包含本文提供的组合中所包含的两种以上抗-c5抗体中的任一种和至少一种另外的治疗剂。在另一方面,本发明提供包含本文提供的组合中所包含的两种以上抗-c5抗体中的任一种的药物制剂,例如,以用在上述任一治疗方法中。在一个实施方案中,药物制剂包含本文提供的两种以上抗-c5抗体的组合和药用载体。在另一个实施方案中,药物制剂包含本文提供的两种以上抗-c5抗体的组合和至少一种另外的治疗剂。
[0302]
在某些实施方案中,其中涉及过量的或不受控制的c5活化的补体介导的疾病或病症选自由下述组成的组:类风湿性关节炎(ra);系统性红斑狼疮(sle);狼疮性肾炎;缺血再灌注损伤(iri);哮喘;阵发性夜间血红蛋白尿(pnh);溶血性尿毒症综合征(hus)(例如,非典型溶血性尿毒症综合征(ahus));致密沉积物病(ddd);视神经脊髓炎(nmo);多病灶运动神经病(mmn);多发性硬化(ms);系统性硬化病;黄斑变性(例如,年龄相关性黄斑变性(amd));溶血,肝酶升高,和低血小板(hellp)综合征;血栓性血小板减少性紫癜(ttp);自发性流产;大疱性表皮松解;再发性流产;妊娠子痫;外伤性脑损伤;重症肌无力;冷凝集素疾病;舍格伦综合征;皮肌炎;大疱性类天疱疮;光线损害性反应;志贺毒素大肠杆菌相关的溶血性尿毒症综合征;典型的或感染性溶血性尿毒症综合征(thus);c3肾小球肾炎;抗中性白细胞细胞质抗体(anca)-相关的脉管炎;体液和血管移植排异;急性抗体介导的排异(amr);移植功能障碍;心肌梗死;同种异体移植物;败血病;冠状动脉疾病;遗传性血管性水肿;皮肌炎;格雷夫斯病;动脉粥样硬化;阿尔茨海默病(ad);亨廷顿病;克-雅病;帕金森病;癌症;伤口;感染性休克;脊髓损伤;葡萄膜炎;糖尿病性眼病;早产儿视网膜病;肾小球肾炎;膜性肾炎;免疫球蛋白a肾病;成人呼吸窘迫综合征(ards);慢性阻塞性肺疾病(copd);囊性纤维化;溶血性贫血;阵发性冷性血红蛋白尿症;过敏性休克;过敏症;骨质疏松症;骨关节炎;桥本甲状腺炎;i型糖尿病;银屑病;天疱疮;自身免疫性溶血性贫血(aiha);特发性血小板减少性紫癜(itp);古德帕斯丘综合征;德戈斯病;抗磷脂综合征(aps);严重的aps(caps);心血管病症;心肌炎;脑血管障碍;外周血管病症;肾血管病症;肠系膜/肠血管病症;脉管炎;亨诺赫-舍恩莱茵紫癜肾炎;塔卡亚萨病;扩张型心肌病;糖尿病性血管疾病;川畸病(动脉炎);静脉气栓(vge),支架放置后的再狭窄;旋转斑块切除术;膜状肾病;吉兰-巴雷综合征(gbs);菲希尔综合征;抗原诱发关节炎;滑膜炎;病毒感染;细菌感染;真菌感染;和由心肌梗死、心肺转流术和血液透析导致的损伤。
[0303]
本发明的两种以上抗体的组合可以单独地用于治疗或与其他试剂组合地用于治疗。例如,本发明的两种以上抗体的组合可以与至少一种另外的治疗剂共同施用。
[0304]
上述的此种组合治疗包括组合施用(其中两种以上治疗剂被包含在同一或分开的制剂中)和分开施用,在此种情况中,本发明的两种以上抗体的组合的施用可以发生在一种或多种另外的治疗剂的施用之前,同时,和/或之后。在一个实施方案中,两种以上抗-c5抗体的组合的施用和另外的治疗剂的施用彼此发生在约一个月以内,或在约一周、两周或三周以内,或在约一天、两天、三天、四天、五天或六天以内。
[0305]
本发明的两种以上抗体的组合(以及任意另外的治疗剂)可以通过任何合适的手段施用,包括肠胃外施用,肺内施用,和鼻内施用,以及,如果局部治疗需要,病变内施用。肠胃外输注包括肌肉内施用,静脉内施用,动脉内施用,腹膜内施用,或皮下施用。用药可以是通过任何合适的途径,例如,通过注射,如静脉内或皮下注射,这部分取决于施用是短暂的还是长期的。本文中考虑多种用药时间方案,包括但不限于单次施用或在多个时间点的多次施用,推注施用,和脉冲输注。
[0306]
本发明的两种以上抗体的组合以与良好医学实践一致的方式配制、用药和施用。该语境中考虑的因素包括治疗的具体疾病,治疗的具体哺乳动物,个体患者的临床状况,病因,药剂递送位点,给药方法,给药时间安排,以及医疗从业者已知的其他因素。两种以上的抗体不需要,但任选地,与目前用于预防或治疗目标疾病的一种或多种药剂配制在一起。此种其他药剂的有效量取决于制剂中存在的每种抗体的量,疾病或治疗的类型,以及以上讨论的其他因素。这些通常以与本文中所述相同的剂量和给药途径使用,或为本文中所述剂量的约1至99%,或以经验/临床确定为合适的任何剂量和任何途径使用。
[0307]
为了预防或治疗疾病,本发明的两种以上抗体的组合的适当剂量(当单独使用或与一种或多种其他另外的治疗剂组合使用时)将取决于待治疗的疾病的类型,两种以上抗体的组合的类型,疾病的严重度和病程,两种以上抗体的组合的施用是用于预防目的还是用于治疗目的,之前的治疗,患者的临床史和对两种以上抗体的组合的反应,以及主治医生的判断。两种以上抗体的组合被合适地一次性或在一系列治疗中施用于患者。根据疾病的类型和严重度,约1μg/kg至15mg/kg(例如0.1mg/kg-10mg/kg)的每种抗体可以是用于施用至患者的初始候选剂量,不论是,例如,通过一次或多次分开的施用,还是通过连续输注。一个典型的日剂量可以为约1μg/kg至100mg/kg以上,这取决于以上提及的因素。对于在若干天或更长的时间内的重复施用,根据条件,通常可以持续治疗直至出现所需的疾病症状的阻抑。两种以上抗体的组合的一个示例性剂量将处在约0.05mg/kg至约10mg/kg的范围内。因此,可以将一个或多个剂量,约0.5mg/kg,2.0mg/kg,4.0mg/kg或10mg/kg(或其任意组合)施用于患者。此种剂量可以间歇施用,例如,每周一次或每三周一次(例如,使得患者接受约两个至约二十个,或例如,约六个剂量的两种以上抗体的组合)。可以施用初始较高的加载剂量,继之以一个或多个较低的剂量。该治疗过程可以容易地通过常规技术和测定监测。
[0308]
要理解的是,任何上述制剂或治疗方法都可以使用本发明的免疫缀合物(以代替包含在本发明的组合中的每种抗-c5抗体或除了包含在本发明的组合中的每种抗-c5抗体以外)进行。
[0309]
h.制品
[0310]
在本发明的另一个方面,提供制品,其包含可用于治疗、预防和/或诊断上述疾病的材料。所述制品包括容器和在容器上或与容器相连的标签或包装插页。合适的容器包括,例如,瓶子,小瓶,注射器,iv溶液袋等。所述容器可以由多种材料(如玻璃或塑料)制成。所
述容器盛装组合物,所述组合物是单独的或与对于治疗、预防和/或诊断病症有效的另一种组合物组合,并且所述容器可以具有无菌接入端口(例如所述容器可以是具有可被皮下注射针刺破的塞子的静脉内溶液袋或小瓶)。组合物中的至少一种活性剂是本发明的组合中包含的抗体。标签或包装插页指示组合物用于治疗所选的病症。标签或包装插页可以还指示所述组合物作为与所述组合物中的另一个活性试剂(其为本发明的组合中所包含的另一种抗体)的组合用于治疗所选的病症。所述制品可以包含(a)其中盛装有组合物的第一容器,其中所述组合物包含本发明的组合中所包含的一种抗体;和(b)其中盛装有组合物的第二容器,其中所述组合物包含本发明的组合中所包含的另一种抗体。所述制品可以包含第一、第二和第三容器,其中包含组合物,其中所述组合物分别包含在本发明的组合中所包含的第一、第三和第三抗体。此外,制品可以包含(a)其中盛装有组合物的第一容器,其中所述组合物包含本发明的组合中所包含的一种抗体;和(b)其中盛装有组合物的第二容器,其中所述组合物还包含细胞毒性或其他治疗剂。本发明的该实施方案中的制品还可以包含包装插页,所述包装插页指示组合物可以用于治疗特定病症。备选地,或另外地,所述制品还可以包含第二(或第三)容器,所述容器包含药用缓冲液,如注射用抑菌水(bwfi),磷酸缓冲盐水,林格溶液和右旋糖溶液。其还可以包含从商业或用户立场来看是需要的其他材料,包括其他缓冲液,稀释液,填料,针和注射器。
[0311]
要理解的是,任何上述制品都可以包括本发明的免疫缀合物以替代两种以上抗-c5抗体的组合,或者除了两种以上抗-c5抗体的组合以外,任何上述制品还可以包括本发明的免疫缀合物。
[0312]
实施例
[0313]
实施例
[0314]
以下是本发明的方法和组合物的实施例。要理解的是,已知以上提供的一般性描述,可以实施多种其他实施方案。
[0315]
实施例1
[0316]
制备c5[表达和纯化重组人和食蟹猴c5]
[0317]
使用freestyle293-f细胞系(thermo fisher,carlsbad,ca,usa)瞬时表达重组人c5(ncbi genbank登录号:np_001726.2,seq id no:13)。将表达人c5的条件培养基用等体积的milliq水稀释,然后施加至q-sepharose ff或q-sepharose hp阴离子交换柱(ge healthcare,uppsala,瑞典),之后用nacl梯度洗脱。汇集含人c5的级分,然后分别将盐浓度和ph调节至80mm nacl和ph6.4。将所得的样品施加于sp-sepharose hp阳离子交换柱(ge healthcare,uppsala,瑞典)并用nacl梯度洗脱。将含人c5的级分汇集并经过cht陶瓷羟基磷灰石柱(bio-rad laboratories,hercules,ca,usa)。然后将人c5洗脱物施加于superdex 200凝胶过滤柱(ge healthcare,uppsala,瑞典)。将含人c5的级分汇集并存储在-150℃。本研究使用内部制备的重组人c5或血浆来源的人c5(calbiochem,cat#204888)。
[0318]
以与人对应物相同的方式进行重组食蟹猴c5(ncbi genbank登录号:xp_005580972,seq id no:14)的表达和纯化。
[0319]
实施例2
[0320]
制备合成的钙文库
[0321]
用作合成的人重链文库的抗体重链可变区的基因文库由10个重链文库组成。基于
在人b细胞库中的种系频率和v基因家族的生物物理学性质,为该文库选择种系框架vh1-2,vh1-69,vh3-23,vh3-66,vh3-72,vh4-59,vh4-61,vh4-b,vh5-51和vh6-1。该合成的人重链文库在抗体-结合位点是多样化的,以模拟人b细胞抗体库。
[0322]
设计抗体轻链可变区基因文库,使其具有钙结合基序并且在将有助于抗原识别的位置处多样化,参考人b细胞抗体库。展现针对抗原的钙依赖性结合特征的抗体轻链可变区基因文库的设计记述在wo 2012/073992中。
[0323]
将重链可变区文库与轻链可变区文库的组合插入到噬菌粒载体中,并且构建噬菌体文库,参考(methods mol biol.(2002)178,87-100)。在fab与piii蛋白之间的接头区向噬菌粒载体中引入胰蛋白酶切割位点。将在基因iii的n2与ct结构域之间具有胰蛋白酶切割位点的修饰的m13ko7辅助噬菌体用于fab展示的噬菌体制备。
[0324]
实施例3
[0325]
分离钙依赖性抗-c5抗体
[0326]
将噬菌体展示文库用分别以4%和1.2mm的终浓度补充了bsa和cacl2的tbs稀释。作为淘选方法,应用常规磁珠选择法,参考通用流程(j.immunol.methods.(2008)332(1-2),2-9,j.immunol.methods.(2001)247(1-2),191-203,biotechnol.prog.(2002)18(2)212-20,mol.cell proteomics(2003)2(2),61-9)。关于磁珠,使用neutravidin包被的珠子(sera-mag speedbeads neutravidin-包被的)或链霉抗生物素蛋白包被的珠子(dynabeads m-280链霉抗生物素蛋白)。将人c5(calbiochem,cat#204888)用ez-link nhs-peg4-生物素(pierce,cat no.21329)标记。
[0327]
初始轮次的噬菌体选择,将噬菌体展示文库与生物素化的人c5(312.5nm)一起在室温温育60分钟。然后使用磁珠捕获展示结合fab变体的噬菌体。
[0328]
在室温与珠子一起温育15分钟后,将珠子用1ml含1.2mm cacl2和0.1%tween20的tbs洗涤三次,并且将珠子用1ml含1.2mm cacl2的tbs洗涤两次。通过将珠子用含1mg/ml胰蛋白酶的tbs重悬15分钟而洗脱噬菌体。将洗脱的噬菌体感染er2738并用辅助噬菌体挽救。将挽救的噬菌体用聚乙二醇沉淀,用补充了终浓度分别为4%和1.2mm的bsa和cacl2的tbs重悬,并且用于下一轮的淘选。
[0329]
第1轮淘选后,选择噬菌体的钙依赖性,其中所述抗体在存在钙离子的条件下更强地与c5结合。在第二轮和第三轮中,以与第一轮相同的方式进行淘选,不同之处在于,使用50nm(第二轮)或12.5nm(第三轮)的生物素化的抗原,并且最终用0.1ml洗脱缓冲液(50mm mes,2mm edta,150mm nacl,ph5.5)洗脱,并且与1μl 100mg/ml胰蛋白酶接触,以选择其钙依赖性。选择后,将所选的噬菌体克隆转化为igg形式。
[0330]
在两种不同的条件下评估所转化的igg抗体针对人c5的结合能力:在30℃,使用octet red384系统(pall life sciences),在1.2mm cacl
2-ph 7.4(20mm mes,150mm nacl,1.2mm cacl2)的结合与解离,和在1.2mm cacl
2-ph 7.4(20mm mes,150mm nacl,1.2mm cacl2)的结合与在3μm cacl
2-ph 5.8(20mm mes,150mm nacl,3μm cacl2)的解离。分离25个ph-钙依赖性的抗原结合克隆的克隆。这些抗体的传感图显示在图1中。
[0331]
实施例4
[0332]
鉴定能够形成多聚体抗原-抗体免疫复合物(ag-ab ic)的抗-c5双特异性抗体
[0333]
4.1.制备抗体表达载体以及表达和纯化重组抗体
[0334]
从实施例3分离的克隆中,选择九个ph或钙依赖性抗-c5抗体克隆用于进一步的分析(cfp0008,0011,0015,0016,0017,0018,0019,0020,0021)。通过本领域技术人员通常已知的方法向cfp0016重链可变区中引入一些氨基酸置换,以改善抗体的性质,如物理化学特性。使用所述cfp0016变体cfp0016h019替代cfp0016用于进一步的分析。这九种抗体的vh和vl区的氨基酸序列记述在表2中。在该表中,括号中所述的名称表示缩写名称。
[0335]
[表2]
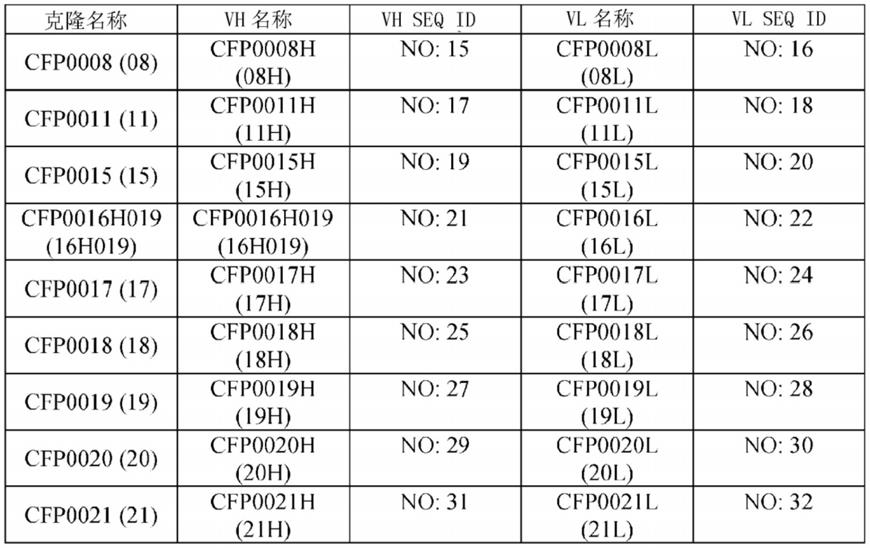
[0336]
所选的抗体的克隆名称和氨基酸序列
[0337][0338]
合成具有编码抗体重链和轻链的核苷酸序列的全长基因,并且通过本领域技术人员公知的方法制备。通过将得到的质粒片段插入到用于在哺乳动物细胞中表达的载体中,而制备重链和轻链表达载体。对所得到的表达载体通过本领域技术人员公知的方法测序。对于抗体的表达,将制备的质粒瞬时转染到freestyle293-f细胞系(thermo fisher scientific)中。通过本领域技术人员公知的方法,使用rprotein a sepharose fast flow(ge healthcare),进行从表达抗体的条件培养基的纯化。
[0339]
4.2.抗-c5双特异性抗体的产生
[0340]
通过将表2所述的两个不同的克隆组合而产生双特异性抗体,所述双特异性抗体潜在识别c5的两个不同的表位。将双特异性抗体制备成igg形式,其在抗体的每个结合位点具有两个不同的fab克隆。在这些双特异性igg抗体中,两条重链包含彼此截然不同的重链恒定区(f760g4p1,seq id no:33和f760g4n1,seq id no:34),从而有效形成这两条重链的异二聚体。使用本领域技术人员公知的方法制备潜在的双特异性抗体,它们是通过组合两个包含表2所述的九个单克隆抗体(mab)的重链和轻链的结合位点构建而成的二十一种双特异性抗体。包含抗-c5 mab"x"和抗-c5mab"y"的结合位点的抗-c5双特异性抗体表示为"x//y"。
[0341]
4.3.通过形成多聚体ag-ab ic评估抗体亲抗原性(avidity)作用
[0342]
包含多于两个抗体或fc的ag-ab ic可以通过多价抗体亲抗原性结合而结合fc受
体(fcrn或fcγ受体)。此处,我们称包含多于两个抗体或fc的ag-ab ic为多聚体或大ag-ab ic。为了评价形成多聚体ag-ab ic的抗体亲抗原性作用,将小鼠fcrn(通过本领域技术人员公知的方法制备的重组体,并且以下称为mfcrn)通过胺偶联法固定在s系列传感器芯片cm5(ge healthcare,cat no.br-1005-30)上。使上述制备的抗-c5 mab或双特异性抗体与人c5以大约一比一摩尔浓度比例接触,并且在室温温育约30分钟,以达到ag-ab ic形成的平衡。使用biacore t200仪器(ge healthcare)或biacore 4000仪器(ge healthcare)测定在ph 7.4且在37℃ag-ab ic针对固定的mfcrn的结合。所用的运行缓冲液为含有1.2mm ca(20mm aces,150mm nacl,1.2mm cacl2,0.05%tween 20)的ph 7.4 aces缓冲液。为了比较ag-ab ic从固定的mfcrn上的解离率,使用结合标准化的反应,其通过减去基线反应(通过该步骤确定的值称为基线标准化的反应)然后将该基线标准化的反应针对在结合相最后时间点的值(作为100)标准化而确定。图2显示了得到的结合标准化的反应,该反应比较抗-c5双特异性抗体与两种抗-c5 mab(其提供所述双特异性抗体的结合位点的来源)。
[0343]
由于mab的ag-ab ic与mfcrn的弱的单体相互作用或亲和性结合,所以所有检测的抗-c5 mab表现出从mfcrn的快速解离。另一方面,由于双特异性抗体的ag-ab ic与mfcrn的多聚体相互作用或抗体亲抗原性结合,大部分检测的抗-c5双特异性抗体表现出比抗-c5 mab更慢的解离。该结果表明,这些表现出较慢解离的抗-c5双特异性抗体通过识别同一个c5分子上的两个不同表位而形成多聚体ag-ab ic。另一方面,一些双特异性组合(15//08,15//20和20//08)表现出与提供所述双特异性抗体(15//08,15//20和20//08)的结合位点的来源的mab类似的快速的从mfcrn的解离,由此这些双特异性抗体不能形成多聚体ag-ab ic。
[0344]
实施例5
[0345]
轻链共同化(commonization)
[0346]
5.1.产生并评价轻链变体
[0347]
在实施例4中发现的适于加快c5的清除的抗-c5双特异性抗体包含两个结合位点,它的两条重链和两条轻链彼此不同。在该实施方案中,提供这样的抗-c5双特异性抗体,即,它的结合位点包含共同的轻链[例如两个结合位点的序列相同的轻链](plos one.2013;8(2):e57479)。针对轻链共同化,选择十个克隆的抗-c5双特异性抗体(15//11,15//17,15//18,15//19,15//21,20//11,20//17,20//18,20//19和20//21)。为了鉴定这些抗-c5双特异性抗体的共同轻链,通过用本领域技术人员公知的方法向轻链cdr中引入一个或多个氨基酸置换而产生多个轻链变体。氨基酸置换主要在两条轻链的序列之间是不同的氨基酸残基的位置引入,所述两条轻链的序列提供所述双特异性抗体的结合位点的来源。图3显示了两条轻链之间的cdr序列的比较。在该图中,*表示在两条轻链之间不同的残基。使用biacore t200仪器(ge healthcare)或biacore 4000仪器(ge healthcare)检测所述轻链变体在ph 7.4和在37℃对c5的结合亲和力。将蛋白a/g(pierce,cat no.#21186)或抗-人igg(fc)抗体(在人抗体捕获试剂盒内;ge healthcare,cat no.br-1008-39)通过胺偶联法固定在s系列cm4(ge healthcare,cat no.br-1005-34)上。抗-c5抗体捕获在固定的分子上,然后注入人c5。所用的运行缓冲液为含有1.2mm ca(20mm aces,150mm nacl,1.2mm cacl2,0.05%tween 20)的ph 7.4aces缓冲液。得到的结果显示在表3中。通过将结合反应针对包含亲本轻链的抗体的结合反应(作为100)标准化而确定%结合值。从该置换研究,可以鉴定对两条
轻链都是可接受的在相同位置的同一氨基酸的替换。
[0348]
5.2.为20//18鉴定共有轻链
[0349]
比较20//18双特异性抗体的两条轻链的序列时,位置53,92和96(按照kabat编号指定)的三个氨基酸残基是不同的,这些残基需要进行共同化。从抗-c5 mab轻链变体针对c5的结合活性的分析看出,位置53的his,asn,ser或thr,位置92的asp,asn或ser和/或位置96的phe,his,trp或tyr被鉴定为保留c5结合亲和性的共有轻链的可接受的残基。具有位置53、92和96的这些可接受的残基的组合的轻链20l065(seq id no:35)被鉴定为20//18的一条共有轻链。然后,如之前所述制备包含克隆20的重链和20l065的轻链以及包含克隆18的重链和20l065的轻链的两种抗体。包含共有轻链[例如20l065]的两种抗体的结合传感图显示在图4中,与包含亲本轻链的抗体的结合传感图进行比较。共有轻链20l065保留克隆20和18的重链的c5结合亲和性。
[0350]
[表3]
[0351]
轻链变体的结合分析(%结合,以亲本抗体作为100)
[0352]
残基的位置按照kabat编号指定。
[0353]
[0354][0355]
实施例6
[0356]
一些抗-c5双特异性抗体在共同注射模型中的体内研究
[0357]
按之前所述制备一些抗-c5双特异性抗体(15//11,15//17,15//18,15//19,15//21,20//11,20//17,20//18,20//19和20//21),所述双特异性抗体包含来自彼此不同重链(f1684mnp17(seq id no:49),和f1684mnn17(seq id no:50))的两个不同的改造的人igg1恒定区。在小鼠共同注射模型中检测十个抗-c5双特异性抗体,以评价它们加速c5从血浆的
清除的能力。在共同注射模型中,对人fcrn转基因小鼠(hfcrn-tgm,b6.mfcrn-/-.hfcrn tg品系276+/+小鼠,jackson laboratories)通过单次静脉内(i.v.)注射施用单独的c5或与抗-c5双特异性抗体预先混合的c5。第一组接受1.34mg/kg c5,但是另一组额外接受1.0mg/kg抗-c5双特异性抗体。通过抗-c5 eclia确定总c5血浆浓度。首先,将抗-人c5小鼠igg分散在ecl平板中,在4℃放置过夜,以制备固定有抗-人c5小鼠igg的平板。将用于标准曲线的样品和样品与抗-人c5兔igg混合。将这些样品添加到固定有抗-人c5小鼠igg的平板中,并在室温放置一小时。然后,使这些样品与hrp缀合的抗-兔igg(jackson immuno research)反应。在将所述平板在室温温育一小时后,加入硫代-标签缀合的抗-hrp。使用sector成像仪2400(meso scale discovery)读取ecl信号。使用softmax pro(molecular devices)从标准曲线中的ecl信号计算人c5的浓度。图5描述了人fcrn转基因小鼠中总c5的血浆浓度时间曲线。
[0358]
尽管已知由于抗原-抗体复合物具有比抗原本身更低的清除(plos one.2013may 7;8(5):e63236),施用不具有ph依赖性抗原结合的常规抗体与施用单独的抗原相比减少抗原从血浆中的清除,但是在本研究中检测的大部分双特异性抗体表现出c5从血浆中快速的清除。在所检测的抗体中,选择克隆20//18用于进一步的优化。
[0359]
实施例7
[0360]
抗-c5双特异性抗体的结合表征和优化
[0361]
7.1.抗-c5双特异性抗体的结合表征
[0362]
在两种不同的条件下(例如,a)在ph 7.4的结合和解离,和b)在ph 7.4结合和在ph 5.8解离),在37℃使用biacore t200仪器(ge healthcare)测定抗-c5双特异性抗体20//18(具有两条不同的轻链)和20//18cl先导物(lead)(具有共有轻链)(这些抗体的氨基酸序列记述在表4中)针对重组人c5的动力学参数。将蛋白a/g(pierce,cat no.#21186)或抗-人igg(fc)抗体(在人抗体捕获试剂盒内;ge healthcare,cat no.br-1008-39)通过胺偶联法固定在s系列cm4(ge healthcare,cat no.br-1005-34)上。抗-c5抗体捕获在固定的分子上,然后注入人c5。所用的运行缓冲液是aces ph 7.4和ph 5.8(20mm aces,150mm nacl,1.2mm cacl2,0.05%tween 20)。通过使用biacore t200评估软件版本2.0(ge healthcare)以1:1结合-ri(无体效应调整)模型拟合传感图而确定在两种ph条件下的动力学参数。这些抗体的传感图显示在图6中。表5中记载了在ph 7.4的动力学参数,缔合速率(ka),解离速率(kd)和结合亲和力(kd),以及通过仅计算每种ph条件下的解离相确定的解离速率(kd)。与20//18相比,20//18cl先导物在ph 7.4表现出相对较慢的缔合和解离速率。
[0363]
[表4]
[0364]
20//18变体的可变区的氨基酸序列
[0365]
[0366]
[表5]
[0367]
在两种不同的条件下20//18变体针对人c5的动力学参数
[0368]
7.2.抗-c5双特异性抗体的优化
[0369]
将20//18cl先导物进一步优化,以在ph 7.4具有改善的针对c5的结合亲和性和改善的ph依赖性(在ph 5.8表现出更快速的解离)。通过本领域技术人员公知的方法制备在vh和vl两个区中具有引入的氨基酸置换的变体。检验这些变体针对人c5的结合。将有效的置换组合,以鉴定优化的20//18(氨基酸序列记载在表4中)。以与实施例7.1中所述相同的方式检验优化的20//18针对人c5的结合,并且优化的20//18的传感图和动力学参数显示在图6和表5中。
[0370]
实施例8
[0371]
优化的20//18双特异性抗体的fc变体在食蟹猴中的体内研究
[0372]
按之前所述制备以下的fc变体:优化的20//18双特异性抗体,优化的20//18-higg1(优化的克隆20-higg1(20h261-g1dp1,seq id no:55),优化的克隆18-higg1(18h012-g1dn1,seq id no:56)和优化的共有lch(20l233-k0,seq id no:57)),-fs156(优化的克隆20-fs156(20h261-fs156p1,seq id no:58),优化的克隆18-fs156(18h012-fs156n1,seq id no:59)和优化的共有lch(20l233-k0,seq id no:57))和-fs154(优化的克隆20-fs154(20h261-fs154p1,seq id no:60),优化的克隆18-fs154(18h012-fs154n1,seq id no:61)和优化的共有lch(20l233-k0,seq id no:57))。
[0373]
为了观察优化的20//18针对食蟹猴c5的交叉反应性,以与实施例7.1所述相同的方式进行biacore动力学分析。得到的动力学参数显示在表6中。
[0374]
[表6]
[0375]
在两种不同的条件下优化的20//18针对食蟹猴c5的动力学参数
[0376]
higg1、fs156和fs154针对食蟹猴fcγ受体(fcγrs)的结合亲和力记述在表7中。fs156具有相当的或小于2倍增强的针对fcγr2a和fcγr2b的结合亲和力,而具有显著降低的针对fcγr1和fcγr3的结合亲和力。fs154具有5-10增强的针对fcγr2a和fcγr2b的结合亲和力,而具有显著降低的针对fcγr1和fcγr3的结合亲和力。
[0377]
对食蟹猴通过单次静脉内(i.v.)注射施用剂量为10mg/kg的抗-c5双特异性抗体。总食蟹猴c5血浆浓度通过抗-c5 eclia进行确定。首先,将抗-食蟹猴c5兔igg分散在96孔平板中,并在4℃放置过夜,以制备固定有抗-食蟹猴c5兔igg的平板。将用于标准曲线的样品和样品与过量的抗-食蟹猴c5人igg混合。将这些样品添加到固定有抗-食蟹猴c5兔igg的平板中,并且在室温放置一小时。然后,使这些样品与硫代标签缀合的抗-人igg反应。在将所述平板在室温温育一小时后,使用sector成像仪2400(meso scale discovery)读取ecl信
号。使用softmax pro(molecular devices)从标准曲线中的ecl信号计算食蟹猴c5的浓度。图7描述了食蟹猴中总c5的血浆浓度时间曲线。
[0378]
[表7]
[0379]
higg1、fs156和fs154针对食蟹猴fcγ受体的结合亲和力(kd)
[0380][0381]
优化的20//18-fs156积极地从血浆中消除c5并且使血浆c5浓度降低为低于基线约2倍;优化的20//18-fs154使血浆c5浓度降低为低于基线约30倍,这证明抗-c5双特异性抗体,即优化的20//18,以fcγr2a和fcγr2b依赖性方式显著增强c5的清除。这证明了能够形成具有增强的fcγr结合的多聚体ag-ab ic的ph和/或钙依赖性抗-c5双特异性抗体是靶向c5的非常有效的方式,所述c5的血浆浓度非常高(多至100μg/ml)并且使用常规单克隆抗体需要更高的抗体剂量。
[0382]
虽然为了清楚理解通过例示和实施例描述了上述发明的一些细节,但是说明书和实施例不应被视为限制本发明的范围。本文中引用的所有专利和科学文献的公开内容通过引用完整地明确地结合。
