1.本发明属于生物技术领域,涉及利用合成生物学生产三萜化合物等技术领域,具体地,本发明涉及产二氢尼洛替星的重组酿酒酵母的制备方法及其应用。
背景技术:
2.印楝素是一种公认无害的植物源杀虫剂,是从楝属植物印楝种子中提取的一种高度氧化的柠檬苦素类三萜化合物,有10多种类似物,但大家通常所说的印楝素指的是印楝素a,相对分子质量为720.71。印楝素纯品为白色非结晶物质,易溶于甲醇、丙酮和二甲亚砜等极性有机溶剂,对光、热都不稳定。印楝素对200多种害虫有明显的驱避效果,使用更加安全、对环境的压力小,是目前全球公认的最优秀的生物农药。
3.印楝素及其前体物质二氢尼洛替星均具有杀虫功效,但是两者在植物中的含量很低,仅存在于印楝树的树叶树皮及种子中,其中种仁中印楝素的含量最高,但也仅有0.02%。印楝素的含量还取决于印楝的品种以及种子的收获时间,随着种子的成熟,印楝素的含量会呈现先增加再下降的趋势。另外,印楝素的含量与种植的气候条件有关,雨水温度湿度均会影响印楝素的含量,印楝生长8年到盛果期株产带内果皮的种子有30kg-50kg。由于印楝是唯一的印楝素生物制品加工的原材料,且喜热,只适宜在热带亚热带的干旱地区生长,通过自然界提取大量印楝素大规模商用较为困难,因此通过化学合成和生物合成的手段来获取印楝素及其前体二氢尼洛替星成为研究热点。
4.科学家们最初在1987年开始研究印楝素的化学合成,因其复杂的结构,花费22年实现了印楝素的全合成,但该合成步骤多达71步,收率仅有0.00015%。化学合成成本高,收率低,限制了其工业化生产。因此科学家们将目光转向了生物合成,通过微生物发酵药用植物活性成分具有成本低,环境友好且不受时空限制等优势,因此学者们很关注通过微生物来生产药用植物次生代谢产物。yan等成功从人参中克隆出一个催化原人参二醇生成人参皂苷ck的糖基转移酶基因ugtpg1,然后通过将人参皂苷ck合成途径的基因引入酿酒酵母,获得了可以生产人参皂苷ck的酿酒酵母菌株。但印楝素等柠檬苦素类化合物的生物合成途径几乎是空白的,想在微生物中组装其合成途径是一个非常巨大的挑战。
技术实现要素:
5.基于以上技术问题,本发明的目的之一是提供一株重组酿酒酵母,该酿酒酵母能产二氢尼洛替星,为实现二氢尼洛替星的生物合成提供了工程菌。
6.本发明的目的可以通过以下技术方案实现:一株重组酿酒酵母,其保藏编号为cgmcc no.23630。
7.一种重组酿酒酵母的制备方法,所述制备方法包括:敲除酿酒酵母中的bts1基因和erg27基因,过表达所述酿酒酵母的erg19基因、erg10基因、erg12基因和idi1基因,并在所述酵母菌中外源表达atcpr基因、aiosc1基因、thmgr基因、atsqe2基因和aicyp71cd2基因。
8.在其中一些实施例中,所述制备方法包括:敲除酿酒酵母中的bts1基因和erg27基因,制备酿酒酵母c-e-b;在所述酿酒酵母c-e-b的染色体rdna位点整合erg19基因、erg10基因、erg12基因、idi1基因和atcpr基因,制备酿酒酵母cb-9;在所述酿酒酵母cb-9的染色体delta位点上整合aicyp71cd2基因、aiosc1基因、thmgr基因和atsqe2基因,制备酿酒酵母di-3,获得重组酿酒酵母;所述aicyp71cd2基因的核苷酸序列如seq id no.2所示。
9.在其中一些实施例中,获取所述aicyp71cd2基因的步骤包括:以印楝的cdna为模板,以核苷酸序列如seq id no.39和seq id no.40所示的扩增引物进行扩增,获得所述aicyp71cd2基因。
10.在其中一些实施例中,在染色体rdna位点上整合的同源重组片段依次包含idi1基因、erg19基因、erg10基因、erg12基因和atcpr基因。
11.在其中一些实施例中,制备酿酒酵母tir-3的步骤中,所述delta位点上整合的同源重组片段依次包含aiosc1基因、thmgr基因和atsqe2基因。
12.在其中一些实施例中,所述aicyp71cd2基因在所述delta位点上连接于所述aiosc1基因和所述thmgr基因之间。
13.在其中一些实施例中,整合采用醋酸锂转化法。
14.在其中一些实施例中,所述制备方法还包括从所述重组酿酒酵母中挑选出二氢尼洛替星产量高的重组酿酒酵母的步骤。
15.一种二氢尼洛替星的制备方法,所述制备方法包括以所述的重组酿酒酵母为工程菌进行发酵的步骤。
16.在其中一些实施例中,发酵采用的条件包括:28℃~32℃,ph5.0~5.5,转速100~800rpm,溶氧>30%,发酵时溶氧与转速关联,自动补糖与溶氧负反馈关联。
17.在其中一些实施例中,发酵采用的培养基包含水以及15g/l~25g/l蛋白胨、5g/l~10g/l酵母粉、15g/l~25g/l葡萄糖和15g/l~25g/l半乳糖。
18.与现有技术相比,本发明具备如下有益效果:本发明提供一株重组酿酒酵母,该酿酒酵母能产二氢尼洛替星,为实现二氢尼洛替星的生物合成提供了工程菌,为酿酒酵母工业化生产二氢尼洛替星化合物提供新的途径,还可以将其作为底盘菌株在胞内鉴定印楝生物下游合成途径中的功能基因。
附图说明
19.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
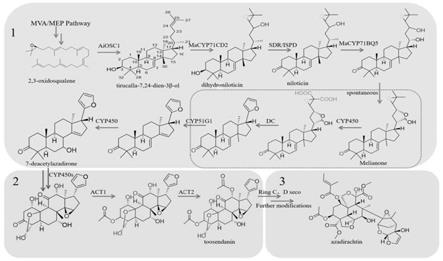
20.图1为印楝素生物合成途径;图2为实施例2和实施例3中启动子-终止子盒质粒的构建、基因表达盒质粒的构建、基因表达簇的整合顺序;图3为aicyp71cd2在本氏烟草中的瞬时表达功能分析;
图4为aicyp71cd2在酿酒酵母tir-3中的表达功能分析;图5为同源重组片段在染色体上的连接方式及电泳检测结果;图6为本发明构建的重组酿酒酵母生物合成二氢尼洛替星的代谢通路;图7为重组酿酒酵母di-1 至di-6产量对比图;图8为高密度发酵工程菌株-重组酵母di-3的二氢尼洛替星产量及生物量;图9为重组酵母di-3提取液的gc-ms检测色谱图;图10为洗脱液gc-ms检测色谱图,红色背景为二氢尼洛替星;图11为制备色谱洗脱后样品gc-ms检测色谱图,红色背景为二氢尼洛替星;图12为重组酵母di-3的裂解产物纯化后
13
c谱与1h谱图。
21.本发明的重组酿酒酵母,命名为酿酒酵母(saccharomyces cerevisiae)di-3,该菌株已于2021年10月20日保藏在中国普通微生物菌种保藏中心,保藏编号为cgmcc no.23630,保藏地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101。该菌株于2021年10月20日由保藏中心收到并登记入册,经保藏中心于2021年10月20日检测为存活菌株。
具体实施方式
22.为了便于理解本发明,下面将对本发明进行更详细的描述。但是,应当理解,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施方式或实施例。相反地,提供这些实施方式或实施例的目的是使对本发明的公开内容的理解更加透彻全面。
23.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施方式或实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”的可选范围包括两个或两个以上相关所列项目中任一个,也包括相关所列项目的任意的和所有的组合,所述任意的和所有的组合包括任意的两个相关所列项目、任意的更多个相关所列项目、或者全部相关所列项目的组合。
24.本发明中,“第一方面”、“第二方面”、“第三方面”等仅用于描述目的,不能理解为指示或暗示相对重要性或数量,也不能理解为隐含指明所指示的技术特征的重要性或数量。
25.本发明中,以开放式描述的技术特征中,包括所列举特征组成的封闭式技术方案,也包括包含所列举特征的开放式技术方案。
26.本发明中,涉及到数值区间,如无特别说明,则包括数值区间的两个端点。
27.本发明中涉及的百分比含量,如无特别说明,对于固液混合和固相-固相混合均指质量百分比,对于液相-液相混合指体积百分比。
28.本发明中涉及的百分比浓度,如无特别说明,均指终浓度。所述终浓度,指添加成分在添加该成分后的体系中的占比。
29.本发明中的温度参数,如无特别限定,既允许为恒温处理,也允许在一定温度区间内进行处理。所述的恒温处理允许温度在仪器控制的精度范围内进行波动。
30.整合,是指通过同源重组将目的基因的多拷贝整合到充分限定的位点的整合方式。
31.印楝素等柠檬苦素类化合物在结构上都属于三萜化合物,虽然目前印楝素生物合成途径尚不清晰,但三萜化合物的上游合成途径已经较为清晰。
32.印楝素是目前世界上公认的无公害绿色农药,但自然界含量很低,化学合成步骤繁琐,通过生物合成的方式来获取印楝素将对印楝素的商业用途提供很大的帮助。但目前印楝素等柠檬苦素类化合物在植物体内的合成途径几乎空白,关键催化基因解析的进展又十分缓慢。
33.印楝素等柠檬苦素都属于三萜化合物,合成途径(图1)包括osc催化2,3-氧化鲨烯形成骨架化合物,再由cyp450对骨架化合物进行修饰、脱甲基化或者酯化形成。酵母中天然具有形成三萜化合物的上有途径mva途径,并且有完整的膜系统,相较其他菌株更适合表达cyp450,所以目前三萜化合物的异源合成通常在酵母中进行。构建印楝素生物合成前体物质二氢尼洛替星的酵母工程菌不仅对下游鉴定印楝素生物合成途径中的酶提供了生物学基础,而且可以为印楝素的异源合成奠定基础。
34.近年来,随着测序技术的发展多种药用植物基因组信息被解析。基于基因组信息分析可以知道药用植物中控制其遗传形状和代谢产物合成的基因序列。人参、甘草在特定环境下积累了一定量的人参皂甙、甘草酸等三萜物质,推测其体内mva途径中hmgr存在多拷贝且催化活性较高,将上述植物来源的高催化活性hmgr基因元件导入酵母细胞中,可大幅度提高酵母mva的代谢流,进而提高酵母产三萜化合物的产量。
35.本发明通过利用酿酒酵母内源途径提供的2,3-氧化鲨烯作为前体物质,引入氧化鲨烯环化酶(aiosc1),并构建高产印楝素合成下游途径的骨架化合物tirucalla-7,24-dien-3β-ol的酿酒酵母,进一步以此为基础引入印楝来源的细胞色素p450酶(cyp450)基因aicyp71cd2,成功构建了产二氢尼洛替星的重组酿酒酵母,本发明提供的酿酒酵母生物合成二氢尼洛替星的代谢通路可参见图5。
36.第一方面,本发明提供一株酿酒酵母,其保藏编号为cgmcc no.23630。
37.第二方面,本发明提供上述重组酿酒酵母的制备方法,所述制备方法包括:敲除酿酒酵母中的bts1基因和erg27基因,过表达所述酿酒酵母的erg19基因、erg10基因、erg12基因和idi1基因,并在所述酵母菌中外源表达atcpr基因、aiosc1基因、thmgr基因、atsqe2基因和aicyp71cd2基因。
38.在其中一个示例中,所述制备方法包括:敲除酿酒酵母中的bts1基因和erg27基因,制备酿酒酵母c-e-b;在所述酿酒酵母c-e-b的染色体rdna位点整合erg19基因、erg10基因、erg12基因、idi1基因和atcpr基因,制备酿酒酵母cb-9;在所述酿酒酵母cb-9的染色体delta位点上整合aicyp71cd2基因、aiosc1基因、thmgr基因和atsqe2基因,制备酿酒酵母di-3,获得重组酿酒酵母;所述aicyp71cd2基因的核苷酸序列如seq id no.2所示。
39.本发明提供的制备方法中,对酿酒酵母出发菌株没有特别限定。
40.在其中一个示例中,获取所述aicyp71cd2基因的步骤包括:以印楝的cdna为模板,以核苷酸序列如seq id no.39和seq id no.40所示的扩增引物进行扩增,获得所述aicyp71cd2基因。
41.在其中一个示例中,所述染色体rdna位点上整合的同源重组片段依次包含idi1基
因、erg19基因、erg10基因、erg12基因和atcpr基因。
42.在其中一个示例中,制备酿酒酵母tir-3的步骤中,所述delta位点上整合的同源重组片段依次包含aiosc1基因、thmgr基因和atsqe2基因。
43.在其中一个示例中,所述aicyp71cd2基因在所述delta位点上连接于所述aiosc1基因和所述thmgr基因之间。
44.本发明提供的制备方法,可以给上述需要整合至酿酒酵母染色体的基因分别装上启动子和终止子后形成基因表达盒,通过同源重组等整合到酿酒酵母的染色体合适位点进行过表达。
45.在其中一个示例中,整合采用醋酸锂转化法。本发明制备方法对转化所用质粒的种类不做特别限定,可以选自,包括但不限于prs425、pyes3等。
46.在其中一个示例中,所述制备方法还包括从所述重组酿酒酵母中挑选出二氢尼洛替星产量高的重组酿酒酵母的步骤。
47.本发明制备方法提供的重组酿酒酵母具备产二氢尼洛替星的功能,优选保藏编号为cgmcc no.23630的重组酿酒酵母,该重组酵母菌株的二氢尼洛替星的产量较高,在合适的条件下发酵,其二氢尼洛替星的产量可高达147mg/l。
48.第二方面,本发明提供一种二氢尼洛替星的制备方法,所述制备方法包括以所述的酿酒酵母为工程菌进行发酵的步骤。
49.可以理解的是,本发明的制备方法,其发酵在合适的条件下进行,包括采用合适的培养基、在合适工艺参数条件下进行。
50.本发明所述的合适工艺参数条件可以选自,包括但不限于:28℃~32℃,ph5.0~5.5,转速100~800rpm,溶氧大于30%,发酵时溶氧与转速关联,自动补糖与溶氧负反馈关联。
51.本发明所述的合适的培养基可以选自,包括但不限于包含水以及15g/l~25g/l蛋白胨、5g/l~10g/l酵母粉、15g/l~25g/l葡萄糖和15g/l~25g/l半乳糖,例如包含水以及20g/l蛋白胨、10g/l酵母粉、20g/l葡萄糖、和20g/l半乳糖。
52.出于说明本发明各种实施方式的目的给出如下实施例,并非意图以任何方式限制本发明。本领域技术人员将理解,如权利要求的范围所限定的,其中的变化和其它用途包括在本发明精神范围内。下列实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到,实施例中所提到的启动子和终止子序列也可以从 ncbi下载获得,具体序列起始位置可根据引物表中的引物获悉。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册( new york:cold spring harborlaboratory press ,1989)中所述的条件,或按照制造厂商所建议的条件。
53.实施例1. aiyp71cd2基因获取本实验全部内容在中国中医科学院中药研究所完成,于中国中医科学院中药研究所的植物间采集新鲜印楝的叶子、叶柄、茎皮、果实和茎,并立即放置于液氮中保存。
54.使用植物rna快速提取试剂盒(天根生化科技有限公司,货号:dp432)提取上述组织的rna,以上述rna为模板,根据反转录试剂盒说明书(试剂盒来自北京全式金生物,目录号:at311-02)进行反转录,合成各个组织的cdna备用。以混合各个组织的cdna为模板,设计引物进行pcr扩增获得aicyp71cd2。
55.aicyp71cd2的序列见表1,引物序列见表2。
56.pcr反应体系:5μl的10
×
pcr buffer、5μl的2mm dntps、3μl 25mm mgso4、正向引物和反向引物各1.5μl、模板和kod-plus-neo各1μl以及32μl的水。
57.pcr反应条件:表1、aicyp71cd2蛋白序列及基因序列aicyp71cd2蛋白序列及基因序列表2、构建质粒、酵母整合所用引物
实施例 2.aiyp71cd2基因的功能验证(酵母和烟草中基因功能验证)本研究首先以敲除bts1与erg27的底盘菌株c-e-b为基础,过表达mva途径中相关基因erg19、erg10、erg12、idi1以及拟南芥来源的atcpr,构建了一株高产鲨烯的底盘菌株cb-9,cb-9基因型见表3。图2为实施例2和实施例3中启动子-终止子盒质粒的构建、基因表达盒质粒的构建、基因表达簇的整合顺序。
58.表3、所使用和构建菌株
印楝来源的aiosc1以及mva途径上的关键基因人参来源的3-羟基-3-甲基戊二酸单酰辅酶a还原酶(thmgr)和拟南芥来源的鲨烯合酶(atsqe2)成功整合在酿酒酵母cb-9的染色体的delta位点上,重组菌株代谢产物中,均能检测到tirucalla-7,24-dien-3β-ol,即印楝来源的aiosc1在重组酿酒酵母中可以将2,3-氧化鲨烯催化生成tirucalla-7,24-dien-3β-ol,成功得到了一株产tirucalla-7,24-dien-3β-ol的酿酒酵母tir-3。
59.选定tir-3为高产tirucalla-7,24-dien-3β-ol底盘菌株,进行下一步鉴定。
60.为了多方面验证aicyp71cd2的功能,本研究将功能基因连接peaq-dest载体上,构建了植物表达载体,随后将含有aiosc1的农杆菌浸染烟草,在烟草的代谢产物中检测到了tirucalla-7,24-dien-3β-ol成分,即aiosc1可以在烟草中发挥功能,验证了aiosc1重组菌株的结果真实性。
61.随后将含有aiosc1与aicyp71cd2的农杆菌混合后侵染烟草,通过gc-ms分析,在产物中同时检测到tirucalla-7,24-dien-3β-ol与二氢尼洛替星,证明来自印楝的aicyp71cd2可以催化tirucalla-7,24-dien-3β-ol为dihydroniloticin(二氢尼洛替星)。
62.图3为aicyp71cd2在本氏烟草中的瞬时表达功能分析;a:表达peaq-ht-aiosc1载体的本氏烟草叶片提取物的气相色谱-质谱分析,tic模式,红色箭头表示aiosc1产物;b:aiosc1产物的质谱图;c:气相色谱-质谱联用(gc-ms)分析同时表达peaq-ht-aiosc1和aicyp71cd2或单独表达peaq-ht-aiosc1的本氏烟草叶片提取物;d:aicyp71cd2产物的质谱分析;e:气相色谱-质谱联用(gc-ms)分析二氢尼洛替星标准品;f:二氢尼洛替星标准品的质谱分析。
63.图4为aicyp71cd2在酿酒酵母tir-3中的表达功能分析;a:表达pyes3-aiosc1和pyes3-aicyp71cd2的酿酒酵母提取物及二氢尼洛替星标准品的气相色谱-质谱分析,对照组仅表达pyes3-aiosc1,tic模式,红色箭头表示aicyp71cd2产物;b:aicyp71cd2产物的质谱分析。
64.实施例 3. 产二氢尼洛替星重组酵母菌株构建首先以实验室前期构建的敲除bts1(gene id: 856036)与erg27( gene id: 850790)的c-e-b为底盘菌株,将mva途径中erg19(gene id: 855779)、erg10(gene id: 856079)、erg12(gene id: 855248)、idi1(gene id: 855986)过表达,并引入来自拟南芥的atcpr基因,以leu为筛选标记,通过醋酸锂法整合至酵母染色图rdna位点,构成一株高产鲨烯的cb-9重组酿酒酵母。
65.随后以cb-9为底盘菌株,将拟南芥来源atcpr与印楝aiosc1带上诱导型启动子gal10,构成pgal10-atcpr-tadh1、tcyc1-aiosc1-pgal1,通过醋酸锂转化法并以his为筛选标记整合至酵母染色体delta位点,得到一株高产tirucalla-7,24-dien-3β-ol的底盘菌株tir-3。以tir-3为底盘菌株,使用gal1-opaicyp71cd2-cyc酵母表达质粒,通过醋酸锂转化法酵母整合,成功鉴定出aicyp71cd2可以催化tirucalla-7,24-dien-3β-ol为二氢尼洛替星。
66.最后,以cb-9为底盘菌株将密码子优化后op-aicyp71cd2,及拟南芥来源atcpr、印楝来源aiosc1以表达盒形式通过醋酸锂转化法整合至酵母染色体delta位点,各重组酵母基因型见图5,其中,a为同源重组片段在染色体上的连接方式示意图;b为同源重组片段电泳检测图,m为2000plus maker,从上到下条带为:5000bp、3000bp、2000bp,1为delta-up,2为ura3,3为op-aicyp71cd2,4为atcpr,5为aiosc1,6为delta-down至此,产二氢尼洛替星的生物合成构建成功,见图6。
67.在转化后的缺陷型培养皿上挑取单菌落活化至对应缺陷型的液体培养基(300μl),随后全部接种至100ml三角瓶装40ml的ypda培养基中,过夜培养,随后5000rpm,2min离心收集菌体,无菌水水洗菌体彻底去除菌体中残留葡萄糖,随后将菌体加入至含有20g/l半乳糖的ypd培养基中进行诱导表达,发酵6天,破碎菌体上机检测。
68.在得到6株高产二氢尼洛替星的重组酿酒酵母di-1到di-6,其中di-3产量最高(图7)。di-3产量最高,为2.08mg/l。表明高产二氢尼洛替星的酿酒酵母构建成功,后续可以通过发酵酿酒酵母di-3来大量制备二氢尼洛替星,还可以将di-3作为底盘菌株在胞内鉴定印楝生物下游合成途径中的功能基因。
69.其中提到的醋酸锂转化法具体操作如下:在加有葡萄糖的缺陷型培养基中活化酿酒酵母cb-9至od
600 nm为0.3,按照1:1000的比例接种到装有30ml ypd液体培养基的100ml三角瓶中,过夜培养至od
600
nm为0.7-1.0,用醋酸锂法制备酵母感受态。通过热激法分别将各基因表达盒导入酿酒酵母cb-9中,具体操作步骤如下:a)将酿酒酵母cb-9在对应缺陷型固体培养基划线,30℃恒温培养2d,待单克隆长出,挑取单克隆接种于5ml的对应缺陷型液体培养基中,在30℃摇床200r/min过夜培养至od
600
nm为0.3左右,活化菌株。b)取300μl上述培养菌液接种于30 ml新鲜ypd培养基中,于30℃摇床中200r/min培养至od
600
nm值达到0.7-1.2之间。c)将上述菌液在超净工作台中转移至50ml无菌离心管中,3000r/min离心5min收集菌体。再将上述收集的菌体重悬于10ml无菌水中,3000r/min离心5 min收集菌体,用以洗
涤菌体上残留的培养基。将收集的菌体转移至1.5ml无菌离心管中,3000r/min离心2min,收集菌体。此时制备感受态前的工作已做完。d)将上述收集的菌体重悬于1ml的100mmol/l liac中,13000r/min离心15s,弃上清。然后收集的菌体重悬于400μl的100mmol/l liac中,然后分装至1.5ml无菌离心管中,每管50μl。e)将分装好的感受态3000r/min离心15s弃上清,并向其依次加入240μl 50%的peg3350、36μl的1mol/l liac以及5μl鲑鱼精子(ssdna,在99℃金属浴中加热10min使之变性,变性后立即放置于冰上备用)以及100 ng质粒(阴性对照加相同体积的水),并用移液枪轻轻吹打混匀。f)将混匀的体系冰浴30min,42℃热激25min,再立即放置冰上2min。3000r/min离心2min,弃上清,并将菌体重悬于800μl ypd液体培养基中,在30℃摇床200r/min振荡培养2h。g)3000r/min离心2min,弃上清,菌体重用800μl无菌水中洗涤,在相同条件下离心弃上清。h)将洗好的菌体重悬于500μl无菌水中,取100μl菌液涂布到对应缺陷型的固体培养基上,放入30℃恒温培养箱培2d。
70.实施例4. 重组酿酒酵母菌株di-3发酵生产二氢尼洛替星通过优化反应器对微生物进行发酵,可实现目标产物高效生产。本实验构建高产二氢尼洛替星的重组酿酒酵母菌株是利用酵母体自身物质为起始底物,而这与酵母自身的生长状态相偶联,因此通过高密度发酵,对环境因素(温度30℃、ph=5.0~5.5,溶氧大于30%,半乳糖补料与溶氧负反馈关联、空气通量10l/min、搅拌速率与溶氧关联等)进行精确控制可以实现在较短时间获得大量细胞及目标产物。种子液接种至装有含葡萄糖的ypd培养基的发酵罐中,当葡萄糖含量为0时开始用半乳糖补料,每隔12h取样,发酵144h。发酵结束后,gc-ms检测的mrm模式对所有取样的菌体代谢产物以及标准品进行检测,高密度发酵后不同时期代谢产物的浓度见图8。基于高密度发酵策略,重组酿酒酵母di-3产二氢尼洛替星达147mg/l,比摇瓶发酵提高70倍。
71.实施例5.重组酿酒酵母di-3表达产物的分析样品处理:取1ml的重组酿酒酵母工程菌株,12000rmp离心10min弃上清,加入无菌水清洗3次,12000rmp离心10min弃上清,加入0.5g的玻璃珠和1ml的乙酸乙酯,震荡15min,超声30min,12000rmp离心10min收集上清液,过滤膜后取100μl加入内衬管。
72.样品检测:采用气相色谱-质谱联用仪(gc-ms)对酿酒酵母的乙酸乙酯萃取产物进行分析鉴定。所用色谱仪为安捷伦气相色谱质谱联用仪gcms-7000,色谱柱为se-30(0.25μm
×
0.25mm
×
30m),载气氦气的流速为1.5ml
·
min-1
;进样口温度300℃,不分流进样,进样量1μl;柱箱程序升温起始温度80℃保持1min,然后以20℃
·
min-1
的速度升温至280℃,保持15min后以20℃
·
min-1
的速度升温至300℃,保持5min;质谱扫描范围m/z40~550,进样体积为2μl。数据采集模式:tic模式。二氢尼洛替星质谱图见图4。各代谢产物离子对分别为:squalene: 136,121; ergosterol: 468,133; lanosterol: 393,187; tirucalla-7,24-dien-3β-ol: 393,187; dihydroniloticin: 497,407。
73.实施例6.重组酿酒酵母di-3菌液中二氢尼洛替星分离纯化及检测(nmr结果)为了得到较高纯度的二氢尼洛替星,需要对发酵菌液进行破碎提取,随后进行分离纯化,以下内容内二氢尼洛替星的提取纯化步骤:1.萃取:1)将发酵结束的菌液离心,用氢氧化钾乙醇溶液(菌液与koh-乙醇按至少10:1的体积比,即25l菌液至少加2.5l)裂解,90℃水浴2h。2)裂解后的菌体降至室温,加入至少与裂解液等体积的乙酸乙酯萃取(先边搅拌边超声20min,再用分液漏斗萃取,取上层,
上层为乙酸乙酯相)。3)再用悬蒸出的乙酸乙酯重新萃取一次。4)先取出第一次萃取的乙酸乙酯相10ml,蒸干衍生化上机检测(图9),同时将所有乙酸乙酯相用旋转蒸发仪蒸干。注:最后可能会有一些油油的物质蒸不干,可以再加乙酸乙酯萃取一次。
74.2.硅胶分离(6l菌液的用量):1)用8g硅胶拌样:将上一部步得到的所有干物质用二氯甲烷复溶,少量多次复溶并拌入硅胶中,每次拌完等待硅胶干后再拌下次。2)干法装柱:用约65g硅胶装柱子,用真空抽滤机将硅胶柱压实,再用5倍柱体积的石油醚走柱子。3)将拌好的样品倒入硅胶层析柱中,用200ml冲柱子,然后依次用300ml的石油醚:乙酸乙酯5:1的溶液、400ml 3:1的溶液,400ml2:1的溶液以及200 ml 1:1的溶液冲柱子。收集3:1和2:1的组分,每50ml收集一管。4)分别从收集的16管组分中取出2ml蒸干,加100μl衍生化试剂,80℃温育30min。gc-ms检测目标物质分布在哪几管(图10),重点关注3:1的6、7、8管和2:1的1、2、3、4管。同时将所有收集的组分蒸干备用。
75.3.半制备色谱分离:1)将上一步得到的所有有目标成分的组分混合,蒸干后用甲醇配制成约20 mg/ml的溶液。如不溶则降低浓度直至全部溶解,每次最大进样量为500μl。2)液相条件:流速3ml/min;紫外210nm;0 min:30%水,70%甲醇;10min:10%水,90%甲醇;20min:0%水,100%甲醇;60min:0%水,100%甲醇。3)出峰时间在34min左右,将34min前后的峰的组分浓缩至1ml取50μl衍生化上机检测(图11)。并将所有目标物质的组分合并蒸干。随后用最少体积的乙醇过饱和溶解样品,4℃静止12h结晶,取结晶样品nmr检测,得到nmr图谱,见图12、表4。
76.表4
上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。以上所述实施例仅表达了本发明的几种实施方式,便于具体和详细地理解本发明的技术方案,但并不能因此而理解为对发明专利保护范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
77.应当理解,本领域技术人员在本发明提供的技术方案的基础上,通过合乎逻辑的分析、推理或者有限的试验得到的技术方案,均在本发明所述附权利要求的保护范围内。因此,本发明专利的保护范围应以所附权利要求的内容为准,说明书及附图可以用于解释权利要求的内容。
