靶向环状rna circrhobtb3的反义寡核苷酸及在结直肠癌治疗中的应用
技术领域
1.本发明属于分子生物学领域,涉及aso药物的设计及应用。具体来说,本发明针对人circrhobtb3的环化及分泌调控元件序列分别设计合成了两条反义寡核苷酸aso,通过促进circrhobtb3以及抑制circrhobtb3的外泌体分选从而提高其细胞内表达,所述aso可在体内外抑制结直肠癌细胞的生长和转移。
背景技术:
2.环状 rna(circrna)是非编码 rna 重要成员之一;不同于线性长链非编码 rna(lncrna),circrna 主要由 rna 聚合酶 ii 转录产生的前体 rna 通过反向剪接产生的一类不具有 5'末端帽子和 3'末端 poly(a) 尾巴结构,却以共价键形成闭环结构的环状 rna 分子。。circrna参与调控一系列的疾病过程,如心血管疾病、神经系统疾病、代谢性疾病和肿瘤等疾病的发生和发展。尤其在肿瘤中通过高通量测序技术筛选已经鉴定出大量与肿瘤密切相关的 circrna。
3.circrhobtb3 是其母基因 rhobtb3 第 6 和第 7 外显子背靠背反向剪接环化产生,目前有文献报道circrhobtb3 的生物学功能通过分子海绵作用吸附 mir-654-3p 和调控 pi3k/akt 信号通路,从而抑制胃癌和卵巢癌进展。我们的前期实验也证明circrhobtb3可以通过别的机制抑制结直肠癌的进展。
4.侵袭和转移是恶性肿瘤最普遍的生物学特征,也是影响患者生存和预后的关键因素,结直肠癌不仅发病率高且在中晚期极易发生转移,成为治疗失败的主要原因。目前并未有针对circrhobtb3的反义寡核苷酸(antisense oligonucleotide,aso)的产品及其在抑制结直肠癌发生发展中的应用的相关研究。
技术实现要素:
5.为了弥补现有技术中的不足,本发明设计并合成了靶向circrhobtb3的aso药物,可以有效提高circrhobtb3在细胞中的水平。用所述aso处理结直肠癌细胞以及动物肿瘤转移模型后,有效抑制了结直肠癌细胞在体外的增殖、迁移和侵袭以及在体内的转移,为恶性肿瘤的治疗提供了一条途径。
6.本发明的一个方面是提供circrhobtb3的反义寡核苷酸aso序列aso-cir,其可以通过靶向circrhobtb3的环化元件,阻碍抑制性剪接因子的结合从而提高circrhobtb3表达水平,所述的aso-cir包含如下序列:5'
‑ꢀ
guugcctgaagattcatggcuagca
ꢀ‑
3',优选的,所述的aso-cir由序列5'
‑ꢀ
guugcctgaagattcatggcuagca
ꢀ‑
3'组成。在一个具体的实施例中,所述的aso-cir被修饰,所述的修饰包括但不限于5’及3’各5个碱基2
’‑
ome修饰,全链硫代磷酸酯键修饰,模式为mmmmmdddddddddddddddmmmmm,其中m代表2
’‑
ome修饰的rna,d表示未修饰的dna,各碱基(碱基类似物)由硫代磷酸酯键连接。
7.本发明的第二个方面提供circrhobtb3的反义寡核苷酸aso序列aso-exo,其可以
通过靶向分泌调控元件,抑制circrhobtb3的外泌体分选从而提高circrhobtb3表达水平;所述aso-exo包含如下序列:5'-uagcaaaaagatcctgggtaguucg-3',优选的,所述的aso-exo由序列5'
‑ꢀ
5'-uagcaaaaagatcctgggtaguucg-3'组成。在一个具体的实施例中,所述的aso-exo被修饰,所述的修饰包括但不限于5’及3’各5个碱基2
’‑
ome修饰,全链硫代磷酸酯键修饰,模式为mmmmmdddddddddddddddmmmmm,其中m代表2
’‑
ome修饰的rna,d表示未修饰的dna,各碱基(碱基类似物)由硫代磷酸酯键连接。
8.本发明的第三个方面提供一种可提高circrhobtb3表达的组合物,包括了aso-cir和aso-exo,其中aso-cir的序列包含5'
‑ꢀ
guugcctgaagattcatggcuagca
ꢀ‑
3';aso-exo序列包含5'-uagcaaaaagatcctgggtaguucg-3'。在一个具体的实施方式中,所述的aso-cir的序列为5'
‑ꢀ
guugcctgaagattcatggcuagca
ꢀ‑
3'。在另外一个具体的实施方式中,所述的aso-exo序列为5'-uagcaaaaagatcctgggtaguucg-3'。在另外一个具体的实施方式中,所述的aso-cir和/或aso-exo的序列被修饰,优选的,所述的修饰包括但不限于5’及3’各5个碱基2
’‑
ome修饰,全链硫代磷酸酯键修饰,模式为mmmmmdddddddddddddddmmmmm,其中m代表2
’‑
ome修饰的rna,d表示未修饰的dna,各碱基(碱基类似物)由硫代磷酸酯键连接。
9.本发明的第四个方面是circrhobtb3的环化和/或分泌调控元件的反义寡核苷酸aso在体外抑制肿瘤细胞的应用。具体的,所述的circrhobtb3的环化和/或分泌调控元件的反义寡核苷酸aso为aso-cir和/或aso-exo,在一个具体的实施例中,所述的aso-cir的包含::5'
‑ꢀ
guugcctgaagattcatggcuagca
ꢀ‑
3';在另外的一个具体实施例中,所述的aso-exo的序列包含::5'-uagcaaaaagatcctgggtaguucg-3'。
10.在一个具体的实施例中,所述的肿瘤细胞为结直肠癌细胞;优选的,结直肠癌细胞为sw480细胞。
11.在另外一个具体的实施例中,所述的应用包括如下步骤:将上述设计aso合成纯化后溶于rnase-free水中,使终浓度为10-30 μm,处理细胞时使用了neofext转染试剂。:1.将细胞培养于六孔板中,每孔10^6个细胞,四个个孔;2.第二天将六孔板中的培养基弃去,分别换成含有2 微升对照、aso-cir、aso-exo以及aso-cir联合aso-exo的dmem培养液,每个孔中另含转染试剂neofect 2微升;3.第三天将培养板中细胞的培养液都换成2ml新鲜的含10%胎牛血清的1640培养基;4.第四天进行cck8细胞增殖实验和transwell小室细胞迁移侵袭实验。
12.在另外一个具体的实施例中,所述的aso被修饰,优选的,所述的修饰方式包括但不限于5’及3’各5个碱基2
’‑
ome修饰,全链硫代磷酸酯键修饰,模式为mmmmmdddddddddddddddmmmmm,其中m代表2
’‑
ome修饰的rna,d表示未修饰的dna,各碱基(碱基类似物)由硫代磷酸酯键连接。
13.本发明的第五个方面是提供是circrhobtb3的环化和/或分泌调控元件的反义寡核苷酸aso在制备抑制肿瘤的试剂中的应用。在一个具体的实施例中,所述的肿瘤为结直肠癌,优选的为小鼠异体脾原位成瘤肝转移模型的结直肠癌;其中,所述的aso为aso-cir和/或aso-exo,其中aso-cir的序列包含5'
‑ꢀ
guugcctgaagattcatggcuagca
ꢀ‑
3';aso-exo序列包含5'-uagcaaaaagatcctgggtaguucg-3'。在一个具体的实施方式中,所述的aso-cir的序
列为5'
‑ꢀ
guugcctgaagattcatggcuagca
ꢀ‑
3'。在另外一个具体的实施方式中,所述的aso-exo序列为5'-uagcaaaaagatcctgggtaguucg-3'。在另外一个具体的实施方式中,所述的aso-cir和/或aso-exo的序列被修饰,优选的,所述的修饰包括但不限于5’及3’各5个碱基2
’‑
ome修饰,全链硫代磷酸酯键修饰,模式为mmmmmdddddddddddddddmmmmm,其中m代表2
’‑
ome修饰的rna,d表示未修饰的dna,各碱基(碱基类似物)由硫代磷酸酯键连接。
14.有益效果:本发明通过cck8细胞增殖实验和transwell小室细胞迁移侵袭实验,脾原位肝转移模型动物实验,检测了aso处理的结直肠癌细胞组与阴性对照细胞组的增殖能力、迁移侵袭能力以及体内的转移能力的差异。结果显示aso处理后,circrhobtb3的水平明显增加,结直肠癌肿瘤细胞的体外增殖能力和迁移侵袭能力以及体内转移能力相比于阴性对照组都明显下降。
附图说明
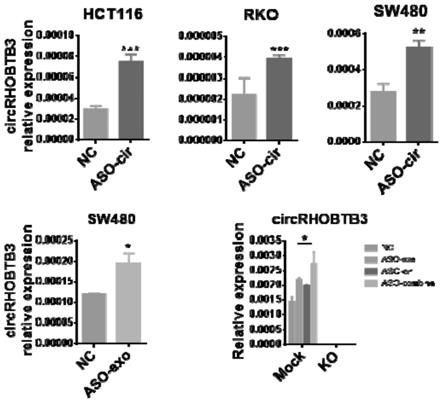
15.图1以aso-cir序列及修饰,合成后处理结直肠癌细胞系rko,hct116,sw480后,qpcr实验验证得出实验组增加circrhobtb3表达水平效果显著;以aso-exo序列及修饰,合成后处理结直肠癌细胞系sw480后,qpcr实验验证得出实验组增加circrhobtb3表达水平效果显著;以aso-cir和aso-exo分别或联合处理circrhobtb3敲除的结直肠癌细胞系sw480-ko后,qpcr实验验证得出mock组中实验组增加circrhobtb3表达水平效果显著,ko组中则无效;其中nc组作为阴性对照,aso-cir组代表aso-cir实验组,aso-exo组代表aso-exo实验组,aso-combine组代表aso-cir和aso-exo联用实验组,mock代表sw480野生型细胞,ko代表sw480 circrhobtb3敲除细胞。
16.图2以aso-cir处理以后,结直肠癌细胞系rko,hct116,sw480增殖能力明显下降;以aso-exo处理以后,结直肠癌细胞系sw480增殖能力明显下降;以aso-cir和aso-exo分别或联合处理circrhobtb3敲除的结直肠癌细胞系sw480-ko后,结直肠癌细胞系sw480-mock增殖能力都明显下降,sw480-ko组都不变;本结果是通过cck8实验得到。
17.图3以aso-cir处理以后,结直肠癌细胞系rko,hct116,sw480迁移侵袭能力受到明显抑制;以aso-exo处理以后,结直肠癌细胞系sw480迁移侵袭能力受到明显抑制;以aso-cir和aso-exo分别或联合处理circrhobtb3敲除的结直肠癌细胞系sw480-ko后,结直肠癌细胞系sw480-mock迁移侵袭能力都受到明显抑制,sw480-ko组都不变;该结果通过transwell小室来完成,照片右面的柱状图是小室拍照后用image j软件统计染色的面积后得到。
18.图4以aso-cir和aso-exo联合注射接种hct116细胞的脾脏肝转移模型小鼠后,结直肠癌细胞系hct116的肝转移灶数目显著减少;该结果通过he染色确定转移发生,右面的散点图是对肉眼可见转移灶的数目进行统计得到。
具体实施方式
19.实施例1aso-cir和aso-exo对结直肠癌细胞增殖能力的抑制1、材料结直肠癌细胞系sw480、ht116、rko由中国科学院生物化学与细胞生物学研究所提供。rpmi1640、dmem、0.05% trypsin、胎牛血清购于gibco公司;cck8试剂购于博士德公司;
neofect购自北京码因科技有限公司。其他药品为国产分析纯。
20.2、方法2.1以sw480和aso-cir为例,分别计数5*10^5个铺于六孔板两个孔。
21.2.2第二天按以下配置转染体系:dmem 100微升,neofect转染试剂 2微升,20 μm aso-cir 2微升。
22.2.3一天后,铺96孔板,进行cck8增殖实验。
23.1)将sw480-control组和sw480-aso-cir组细胞用胰蛋白酶消化下来,收集细胞,计数,使其细胞终浓度为每100ul含10%胎牛血清1640培养基含2000个细胞,总量为3ml;2) 将两组细胞终浓度稀释为每100ul含10%胎牛血清1640培养基含2000个细胞的培养基,加到96孔板中,每组12个小孔(0h,24h,48h,72h共4个时间点,每个时间点需3个复孔,所以需12个小孔),每个小孔100ul培养基,含2000个细胞。同时向96孔板中加12个小孔的无细胞的l含10%胎牛血清1640培养基作为空白对照blk。其余空下的孔加上约100ulpbs,防止培养基蒸发。
24.3)3h后,细胞贴壁,向sw480-control组和sw480-aso-cir组及blk组加cck8试剂,每一组加3个小孔,每个小孔加10ul。
25.4)加cck8试剂3h后,将所有加药的孔按顺序一一对应转移到一张新的96孔板中,在酶标仪上选择检测cck8的波长,进行吸光度检测。此时,为0h数据。
26.5) 0h为基点,后续进行24h,48h,72h的检测试验。操作过程与0h操作相同。
27.6) 数据处理,每个时间点实验组3个复孔的od减去blk组三个复孔od值的均值,即为实验组3个复孔的绝对od值。然后再根据每个时间点的两组细胞的3个复孔的绝对od值,得到了增殖曲线,见图2。
28.实施例2aso-cir和aso-exo对结直肠癌细胞迁移侵袭能力的抑制1、材料结直肠癌细胞系sw480、ht116、rko由中国科学院生物化学与细胞生物学研究所提供。rpmi1640、dmem、0.05% trypsin、胎牛血清购于gibco公司;cck8试剂购于博士德公司; transwell双层板购于costar公司,matrigel胶购于bd公司,结晶紫购于碧云天公司。其他药品为国产分析纯。
29.2、方法2.1以sw480和aso-cir为例,分别计数5*10^5个铺于六孔板两个孔。
30.2.2第二天按以下配置转染体系:dmem 100微升,neofect转染试剂 2微升,20 μm aso-cir 2微升。
31.2.3一天后,铺transwell小室。
32.1)将含有50ug/ul的fn均匀涂在小室底部涂10ul。于生物安全柜内等其风干(侵袭实验要加matrigel,原液用无血清1640稀释50倍,每小孔加50ul,置于细胞培养箱1h,待matrigel凝固,余下培养基析出后,将其吸除)。
33.2)将sw480-control组和sw480-aso-cir组细胞用胰蛋白酶消化下来,收集细胞,计数,使其细胞终浓度为1*10^6个每100ul无血清1640培养基,总量为400ul。
34.3) 向容纳小室的下层24孔板内每孔加500ul含10%胎牛血清1640培养基。上层小室内加100ul含1*10^6个细胞的无血清培养基。sw480-control组和sw480-aso-cir组每组
设置三个复孔。
35.4)约1-2天后,将sw480-control组和sw480-aso-cir组小室同时取出取出,吸掉室内培养基擦除室内细胞,用600ul4%多聚甲醛固定15分钟;结晶紫染色10分钟;pbs洗三次,晾干后。显微镜下拍照,随机选取3个视野。得到图3左侧照片。
36.5)对上述随机选取的3个视野通过imagej统计染色细胞所占的面积百分比。得到图3右侧柱状图。
37.实施例3aso-cir和aso-exo对结直肠癌细胞系脾原位肝转移模型转移能力的抑制1、材料结直肠癌细胞系hct116由中国科学院生物化学与细胞生物学研究所提供。6周龄雄性nudemice购于上海斯莱克。其他药品为国产分析纯。
38.2、方法2.1将hct116细胞,计数7*10^6个每毫升悬浮于pbs中。
39.2.2麻醉小鼠,暴露脾脏,通过胰岛素针将100微升hct116细胞注射入小鼠脾脏,缝合皮肤及肌层。
40.1)约30天后,通过尾静脉注射20nmolaso-control或10nmolaso-cir和10nmolaso-exo的混合物,每3天注射一次,共计注射6次。
41.2)约60天后,安乐死小鼠,解剖小鼠获得肝脏与脾脏,计数肉眼可见肝转移灶个数,得到右侧散点图,固定组织切片后进行he染色,确定肝脏病灶为肿瘤转移灶。
42.以上具体实施方式仅是为解释说明本发明产品和应用的最佳应用举例,任何本领域技术人员知晓的所属领域的常规技术手段和应用方式均包含的本发明要求的保护范围之内。
