csf1r相关基因突变作为诊断cvm的标志物及其应用
技术领域
1.本发明属于医学检测技术领域,具体而言,涉及csf1r相关基因突变作为诊断cvm的标志物及其应用。
背景技术:
2.先天性椎体畸形(congenital vertebral malformation,cvm)是一种严重的先天脊柱发育异常,同时也是造成青少年残疾的主要疾病之一。cvm是由于胚胎发育过程中体节发育异常所引起的一组以脊柱椎体结构异常为主要特征的疾病,可表现为先天性脊柱侧凸(congenital scoliosis,cs)、脊柱后凸等脊柱畸形,进而导致颈背痛、心肺功能受损、劳动能力下降,甚至残疾等严重的躯体问题(giampietro p f, raggio c l, blank r d, et al. clinical, genetic and environmental factors associated with congenital vertebral malformations[j]. molecular syndromology, 2013, 4(1-2): 94-105.)。流行病学调查显示cvm在新生儿中的发病率在0.5-1
‰
之间,但是由于部分患者并无明显症状或症状较轻而未被发现,因此,实际的cvm在新生儿中的发病率更高。致畸因素主要存在于成长发育高峰期之前,当cvm患者进入脊柱发育高峰期时,畸形进展通常比较迅速,患者往往表现为颈胸背部疼痛、心肺功能受限、运动能力降低,加之躯体疼痛、畸形易诱发严重的心理问题,矫形手术复杂、费用高昂,也给家庭和社会带来极大的负担。
[0003]
cvm的发病机制目前尚未完全明确,cvm归因于胚胎期的轴旁中胚层、体节或中轴骨发育异常,在胚胎发育过程中任何对于轴旁中胚层、体节和中轴骨发育过程的影响都可能导致cvm(mcmaster m j. congenital scoliosis caused by a unilateral failure of vertebral segmentation with contralateral hemivertebrae[j]. spine, 1998, 23(9): 998-1005.)。因此,cvm的发生是多种因素共同作用的结果,主要是由遗传因素和环境因素共同作用,相关研究报道cvm具有遗传倾向性,相对于环境因素,遗传因素被认为在cvm的发生和发展中占据了主导的地位,目前认为胚胎发育时期体节形成相关基因的变异或调控异常是导致cvm的重要机制。随着基因组学和测序技术的快速发展,已有研究报道pax1、tbx6、wnt3a、lmx1a、dll3等基因的多态性和罕见变异与cvm密切相关;染色体17p11.2、16p11.2、10q24.31、21p11、22q11.2等区域的拷贝数变异与cvm密切相关。随着对cvm的研究不断深入,越来越多的研究结果表明罕见突变可能在遗传病cvm的发生和发展中的作用更为重要。
[0004]
目前,关于cvm相关的罕见突变的研究进展缓慢。本发明针对上述缺陷,通过对538名cvm患者进行外显子组测序和生物信息学分析,首次在csf1r基因上发现了突变位点c.2749_2758delgacaggagag、c.2797g》t、c.2906_2909dupatca,经体外和体内的功能实验验证了上述突变位点为cvm的致病突变,因此,可通过采集受试者的外周血,提取基因组dna,检测csf1r基因上是否存在一种或多种上述突变位点,即可用于辅助cvm的快速诊断,本发明为从病因学出发控制cvm的发病率、实现cvm的早期诊断和早期干预奠定了基础。
技术实现要素:
[0005]
针对目前本领域存在的技术不足,本发明的目的在于提供csf1r相关基因突变作为诊断cvm的标志物及其应用,所述csf1r相关基因突变包括c.2749_2758delgacaggagag、c.2797g》t、c.2906_2909dupatca,经体外和体内的功能实验验证了上述突变位点为cvm的致病突变,表明上述致病突变能用于cvm的早期诊断。
[0006]
本发明的上述目的通过以下技术方案得以实现:本发明的第一方面提供了一种用于诊断cvm的基因突变。
[0007]
进一步,所述基因突变是csf1r基因上的突变。
[0008]
进一步,所述突变为c.2749_2758delgacaggagag、c.2797g》t、c.2906_2909dupatca。
[0009]
作为一种可选择的实施方式,所述突变为c.2749_2758delgacaggagag、c.2797g》t、c.2906_2909dupatca中的任意一种。
[0010]
作为一种可选择的实施方式,所述突变为c.2749_2758delgacaggagag、c.2797g》t、c.2906_2909dupatca中的任意两种。
[0011]
作为一种可选择的实施方式,所述突变为c.2749_2758delgacaggagag、c.2797g》t、c.2906_2909dupatca三种。
[0012]
本发明中所述的位于csf1r基因上的突变位点的具体信息分别如下:c.2749_2758delgacaggagag的具体信息:nm_005211.3:c.2749_2758delgacaggagag(p.asp917serfster32);c.2797g》t的具体信息:nm_005211.3:c.2797g》t(p.gly933cys);c.2906_2909dupatca的具体信息:c.2906_2909dupatca(p.phe971serfster7)。
[0013]
本发明的第二方面提供了一种检测试剂。
[0014]
进一步,所述检测试剂是本发明第一方面所述的基因突变的检测试剂。
[0015]
进一步,所述检测试剂包括所述基因突变的特异性扩增引物和/或特异性识别探针;优选地,所述基因突变为c.2749_2758delgacaggagag、c.2797g》t、c.2906_2909dupatca。
[0016]
进一步,所述基因突变c.2749_2758delgacaggagag、c.2797g》t、c.2906_2909dupatca的特异性扩增引物的序列分别如seq id no.1-seq id no.2、seq id no.3-seq id no.4、seq id no.5-seq id no.6所示。
[0017]
进一步,所述试剂还包括dntps、taq酶、mg
2+
和pcr反应缓冲液。
[0018]
可采用本领域技术人员已知的某些方法来检测所述基因突变,所述方法包括(但不限于):dna测序;引物延伸测定法,包括细胞突变特异性核苷酸掺入测定法和细胞突变特异性引物延伸测定法(例如:细胞突变特异性pcr、细胞突变特异性连接链式反应(lcr)、和缺口-lcr);突变特异性寡核苷酸杂交测定法(例如:寡核苷酸连接测定法);切割保护测定法,其中使用免受切割剂作用的保护来检测核酸双链体中的错配碱基;对muts蛋白结合的分析;比较变异型和野生型核酸分子迁移率的电泳分析;变性梯度凝胶电泳(dgge,如在例如myers等(1985)nature 313:495中所述的方法);对rna酶在错配碱基对处切割的分析;分析对异源双链dna的化学或酶促切割;质谱术(例如:maldi-tof-ms);遗传比特分析
(genetic bitanalysis,gba);5’核酸酶测定法(例如:taqman
tm
);采用分子信标的测定法。
[0019]
进一步,本发明所述的引物或探针可以使用磷酰亚胺固相支持法或其他熟知方法化学合成。也可以使用本领域已知的许多手段修饰所述核酸序列。这些修饰的非限制性实例是甲基化、加帽、用天然核苷酸的一种或多种类似物进行的置换和在核苷酸之间的修饰,例如,修饰不带电荷的连接体(例如,磷酸甲酯、磷酸三酯、磷酰亚胺、氨基甲酸酯等),或修饰带电荷的连接体(例如,硫代磷酸酯、二硫代磷酸酯等)。
[0020]
本发明的第三方面提供了一种cvm的诊断产品。
[0021]
进一步,所述诊断产品包括本发明第二方面所述的检测试剂;优选地,所述诊断产品包括试剂盒、芯片、试纸。
[0022]
进一步,所述试剂盒还包括使用说明书或标签、阳性对照物、阴性对照物、缓冲剂、助剂或溶剂;所述说明书或标签详细记载了如何使用所述试剂盒进行检测以及所述试剂盒用于诊断cvm。在某些实施方案中,所述试剂盒还包含洗涤溶液。在某些实施方案中,所述试剂盒还包含进行杂交试验的试剂、mrna分离或纯化工具、检测工具以及阳性和阴性对照。在某些实施方案中,所述试剂盒还包含使用该试剂盒的说明书。在某些实施方案中,本发明提供的是用于检测一种或多种生物标志物的蛋白质水平的试剂盒。在某些实施方案中,所述试剂盒包含用识别蛋白质生物标志物的抗体包被的试纸条、洗涤溶液、进行该试验的试剂、蛋白质分离或纯化工具、检测工具以及阳性和阴性对照。在某些实施方案中,所述试剂盒还包含使用该试剂盒的说明书。所述试剂盒可以定制供在家使用、临床使用或科学研究使用。
[0023]
进一步,本发明所述的试剂盒可包含适于实用(如针对不同的检测方法)的多种不同的试剂,并不限于目前本发明中所列举的试剂,只要是基于csf1r基因上的突变c.2749_2758delgacaggagag、c.2797g》t、c.2906_2909dupatca的检测来诊断cvm的试剂均包含在本发明的范围内。
[0024]
进一步,所述试剂盒可以采用例如试纸条、膜、芯片、盘、测试条、滤器、微球、载片、多孔板或光纤。所述试剂盒的固相支持物可以是例如塑料、硅片、金属、树脂、玻璃、膜、颗粒、沉淀物、凝胶、聚合物、薄片、球、多糖、毛细管、胶片、板或载片。
[0025]
进一步,所述芯片的制备可采用本领域技术人员已知的生物芯片的常规制备方法,包括(但不限于):采用修饰玻片或硅片的固相载体,探针的5’端含有氨基修饰的聚dt串,将寡核苷酸探针配制成溶液,然后采用点样仪将其点在修饰玻片或硅片上,排列成预定的序列或阵列,然后通过放置过夜来固定,就可得到本发明所述的芯片;如果核酸不含氨基修饰,则其制备方法也可参照:王申五主编的《基因诊断技术-非放射性操作手册》;j.l.erisi, v.r.iyer, p.o.brown. exploring the metabolic and genetic control of gene expression on a genomic scale. science, 1997;278:680和马立人,蒋中华主编. 生物芯片. 北京:化学工业出版社,2000,1-130。
[0026]
本发明的第四方面提供了一种构建cvm斑马鱼模型的方法。
[0027]
进一步,所述方法包括如下步骤:(1) 培育斑马鱼的胚胎;(2) 构建含有突变基因序列的突变的csf1r质粒;(3) 质粒线性化后,进行转录获得mrna;(4) 将所述mrna注射入斑马鱼胚胎单细胞期至二细胞期的细胞中;
优选地,步骤(2)中所述突变基因为csf1r基因上的c.2749_2758delgacaggagag;优选地,步骤(4)中所述mrna为50pg。
[0028]
进一步,步骤(1)中所述的斑马鱼优选为tg(ola.sp7:nlsgfp)转基因斑马鱼。
[0029]
本发明的第五方面提供了本发明第一方面所述的基因突变在制备本发明第二方面所述的检测试剂中的应用。
[0030]
进一步,所述基因突变位点为c.2749_2758delgacaggagag、c.2797g》t、c.2906_2909dupatca。
[0031]
本领域技术人员根据基因突变位点上下游序列设计特异性扩增引物或者特异性识别探针,引物和探针的设计方法是本领域已知的常规技术。
[0032]
本发明的第六方面提供了本发明第一方面所述的基因突变或本发明第二方面所述的检测试剂在制备cvm的诊断产品中应用;优选地,所述cvm的诊断产品如本发明第三方面所述的cvm的诊断产品;更优选地,所述诊断产品通过检测样本中本发明第一方面所述的基因突变来诊断受试者是否患有cvm;最优选地,所述样本的来源是受试者的血液。
[0033]
进一步,所述诊断产品包括试剂盒、芯片、试纸。
[0034]
本发明的第七方面提供了本发明第四方面所述的方法制备得到的cvm斑马鱼模型在筛选治疗cvm的候选药物中的应用。
[0035]
进一步,所述筛选治疗cvm的候选药物的方法包括如下步骤:(1) 将待筛选的物质施用于cvm斑马鱼模型中;(2) 检测斑马鱼的cvm症状缓解情况;(3) 若施用待筛选的物质后,斑马鱼的cvm症状得到缓解,则该待筛选的物质是治疗cvm的候选药物。
[0036]
本发明所述的基因突变包括其对应的突变蛋白,因此,权利要求书中所述的基因突变位点改为突变蛋白后,仍包含在本发明的保护范围内,任何对突变位点或突变蛋白的改进和修饰也都将落入本发明权利要求的保护范围内。
[0037]
本发明可以利用本领域内已知的任何方法对基因及其编码的蛋白进行检测。本领域技术人员应当理解,检测基因的手段不是本发明的重要方面。本发明中的基因使用本领域普通技术人员已知的多种检测技术进行检测,这些技术包括(但不限于):核酸测序、核酸杂交、核酸扩增技术、免疫检测技术。
[0038]
进一步,检测基因突变或蛋白突变的方法包括(但不限于):taqman法、质谱法、dna微阵列法、测序法、微测序、杂交、限制性片段分析、寡核苷酸连接检测、等位基因特异性pcr-hrm或联合应用上述方法。
[0039]
除非另有定义,本发明上下文中的所使用的所有的技术和科学术语具有本领域普通技术人员所理解的相同含义。本发明的说明书中所使用的术语只是为了描述具体的实施例,不是旨在于限制本发明,此外,对部分术语解释如下。
[0040]
本发明中使用的术语“引物”,是指能够与核酸杂交并容许互补核酸聚合(一般通过提供游离3
’‑
oh基团)的单链多核苷酸。
[0041]
本发明中使用的术语“探针”,是指能与另一分子的特定序列或亚序列或其它部分
结合的分子。除非另有指出,“探针”通常指能通过互补碱基配对与另一多核苷酸结合的多核苷酸探针。根据杂交条件的严谨性,探针能和与该探针缺乏完全序列互补性的靶多核苷酸结合。探针可作直接或间接的标记,其范围包括引物。杂交方式,包括(但不限于):溶液相、固相、混合相或原位杂交测定法。
[0042]
本发明中使用的术语“扩增”,是指生成参照核酸序列或其互补物的一个或多个拷贝的过程。扩增可以是线性或指数性的(例如聚合酶链式反应(pcr))。“拷贝”不必然表示相对于模板序列的完全序列互补性或同一性。例如,拷贝可以包含核苷酸类似物诸如脱氧肌苷、有意的序列改变(诸如经由包含与模板可杂交但不完全互补的序列的引物引入的序列改变)和/或扩增期间发生的序列错误。
[0043]
本发明中使用的术语“外显子”,是指在成熟mrna中被保留下的部分,即成熟mrna对应于基因中的部分。内含子是在mrna加工过程中被剪切掉的部分,在成熟mrna中不存在。外显子和内含子都是对于基因而言的,编码的部分为外显子,不编码的为内含子,内含子没有遗传效应。
[0044]
本发明中使用的术语“诊断”,是指分子或病理状态、疾病或状况的鉴定或分类。其还可以指特定亚型的疾病的分类,例如通过分子特征(例如以特定基因或核酸区域中的核苷酸变异表征的患者亚群)来进行。
[0045]
本发明中使用的术语“治疗”,是指涉及人类或动物(例如,被兽医所应用)的治疗,其中可达到某些预期的治疗效果,例如,抑制病症的发展(包括降低发展速度、使发展停止)、改善病症和治愈病症。还包括作为预防措施(例如预防)的治疗。对还没有发展为病症但有发展为该病症危险的患者的用途,也包括在术语“治疗”中。
[0046]
本发明的优点和有益效果:(1) 通过对538名cvm患者进行外显子组测序和生物信息学分析,首次在csf1r基因上发现了突变位点c.2749_2758delgacaggagag、c.2797g》t、c.2906_2909dupatca,并通过体外和体内的功能实验验证了上述突变位点为cvm的致病突变。
[0047]
(2) 本发明提供了一种cvm斑马鱼模型的构建方法,采用所述方法构建的斑马鱼模型表现为cvm患者的椎体表型,为进一步研究人类cvm的致病机制提供了重要的研究模型。
[0048]
(3) 本发明提供的csf1r相关基因突变作为诊断cvm的标志物,为从病因学出发控制cvm的发病率、实现cvm的早期诊断、早期干预、早期治疗奠定了基础。
[0049]
(4) 本发明提供的能用于诊断cvm的标志物,通过检测受试者血液基因组dna上的csf1r基因上是否存在所述突变位点(c.2749_2758delgacaggagag、c.2797g》t、c.2906_2909dupatca),即可判断出该受试者是否患有cvm,所述诊断方法是一种非侵入性、无创的方法,能够快速有效的做到早期诊断,争取最早的干预时间。
[0050]
附图说明
[0051]
以下,结合附图来详细说明本发明的实施方案,其中:图1显示3例cvm患者中csf1r羧基末端突变位点的突变信息和临床表型,其中,a图:csf1r羧基末端罕见突变位点的sanger测序结果,b图:脊柱平片和计算机断层扫描(ct)
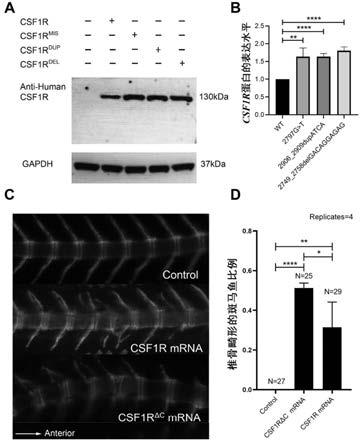
结果图;图2显示cvm患者中csf1r羧基末端罕见突变位点的无意义介导的衰变(nmd)预测和分布,其中,a图:在cvm队列中鉴定出的两个csf1r截短变体的nmd预测,b图:csf1r蛋白的简化图;图3显示csf1r羧基末端突变位点的体内和体外功能性研究,其中,a图:由野生型或突变型csf1r质粒转染的cos-7细胞制成的总细胞裂解物中的csf1r蛋白水平,b图:野生型和突变型质粒转染的cos-7细胞制成的总细胞裂解物中的csf1r蛋白表达水平的定量分析结果,c图:注射野生型csf1r mrna或csf1r
δc
mrna的tg(ola.sp7:nlsgfp)斑马鱼的荧光成像图;d图:实验组(csf1r mrna,csf1r
δc
mrna)与对照组的斑马鱼表现为cvm表型的统计结果图,* p《0.05,** p《0.01,*** p《0.001,**** p《0.0001。
[0052]
具体实施方式
[0053]
下面结合具体实施例,进一步阐述本发明,仅用于解释本发明,而不能理解为对本发明的限制。本领域的普通技术人员可以理解为:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照厂商所建议的条件实施检测。
[0054]
实施例1 筛选与cvm相关的基因突变1、样本收集收集了2009年至2018期间在北京协和医院(pumch)被确诊为先天性椎体畸形(cvm)的患者583名,并纳入disco脊柱畸形研究平台(deciphering disorders involving scoliosis and comorbidities,disco)的一部分(http://www.discostudy.org/),记录了患者的详细临床表型信息,包括相关影像学资料,如x线、计算机断层扫描(ct)及脊柱三维重建、全脊柱磁共振成像(mri),所有受试者本人或其父母均签署了知情同意书,本研究经北京协和医院伦理委员会的批准。
[0055]
2、外显子组测序和数据分析所有收集到的cvm患者均进行了外显子组测序。从患者的外周血中提取dna,并对所有受试者进行了外显子组测序,从dna样品制备illumina配对末端文库并进行外显子组捕获,然后在illumina hiseq 4000平台上测序。使用内部开发的分析管道(peking union medical college pipeline,pump)调用和过滤变体。
[0056]
在本研究中,从外显子组数据汇总提取了所有csf1r中的罕见变异体用于进一步的分析研究。
[0057]
3、变体解释和优先顺序基于基因组聚合数据库(gnomad,http://gnomad.broadinstitute.org/)进行变体解释。其中,csf1r中的罕见变异体按照以下标准进行提取和过滤:(1) 截短(无意义、移码、剪接受体/供体)和次要等位基因频率(maf)≤0.001;(2) 普通人群中公共数据库中缺少的错义变体。
[0058]
4、实验结果
实验结果显示,从3名cvm患者中,鉴定出csf1r中的3个新型的有害杂合变体,包括2个截短变体和1个错义变体(见表1)。
[0059]
受试者disco-css170368。该受试者是一名接受脊柱外科手术的14岁女孩,脊柱平片显示患者脊柱右弯,主弯的冠状面cobb角(t2-l1)为114
°
。ct及脊柱三维重建的结果图显示t5-t9先天性融合,t3-9异型增生,l4半椎骨增生以及左侧第6和第7肋骨异常(见图1b)。此外,还进行了全脊柱mri检查,结果显示出轻度的红肿和脊髓空洞症,在病程进展的过程中,女孩没有呼吸困难、四肢麻木或四肢无力、腰酸或四肢疼痛等症状。该受试者的临床诊断结果为严重的先天性脊柱侧弯、肺功能不全、双体脊髓空洞症和脊髓空洞症。通过外显子组测序分析,在该受试者中鉴定出csf1r中的新型截短变体(nm_005211.3:c.2749_2758delgacaggagag),在患者的csf1r基因第21号外显子上的2749和2758位之间缺失了10个核苷酸,导致csf1r发生了移码突变。本专利权人研究了nmd esc预测因子(见图2a)的无意义介导的mrna衰变(nmd)的潜在作用,结果表明带有该突变的mrna可能会逃脱nmd,因此,这种移码突变可能会产生异常的蛋白质产物(p.asp917serfster32)。
[0060]
受试者disco-css180319。该受试者是一名10岁的cvm确诊女孩患者,其影像学检查显示主曲线的cobb角为56
°
(t3-t7)。此外,在ct及脊柱三维重建的结果图中也观察到了t3-t7的结构紊乱(见图1b)。通过外显子组测序分析,在该受试者中鉴定出csf1r中的错义变体(nm_005211.3:c.2797g》t),可导致氨基酸的变化(p.gly933cys),甘氨酸被胱氨酸替代后,胱氨酸倾向于被氧化并在彼此之间形成二硫键,可能会影响csf1r同型二聚体的形成及其生物学功能。
[0061]
受试者disco-css170278。该受试者是一名16岁的胸部和腰椎侧弯的男孩患者,该受试者的脊柱平片结果显示t10半椎骨的存在(见图1b),通过外显子组测序分析,在该受试者中鉴定出csf1r中的错义变体(nm_005211.3:c.2906_2909dupatca),这种有害变体可导致阅读框移位,即csf1r的最后两个氨基酸被删除,并且几个额外的氨基酸被添加到该蛋白质的羧基端。
[0062]
此外,在研究队列中鉴定出的三种罕见的csf1r变体均位于ptk域下游的羧基末端区域内或附近(见图2b),而在csf1r的羧基末端区域包含多个参与蛋白质代谢的自磷酸化位点。
[0063]
表1 cvm患者中筛选出的有害和罕见的csf1r突变
实施例2利用sanger测序对致病基因突变进行验证对来自所有受试者个体的基因组dna进行sanger测序,以正确确认所有实施例1中鉴定出的变体。
[0064]
1、实验方法采用pcr从cvm患者获得的基因组dna中扩增变体编码扩增子;表2扩增体系表3扩增条件扩增体系见表2,扩增条件见表3;pcr扩增及sanger测序所采用的引物分别如下:(1)突变1(c.2749_2758delgacaggagag)正向引物:gccgagctgttgagtgaaat(seqidno.1)反向引物:tctagtgagcacctgacctg(seqidno.2)(2)突变2(c.2797g》t)正向引物:tggtactccctgtcgtcaac(seqidno.3)反向引物:aggtctctctaggggtgtgtg(seqidno.4)(3)突变3(c.2906_2909dupatca)正向引物:tggtactccctgtcgtcaac(seqidno.5)反向引物:aggtctctctaggggtgtgtg(seqidno.6)使用axygenap-gx-50试剂盒(批号:05915ke1)对扩增产物纯化。之后在abi3730xl仪器上进行sanger测序。
[0065]
2、实验结果实验结果见图1a,sanger测序结果证实了患者中csf1r的变体c.2749_2758delgacaggagag、c.2797g》t、c.2906_2909dupatca的存在,确认了上述突变为真性突变。
[0066]
实施例3 致病基因突变的体外功能验证为了进一步研究csf1r的变体的发病机理,本实施例使用pegfp-c1载体质粒将csf1r的变体c.2749_2758delgacaggagag、c.2797g》t、c.2906_2909dupatca分别转染到cos-7细胞中,通过dna测序验证所有的质粒,通过蛋白质印迹法分析转染细胞中csf1r的表达。
[0067]
1、质粒构建及定点突变所述构建的质粒包括野生型csf1r质粒和突变型csf1r质粒;(1) 分别设计引物扩增野生型csf1r、突变型csf1r的突变序列(c.2749_2758delgacaggagag、c.2797g》t、c.2906_2909dupatca),根据无缝克隆原理在目的基因前后加入与载体同源重组序列设计合成引物,引物分别如下:(2) pcr扩增pcr扩增的反应体系和反应条件见表4和表5;表4 反应体系
表5 反应条件(3) 琼脂糖切胶回收合成后的pcr片段;(4) ecori/bamhi双酶切载体pcs2+,所述酶切体系见表6;表6 酶切体系37℃酶切0.5h后回收酶切产物;(5) 重组反应并转化,重组反应体系见表7;表7 重组反应体系
a) 混匀后37℃重组反应30 min,反应结束后立即将重组反应液冰浴5 min;b) 转化:在重组好的产物中加入100 μl top10感受态细胞,混匀42℃热激60 s,冰水浴120 s,将转化好的混合物均匀的涂在含有氨苄霉素抗性的lb平板中37℃过夜培养。
[0068]
(6) 阳性克隆筛选与鉴定挑取单克隆进行pcr鉴定反应,鉴定引物如下:cmv-f:cgcaaatgggcggtaggcgtg (seq id no.15)csf1r-cx-1r:cactggtgtgaagaggaact (seq id no.16)2、细胞培养和质粒转染将cos-7细胞置于dulbecco改良的eagle培养基(dmem,invitrogen)中进行培养,并在6孔板中,添加胎牛血清(gibco)、青霉素(50 u/ml)和链霉素(50 μg/ml)。分别将野生型和突变型csf1r质粒(pegfp-c1质粒 1 μg)转染到上述细胞中,48小时后收集细胞。
[0069]
3、western blot验证细胞内相关蛋白的表达情况取部分48小时后收集到的细胞,提取总蛋白进行western blot验证细胞内csf1r蛋白的表达情况,使用以下抗体评估细胞裂解物中的蛋白质表达:小鼠抗gfp单克隆抗体(1:1000,zsjqb co.,ltd.)和小鼠抗gapdh单克隆抗体(1:1000, zsjqb co.,ltd.)。
[0070]
4、统计分析使用卡方检验评估不同实验组和对照组之间的统计学差异,所有统计过程均采用graphpad prism8,p≤0.05被认为具有统计学意义。其中,*、**、***和****分别表示p《0.05、p《0.01、p《0.001和《0.0001。
[0071]
5、实验结果实验结果见图3a和图3b,结果显示,与转染野生型csf1r质粒的细胞相比,转染突变型csf1r质粒的细胞中csf1r蛋白的表达水平显著增加(c.2797g》t,p=0.00259;c.2906_2909dupatca,p=0.00005;c.2749_2758delgacaggagag,p =0.00004),表明csf1r基因上的突变位点c.2749_2758delgacaggagag、c.2797g》t、c.2906_2909dupatca能提高csf1r蛋白的稳定性。
[0072]
实施例4 致病基因突变的体内功能验证为了进一步对致病基因突变进行验证,本实施例采用转基因斑马鱼进行了验证实验。
[0073]
1、斑马鱼的饲养与培育利用tg(ola.sp7:nlsgfp)转基因斑马鱼,在成骨细胞中,sp7启动子驱动gfp表达,用于动物模型的构建。斑马鱼饲养在28℃的环境中,每天喂盐水虾2次。从二细胞期至四细胞期的细胞阶段到受精后3天,胚胎在亚甲基蓝中进行孵化,以避免真菌感染。
[0074]
2、体外mrna转录将人野生型csf1r的dna序列克隆到pcs2+质粒中,构建人野生型csf1r质粒。然后,构建插入变异体(c.2749_2758delgacaggagag),以产生含有突变基因序列的人突变csf1r质粒。质粒线性化后,用mmessage mmachine
™ꢀ
sp6 ultra转录试剂盒(ambion)进行转录以获得相应的mrna。
[0075]
3、胚胎注射将野生型csf1r mrna和突变的csf1r mrna(每个50 pg)溶解于蒸馏水(每个2 nl)
中,并分别在单细胞期至二细胞期的细胞阶段注入胚胎中,同时将等量的水注入胚胎中,作为对照组。实验组和对照组保留所有个体进行表型评估。
[0076]
本发明过表达了突变的csf1r等位基因(nm_005211.3:c.2749_2758delgacaggagag),该突变体耗尽了ptk域下游的所有羧基末端区域,将该突变的mrna缺失的羧基末端区域称为csf1r
δc
mrna。
[0077]
4、荧光成像和表型评估通过荧光显微镜收集14 dpf(受精后14天)的斑马鱼幼鱼的荧光图像。观察并记录椎骨形态,进行表型评估和统计分析。
[0078]
5、统计分析使用卡方检验评估不同实验组和对照组之间的统计学差异,所有统计过程均采用graphpad prism8,p≤0.05被认为具有统计学意义。其中,*、**、***和****分别表示p《0.05、p《0.01、p《0.001和《0.0001。
[0079]
6、实验结果结果显示,通过荧光显微镜在21 dpf (受精后21天)下收集脊柱的荧光图像。csf1r mrna过表达组的斑马鱼表现出椎骨畸形,包括椎骨融合、半椎骨和融合的椎弓根(见图3c),覆盖了人类cvm的表型,这些与椎骨有关的表型表明,csf1r表达的剂量效应可能是椎骨畸形的原因。实验组(csf1r mrna:24%,7/29;csf1r
δc
mrna:52%,13/25)与对照组(0%)之间的斑马鱼显示cvm表型的百分比存在显著性的差异(卡方检验,csf1r mrna:p=0.00635;csf1r
δc
mrna:p=0.00002),与在胚胎期注射csf1r mrna的斑马鱼相比,注射csf1r
δc
mrna的斑马鱼具有明显更高的椎骨畸形表型百分比(卡方检验p=0.03452)(见图3d),表明人csf1r
δc
mrna的注射导致斑马鱼椎体畸形的比例高于野生型mrna,进一步证明csf1r的羧基末端区域的变异体的致病性。
[0080]
通过上述体外和体内的功能验证实验,本研究认定csf1r基因上的突变位点c.2749_2758delgacaggagag、c.2797g》t、c.2906_2909dupatca通过干扰泛素蛋白连接酶c-cbl的结合来抑制csf1r的降解,从而增加csf1r蛋白的表达水平,增强csf1r的生物学功能,进一步影响骨骼代谢和椎骨发育,导致cvm的发生。
[0081]
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
