1.本发明属于肿瘤医学领域,具体涉及一种结直肠癌细胞外泌体及其分离提取方法与应用。
背景技术:
2.结直肠癌(colorectal cancer,crc)是最常见的消化道恶性肿瘤之一,具有高发病率、高死亡率的特点,发病率和死亡率逐年上升。资料显示结直肠癌治疗失败的主要原因是术后的局部复发和远处转移。其中,大约23%的患者在就诊时已患有转移性疾病,大约40%的患者在治疗过程中发生转移,而结直肠癌的转移是导致超过一半的患者死亡的原因,且转移性结直肠癌患者的5年总生存率低于10%。也有15%的患者在肝转移被早期诊断并及早治疗后获益,其5年生存率可以提高至40%~74%,因此,检测结直肠癌早期转移对于提高患者的生存率至关重要。近年来对结直肠癌患者出现转移进行早期判断和预测已经成为临床研究的热点之一。
3.近年来细胞外囊泡(extracellular vesicles,evs)逐渐成为国内外研究热点,它是由细胞分泌的或由细胞膜脱落的囊泡状小体,具有双层膜结构,直径在30-1000nm不等,细胞外囊泡主要包含微囊泡(microvesicles,mvs)和外泌体(exosomes)两大部分,近年来发现二者尤其是外泌体具有多种类型的生物学功能,其在疾病诊断和临床应用中有着重要的意义。而传统的外泌体制备技术,仍难以实现外泌体的大量制备。因此,其临床应用推广尚有赖于通过改进其制备技术,提升其制备量,而满足疾病诊断和临床应用所需。
技术实现要素:
4.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种分离提取结直肠癌细胞外泌体的方法,能够快速得到高纯度的外泌体。
5.本发明还提出一种上述分离提取结直肠癌细胞外泌体的方法提取得到的外泌体。
6.本发明还提出一种具有上述外泌体的应用。
7.根据本发明的一个方面,提出了一种分离提取结直肠癌细胞外泌体的方法,所述方法包括以下步骤:
8.s1、将结直肠癌细胞,采用含血清培养基培养后转移至不含血清的培养基中,培养后,收集培养基上清液;
9.s2、将s1中获取的培养基上清液2-6℃,1500-4000g离心8-20min,收集液相a;
10.s3、将步骤s2中得到的液相a,2-6℃,4500-6000g离心20-35min,收集液相b;
11.s4、将s3中得到的液相b,2-6℃,10000-12000g离心30-45min,收集液相c;
12.s5、将s4中得到的液相c,2-6℃,100000-120000g离心60-120min,收集固相a;
13.s6、将s5中得到的固相a复溶,2-6℃,100000-120000g离心60-80min,收集固相b;
14.s7、将s6中取得的固相b复溶,透析;
15.s8、用s7中得到的透析后的溶液,进行过滤得到滤液;
16.s9、将s8得到的滤液2-6℃,100000-120000g离心,收集固相c,即为外泌体。
17.在本发明方案的一些实施方式中,所述结直肠癌细胞选自hct116、lim1215和sw620中的一种。
18.在本发明方案的一些实施方式中,所述结直肠癌细胞用含血清培养基培养至细胞汇合度为80%时转移至不含血清的培养基中。
19.在本发明方案的一些实施方式中,所述细胞在不含血清的培养基中的培养时间为12-48h。
20.在本发明的一些实施方式中,所述复溶采用预冷的pbs溶液进行。
21.在本发明的一些实施方式中,所述透析采用mw:8000-14000的透析袋,2-6℃透析4h-6h。
22.在本发明的一些实施方式中,所述过滤采用0.22μm或0.45μm微孔滤膜。
23.在本发明的一些实施方式中,所述步骤s9中离心的时间为60-90min。
24.在本发明的一些实施方式中,所述步骤s9中还包括将固相c采用预冷的pbs溶液进行复溶的步骤。
25.根据本发明第二方面的实施方式,提出了一种采用上述方法制备得到的结直肠癌细胞外泌体。
26.根据本发明第三方面的实施方式,提出了一种上述外泌体在制备结直肠癌细胞检测标志物中的应用。
27.一种直肠癌细胞检测标志物,包括上述结直肠癌细胞外泌体。
28.一种结直肠癌细胞检测试剂盒,所述试剂盒中包括上述结直肠癌细胞外泌体的标准品。
29.根据本发明方案的实施方式,具有如下有益效果:本发明方案分离提取直肠癌细胞外泌体的方法简单,将细胞培养后的培养基采用逐步提升提离心速度和时间去除杂质,分离出培养上清液,并收集,再分步调控超速离心的离心速度和时间,分离得到的外泌体,将得到的外泌体进一步透析,过滤得到纯化后的外泌体,本发明方法简单、高效,用时短,通过各个步骤的协同,提取得到的外泌体的制备量更多,纯度高,稳定性好,本发明方法可以用于工业化生产结直肠癌外泌体。
附图说明
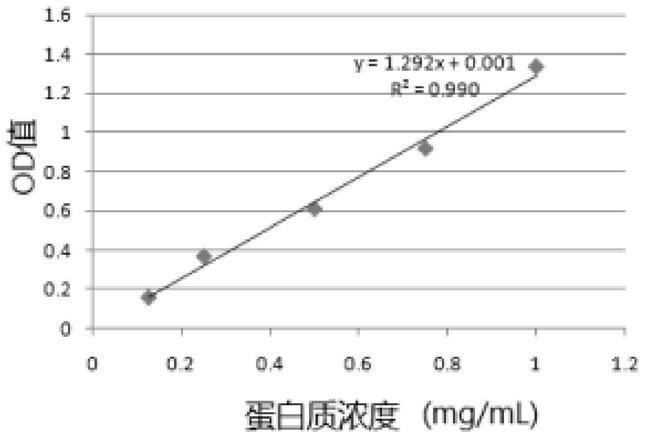
30.图1为本发明方案测试例中的蛋白质标准曲线图。
具体实施方式
31.以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
32.本发明方案采用的结直肠癌细胞sw620购自上海奥陆生物科技有限公司。
33.实施例1
34.本实施例提供了一种结直肠癌细胞外泌体提取分离方法,所述方法具体步骤如
下:
35.(1)将结直肠癌细胞sw620,采用含血清的基础培养基培养至细胞汇合度为80%时转移至不含血清的基础培养基中,培养32h,收集培养基上清液;
36.(2)将(1)中获取的培养基上清液4℃,2500g离心20min,收集液相a,去沉淀;
37.(3)将步骤(2)中得到的液相a,4℃,5000g离心25min,收集液相b,去沉淀;
38.(4)将(3)中得到的液相b,4℃,11000g离心40min,收集液相c,去沉淀;
39.(5)将(4)中得到的液相c,4℃,110000g离心90min,收集固相a;
40.(6)将(5)中得到的固相a加入10倍质量体积比的预冷的pbs溶液制备成悬液,4℃,100000g离心70min,收集固相b;
41.(7)将(6)中取得的固相b加入10倍质量体积比的预冷的pbs溶液制备成悬液,采用mw:8000-14000的透析袋,4℃透析5h;
42.(8)用(7)中得到的透析后的溶液,进行采用0.22μm微孔滤膜过滤得到滤液;
43.(9)将(8)得到的滤液4℃,110000g离心70min,收集固相c,采用预冷的pbs溶液制备成悬液即为外泌体。
44.实施例2
45.本实施例提供了一种结直肠癌细胞外泌体提取分离方法,所述方法具体步骤如下:
46.(1)将结直肠癌细胞sw620,采用含血清培养基培养至细胞汇合度为80%时转移至不含血清的培养基中,培养32h,收集培养基上清液;
47.(2)将(1)中获取的培养基上清液4℃,2500g离心10min,收集液相a,去沉淀;
48.(3)将步骤(2)中得到的液相a,4℃,6000g离心25min,收集液相b,去沉淀;
49.(4)将(3)中得到的液相b,4℃,12000g离心45min,收集液相c,去沉淀;
50.(5)将(4)中得到的液相c,4℃,110000g离心90min,收集固相a;
51.(6)将(5)中得到的固相a加入10倍质量体积比的预冷的pbs溶液制备成悬液,4℃,100000g离心70min,收集固相b;
52.(7)将(6)中取得的固相b加入10倍质量体积比的预冷的pbs溶液制备成悬液,采用mw:8000-14000的透析袋,4℃透析5h;
53.(8)用(7)中得到的透析后的溶液,进行采用0.22μm微孔滤膜过滤得到滤液;
54.(9)将(8)得到的滤液4℃,110000g离心70min,收集固相c,采用预冷的pbs溶液制备成悬液即为外泌体。
55.实施例3
56.本实施例提供了一种结直肠癌细胞外泌体提取分离方法,所述方法具体步骤如下:
57.(1)将结直肠癌细胞sw620,采用含血清培养基培养至细胞汇合度为80%时转移至不含血清的培养基中,培养32h,收集培养基上清液;
58.(2)将(1)中获取的培养基上清液4℃,1500g离心20min,收集液相a,去沉淀;
59.(3)将步骤(2)中得到的液相a,4℃,4500g离心25min,收集液相b,去沉淀;
60.(4)将(3)中得到的液相b,4℃,10000g离心40min,收集液相c,去沉淀;
61.(5)将(4)中得到的液相c,4℃,110000g离心90min,收集固相a;
62.(6)将(5)中得到的固相a加入10倍质量体积比的预冷的pbs溶液制备成悬液,4℃,100000g离心70min,收集固相b;
63.(7)将(6)中取得的固相b加入10倍质量体积比的预冷的pbs溶液制备成悬液,采用mw:8000-14000的透析袋,4℃透析5h;
64.(8)用(7)中得到的透析后的溶液,进行采用0.22μm微孔滤膜过滤得到滤液;
65.(9)将(8)得到的滤液4℃,110000g离心70min,收集固相c,采用预冷的pbs溶液制备成悬液即为外泌体。
66.实施例4
67.本实施例提供了一种结直肠癌细胞外泌体提取分离方法,所述方法具体步骤如下:
68.(1)将结直肠癌细胞sw620,采用含血清培养基培养至细胞汇合度为80%时转移至不含血清的培养基中,培养32h,收集培养基上清液;
69.(2)将(1)中获取的培养基上清液4℃,2500g离心20min,收集液相a,去沉淀;
70.(3)将步骤(2)中得到的液相a,4℃,5000g离心25min,收集液相b,去沉淀;
71.(4)将(3)中得到的液相b,4℃,11000g离心40min,收集液相c,去沉淀;
72.(5)将(4)中得到的液相c,4℃,120000g离心100min,收集固相a;
73.(6)将(5)中得到的固相a加入10倍质量体积比的预冷的pbs溶液制备成悬液,4℃,120000g离心70min,收集固相b;
74.(7)将(6)中取得的固相b采用加入10倍质量体积比的预冷的pbs溶液制备成悬液,采用mw:8000-14000的透析袋,4℃透析5h;
75.(8)用(7)中得到的透析后的溶液,进行采用0.22μm微孔滤膜过滤得到滤液;
76.(9)将(8)得到的滤液4℃,110000g离心70min,收集固相c,采用预冷的pbs溶液制备成悬液即为外泌体。
77.实施例5
78.本实施例提供了一种结直肠癌细胞外泌体提取分离方法,所述方法具体步骤如下:
79.(1)将结直肠癌细胞sw620,采用含血清培养基培养至细胞汇合度为80%时转移至不含血清的培养基中,培养32h,收集培养基上清液;
80.(2)将(1)中获取的培养基上清液4℃,2500g离心20min,收集液相a,去沉淀;
81.(3)将步骤(2)中得到的液相a,4℃,5000g离心25min,收集液相b,去沉淀;
82.(4)将(3)中得到的液相b,4℃,11000g离心40min,收集液相c,去沉淀;
83.(5)将(4)中得到的液相c,4℃,100000g离心100min,收集固相a;
84.(6)将(5)中得到的固相a加入10倍质量体积比的预冷的pbs溶液制备成悬液,4℃,100000g离心70min,收集固相b;
85.(7)将(6)中取得的固相b加入10倍质量体积比的预冷的pbs溶液制备成悬液,采用mw:8000-14000的透析袋,4℃透析5h;
86.(8)用(7)中得到的透析后的溶液,进行采用0.22μm微孔滤膜过滤得到滤液;
87.(9)将(8)得到的滤液4℃,110000g离心70min,收集固相c,采用预冷的pbs溶液制备成悬液即为外泌体。
88.对比例1
89.本对比例与实施例1的步骤(1)相同,区别在于,采用市售外泌体提取试剂盒对结直肠癌细胞培养基上清液进行外泌体提取。
90.对比例2
91.本对比例采用密度梯度离心法对结直肠癌细胞进行外泌体提取。具体包括如下步骤:
92.(1)将结直肠癌细胞sw620,采用含血清培养基培养至细胞汇合度为80%时转移至不含血清的培养基中,培养32h,收集培养基上清液;
93.(2)将(1)中获取的培养基上清液4℃,2500g离心20min,收集液相a,去沉淀;
94.(3)将步骤(2)中得到的液相a,4℃,5000g离心25min,收集液相b,去沉淀;
95.(4)将(3)中得到的液相b,4℃,11000g离心40min,收集液相c,去沉淀;
96.(5)将(4)中得到的液相c,4℃,110000g离心90min,收集固相;
97.(6)将(5)中得到的固相加入10倍质量体积比的预冷的pbs溶液制备成悬液,将悬液以1:400的体积比加入hepes缓冲液(购自赛默飞世尔科技(中国)有限公司)中,并通过体积比1:1与80%蔗糖混合,得到最终浓度为40%的蔗糖,将混合物置于4ml超速离心管的底部,小心的将30%蔗糖在hepes缓冲液中分层,然后在顶部加入下一层5%的蔗糖;
98.(7)将步骤(6)得到的超速离心管100000g离心18h,收集12个等的级层,级层2至7含有纯化的外泌体。
99.测试例
100.1、外泌体形态的观察
101.外泌体形态观察采用透射电镜,本技术方案实施例1-5和对比例1-2制备得到的结直肠癌细胞的外泌体外形均呈圆形或椭圆形。
102.2、外泌体浓度测定
103.(1)、标准曲线的测定
104.用采用bsa试剂盒测定外泌体浓度,以bsa作为标准品,制备蛋白质标准曲线,bsa标准浓度如表1所示。
105.表1
106.管号稀释液体积bsa体积(来源)bsa终浓度(μg/ml)a0μl300μl(母液)2000b125μl375μl(母液)1500c325μl325μl(母液)1000d175μl175μl(b管)750e325μl325μl(c管)500f325μl325μl(e管)250g325μl325μl(f管)125h400μl100μl(g管)25i400μl00
107.分别取25μl表格中配制好的bsa标准液以及待测样品,加入到96孔板中。每孔中快速加入200μl bca工作液,充分混匀。加盖,37℃孵育30min后冷却至室温或室温放置2h,用
酶标仪于562nm处检测其吸光度测得的标准曲线如图1所示。
108.(2)样品浓度测定
109.方法:取25μl含外泌体的液体(实施例1-5和对比例1-2的结直肠癌外泌体),加入200μl bca工作液,充分混匀。加盖,37℃孵育30min后冷却至室温,测定吸光值,吸光值测定3次,取平均值,根据蛋白质标准曲线计算外泌体的浓度。
110.将实施例1-5和对比例1-2的结直肠癌外泌体的分离提取实验重复3次,分别检测制备得到的外泌体浓度,3次重复实验结果如表2所示。
111.表2
112.组别吸光度吸光度吸光度蛋白质浓度(mg/ml)实施例10.6760.6870.6830.527实施例20.6480.6520.6670.506实施例30.6450.6310.6240.489实施例40.6860.6710.6640.52实施例50.6430.6120.6540.492对比例10.6280.5910.6340.477对比例20.5940.5780.6130.459
113.从表2中可以看出,本发明方案制备得到的外泌体浓度更高,即纯度更高;三次测定过程中吸光度差异更小,由此表明本发明方案制得的外泌体稳定性好。
114.上面结合附图对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
