一种可离子化脂质分子、其制备方法及其在制备脂质纳米颗粒中的应用
1.引用的优先权
2.本技术要求cn202110159969.3的优先权,该优先权文件的全文通过引用并入本文。
技术领域
3.本发明涉及生物技术领域,特别是一种可离子化脂质分子、其制备方法及其在制备脂质纳米颗粒的应用。
背景技术:
4.治疗性核酸包括小型干扰rna(sirna)、微rna(mirna)、信使rna(mrna)。此类核酸通过多种机制起作用。在sirna或mirna的情况下,可通过rna干扰(rnai)的方法下调特定蛋白质的细胞内水平。将sirna或mirna引入细胞质后,sirna或mirna可结合risc蛋白质,其有义链被risc复合体移走,因而在risc内提供了可识别并结合具有针对结合的sirna或mirna序列的互补序列的mrna的模板。在结合互补mrna后,risc复合体切割mrna并且释放切割的链。rnai可通过相应的编码蛋白质合成的mrna的靶向特异性破坏来提供特定蛋白质的下调。
5.rnai技术的治疗性应用极其广泛,因为可用针对靶蛋白的任意核苷酸序列来构建相对应的sirna或mirna。目前,sirna或mirna构建体已在体外和体内模型中显示出特异性下调靶蛋白的能力。然而,sirna或mirna用作全身性治疗剂将面临两个问题。其一,它们对血浆中的核酸酶非常敏感;其二,当全身性施用sirna或mirna时,其进入可在其中结合risc的细胞内区室的能力有限。为稳定此类双链分子,可在分子内掺入经化学修饰的核苷酸连接体,例如硫代磷酸酯基团。然而,这种化学修饰只能提供有限的保护作用,并且可能降低分子的活性。其他方法包括使用载体递送系统诸如聚合物、可离子化脂质分子,或对此类双链分子进行化学修饰(例如通过共价连接可离子化脂质分子),来促进sirna或mirna的细胞内递送。
6.mrna通过转移存储在dna中的指令来控制活细胞所需的蛋白质合成。mrna治疗是利用化学修饰后的mrna分子进入细胞质中,利用细胞质内的自有核苷酸进行转录表达,生成机体所需要的蛋白质。mrna疫苗是将mrna在体外进行相关的修饰后传递至机体细胞内表达并产生蛋白抗原,从而诱导机体产生针对该抗原的免疫应答,进而扩大机体的免疫能力。理论上,mrna能够表达任何蛋白质,因此可来治疗各种疾病和生产各类疫苗。
7.mrna可分为非复制性mrna(nonreplicating mrna)和自扩增mrna(self-amplifying mrna)两类:非复制性mrna仅编码目标蛋白并包含5’和3’非翻译区(utr);自扩增mrna不仅编码目标蛋白,而且还编码能够使细胞内rna扩增和蛋白表达的复制机制。与非复制性mrna相比,自扩增mrna可以持续大量表达目标蛋白,即在同样地治疗或免疫效果的前提下,施用更少的剂量。
8.基于mrna的治疗的挑战之一是半衰期短,可被大量细胞外rna酶迅速降解。此外是其免疫原性,即外源性rna通常被机体视为病毒感染的信号。可通过对mrna结构进行各种化学修饰,例如修改5'-帽,多聚腺苷酸(a)尾部,5'-和3'-utr以及编码区域,替换天然腺苷为n1-甲基腺苷(m1a)或n6-甲基腺苷(m6a),来稳定mrna空间结构并且降低免疫原性以实现蛋白的高表达水平。另外,由于mrna的大小明显大于sirna或mirna构建体,大多数细胞对mrna的摄入效率低。迄今为止,研究人员已使用基于各种脂质材料的载体递送系统,例如各种囊泡,脂质体,脂质纳米颗粒(lnp),脂质乳剂,脂质植入物等,递送化学修饰或未修饰的mrna进入细胞内部。
9.核酸(nucleic acids,rna)在调节体内蛋白表达方面具有巨大的治疗潜力,但裸rna被细胞内化的效率极低,并且其在体内递送过程中容易被肾脏快速清除,或者被体内rna酶快速降解,其实际疗效大打折扣。为了更安全有效地发挥rna的治疗能力,科学家使用脂质纳米颗粒(lnp)来封装和传递rna到机体特定部位。这种rna递送策略在递送双链小干扰rna(sirnas,21到23个核苷酸长度)方面展现出了巨大的应用价值。比如类脂质c12-200已被广泛用于制作sirna-lnp制剂,用于体内各种治疗应用,以抑制蛋白表达。人工合成的可电离脂质材料(synthetic ionizable lipids)和类脂质材料(lipid-like materials)出现后,不仅大大降低了lnp的体内毒性,还使得体内递送大分子量rna(比如mrna)成为可能。这些含胺的可电离脂质或类脂质分子带正电荷,通过静电吸引的方式,可以高效的与带负电荷的mrna结合并自组装形成lnp。lnp能够提高rna的血液循环时间,并提高细胞的摄取率;在细胞内rna通过内体逃逸途径,释放到细胞质中,得以表达出特定的蛋白,起到一定的治疗作用。
10.lnp的原料成分主要有以下4种:1)可电离脂质或类脂质分子(如dlin-kc2-dma、dlin-mc3-dma、l319)。这是实现体内递送mrna的核心成分。2)磷脂分子,是一种磷脂,它为lnp双分子层提供结构,也可能有助于核内体逃逸;3)胆固醇,增强lnp稳定性,促进膜融合;4)聚乙二醇例如dmg-peg2000,它可以控制并减少lnp的粒径,并“保护”lnp不受免疫细胞非特异性内吞作用的影响。
11.在体内,lnp的原料和组分变化会对mrna-lnp制剂的物理化学稳定性和mrna作用效力产生深远影响。现有的lnp组分方案无法充分的发挥mrna-lnp制剂的效力,需要持续对可离子化脂质分子的结构调整并针对特定rna进行设计优化,本发明解决这样的问题。
技术实现要素:
12.为解决现有技术的不足,本发明的目的在于提供一种可离子化脂质分子、其制备方法、包含其的组合物、其在制备用作将核酸递送至细胞的载体中的应用及其在制备脂质纳米颗粒lnp的应用,通过改进可离子化脂质分子的结构并对lnp组分方案的调整,提高mrna-lnp制剂的作用效力。
13.为了实现上述目标,本发明采用如下的技术方案:
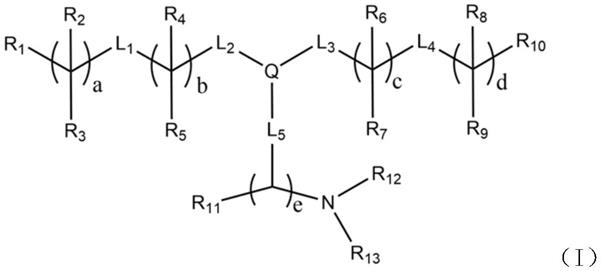
14.本发明提供了一种可离子化脂质分子、其药学上可接受的盐及其立体异构体,所述可离子化脂质分子具有式(i)的结构:
[0015][0016]
其中,
[0017]
q选自苯环、环戊基、环己基、吡咯环或嘧啶环;
[0018]
l1和l4各自独立地选自
–
o(c=o)-、-(c=o)o-或碳-碳双键;
[0019]
l2和l3各自独立地选自-(ch2)
x
o-或-o(ch2)
x-,其中x为0至4之间的整数;
[0020]
l5选自-(ch2)y–
o(c=o)-、-(ch2)
y-(c=o)o-或-(ch2)
y-o-,其中y为0至4之间的整数;
[0021]
l2、l3、l5各自独立地分别与q中的任意3个位点连接,所述位点为碳或者氮;
[0022]
a和d各自独立地为0至18的整数;
[0023]
b和c各自独立地为1至18的整数;
[0024]
e为1至5的整数;
[0025]
r1和r
10
各自独立地选自甲基或环烃基;
[0026]
r2和r3各自独立地选自h或c
1-c
12
烃基;或者r2选自h或c
1-c
12
烃基,并且两个相邻r3所连接的两个碳原子形成碳-碳双键;
[0027]
r4和r5各自独立地选自h或c
1-c
12
烃基;或者r4选自h或c
1-c
12
烃基,并且两个相邻r5所连接的两个碳原子形成碳-碳双键;
[0028]
r6和r7各自独立地选自h或c
1-c
12
烃基;或者r6选自h或c
1-c
12
烃基,并且两个相邻r7所连接的两个碳原子形成碳-碳双键;
[0029]
r8和r9各自独立地选自h或c
1-c
12
烃基;或者r8选自h或c
1-c
12
烃基,并且两个相邻r9所连接的两个碳原子形成碳-碳双键;
[0030]r11
独立地选自h或c
1-c6烃基;
[0031]r12
和r
13
各自独立地为c
1-c6烃基。
[0032]
优选地,其中,q选自苯环、环戊基或者环己基;更优选地,q为苯环。
[0033]
优选地,其中,l2、l3、l5与q的连接方式为1,2,5-三取代,1,3,5-三取代,1,2,4-三取代或1,4,5-三取代或1,3,6-三取代。
[0034]
优选地,其中,y为0,1或2。
[0035]
优选地,其中,a和d各自独立地为6至10的整数。
[0036]
优选地,其中,b和c各自独立地为1至10的整数。
[0037]
优选地,其中,e选自2或3。
[0038]
优选地,其中,r1和r
10
中的环烃基选自环丙基、环丁基、环戊基、环己基或环庚基;
[0039]r2-r9定义中的c
1-c
12
烃基选自c
1-c
12
烷基、c
1-c
12
烯基或c
1-c
12
炔基;更优选地,c
1-c
12
烃基为c
1-c6烷基;
[0040]r11
选自h、甲基、乙基、丙基、丁基、戊基或己基,更优选甲基;
[0041]r12
和r
13
各自独立地选自甲基、乙基、丙基、丁基、戊基或己基,更优选甲基。作为例举,表1给出了本技术中的代表性化合物一至二十五。
[0042]
表1:本技术的代表性化合物
[0043]
[0044]
[0045]
[0046]
[0047]
[0048][0049]
优选地,所述的可离子化脂质分子为化合物一:
[0050][0051]
优选地,所述的可离子化脂质分子为化合物二:
[0052][0053]
优选地,所述的可离子化脂质分子为化合物三:
[0054][0055]
本技术提供了一种所述可离子化脂质分子的制备方法,以化合物一为例,所述方
法包括如下步骤:
[0056]
步骤一,在以二氯甲烷(dcm)为溶剂混合有的混合液中添加4-二甲氨基吡啶(dmap)和三乙胺(tea);再在溶液中添加1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edci),搅拌反应;待检测显示反应完成后,经过萃取、清洗、干燥、浓缩、纯化后得到呈黄色油状的
[0057]
步骤二,在以n,n-二甲基甲酰胺(dmf)为溶剂混合有的溶液中添加cs2co3,搅拌反应待检测显示反应完成后,经过萃取、清洗、干燥、浓缩、纯化后得到白色固体形式的
[0058]
步骤三,在四氢呋喃(thf)、乙醇和的混合液中添加0℃以下的nabh4,搅拌反应待检测显示反应完成后,经过萃取、清洗、干燥、浓缩后得到白色固体形式的
[0059]
步骤四,将和1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edci)在吡啶溶液中搅拌反应,待检测显示反应完成后,经过萃取、清洗、干燥、浓缩、纯化后得到无色油状可离子化脂质分子
[0060]
前述的一种可离子化脂质分子的制备方法,检测显示反应完成的方法为tlc硅胶板薄层色谱。
[0061]
本发明提供了一种组合物,其包含所述可离子化脂质分子、其药学上可接受的盐及其立体异构体,以及治疗剂。
[0062]
优选地,其中,所述治疗剂包括核酸。
[0063]
优选地,其中,所述核酸选自小型干扰rna(sirna)、微rna(mirna)、信使rna(mrna)。
[0064]
优选地,其中,mrna为非自复制mrna或自复制mrna。
[0065]
优选地,其中,所述组合物包含一种或多种选自中性脂质、甾族化合物和聚合物缀合的脂质的赋形剂;
[0066]
优选地,所述中性脂质选自1,2-二硬酯酸-sn-甘油磷脂酰胆碱(dspc)、二棕榈酰磷脂酰胆碱(dppc)、二肉豆蔻酰磷脂酰胆碱(dmpc)、二油酰磷脂酰胆碱(dopc)、棕榈酰油酰磷脂酰胆碱(popc)、1,2-二油酰-sn-甘油-3-磷酸乙醇胺(dope)中的一种或多种;更优选dspc、dope;
[0067]
所述甾族化合物选自胆固醇、谷甾醇、岩皂甾醇、菜油甾醇、豆甾醇;更优选胆固醇;
[0068]
所述聚合物缀合的脂质为聚乙二醇,所述聚乙二醇优选为聚乙二醇化的dmg,更优选为二肉豆蔻酰甘油-聚乙二醇2000(dmg-peg2000)。其中dmg表示1,2-二肉豆蔻甘油酯。
[0069]
优选地,其中可离子化脂质分子与中性脂质的摩尔比为2:1至8:1,可离子化脂质分子与胆固醇的摩尔比为2:1至1:1;可离子化脂质分子与聚乙二醇化的dmg的摩尔比为100:1至25:1。
[0070]
本发明还提供了一种所述的可离子化脂质分子、其药学上可接受的盐及其立体异构体用作制备将核酸递送至细胞的载体中的应用。
[0071]
优选地,所述核酸选自小型干扰rna(sirna)、微rna(mirna)、信使rna(mrna)。
[0072]
更优选地,其中mrna为非自复制mrna或自复制mrna。
[0073]
本发明提供了一种所述可离子化脂质分子、其药学上可接受的盐及其立体异构体在制备脂质纳米颗粒的应用,包括:将可离子化脂质分子与磷脂、胆固醇、聚乙二醇通过合成获得脂质体纳米颗粒lnp,所述lnp能提高负载物-mrna在细胞内的翻译表达水平。
[0074]
优选地,其中,所述聚乙二醇优选为聚乙二醇化的dmg,更优选为dmg-peg2000。
[0075]
优选地,其中,所述可离子化脂质分子选自化合物一至化合物三:
[0076]
化合物一:
[0077]
化合物二:
[0078]
化合物三:
[0079]
优选地,其中,所述磷脂为dspc或者dope。
[0080]
优选地,其中,合成载体lnp的配方按照的摩尔百分比为:可离子化脂质分子(例如化合物一至三中的任一个):胆固醇:磷脂:聚乙二醇=20-70%:20-60%:2-20%:0.1-5%。
[0081]
更优选地,其中,当使用化合物一时,合成载体lnp的配方按照的摩尔百分比为:可离子化脂质分子:胆固醇:dspc:dmg-peg2000=31.5%:56%:10%:2.5%。当使用化合物二或化合物三时,合成载体lnp的配方按照的摩尔百分比为:可离子化脂质分子:胆固醇:dspc:dmg-peg2000=38.5%:50%:10%:1.5%。
[0082]
优选地,其中,可离子化脂质分子与磷脂、胆固醇、聚乙二醇通过微流控合成方法获得lnp。
[0083]
优选地,所述微流控合成方法包括如下步骤:
[0084]
准备可离子化脂质分子与磷脂、胆固醇、聚乙二醇的混合液;
[0085]
准备mrna稀释液;
[0086]
用微流控合成仪器,以及用原厂提供的微流控芯片制备lnp:一侧注射器装入mrna稀释液,另一侧注射器装入混合液,设置参数后,重复几次,用完所有的混合液,收集所有的产物lnp溶液,并在30分钟内加入柠檬酸缓冲液稀释至溶液中乙醇比例小于0.5%。
[0087]
优选地,所述微流控合成方法还包括:通过切向流过滤纯化制备得到lnp。
[0088]
本发明提供了一种包含增强绿色荧光蛋白mrna(egfp_mnra)的脂质纳米颗粒组合物的制备,其是将可离子化脂质、胆固醇、dspc和dmg-peg2000以38.5:50:10:1.5的摩尔比溶解于乙醇。以10:1至30:1(优选的,10:1)的总脂质与mrna的重量比制备脂质纳米颗粒(lnp)。简略地,将mrna在10至50mm(优选的,50mm)柠檬酸盐缓冲液(ph 6)中稀释至0.2mg/ml。使用注射器泵,将脂质的乙醇溶液与mrna水溶液以约1:5至1:2(体积/体积)(优选的,1:4)的比例混合,总流速为15ml/min以上。然后去除乙醇,并通过透析用pbs替代外部的缓冲液。最后,将脂质纳米颗粒通过0.22μm孔无菌过滤器过滤。通过准弹性光散射确定的脂质纳米颗粒的粒径为直径80-100nm。
[0089]
本发明基于新型可离子化脂质分子的发现,该新型可离子化脂质分子当在用于将活性剂或治疗剂(例如核酸)体内递送至哺乳动物细胞中的脂质纳米颗粒中使用时提供优点。特别地,本发明的实施方案提供了包含一种或多种本文描述的新型可离子化脂质分子的核酸-脂质纳米颗粒组合物,其提供增强的核酸活性和增强的组合物体内耐受性,使得相比先前描述的核酸-脂质纳米颗粒组合物在治疗效果指数上的显著提高。
[0090]
上述式(i)可以单独使用,也可结合其他脂质组分,如中性脂质、带电脂质、甾族化合物(包括例如,所有甾醇类)和/或它们的类似物和/或聚合物缀合的脂质,以便形成用于递送治疗剂的脂质纳米颗粒。在一些实例中,所述脂质纳米颗粒用于递送核酸,如sirna,mirna和/或mrna。还提供了这类脂质纳米颗粒用于治疗各种疾病或病况(如实体瘤和/或蛋白质缺乏引起的疾病或病况)的方法。还提供了对有此需要的患者施用治疗剂的方法,该方法包括制备包含式(i)的化合物的脂质纳米颗粒与治疗剂的组合物,和将该组合物递送至患者。
[0091]
在特定的实施方案中,本发明提供了新型可离子化脂质,其能够形成改善的用于体外和体内递送mrna和/或其他寡核苷酸的组合物。在一些实施方案中,这些改善的脂质纳米颗粒组合物对于由mrna编码的蛋白质的表达是有用的。在一些其他实施方案中,所述脂质纳米颗粒对用于转基因表达的mrna和质粒的递送也是有用的。在其他实施方案中,所述
脂质纳米颗粒组合物对于引发由蛋白质表达产生的药理学作用是有用的,所述药理学作用例如,通过递送适合的红细胞生成素mrna产生增加的红细胞,或者通过递送用于编码适合抗体的mrna来防止感染。
[0092]
本发明的药物组合物可以配制成固体、半固体或液体形式的制剂,例如软膏、溶液、悬浮液、注射剂、吸入剂、胶、微球和气溶胶。施用这类药物组合物的典型途径包括但不限于口服、局部、经皮、吸入和鼻内途径,包括皮下注射,静脉内、肌内、皮内或输注技术。
[0093]
本发明的液体药物组合物,不论其为溶液、悬浮液还是其他类似的形式,可以包括以下佐剂中的一种或多种:无菌稀释剂,例如注射用的水、盐水溶液、优选生理盐水、林格氏溶液、等渗氯化钠;不挥发性油类,例如可用作溶剂或悬浮介质的合成的单甘酯或双甘酯,聚乙二醇、甘油、丙二醇或其他溶剂;抗氧化剂,例如抗坏血酸或亚硫酸氢钠;螯合剂,例如乙二胺四乙酸;缓冲剂,例如乙酸盐、三羟甲基氨基甲烷、柠檬酸盐或磷酸盐;以及用于调节张力的制剂,例如氯化钠或葡萄糖;用作冷冻保护剂的试剂,例如蔗糖或海藻糖。制剂可以封装在玻璃或塑料制作的安瓿、一次性注射器或多剂量瓶中。生理盐水是优选的佐剂。可注射的药物组合物优选为无菌的。
[0094]
本发明的药物组合物用于局部施用的情况下,载体可以适当地包含溶液基质、乳液基质、软膏基质或凝胶基质。例如,所述基质可以包含以下的一种或多种:矿脂、羊毛脂、聚乙二醇、蜂蜡、矿物油、诸如水和醇的稀释剂、以及乳化剂和稳定剂。增稠剂可以存在于用于局部施用的药物组合物中。如果用于经皮施用,组合物可以包括经皮贴片或离子电渗装置。
[0095]
本发明的组合物可以在施用一种或多种其他治疗剂的同时、之前或之后施用。这类组合治疗包括施用本发明组合物和一种或多种另外的活性剂的单一药物剂量制剂,以及施用本发明组合物和各个在其自身单独药物剂量制剂中的活性剂。例如,本发明组合物和其他活性剂可以以单一注射剂量组合物(例如注射液)一起向患者施用,或者各个试剂以不同的注射剂量制剂施用。当使用不同的剂量制剂时,本发明化合物和一种或多种另外的活性剂可以在基本同一时间施用,或者在相互交错的时间施用。
[0096]
本发明的有益之处在于:
[0097]
本发明通过改进可离子化脂质分子的结构得到一类新型的可离子化脂质分子,所述可离子化脂质分子能够有效地将核酸提送至细胞的细胞质中。
[0098]
本发明通过将可离子化脂质分子与磷脂、胆固醇、聚乙二醇合成得到的lnp,获得的lnp具有更加优异的mrna载体性能,可以明显提高其负载物-mrna在细胞内的翻译表达水平。
附图说明
[0099]
图1是本发明的制备方法的一种实施例的合成流程图;
[0100]
图2是本发明制备得到的xh-04lnp的冷冻电镜图片;
[0101]
图3是本发明mc3-lnp(a)和xh-04-lnp(b)在bhk细胞中spike protein表达水平的流式结果;
[0102]
图4是通过不同可离子化脂质分子制备的脂质纳米颗粒与增强绿色荧光蛋白mrna的组合物,于不同浓度下在bhk细胞中表达的荧光蛋白平均强度。
具体实施方式
[0103]
以下结合附图和具体实施例对本发明作具体的介绍。实施例的目的在于例举,而不应理解为是对本技术权利要求保护范围的限制。
[0104]
实施例
[0105]
以下缩写字母分别代表如下试剂:
[0106]
dcm:二氯甲烷;dmap:4-二甲氨基吡啶;tea:三乙胺,edci:1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐;tlc:硅胶板薄层色谱;thf:四氢呋喃;dmf:n,n-二甲基甲酰胺;dspc:1,2-二硬酯酸-sn-甘油磷脂酰胆碱,dope:1,2-二油酰-sn-甘油-3-磷酸乙醇胺,tff:切向流过滤。
[0107]
实施例1化合物一(代号:xh-04)的合成
[0108]
(化合物一、代号:xh-04)
[0109]
化合物一的制备方法如图1所示;具体包括如下步骤:
[0110]
步骤一,向dcm二氯甲烷(100ml)中化合物1(20.0g,89.6mmol,1.00当量)的溶液中添加化合物1a(14.2g,98.6mmol,1.10当量)、dmap4-二甲氨基吡啶(1.10g,8.96mmol,0.10当量)和tea三乙胺(36.3g,358.6mmol,49.9ml,4.00当量)。向溶液中添加edci 1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(22.3g,116.5mmol,1.30当量)。反应在25℃搅拌12小时。tlc硅胶板薄层色谱(石油醚:乙酸乙酯=10:1,rf=0.62)显示反应完成。将反应溶液倒入h2o(100ml)中。用二氯甲烷(200ml
×
2)萃取溶液。用盐水(100ml)冲洗有机层。有机层用硫酸钠干燥,减压浓缩,得到粗产品。粗产物通过柱层析(sio2,石油醚:乙酸乙酯=1:0至0:1)纯化,得到呈黄色油状的化合物2(22.0g,63.0mmol,70.3%)。1h nmr:(400mhz,cdcl3)δ4.03(t,j=6.8hz,2h),3.38(t,j=6.0hz,2h),2.27(t,j=7.6hz,2h),1.71-1.86(m,2h),1.56-1.61(m,4h),1.40-1.43(m,2h),1.22-1.33(m,16h),0.84-0.88(m,3h)。
[0111]
步骤一的反应式为:
[0112]
[0113]
步骤二:向化合物2(20.0g,57.25mmol,1.00当量)和化合物2a(3.95g,28.6mmol,0.50当量)在dmf二甲基甲酰胺(120ml)中的溶液中添加cs2co3(37.3g,114.5mmol,2.00当量)。将悬浮液在25℃搅拌6小时。tlc硅胶板薄层色谱(石油醚:乙酸乙酯=8:1,rf=0.40)显示反应完成。将反应溶液倒入h2o(200ml)中。用二氯甲烷(200ml
×
3)萃取溶液。用盐水(100ml)冲洗有机层。有机层用硫酸钠干燥,减压浓缩,得到粗产品。粗产物通过柱层析(sio2,石油醚:乙酸乙酯=1:0至10:1)纯化,得到白色固体形式的化合物3:二壬基-8,8
’‑
((2-甲酰基-1,4-亚苯基)双氧)辛酸(15.0g,22.2mmol,77.6%产率)。1h nmr:(400mhz,cdcl3)δ10.47(s,1h),7.31(d,j=3.2hz,1h),7.10(dd,j1=8.8hz,j2=3.2hz,1h),6.92(d,j=9.2hz,1h),4.01-4.08(m,6h),3.94(t,j=6.4hz,2h),2.31(t,j=7.2hz,4h),1.74-1.84(m,4h),1.59-1.68(m,8h),1.27-1.43(m,36h),0.87-0.90(m,6h)。
[0114]
步骤二的反应式为:
[0115][0116]
步骤三,向化合物3(12.0g,17.78mmol,1.00当量)在四氢呋喃thf(72ml)和乙醇etoh(36ml)中的溶液中添加0℃下的nabh4(739.9mg,19.6mmol,1.00当量)。添加后,将反应溶液在25℃下搅拌2小时。tlc硅胶板薄层色谱(石油醚:乙酸乙酯=5:1,rf=0.20)显示反应完成。将反应溶液倒入h2o(100ml)中。用二氯甲烷(200ml
×
2)萃取溶液。用盐水(200ml)冲洗有机层。有机层在硫酸钠上干燥并减压浓缩,得到白色固体形式的化合物4(11.8g,粗品)。1h nmr:(400mhz,cdcl3)δ6.87(d,j=2.4hz,1h),6.71-6.76(m,2h),4.63(s,2h),4.04(t,j=6.8hz,4h),3.93(t,j=6.4hz,2h),3.88(t,j=6.4hz,2h),3.69-3.74(m,1h),2.28(t,j=7.2hz,4h),1.69-1.78(m,4h),1.56-1.65(m,8h),1.21-1.45(m,36h),0.84-0.88(m,6h)。
[0117]
步骤三的反应式为:
[0118]
[0119]
步骤四,将化合物4(11.0g,16.3mmol,1.00当量)、化合物4a(3.13g,18.69mmol,1.15当量,hcl)和edci1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(7.16g,37.4mmol,2.30当量)在吡啶(55ml)中的溶液在40℃搅拌20小时。tlc硅胶板薄层色谱(二氯甲烷:甲醇=10:1,rf=0.39)显示反应完成。将反应溶液倒入饱和氯化铵溶液(60ml)中。用乙酸乙酯(120ml
×
3)萃取溶液。有机层用硫酸钠干燥,减压浓缩,得到粗产品。粗产物用硅胶柱层析(石油醚:乙酸乙酯=100:1至0:1)纯化,得到无色油状化合物一,xh-04(4.00g,5.06mmol,31.2%产率)。1h nmr:(400mhz,cdcl3)δ6.89(s,1h),6.77(d,j=2.4hz,2h),5.14(s,2h),4.06(t,j=6.8hz,4h),3.90(q,j=6.4hz,4h),2.30-2.42(m,4h),2.26-2.29(m,10h),1.82-1.89(m,2h),1.72-1.78(m,4h),1.27-1.45(m,36h),0.86-0.90(m,6h)。
[0120]
步骤四的反应式为:
[0121][0122]
实施例2化合物二的合成
[0123]
化合物二:
[0124]
在壬醇(19.4g)和溴辛酸(30g)的二氯甲烷溶液(210ml)中加入三乙胺(40.8g)和二甲基氨基吡啶(1.64g)和1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(25.7g),于室温下搅拌12h后加入盐酸(20ml)溶液终止反应。用乙酸乙酯萃取3次,并且用卤水洗涤滤液。用无水硫酸镁干燥,过滤并去除溶剂,经层析柱纯化后得到14g壬基-8-溴辛酸乙酯。
[0125]
在十七胺-1,9,17-三醇(63.2g)和溴辛酸(50g)的二氯甲烷溶液(350ml)中加入三乙胺(68g)和二甲基氨基吡啶(2.74g)和1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(94.5g),于室温下搅拌12h后加入盐酸溶液以终止反应,然后用乙酸乙酯萃取3次,并且用卤水洗涤滤液。用无水硫酸镁干燥,过滤并去除溶剂,经层析柱纯化后得到无色油状物。向5-溴-2-羟基苯甲醛(25g)在二甲基甲酰胺(175ml)的溶液中加入该无色油状物(47.7g)和碳酸钾(34.3g),于80℃下搅拌12h,然后加入去离子水(300ml)终止反应。用乙酸乙酯萃取3次,并且用卤水洗涤滤液。有机部分经无水硫酸镁干燥,过滤并去除溶剂,经层析柱纯化后
得到57g的1h nmr:(400mhz,cdcl3)δ10.41(s,1h),7.92(d,j=2.4hz,1h),7.61-7.59(m,1h),6.87(d,j=8.8hz,1h),4.88-4.84(m,1h),4.05(t,j=6.4hz,2h),2.31-2.27(m,2h),1.86-1.81(m,2h),1.71-1.64(m,2h),1.51-1.37(m,36h),0.87-0.85(m,6h)。
[0126]
将(20g)溶解在四氢呋喃(40ml)和甲醇(100ml)的混合液中,预冷至0℃并使用硼氢化钠(520mg)处理3h。加入氯化铵溶液(20ml)终止反应后用乙酸乙酯萃取3次,并用卤水洗涤滤液,经无水硫酸镁干燥,过滤,层析柱纯化后得到棕色油状物。棕色油状物在二甲基甲酰胺(21ml)中溶解并加入对甲基苯磺酰咪唑(3.5g)和叔丁基二苯基氯硅烷(11.3g)处理12h,层析柱纯化后得到24g黄色油状物。
[0127]
将10g黄色油状物在二氧六环(70ml)中溶解并加入3.71g的和[1,1'-双(二苯基膦基)二茂铁]二氯化钯(890mg)和乙酸钾(2.39g)在氮气氛下处理12h,层析柱纯化后得到13g黄色油状物。黄色油状物(13g)在四氢呋喃(130ml)中溶解并加入过氧化氢(3.39g)和氢氧化钠(1m,14.9ml)处理1h。加入硫代硫酸钠终止反应,用乙酸乙酯萃取2次,并用卤水洗涤滤液,经无水硫酸镁干燥,过滤,层析柱纯化后得到棕色油状中间产物3,1h nmr:(400mhz,cdcl3)δ7.76-7.67(m,4h),7.46-7.34(m,7h),7.18(s,1h),6.67(s,1h),4.81-4.72(m,1h),4.69(s,1h),3.81-3.78(m,2h),2.25(t,j=7.4hz,2h),1.66-1.55(m,5h),1.42-1.43(m,4h),1.30-1.22(m,34h),1.12(s,9h),0.88(t,j=6.8hz,6h)
[0128]
用壬基-8-溴辛酸乙酯(5.03g)和碳酸钾(3.46g)处理棕色油状中间产物3(9.5g)在二甲基甲酰胺(63ml)中的溶液,于90℃下搅拌12h。用溶剂萃取3次,并用卤水洗涤滤液,经无水硫酸镁干燥,过滤,层析柱纯化后得到6.3g黄色油状物。黄色油状物溶解于四氢呋喃(30ml)中并加入四丁基氟化铵(1m,12.2ml)搅拌反应5h。用乙酸乙酯萃取2次,并用卤水洗涤滤液,经无水硫酸镁干燥,过滤,层析柱纯化后得到6g黄色油状物。黄色油状物溶解于吡啶(6ml)中并加入4-氨基丁酸(1.91g)和碳二亚胺(2.91g)于50℃搅拌反应12h。经减压浓缩和层析柱纯化后得到3g终产物化合物二(43.7%收率)。1h nmr:(400mhz,cdcl3)δ6.86(s,1h),6.79(s,2h),5.15(s,2h),4.86(t,j=6.2hz,1h),4.06(t,j=6.6hz,2h),3.91(td,j=6.4,9.0hz,4h),3.09-2.91(m,2h),2.74(s,6h),2.52(t,j=6.6hz,2h),2.32-2.27(m,4h),2.23-2.10(m,2h),1.79-1.74(m,4h),1.65-1.58(m,6h),1.55-1.41(m,9h),1.41-1.34(m,9h),1.33-1.23(m,34h),0.93-0.83(m,9h)。
[0129]
实施例3:化合物三的合成
[0130]
化合物三:
[0131]
化合物三的合成参考化合物二的合成方法。化合物三的核磁氢谱如下:
[0132]1h nmr:(400mhz,cdcl3)δ6.86(s,1h),6.79(s,2h),5.15(s,2h),4.86(t,j=6.2hz,1h),4.06(t,j=6.6hz,2h),3.91(td,j=6.4,9.0hz,4h),3.09-2.91(m,2h),2.74(s,6h),2.52(t,j=6.6hz,2h),2.32-2.27(m,4h),2.23-2.10(m,2h),1.79-1.74(m,4h),1.65-1.58(m,6h),1.55-1.41(m,9h),1.41-1.34(m,9h),1.33-1.23(m,34h),0.93-0.83(m,9h)。
[0133]
实施例4:化合物四至化合物二十五的合成
[0134]
参考化合物一的合成方法,制备得到化合物四至化合物二十五,并通过核磁、质谱加以验证。限于说明书篇幅,未详细列出其合成步骤和表征数据。
[0135]
实施例5化合物一在制备脂质纳米颗粒的应用
[0136]
一种可离子化脂质分子在制备脂质纳米颗粒的应用,包括:可离子化脂质分子与磷脂、胆固醇、聚乙二醇通过微流控合成方法获得lnp,lnp能提高负载物-mrna-在细胞内的翻译表达水平。作为一种优选,磷脂为dspc(1,2-二硬酯酸-sn-甘油磷脂酰胆碱)或者dope(1,2-二油酰-sn-甘油-3-磷酸乙醇胺),聚乙二醇,作为进一步的优选为dmg-peg2000。需要说明的是:微流控合成方法只是一种优选,也可以是薄膜水化挤出法(thin film hydration followed by extrusion)合成lnp,这些方法都不是穷举,只要是通过本发明的xh-04合成得到lnp的方法都在本发明的保护范围内。
[0137]
合成新型载体lnp的配方按照摩尔百分比为:xh-04:胆固醇:磷脂:聚乙二醇=20-70%:20-60%:2-20%:0.1-5%。作为一种优选,合成新型载体lnp的配方按照摩尔百分比为:xh-04:胆固醇:dspc:dmg-peg2000=31.5:56:10:2.5(mol%)。需要说明的是:最优配方已在以下实验得到验证,本领域技术人员可知:这个范围的摩尔百分比的配方是常见的灵活范围,都可以得到lnp,只要是通过这样的配方得到的lnp,均在本发明的保护范围内,在这里不赘述实验过程和数据。需要说明的是:不是只有xh-04、胆固醇、dspc、dmg-peg2000这一种组合方式,dspc可替换成dope,dmg-peg2000可以换成任何一种peg(聚乙二醇)。
[0138]
性能检测的具体步骤如下:
[0139]
(1)通过切向流过滤(tangential flow filtration,tff)纯化lnp;
[0140]
需要说明的是:纯化lnp的方法除了切向流过滤纯化,也可以是透析加浓缩的方法,这些方法都不是穷举,只要是能够纯化本发明的配方得到的lnp,都在本发明的保护范
围内。
[0141]
(2)以spike protein_mrna作为标记mrna,体外验证lnp递送载体的性能。
[0142]
以下通过实验验证本发明的技术效果:
[0143]
先制备lnp,具体过程如下:
[0144]
1、准备工作液
[0145]
(1)配制各组分的母液(cholesterol胆固醇:10mg/ml,dspc 1,2-二硬脂酰-sn-甘油-3-磷酸胆碱:10mg/ml,dmg-peg2000 1,2-二肉豆蔻酰-rac-甘油-3-甲氧基聚乙二醇2000:4mg/ml),可离子化脂质分子xh-04(化合物一,10mg)。
[0146]
(2)用总量1ml无水乙醇充分溶解10mg xh-04。并将xh-04与dmg-peg2000 1,2-二肉豆蔻酰-rac-甘油-3-甲氧基聚乙二醇2000、cholesterol胆固醇置于37℃水浴锅中水浴40min;将dspc 1,2-二硬脂酰-sn-甘油-3-磷酸胆碱放置于55℃水浴锅中水浴40分钟。
[0147]
(3)按照下表2所示体积,加入并充分混合预热后的各组分的母液,然后继续加入7.32ml无水乙醇稀释该混合液。继续保持37℃水浴。
[0148]
表2
[0149][0150]
2、通过微流控合成lnp
[0151]
用nanoassemblr微流控仪器,以及用原厂提供的微流控芯片制备lnp。微流控芯片通道经清洁和预处理后,左侧注射器装入8ml超纯水,右侧注射器装入2ml的各脂质组分的混合液。仪器控制软件中参数设置如下:总液体流速16ml/min,左右侧流速比4:1,初始丢弃体积0.550ml,结束丢弃体积0.150ml。重复几次,用完全部的脂质组分混合液,收集所有的产物lnp溶液,并在30分钟内加入超纯水稀释至溶液中乙醇比例小于0.5%。
[0152]
3、通过tff超滤纯化lnp
[0153]
用中空纤维超滤膜柱进行换液,除去lnp溶液中的乙醇成分,使lnp分散在超纯水中,于2-8摄氏度下保存。得到的xh-04lnp的冷冻电镜图片如图2所示。
[0154]
制备包裹spike protein_mrna的lnp并与现有lnp产品进行对比实验,具体过程如下:
[0155]
dlin-mc3-dma可离子化脂质分子(cas号1224606-06-7)是现有lnp产品的主要成分。本实施例使用dlin-mc3-dma和其它必要组分制备合成mc3-lnp产品并包裹spike protein_mrna,作为对照。同时使用本发明所提供的可离子化脂质分子xh-04替代dlin-mc3-dma分子,与cholesterol胆固醇,dspc1,2-二硬脂酰-sn-甘油-3-磷酸胆碱,dmg-peg2000 1,2-二肉豆蔻酰-rac-甘油-3-甲氧基聚乙二醇2000等组分一起合成xh04-lnp产品并包裹spike protein_mrna。在体外验证xh04 lnp递送mrna的性能。
[0156]
1、准备工作液
[0157]
(1)准确配制各组分的母液(cholesterol胆固醇:10mg/ml,dspc 1,2-二硬脂酰-sn-甘油-3-磷酸胆碱:10mg/ml,dmg-peg2000 1,2-二肉豆蔻酰-rac-甘油-3-甲氧基聚乙二醇2000:4mg/ml,可离子化脂质分子xh-04或者dlin-mc3-dma(10mg)。
[0158]
(2)用总量1ml无水乙醇充分溶解10mg xh-04(或者dlin-mc3-dma)。并将xh-04与dmg-peg2000 1,2-二肉豆蔻酰-rac-甘油-3-甲氧基聚乙二醇2000、cholesterol胆固醇置于37℃水浴锅中水浴40min;将dspc 1,2-二硬脂酰-sn-甘油-3-磷酸胆碱放置于55℃水浴锅中水浴40分钟。
[0159]
(3)按照下表所示体积,加入并充分混合预热后的各组分的母液,然后继续加入7.32ml无水乙醇稀释该混合液。继续保持37℃水浴。
[0160][0161]
(4)取507μg的spike protein_mrna,用柠檬酸缓冲液(ph 6.0)稀释至39.37ml,置于50ml的离心管中(冰上放置)。
[0162]
2、通过微流控合成lnp
[0163]
用nanoassemblr微流控合成仪器,以及用原厂提供的微流控芯片制备lnp。微流控芯片通道经清洁和预处理后,左侧注射器装入8ml的mrna稀释液,右侧注射器装入2ml的各脂质组分的混合液。仪器控制软件中参数设置如下:总液体流速16ml/min,左右侧流速比4:1,初始丢弃体积0.550ml,结束丢弃体积0.150ml。重复几次,用完所有的脂质组分混合液,收集所有的产物lnp溶液,并在30分钟内加入柠檬酸缓冲液稀释至溶液中乙醇比例小于0.5%。
[0164]
3、通过tff超滤纯化lnp
[0165]
用中空纤维超滤膜柱进行换液,除去lnp溶液中的乙醇和柠檬酸等成分,使lnp分散在制剂缓冲液中。测定并调整溶液中mrna的浓度至10μg/ml,并将包裹有mrna的lnp分装后于-80摄氏度下保存。
[0166]
4、体外验证lnp递送载体的性能
[0167]
将包裹有mrna的lnp制剂与bhk细胞共培养72h,使用流式细胞术检测细胞内spike protein的表达水平。
[0168]
(1)细胞复苏与传代。将bhk-21细胞复苏,于培养瓶中培养传代至所需的细胞数量。
[0169]
(2)种板。将培养瓶中的细胞消化下来并计数,以每孔1万个细胞铺在96孔板中,过夜培养至细胞贴壁。
[0170]
(3)加药。将96孔板中的培养基吸干,加入pbs清洗3次,然后吸干培养基中的液体。
向各孔中加入200μl的lnp制剂和1800μl的培养基,于培养箱中培养至72h。
[0171]
(4)收集细胞后,使用相应的一抗和荧光二抗孵育标记,用流式细胞术比较阳性细胞率。如图3所示。可以看出,使用xh04-lnp负载的mrna在细胞内的表达效果(57.62%)远高于现有产品mc3-lnp的效率(5.77%)。
[0172]
本发明提出了一种新型结构的可离子化脂质分子xh-04(化合物一),再通过与脂质原料配比,获得的lnp具有更加优异的mrna载体性能,可以明显提高其负载物-mrna-在细胞内的翻译表达水平。
[0173]
实施例6:包含增强绿色荧光蛋白mrna的脂质纳米颗粒组合物的制备
[0174]
将可离子化脂质分子化合物二或化合物三(10mg)、胆固醇、dspc和dmg-peg2000以38.5:50:10:1.5的摩尔比溶解于乙醇。以10:1的总脂质与mrna的重量比制备脂质纳米颗粒(lnp):将mrna在50mm柠檬酸盐缓冲液(ph 6)中稀释至0.2mg/ml。使用注射器泵,将脂质的乙醇溶液与mrna水溶液以1:4(体积/体积)的比例混合,总流速为15ml/min。然后去除乙醇,并通过透析用pbs替代外部的缓冲液。最后,将脂质纳米颗粒通过0.22μm孔无菌过滤器过滤。通过准弹性光散射确定的脂质纳米颗粒的粒径为直径80-100nm。
[0175]
实施例7:脂质纳米颗粒组合物的负载性能评估
[0176]
bhk细胞来自atcc并在37℃、5%co2下维持于补充有10%胎牛血清(hyclone)的dulbecco改良的eagle培养基(hyclone)。使用包含增强绿色荧光蛋白mrna的脂质纳米颗粒,将0.1μg或0.5μg的实施例6制备的脂质纳米颗粒组合物或商用的mc3纳米颗粒组合物(dlin-mc3-dma可离子化脂质分子,cas号1224606-06-7)与细胞共孵育,来将治疗性核酸递送进入bhk细胞。共孵育24小时后,使用荧光显微镜观察细胞内绿色荧光蛋白的表达,并计算平均荧光强度。结果如图4所示。
[0177]
参见图4可知,采用0.1μg或0.5μg本发明的化合物二制备的脂质纳米颗粒组合物,进行细胞转染后,细胞内绿色荧光蛋白的表达强度超过使用商用的mc3纳米颗粒组合物的表达;采用0.1μg或0.5μg本发明的化合物三制备的脂质纳米颗粒组合物,进行细胞转染后,细胞内绿色荧光蛋白的表达强度接近商用的mc3纳米颗粒组合物的荧光表达,表明本发明的可离子化脂质分子能够有效地将治疗性核酸递送进入bhk细胞。
[0178]
实施例8:使用包含mrna核酸治疗剂的脂质纳米颗粒组合物的蛋白体外表达能力评估
[0179]
bhk细胞来自atcc并在37℃、5%co2下维持于补充有10%胎牛血清(hyclone)的dulbecco改良的eagle培养基(hyclone)。通过与0.1μg或0.5μg的本发明的可离子化脂质化合物制备的脂质纳米颗粒组合物或商用的mc3纳米颗粒组合物共孵育,将其中包含的编码增强绿色荧光蛋白的mrna核酸递送进入bhk细胞并表达对应蛋白。共孵育24小时后,使用胰蛋白酶消化并收集细胞,使用流式细胞仪进行细胞内绿色荧光蛋白的信号强度收集。以加入未包含编码增强绿色荧光蛋白的mrna的商用mc3纳米颗粒组合物的细胞组作为对照,进行蛋白表达相对比例的分析。结果如表3所示。
[0180]
表3:通过商用或本发明的可离子化脂质制备的脂质纳米颗粒与增强绿色荧光蛋白mrna的组合物,于不同浓度下在bhk细胞中的荧光蛋白表达率
[0181][0182]
未包含编码增强绿色荧光蛋白的mrna的商用mc3纳米颗粒组合物与细胞共孵育后的荧光强度设为基点,其荧光蛋白表达率为0。由表3可知,采用0.5μg本发明的脂质纳米颗粒组合物能够获得相当于商用的mc3纳米颗粒组合物的绿色荧光蛋白的表达效果,表明本发明的可离子化脂质分子能够有效地将治疗性核酸递送进入bhk细胞,并具有优异的荧光蛋白表达率。
[0183]
以上显示和描述了本发明的基本原理、主要特征和优点。本领域技术人员应该了解,上述实施例不以任何形式限制本发明,凡采用等同替换或等效变换的方式所获得的技术方案,均落在本发明的保护范围内。
