1.本发明涉及基因工程技术领域,具体而言,涉及生物活性蛋白(imute)及其制备方法。
背景技术:
2.多肽与传统的抗生素不同,多肽是一类由20~60个氨基酸组成的多肽类小分子,具有杀菌快速且不会导致微生物耐药等特性,是良好的抗菌候选材料。实验结果显示,用低于致死量的抗生素喂养细菌后,4~5代细菌就会对抗生素产生耐药性,而用同样剂量的多肽喂养细菌,直到32代后,提高多肽剂量,细菌依旧会被多肽所杀死,不会产生耐药性。
3.抗生素耐药性威胁日益严峻,研究新型抗感染药物成为紧迫的医学问题之一。而多肽具有广谱抗菌活性,靶菌株不易产生抗性突变,对细菌(包括某些耐药性病原菌)有很强的杀伤作用。
4.多肽是生物机体天然免疫系统的重要组成成分,传统多肽具有一定的局限性,当前市场上多肽多是鱼目混珠,不是真正意义上的多肽;化学合成居多,生产效率低,生产成本较高;也有重组表达的多肽,但菌种表达量低,无法产业化;多数具有不同程度的生物毒性,无法做成药;多数多肽的抗菌活性不理想,mic(最低抑菌浓度)为千分之七左右;很多多肽的水溶性、稳定性不好,也无法做成药。
5.因此,需要对多肽进行改造,保持其已有的抗菌活性,并大程度地减小毒性,增强稳定性,同时通过优化工艺以实现低成本化。难点与创新点则在于如何提升多肽的活性和增加特异性,这一方面来自于天然多肽本身的特性,另一方面取决于不同细菌本身的性质,如革兰氏阴性菌和革兰氏阳性菌在细胞壁和细胞膜差别巨大,就可以根据这一特点,针对不同类型的细菌,通过设计改造来优化多肽。鉴于此,特提出本发明。
技术实现要素:
6.本发明的目的在于提供了生物活性蛋白及其制备方法。本发明提供的生物活性蛋白(imute)是一种新型抗菌、抗炎性多肽,其具有更好的抗菌、抗炎活性、低细胞毒性,此外,本发明提供的制备方法得率高、方法简便,所制备的生物活性蛋白(imute)纯度高。
7.本发明是这样实现的:第一方面,本发明提供一种生物活性蛋白(imute),其氨基酸序列选自seq id no .1-5中的任意一种:序号编码氨基酸序列1seqidno.1mgklhklghkhlhawkkyghihg2seqidno.2mgklrklgrkrlrawkkygrirg3seqidno.3klrklgrkrlrawkkygrirg4seqidno.4klhklghkhlhawkkyghihg
5seqidno.5mgklrklgrkrlrawkkygr本发明提供的seq id no .1-5所示的生物活性蛋白(imute)是在传统的哺乳动物来源多肽基础上,进行了优化改造,并采用基因工程重组技术异源表达系统来生产的新型多肽。
8.另一方面,本发明提供一种分离的核酸分子,其编码如上所述的生物活性蛋白(imute)。
9.进一步地,在本发明的一些实施方案中,其核酸序列如seq id no .6所示,如下:atgggtaaattacgaaaattaggtcgaaaacgattacgagcgtggaaaaaatacggtcgaattcgaggttga。
10.seq id no .6所示核酸序列可以编码seq id no .2所示的生物活性蛋白。其他生物活性蛋白的核苷酸序列本领域技术人员可以在此基础上,根据氨基酸的密码子合理变化得到,这对本领域技术人员来说是容易实现的。
11.seq id no .6所示的核苷酸序列是经过了密码子优化后的序列,采用该核苷酸序 列在大肠杆菌中重组表达上述生物活性蛋白,其表达效率更高,更能提高生物活性蛋白的得率。
12.进一步地,在本发明的一些实施方案中,所述生物活性蛋白的氨基酸序列如seq id no .2所示。
13.另一方面,本发明提供一种载体,含有如上所述的核酸分子。
14.进一步地,在本发明的一些实施方案中,所述载体含有驱动所述核酸分子表达的启动子。
15.进一步地,在本发明的一些实施方案中,所述启动子为t7 启动子。
16.进一步地,在本发明的一些实施方案中,所述载体的骨架为pet-28a。
17.进一步地,在本发明的一些实施方案中,所述核酸分子位于所述载体的ncoi酶切位点和xhoi酶切位点之间。
18.另一方面,本发明提供一种重组细胞,其含有如上任一项所述的载体。
19.进一步地,在本发明的一些实施方案中,所述重组细胞选自大肠杆菌。大肠埃希菌(e .coli)是目前利用最广泛的表达宿主菌,其具有遗传背景清晰,易于操作,培养简单,生产成本低的特点。
20.进一步地,在本发明的一些实施方案中,所述大肠杆菌含有pet28a(+)-bap 23表达载体。
21.另一方面,本发明提供一种制备如上所述的生物活性蛋白的方法,其包括:培养如上所述的重组大肠杆菌。
22.进一步地,在本发明的一些实施方案中,所述方法包括:在培养所述重组细胞的培养液的od600达到1-2时,加入诱导剂进行诱导培养。
23.进一步地,在本发明的一些实施方案中,诱导培养的温度为28-33℃,诱导培养的时间4-6h。
24.进一步地,在本发明的一些实施方案中,诱导剂为iptg。
25.进一步地,在本发明的一些实施方案中,诱导剂在培养液中的浓度控制为0.1-1mm。
26.进一步地,在本发明的一些实施方案中,当重组细胞为大肠杆菌时,所述方法包括:在培养结束后,收集菌体对其进行超声破碎,低温高速离心,收集上清液。
27.进一步地,在本发明的一些实施方案中,所述方法还包括:将所述上清液再进行阳离子交换层析,用洗脱溶液洗脱后,收集洗脱液。
28.进一步地,在本发明的一些实施方案中,阳离子交换层析所用的层析介质为cm-sepharose fast flow介质。
29.进一步地,在本发明的一些实施方案中,所述洗脱溶液是含1.3m nacl的tris-hcl溶液洗杂蛋白和2m nacl的tris-hcl溶液洗脱生物活性蛋白。
30.进一步地,在本发明的一些实施方案中,所述方法还包括:采用截留分子量为1kd的透析膜对所述流穿液进行超滤,脱盐,得到所述生物活性蛋白(imute)。
31.附图说明
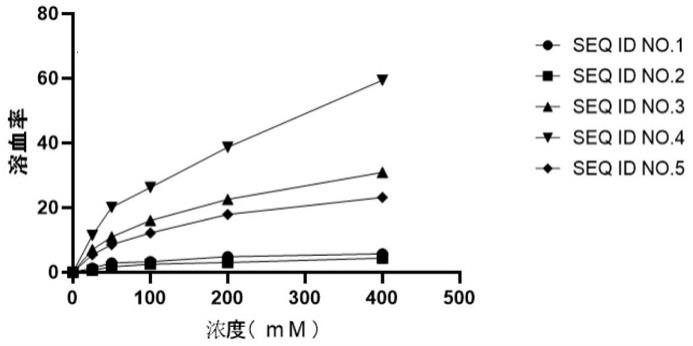
32.图1为为实施例2中候选多肽的溶血检测结果。
33.图2为实验例4中的不同bap 23编码序列的表达效率检测结果泳道5marker、泳道1空白菌、第2泳道为对照组1的诱导表达量,第4泳道为对照组2的诱导表达量,泳道3为实施例3的诱导表达量。
34.图3为实施例6中的bap 23 生物活性蛋白(imute)的tricine
ꢀ‑
sds-page电泳图泳道1 marker、泳道2纯化后的生物活性蛋白。
35.图4为实施例8中的bap 23 生物活性蛋白(imute)样品的抗炎实验数据以及模拟图谱。
36.具体实施方式
37.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
38.以下结合实施例对本发明的特征和性能作进一步的详细描述。
39.实施例1采用化学固相合成的方式,合成seq id no .1至seq id no .5中的候选氨基酸序列;采用hplc检测合成的多肽纯度,确定合成的多肽纯度大于95%;其中hplc检测条件为a:含有0.05%(v/v)的三氟乙酸的水溶液,b:含有0.05%(v/v)的三氟乙酸的乙腈,检测波长为210nm,在40分钟内,b从0线性提高至100%(v/v)。取得合格的合成候选序列的多肽后,采用最低抑菌浓度(mic)作为评价指标,优选了一株革兰氏阳性细菌金黄色葡萄球菌和一株革兰氏阴性细菌大肠杆菌作为指示菌进行抑菌活性评价。mic检查:(1)采用lb培养基倍比稀释不同浓度的抗菌药物溶液;(2)分别添加到96孔聚苯乙烯板中,在第1至11孔添加药液,每孔100ul,药物浓度分别640、320、160、80、40、20、10、5、2.5、1.25、0.625ug/ml,第12孔添加100ullb培养基作为生长对照;(3)将细菌悬液采用lb培养基稀释制备成约2 106cfu/ml的
悬液;(4)将100ul细菌悬液添加至96孔板中,在37℃条件下,培养约20小时,测定吸光值,判定最小抑菌浓度。实验结果如下表:从mic分析可以得出,seq id no .1-seq id no .5的多肽均具有良好的抑菌能力,其中seq id no .2具有较优的抑菌能力,因此作为候选序列进行进一步开发。
40.实施例2将实施例1中合成好的候选氨基酸序列,采用溶血性作为评价指标,如图1为检测后的溶血性数据。其中seq id no .2序列具有较低的溶血性作为后续优选开发对象,后文中,将seq id no .2的多肽命名为bap 23。溶血性检测,采用新鲜的人血红细胞进行,(1)采用ph=7.4的pbs溶液将人血红细胞1000g离心力离心7分钟,洗涤2-3次,至上清液不显红色为止;(2)将候选多肽溶解至同样的pbs溶液中,按照0、100um、200um、400um与洗涤后的人红细胞同等比例加入,以1%的triton x-100为阳性对照;(3)37℃条件下,孵育1小时;(4)1000g离心力离心5分钟;(5)在405nm的波长下,检测离心后的上清。计算公式如下:实施例31 构建含有bap 23基因表达载体,方法如下:采用全基因合成技术合成含bap 23基因片段:ccatggatgggtaaattacgaaaattaggtcgaaaacgattacgagcgtggaaaaaatacggtcgaattcgaggttgatgactcgag。
41.其中,下划线处字母为bap 23基因序列(seq id no .6,该序列是根据大肠杆菌密码子偏好性进行设计,编码的氨基酸序列为mgklr klgrk rlraw kkygr irg(seq id no .2);5’端和3’端分别具有限制性内切酶ncoi和xhoi。
42.2 构建含有pet28a(+)-bap 23表达载体的重组大肠杆菌方法:将测序正确的重组载体pet-28a(+)-bap 23用热激法转化bl21(de3)plys大肠杆菌,并用lb(含硫酸卡那霉素,30μg/ml)平板进行筛选。热激法采用42℃热激1.5分钟,冰上静置2分钟;然后加入无抗性的lb肉汤培养基37℃、120rpm培养1小时;最后将其均匀涂布在含有硫酸卡那霉素的lb抗性平板上,37℃倒置培养过夜,进行阳性克隆筛选。
43.得到的重组大肠杆菌命名为bl21(de3) plyss-bap 23。
44.实验例4
检测实施例3得到的重组大肠杆菌中的bap 23的表达情况检测方法:取实施例3的重组大肠杆菌bl21(de3) plyss-bap 23,采用lb基础培养基在37℃、220rpm培养重组bl21(de3) plyss-bap 23,当菌体密度od600达到1-2时,降温至30℃,添加1mm iptg诱导4-5小时;取0.1ml菌液离心收集菌体,加入4
×
loading buffer 20μl、纯化水60μl,100℃煮10min,12000rpm离心后取上清进行全菌电泳,用于检测诱导表达情况,结果见图2。
45.此外,设置对照组,比较不同bap 23编码序列对表达水平的影响,对照组的bap 23编码序列如下:对照组1:5’atgggaaaactccgcaaactcggacgcaaacgcctccgcgcatggaaaaaatatggacgcattcgcggatga3’;对照组2:5’atgggaaagctccgtaagctcggacgtaagcgtctccgtgcatggaagaagtatggacgtattcgtggatga3’。
46.按实施例3基本相同的方法,用对照组1或2的bap 23编码序列代替实施例3中的bap 23编码序列,制备重组大肠杆菌,并进行表达测试,结果见图2。
47.图2中,第2泳道为对照组1的诱导表达量,第4泳道为对照组2的诱导表达量,泳道3为实施例3的诱导表达量;可以看出,泳道3的条带颜色更深,说明实施例3的重组大肠杆菌中的bap 23表达水平比对照组高了近1倍,表明实施例3中的bap 23编码序列(seq id no .6)其表达效率更高,高于对照组的bap 23编码序列。
48.实施例5为了大规模获得bap 23多肽,需要进行大量发酵表达培养,条件如下:取实施例3得到的重组大肠杆菌bl21(de3) plys-bap 23,用lb培养基进行扩培,在大肠杆菌od600在1-2时,进行iptg诱导表达,iptg浓度为0.1mm,诱导时间在4-5h。
49.发酵液中bap23表达量检测方法如下:诱导结束后,取10ml的培养液,10000rpm离心10min,pbs洗涤一次后等体积重悬,将重悬液进行超声破碎,破碎液9000rpm离心20min后取上清,采用实施例1中hplc的检测方法检测bap23的含量。
50.结果显示,在摇瓶培养条件下,bap 23的表达水平可以达到20mg/l以上。
51.实施例6重组bap 23的纯化(1)将实施例5培养的bl21(de3)plyss-bap 23菌液,使用低温高速离心机离心后,收集菌体;(2)将收集的菌体加入纯化水进行重悬,重悬后进行超声破碎,将充分破碎的溶液在10000rpm,4℃条件下离心15min,取上清;(3)上述上清液进行阳离子交换层析,阳离子交换层析所用的层析介质为cm-sepharose fast flow介质,首先含1.2m nacl的tris-hcl缓冲液洗涤杂质蛋白,再用含2m nacl的tris-hcl缓冲液洗脱目的蛋白,收集洗脱液;(4)上述洗脱液经过1kd的透析膜脱盐、换液后,得到具有抗菌、抗炎活性的bap 23
即纯度高的生物活性蛋白(imute)。
52.bap 23 生物活性蛋白(imute)样品采用tricine-sds-page进行检测,并分析bap 23 生物活性蛋白(imute)纯度。
53.结果见图3,分子量大小与bap 23的理论分子量一致。
54.实施例7bap 23 生物活性蛋白(imute)单体生物学活性检测mic实验(1)将指示菌大肠杆菌接种于tsb培养基中,33℃,180-220rpm培养24小时后,调整od600为0.8-0.9左右作为待用菌悬液,用mh肉汤培养基稀释500倍后备用;(2)取一支样品吸取样品50μl,2倍法逐级稀释,稀释液为无菌超纯水,共稀释11级;(3)吸取50μl的样品或者硫酸卡那霉素标品加入到96孔板,再吸取50μl待测菌加入96孔板中,第12孔为不含待测样品的生长对照。同时设置稀释液与mh肉汤的阴性对照组,每组两个平行。35℃,孵育17h,观测记录结果,结果见表1;表1为实施例7中的bap 23 生物活性蛋白(imute)样品的mic抑菌数据。
55.从实施例7中,可以得出,本发明实施例提供的bap 23 生物活性蛋白(imute)单体对细菌具有良好的抑菌效果。
56.实施例8bap 23 生物活性蛋白(imute)单体生物学活性检测-抗炎实验(1) 培养细胞,密度达到90%以上后,移去培养基加入pbs清洗两次,加入pbs轻轻吹打壁上细胞,500r/min离心5min,去上清;(2) 上述细胞沉淀中加入dmem高糖完全培养基,吹打重悬,计数细胞,把高浓度细胞悬液稀释至10万/ml,接种至96孔板,每孔100μl,培养24h;(3) 次日用移液器吸去96孔板上清,加入100μl含有80μg/ml、40μg/ml、20μg/ml、10μg/ml、5μg/ml、2.5μg/ml、1.25μg/ml、0.625μg/ml bap 23完全培养基及100μl含有lps的完全培养基,培养24h;(4) 次日,吸取上清,离心,取上清用培养基稀释一倍;(5) 使用il-6 elisa检测试剂盒,检测il-6吸光值,计算其ed50值,结果见图4。
57.从实施例8中,可以得出,本发明实施例提供的bap 23 生物活性蛋白(imute)单体对炎症因子il-6具有良好的结合作用,具有一定的抗炎效果。
