靶向cd276的嵌合抗原受体、嵌合抗原受体t细胞及制备方法和制药应用
技术领域
1.本发明属于生物医药技术领域,涉及一种靶向cd276的嵌合抗原受体、嵌合抗原受体t细胞及制备方法和制药应用。
背景技术:
2.肝细胞癌是严重威胁人类健康的恶性肿瘤,占所有原发性肝癌的90%,是全球第二大致死性癌症。目前针对肝细胞癌的治疗方法比如化疗、放疗、肝切除术、消融疗法、靶向疗法如索拉菲尼、抗体疗法如免疫检查点抑制剂、血管内皮生长因子受体抑制剂,然而这些疗法的疗效都是不够的(lee,y.h.,et al.,combinational immunotherapy for hepatocellular carcinoma:radiotherapy,immune checkpoint blockade and beyond.frontiers in immunology,2020.11.),对病人和病人的家庭造成了难以挽回的伤害。因此迫切需要的新的治疗肝细胞癌的药物。
3.嵌合抗原受体t细胞(car-t)疗法是新型的免疫细胞治疗方法,具有特异性且高效的杀伤表达相应抗原的肿瘤细胞的功能,它通过基因工程手段使嵌合抗原受体表达在t细胞表面,通过在体外制备和扩增嵌合抗原受体t细胞,然后回输至人体,激活自身免疫系统,发挥对肿瘤细胞的高效杀伤(1.rafiq,s.,c.s.hackett,and r.j.brentjens,engineering strategies to overcome the current roadblocks in car t cell therapy.nature reviews clinical oncology,2020.17(3):p.147-167.;2.benmebarek,m.r.,et al.,killing mechanisms of chimeric antigen receptor(car)t cells.international journal of molecular sciences,2019.20(6).)嵌合抗原受体t细胞技术被认为是最有可能攻克癌症的疗法,并且靶向cd19的car-t细胞在血液肿瘤中产生了良好的效果。目前全球已有6款car-t药物获批上市,展现了car-t细胞治疗在治疗癌症中的巨大应用前景。
4.cd276又称为b7-h3,是属于b7家族的一类跨膜蛋白。cd276在多种癌症中高表达,包括肺腺癌、脑胶质瘤、神经母细胞瘤、胰腺癌和卵巢癌等,在正常组织中几乎不表达。靶向cd276的单克隆抗体在多种肿瘤模型中介导肿瘤的有效清除。cd276在肝细胞癌高表达并且与肝癌的进展和肿瘤病人的不良预后相关。这提示,cd276可以作为一个治疗肝细胞癌的有潜力靶点。
5.目前,靶向cd276的car-t细胞对肝细胞癌和其它高表达cd276的恶性肿瘤的杀伤活性研究有限。
技术实现要素:
6.为了克服上述现有技术的缺点,本发明的目的在于提供一种靶向cd276的嵌合抗原受体、嵌合抗原受体t细胞及制备方法和制药应用。
7.为了达到上述目的,本发明采用以下技术方案予以实现:
8.本发明的内容之一在于,提供一种靶向cd276的嵌合抗原受体,所述靶向cd276的
嵌合抗原受体包括如seq id no:1所示的氨基酸序列。
9.优选地,所述靶向cd276的嵌合抗原受体的编码基因包括如seq id no:2所示的核苷酸序列。
10.优选地,所述靶向cd276的嵌合抗原受体包括从氨基端到羧基端依次为靶向cd276的单链抗体、胞外铰链区、跨膜区和胞内结构区的氨基酸序列。
11.进一步优选地,所述靶向cd276的单链抗体的氨基酸序列包括如seq id no:3所示的氨基酸序列。
12.更进一步优选地,所述靶向cd276的单链抗体的编码基因包括如seq id no:4所示的核苷酸序列。
13.进一步优选地,所述胞外铰链区为cd8α铰链区。
14.更进一步优选地,所述cd8α铰链区的氨基酸序列包括如seq id no:5所示的氨基酸序列。
15.更进一步优选地,所述cd8α铰链区的编码基因包括如seq id no:6所示的核苷酸序列。
16.当然,胞外铰链区还可以使用cd28铰链区、igg1铰链区或igg4铰链区。
17.进一步优选地,所述跨膜区为cd8α跨膜区。
18.更进一步优选地,所述cd8α跨膜区的氨基酸序列包括如seq id no:7所示的氨基酸序列。
19.更进一步优选地,所述cd8α跨膜区的编码基因包括如seq id no:8所示的核苷酸序列。
20.当然,跨膜区还可以使用cd4跨膜区、cd28跨膜区、cd3ζ跨膜区或icos的跨膜区。
21.进一步优选地,所述胞内结构区由4-1bb共刺激结构区和cd3ζ信号结构区依次串联构成。
22.更进一步优选地,所述4-1bb共刺激结构区的氨基酸序列包括如seq id no:9所示的氨基酸序列。
23.更进一步优选地,所述4-1bb共刺激结构区的编码基因包括如seq id no:10所示的核苷酸序列。
24.进一步优选地,所述cd3ζ信号结构区的氨基酸序列包括如seq id no:11所示的氨基酸序列。
25.更进一步优选地,cd3ζ信号结构区的编码基因包括如seq id no:12所示的核苷酸序列。
26.当然,共刺激结构区还可以使用cd28、ox40、icos或cd27的胞内区。
27.本发明的内容之二在于提供一种靶向cd276的嵌合抗原受体t细胞,包括上述的靶向cd276的嵌合抗原受体;该靶向cd276的嵌合抗原受体的氨基酸序列包括如seq id no:1所示的氨基酸序列。
28.进一步地,所述靶向cd276的嵌合抗原受体car-cd276的编码基因包括如seq id no:2所示的核苷酸序列。
29.本发明的内容之三在于提供一种靶向cd276的嵌合抗原受体t细胞的制备方法,包括以下步骤:
30.1)提供靶向cd276的嵌合抗原受体car-cd276的编码基因,所述的靶向cd276的嵌合抗原体car-cd276的编码基因如seq id no:2所示的核苷酸序列。
31.2)将所述car-cd276的编码基因插入到pwpxld载体中,得到pwpxld-car-cd276重组质粒;
32.3)将所述pwpxld-car-cd276重组质粒与包膜质粒、包装质粒共转染宿主细胞,得到重组慢病毒;
33.4)将所述重组慢病毒转染cd3阳性t淋巴细胞,经分离获得靶向cd276的嵌合抗原受体t细胞。
34.进一步地,所述包膜质粒为pmd2g,所述包装质粒为pspax2,所述宿主细胞为hek293t细胞。
35.进一步地,步骤4)中,所述cd3阳性t淋巴细胞是从人外周血单个核细胞中分离获得。
36.更进一步地,所述人源外周血单个核细胞来源于自体静脉血、自体骨髓、脐带血和胎盘血等。
37.本发明的内容之四在于提供一种重组病毒载体,所述重组病毒载体包括如上述的靶向cd276的嵌合抗原受体car-cd276的编码基因。
38.该重组病毒载体包含靶向cd276的嵌合抗原受体car-cd276的编码基因,该编码基因的核苷酸序列如seq id no:2或seq id no:13所示;
39.如seq id no:13所示的核苷酸序列与如seq id no:2所示的核苷酸序列相比,多了信号肽的编码基因。所述信号肽的编码基因可以较好地指导所述嵌合抗原受体car-cd276表达到细胞表面。
40.优选地,所述靶向cd276的嵌合抗原受体car-cd276的编码基因,包括从5’端到3’端依次连接的cd8α信号肽的编码基因、靶向cd276的单链抗体的编码基因、cd8α胞外铰链区的编码基因、cd8α跨膜区的编码基因和由4-1bb共刺激结构区和cd3ζ信号结构区依次串联构成的胞内信号区的编码基因。
41.进一步优选地,所述car-cd276的氨基酸序列包括如seq id no:14所示的氨基酸序列。
42.进一步优选地,所述cd8α信号肽的编码基因包括如seq id no:15所示的核苷酸序列。
43.进一步优选地,所述cd8α信号肽的氨基酸序列包括如seq id no:16所示的氨基酸序列。
44.进一步优选地,所述靶向cd276的单链抗体的编码基因包括如seq id no:4所示的核苷酸序列、所述cd8α胞外铰链区的编码基因包括如seq id no:6所示的核苷酸序列、所述cd8α跨膜区的编码基因包括如seq id no:8所示的核苷酸序列、所述4-1bb共刺激结构区的编码基因包括如seq id no:10所示的核苷酸序列、所述cd3ζ信号结构区的编码基因包括如seq id no:12所示的核苷酸序列。
45.所述病毒载体为pwpxld慢病毒载体。
46.本发明的内容之五在于提供上述的靶向cd276的嵌合抗原受体、靶向cd276的嵌合抗原受体t细胞或重组病毒载体在制备治疗肝癌的药物中的应用。
47.优选地,该药物对表达cd276的阳性肿瘤细胞杀伤活性强。
48.本发明的目的之六在于提供一种治疗肝细胞癌的药物,该药物包括上述的靶向cd276的嵌合抗原受体、靶向cd276的嵌合抗原受体t细胞或重组病毒载体。
49.当然,所述靶向cd276的嵌合抗原受体t细胞也适用于用于其它高表达cd276的恶性肿瘤的治疗。
50.与现有技术相比,本发明具有以下有益效果:
51.本发明提供了一种靶向cd276的嵌合抗原受体,以及包括靶向cd276的嵌合抗原受体t细胞。靶向cd276的嵌合抗原受体t细胞可以靶向表达cd276的肿瘤细胞,激活t细胞发挥细胞免疫作用,高效且特异性地杀伤cd276阳性肿瘤细胞,更好地维持嵌合抗原受体t细胞的活力和杀伤力,是有潜力的根治肝细胞癌的免疫细胞疗法。
52.本发明公开的靶向cd276的嵌合抗原受体t细胞以4-1bb为共刺激结构区,使得靶向cd276的嵌合抗原受体t细胞在体内具有更长的持久性,有利于记忆表型t细胞的产生,对表达cd276的阳性肿瘤细胞系有强的杀伤活性。本发明经过体外功能测试,靶向cd276的嵌合抗原受体t细胞对cd276阳性肝癌细胞系有杀伤活性。
附图说明
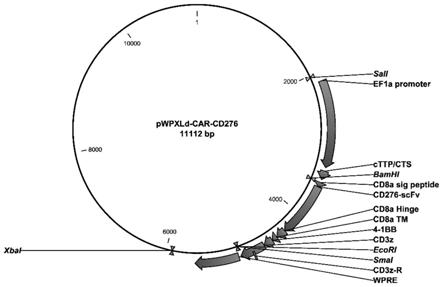
53.图1为pwpxld-car-cd276重组质粒的质粒图谱;
54.图2为靶向cd276的嵌合抗原受体在t细胞表面表达结果图;其中,(a)为utd非转导病毒的t细胞;(b)为car-cd276转导病毒的t细胞;
55.图3为靶向cd276的嵌合抗原受体t细胞对肝细胞癌细胞系huh7的杀伤结果图。
具体实施方式
56.为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
57.需要说明的是,本发明的说明书和权利要求书及上述附图中的术语“第一”、“第二”等是用于区别类似的对象,而不必用于描述特定的顺序或先后次序。应该理解这样使用的数据在适当情况下可以互换,以便这里描述的本发明的实施例能够以除了在这里图示或描述的那些以外的顺序实施。此外,术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或设备不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出的或对于这些过程、方法、产品或设备固有的其它步骤或单元。
58.下面结合附图对本发明做进一步详细描述:
59.一、一种靶向cd276的嵌合抗原受体t细胞的制备方法,包括以下步骤:
60.(1)制备靶向cd276的嵌合抗原受体car-cd276的基因序列
61.靶向cd276的嵌合抗原受体car-cd276结构包括cd8α信号肽、靶向cd276的单链抗体(cd276-scfv)、cd8α铰链区、cd8α跨膜区、4-1bb共刺激结构区和cd3ζ信号结构区的编码
基因,所述信号肽的编码基因如seq id no:15所示,所述靶向cd276的单链抗体的编码基因包括如seq id no:4所示的核苷酸序列、所述cd8α胞外铰链区的编码基因包括如seq id no:6所示的核苷酸序列、所述cd8α跨膜区的编码基因包括如seq id no:8所示的核苷酸序列、所述4-1bb共刺激结构区的编码基因包括如seq id no:10所示的核苷酸序列、所述cd3ζ信号结构区的编码基因包括如seq id no:12所示的核苷酸序列。
62.所述靶向cd276的嵌合抗原受体car-cd276结构由江苏金唯智生物技术有限公司进行基因合成,得到靶向cd276的嵌合抗原受体car-cd276的编码基因,所述car-cd276的编码基因包括如seq id no:13所示的核苷酸序列。
63.(2)构建pwpxld-car-cd276重组质粒
64.将合成的car-cd276的编码基因插入到pwpxld载体的bamh1和ecor1酶切位点之间,然后转入大肠杆菌感受态细胞dh5α,进行阳性克隆pcr鉴定和测序鉴定。如图1所示为pwpxld-car-cd276重组质粒图谱。
65.(3)重组慢病毒构建
66.将pwpxld-car-cd276重组质粒、包装质粒pspax2、包膜质粒pmd2g使用lipofectamine3000转染试剂共转染入培养好的hek293t细胞。第48h收集含病毒的上清,首先2000rpm室温离心5分钟,取上层上清,然后经0.45μm滤膜过滤,得到的重组慢病毒上清用于t细胞感染。
67.(4)靶向cd276的嵌合抗原受体t细胞的制备
68.a)pbmc(外周血单个核细胞)的分离
69.pbmc来源于健康志愿者的自体静脉血。
70.抽取所述健康志愿者血液,使用ficoll收集外周血单个核细胞,离心分离后取中间层细胞;经pbs洗涤计数后得到pbmc。
71.b)免疫磁珠法分离抗原特异性t淋巴细胞
72.取上述pbmc,加入kbm581培养基,配成细胞悬液;按磁珠与细胞的比例为1:1,加入cd3/cd28免疫磁珠,室温下于摇床进行孵育;采用磁铁对孵育磁珠的细胞进行筛选;去除未吸附的细胞悬液后,加入上述kbm581培养基重悬磁珠-细胞混合物得到cd3阳性t淋巴细胞,继续培养24小时后用于慢病毒感染。
73.c)病毒转染法制备抗原特异性t淋巴细胞
74.取上述经过免疫磁珠分离法得到的cd3阳性t淋巴细胞,加入与cd3阳性细胞数相应的所述重组慢病毒进行培养。
75.培养的第3天,收集合适数量的感染慢病毒的t细胞,流式细胞术分析表面car的表达,结果如图2所示,图2中(a)为utd非转导病毒的t细胞,(b)为car-cd276转导病毒的t细胞。使用生物素标记的anti-fab一抗进行染色,然后使用链霉亲和素偶联的apc二抗进行流式分析。图2结果显示,减去utd背景值,car-cd276有26%的表面表达,表明靶向cd276的嵌合抗原受体t细胞制备成功。继续培养48小时,收集靶向cd276的嵌合抗原受体t细胞用于杀伤实验分析或保存在细胞冻存液中,放置于程序降温盒中-80℃保存24小时,然后转移至液氮灌长期保存。
76.二、体外功能测试
77.本发明经过体外功能测试,靶向cd276的嵌合抗原受体t细胞对cd276阳性肝癌细
胞系有杀伤活性。具体方法和结果如下:
78.(1)使用rtca系统分析靶向cd276嵌合抗原受体t细胞对cd276阳性肿瘤细胞系杀伤。
79.首先用50ul dmem培养基进行rtca单板的平衡,然后收集培养好的靶细胞huh7,细胞计数,在每个孔中加入含有5000个huh7细胞的50ul细胞悬液,37℃培养箱中放置15分钟,然后放置在rtca电阻系统中,24小时后,收集靶向cd276的嵌合抗原受体t细胞,细胞计数,按不同的效应细胞与靶细胞的比例(e:t)10:1,5:1,2.5:1把相应细胞数目的嵌合抗原受体t细胞悬液100ul加入到huh7细胞中,设置对照组(control,加培养基组),utd组(加未转导病毒的t细胞),car-t组(加靶向cd276嵌合抗原受体t细胞组),每组设置3个复孔,放入rtca电阻系统中,24小时后进行杀伤活性分析。
80.(2)结果分析
81.使用指定时间点的细胞指数(cell index)进行utd或car-t杀伤率分析。
82.所述utd杀伤率计算公式为:
83.utd杀伤率=(对照组细胞指数值-utd组细胞指数值)/对照组细胞指数值
×
100。
84.所述car-t杀伤率计算公式为:
85.car-t杀伤率=(对照组细胞指数值-car-t组细胞指数值)/对照组细胞指数值
×
100。
86.结果如图3所示显示,car-t与utd组相比,对huh7细胞有更强的杀伤活性(图3)。表明构建的靶向cd276的嵌合抗原受体t细胞对表达cd276的阳性肿瘤细胞系有较强的杀伤活性,预示着所述靶向cd276的嵌合抗原受体t细胞在肝细胞癌的治疗中有较大的应用前景。
87.以上内容仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明权利要求书的保护范围之内。
