一株具有
α-葡萄糖苷酶高抑制活性的短乳杆菌及其应用
技术领域
1.本发明涉及微生物技术领域,更具体地说是涉及一株具有α-葡萄糖苷酶高抑制活性的短乳杆菌。
背景技术:
2.高糖高脂饮食常引起肥胖、高血糖、高血脂等慢性病,严重危害人们健康。国内外科学研究已证实益生菌在缓解和防治高血脂、高血糖等慢性病方面具有显著效果,且相较于传统药物治疗,益生菌对机体无副作用,不会引起并发症。当前认为益生菌调节血糖水平主要作用机理包括:(1)调节肠道微生态平衡,增强肠道黏膜屏障功能;(2)调节机体免疫功能;(3)修复机体氧化损伤;(4)抑制或推迟肠道对葡萄糖的吸收。其中,基于抑制或推迟肠道对葡萄糖的吸收成为体外筛选降糖益生菌的主要依据。食物中的碳水化合物在肠道内主要以单糖的形式被吸收。人体摄入的淀粉等多糖物质被唾液和胰α-淀粉酶降解生成寡糖及二糖后,还需要在肠道α-葡萄糖苷酶的作用下酶解生成葡萄糖后才能被吸收。α-葡萄糖苷酶抑制剂主要通过可逆性竞争α-葡萄糖苷酶与糖的结合位点,限制或延缓碳水化合物在肠内的分解和吸收,有效推迟并减轻糖尿病人餐后血糖升高的时间及进程,进而发挥降糖作用。另外,有文献报道体外抗氧化活性较高的活性成分不仅具有较高的体内自由基清除能力,而且还能提高小鼠体内的超氧化物歧化酶的酶活,改善肝内的糖代谢紊乱,提高小鼠的肝糖原代谢水平,降低血糖值,即其抗氧化活性与与降血糖活性具有一定的相关性。
3.虽然目前已经分别筛选了多株具有α-糖苷酶抑制活性的乳酸菌,但是,尚未见到具有α-糖苷酶抑制活性短乳杆菌的报道。
4.因此,如何提供一种具有抑制α-糖苷酶活性功能的短乳杆菌并对其进行应用是本领域技术人员亟需解决的问题。
技术实现要素:
5.有鉴于此,本发明提供了一株具有α-葡萄糖苷酶高抑制活性的短乳杆菌,该菌株可以有效抑制α-糖苷酶活性,进而抑制葡萄糖的生成及肠道对葡萄糖的吸收,以达到降糖的效果。
6.为了实现上述目的,本发明采用如下技术方案:
7.一株具有α-葡萄糖苷酶高抑制活性的短乳杆菌,所述菌株为短乳杆菌(lactobacillus brevis)117-3,于2021年09月01日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.23335,保藏地址为北京市朝阳区北辰西路1号院3号,分类命名为短乳杆菌lactobacillus brevis。
8.所述的具有α-葡萄糖苷酶高抑制活性的短乳杆菌在制备具有辅助降血糖和降血脂功能食品中的应用。
9.经由上述技术方案可知,本发明记载的短乳杆菌菌株具备α-葡萄糖苷酶高抑制活性,细胞表面疏水性51.65%,自聚合达75%,可以和食源性肠道病原菌共聚合,可以在
caco-2细胞表面粘附,表明该菌株在肠道中定殖能力强。该菌株还具有良好的降胆固醇能力,体外实验表明,其胆固醇吸收率为23.51%(13.77
±
0.46mg/l),并具有较强的abts+和dpph清除能力。本菌株可用于制备各种调节血糖血脂的食品、保健品、食品添加剂或药品。
附图说明
10.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
11.图1附图为菌株117-3的菌落形态图;
12.图2附图为菌株117-3的革兰氏染色镜检图;
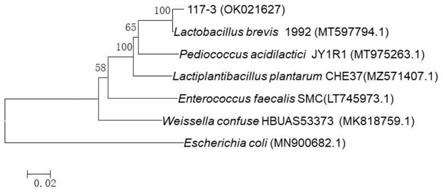
13.图3附图为菌株117-3的系统发育树。
具体实施方式
14.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
15.本发明实施例公开了一种具有α-糖苷酶高抑制活性的短乳杆菌(lactobacillus brevis)117-3,于2021年09月01日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.23335,保藏地址为北京市朝阳区北辰西路1号院3号,分类命名为短乳杆菌lactobacillus brevis。
16.以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。
17.实施例1菌株117-3的分离与鉴定
18.(1)菌株分离纯化:取陕西西安地区手工发酵蔬菜0.5g,用无菌剪刀将样品剪成0.3
×
0.3cm小块,加入10ml无菌生理盐水涡旋振荡3min梯度稀释至10-7
,分别吸取10
-4
~10
-7
稀释液100μl涂布于加有2%碳酸钙的mrs固体培养基上,37℃静置培养48h,见图1;挑取有溶钙圈的菌落,在mrs固体培养基上划线纯化革兰氏染色并在显微镜下观察,见图2;选取革兰氏染色阳性且显微形态为杆状的菌株,25%甘油,-80℃冷冻保存备用。
19.(2)菌株鉴定:使用细菌基因组提取试剂盒(takara minibest bacterial genomic dna extraction kit ver2.0)提取菌株117-3的dna,使用细菌16s rdna通用引物进行pcr扩增:上游引物27f:agag tttg atcm tggc tcag;下游引物1492r:ggtt acct tgtt acga ctt。pcr扩增反应体系(50μl):5.0μl10
×
taq酶缓冲液,0.4μmol/l引物,4μl 200mmol/l dntp,40ng dna模板,1u taq酶(takara),34μl ddh2o。
20.pcr反应按下述程序进行扩增:95℃预变性5min;95℃变性30s,55℃退火1min,72℃延伸1min,35个循环;最后72℃延伸5min。反应在bio-rad pcr仪上进行,并通过l%琼脂糖凝胶电泳检测16s rdna扩增片段,送交深圳华大基因科技有限公司进行测序。将测序结果与genbank中序列进行blast比对,结果表明本发明菌株16s rdna基因序列(如seq id no.1所示)与lactobacillus brevis 1992(ok021627)基因序列相似度最高,为98.72%,用
mega-x软件构建系统进化树(图1),可知该菌株为短乳杆菌(lactobacillus brevis),于2021年9月1日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为北京市朝阳区北辰西路1号院3号,保藏编号为:cgmcc no.23335;分类学命名为:短乳杆菌lactobacillus brevis。
21.实施例2:菌株117-3的胃肠模拟存活性能
22.模拟胃液配制:用灭菌后的生理盐水(0.85%)将胃蛋白酶(p7000)配制成浓度为3g/l的胃蛋白酶溶液,用4mol/l盐酸溶液调节ph值至2.0,而后经0.22μm微孔滤膜过滤除菌后备用。
23.模拟肠液配制:用灭菌后的生理盐水(0.5%)将胰蛋白酶(usp(p7545))配制成浓度为1mg/ml溶液,加入0.3%的牛胆盐,并用1mol/l氢氧化钠调节ph值至8.0,而后经0.22μm微孔滤膜过滤除菌后备用。
[0024]-80℃冷冻保藏的乳酸菌菌株连续活化两代,以1%(v/v)接种量接种于mrs液体培养基中,37℃静置培养18h,离心收集菌体(8000
×
g at4℃for 10min),pbs重悬,将菌体浓度调整至109cfu/ml。取1ml上述菌悬液加入9ml人工胃液,37℃静置培养1h;上述混合液离心(8000g,4℃,10min)去除上清后重悬于10ml的肠道模拟液,37℃静置培养2h;离心(条件同上)弃上清,用0.85%灭菌生理盐水连续稀释后mrs平板涂布计数,未经胃肠模拟液处理的初始活菌数记为n0,处理后活菌数计做n
t
,每组三个平行,存活率计算公式如下:
[0025]
存活率%=(log cfu/mln
t
)
×
(log cfu/mln0)
×
100
[0026]
结果表明,菌株117-3在ph2.0的模拟胃液中孵育1h后,存活率接近100%,说明本发明菌株对酸和胃蛋白酶均具有较强的耐受能力,可以在模拟胃液环境中存活;经模拟胃液后,菌株117-3在模拟肠液中继续孵育2h后的存活率仍达到95%以上,说明该菌株可以耐受肠道的高胆盐环境,并具有胰蛋白酶耐受能力,经过胃肠消化系统后仍具有较高存活率。见表1;
[0027]
表1
[0028][0029]
实施例3:细胞表面黏附特性
[0030]
(1)细胞疏水性:-80℃冷冻保藏的乳酸菌菌株连续活化两代,以1%(v/v)接种量接种于mrs液体培养基中,37℃静置培养18h,离心(8000g,4℃,10min)收集菌体;使用pbs(ph7.4)洗涤2次后重悬于pbs中,调整od
600
至0.4
±
0.02,标记为a0。3ml上述细胞菌悬液与1ml氯仿混合,涡旋振荡30s,混匀后37℃静置于30min。取上层水相,测定600nm下的吸光值标记为a
t
。
[0031]
表面疏水性(a%)计算公式:a%=(a
0-a
t
)/a0×
100%,
[0032]
(2)自聚合能力:-80℃冷冻保藏的乳酸菌菌株连续活化两代,以1%(v/v)接种量接种于mrs液体培养基中,离心收集菌体(8000g,4℃,10min);pbs(ph7.4)洗涤2次后于pbs
中重悬,调整菌液浓度至108cfu/ml,取50ul的菌悬液,加入到150ul的pbs中混匀,测定600nm下的吸光值,记做a0;4ml等量的细胞菌悬液装入5ml的离心管中,混匀后37℃静置6h。取50ul的上部菌悬液,加入到150ul的pbs中混匀,测定600nm下的吸光值,记做a
t
。
[0033]
凝集率(a%)计算公式:a%=(a
0-a
t
)/a0×
100%(3)共聚合能力:乳酸菌在mrs培养基中培养24h,离心收集菌体(4500
×
g,15min),使用pbs(ph7.4)洗涤2次后于pbs中重悬,将菌数调整为108cfu/ml。同时,致病菌采用同样的方法,重悬于pbs中,并且调整菌数为108cfu/ml。分别吸取2ml待测菌菌悬液和致病菌菌悬液于试管中,漩涡震荡10s混匀,37℃培养4h,每次取50ul的上部菌悬液,加入到150ul的pbs中测定其在波长为600nm下的吸光值。
[0034]
a%=(a
0-a
4h
)/a0×
100%,其中,a0为初始时间时600nm下的吸光度;a
4h
为反应4h后的吸光光度值。
[0035]
(3)小肠细胞caco-2粘附实验:高糖dmem培养液(hyclone,usa),额外添加10%的胎牛血清,1%的非必须氨基酸,1%的青-链霉素(10000iu/ml,10000ug/ml)配制dmem完全培养基。将自液氮罐中取出的caco-2细胞冻存管,立即放入37℃水槽中快速解冻,解冻后的细胞悬液缓缓加入细胞培养皿,再向培养皿中加入10mldmem完全培养基,混合均匀,放入37℃,5%co2的恒温培养箱中培养。2~3天后,待细胞覆盖培养皿的80%~90%,胰蛋白酶消化传代。传代三次后,细胞转接到24孔培养板上,每孔接种量达到105个,37℃,5%co2的恒温培养箱中培养21天每两天更换培养液,得到分化的单层caco-2细胞。粘附实验4小时前将培养液替换成dmem培养基(添加10%的胎牛血清,1%的非必须氨基酸)每孔加入1ml重悬于无双抗的dmem培养液的117-3菌悬液((1
×
108cfu/ml))37℃,5%二氧化碳条件下培养1h,之后用预热的dpbs(ph7.2,无ca
+
和mg
+
);procell)冲洗两遍,洗去未吸附的细菌细胞。再用含1%(v/v)tritonx-100的dpbs溶解吸附的细胞10min。收集菌体,平板计数法计算117-3对caco-2细胞的吸附率;见表2;
[0036]
吸附率%=吸附的活菌数/加入的活菌数
×
100%
[0037]
表2
[0038][0039]
结果如上表所示,短乳杆菌117-3的疏水性为51.65%,其自聚集率达到75.98%,对caco-2细胞的吸附率为3.03%。以上数据表明,本发明菌株具有良好的细胞表面粘附特性,在肠道中有较好的粘附定殖潜力。
[0040]
实施例4:降糖降脂清除自由基能力
[0041]-80℃冷冻保藏的乳酸菌菌株连续活化两代,以1%(v/v)接种量接种于mrs液体培养基中,37℃静置培养18h。离心(8000g,4℃,10min)得到培养液上清和菌体沉淀。上清液经0.22μm滤膜过滤后即为菌株发酵上清液(cfs);菌体用pbs(ph7.4)洗涤2次后重悬于pbs中,调整菌体浓度至1
×
109ceu/ml分成两份,一份4℃保存备用即为菌悬液(ic)。另一份超声破
碎(工作3s、间隔8s、800w,超声破碎15min),12000rpm,4℃离心10min,收集上清液,经0.22μm滤膜过滤后即为细胞破碎物上清液(cfe)。
[0042]
(1)α-葡萄糖苷酶抑制活性测定:在96孔板210μl的反应体系中,依次加入50μl浓度为0.1mol/lpbs溶液(ph6.8)、50μl浓度为20mmol/lpnpg溶液(α-葡萄糖苷酶底物)和30μl样品溶液(30μl 0.1mol/l,ph6.8 pbs溶液作为空白对照),37℃孵育10min。然后加入30μl浓度为0.4u/ml的α-葡萄糖苷酶溶液或等体积的pbs溶液(0.1mol/l,ph6.8)作为空白对照,37℃继续反应30min,最后加入50μl浓度为1mol/l的na2co3溶液终止反应。反应完成后,采用酶标仪(bio)测定od
405
,并按如下公式计算α-葡萄糖苷酶抑制率(%)。
[0043]
α-葡萄糖苷酶抑制率(%)=[1-a/b]*100%
[0044]
公式中:a为样品组,含有样品溶液和α-葡萄糖苷酶溶液;
[0045]
b为对照组,不含样品溶液(含与样品溶液等体积的pbs溶液),含α-葡萄糖苷酶溶液;
[0046]
结果见表3;菌株117-3细胞发酵液上清对α-葡萄糖苷酶的抑制率高达84.01%,细胞和细胞破碎液也对α-葡萄糖苷酶具有一定的抑制作用,抑制率分别为8.01%和10.77%。
[0047]
表3
[0048][0049]
用同样的方法测定其他几株短乳杆菌对α-葡萄糖苷酶的抑制作用,结果见表4;
[0050]
表4
[0051][0052]
(2)降胆固醇能力测定:mrs-cho液体培养基的制备:称量0.1g胆固醇、0.2g牛胆盐、0.1g蔗糖酯,加入1ml吐温-80中,搅拌均匀,加入5ml冰乙酸60℃加热溶解,溶解液经超声处理(130w,20khz;60%超声破碎20个循环,每个循环8次,超声2s,间歇3s)后得到胆固醇胶束溶液。新鲜的mrs肉汤培养基,添加0.3%的牛胆粉以及胆固醇胶束(0.1g/l滤器除菌)按照1%的接种量接入益生菌,37℃静置培养18h。10000rpm离心15min去除菌体,1ml上清与1mlkoh(33%w/v)2ml96%乙醇混匀,涡旋振荡2min,60℃水浴15min室温冷却,加入2ml蒸馏
水,3ml正己烷,涡旋振荡1min。1ml的正己烷分层被迅速转入玻璃管中,80℃水浴中蒸发,残留物被迅速溶解于2ml邻苯二醛中,再加入0.5ml浓硫酸,涡旋振荡1min上述混合物室温中反应30min,测定550nm的吸光值。用等体积无菌水替代乳酸菌完成上述反应步骤,作为空白。胆固醇清除率=[1-a
550
sample/a
550
blank]
×
100%,见表5;
[0053]
表5
[0054]
菌株胆固醇吸收率(%)吸收量(mg/l)117-323.51
±
0.8313.77
±
0.46mg/l
[0055]
本发明菌株胆固醇吸收率为23.51%,吸收量13.77
±
0.46mg/l,表明本发明菌株具有良好的胆固醇吸收能力。
[0056]
(3)自由基去除率:1ml的ic/cfs/cfe和1ml的dpph溶液(溶于甲醇,浓度0.2mm)混合,涡旋振荡30s充分混合后,室温避光放置30min。1ml的去离子水与1ml的dpph溶液混合,与样品同样操作,作为空白。记录od
517
的吸光值。自由基清除率=[1-a
517
sample/a
517
blank]
×
100%;见表6;
[0057]
表6
[0058][0059]
(4)阳离子去除率:20μl的ic/cfs/cfe和2ml的abts+工作液混合,涡旋振荡30s充分混合后,室温放置6min。用20ul去离子水替代步骤4中的样品作为空白,紫外分光光度计测量734nm的吸光值。阳离子清除率=[1-a
734
sample/a
734
bl ank]
×
100%。
[0060]
表7
[0061][0062]
实施例5抗生素抗性特征
[0063]
将已活化的菌株117-3接种于mrs液体培养基中,37℃静置培养18h,采用混菌法将菌液加入mrs固体培养基中,终浓度为1
×
105cfu/ml,20ml/板。采用纸片琼脂扩散法(k-b法),用无菌镊子将药敏纸片均匀放置在平板上,37℃静置培养24h后,记录各药敏纸片的抑菌圈直径大小,参照美国临床和实验室标准协会(clsi)国际标准中对抗菌药物敏感性的最小抑菌圈直径大小来判定菌株的药敏性。见表8;
[0064]
表8
[0065][0066]
判定标准(抗性r/敏感s,mm):万古霉素(≥17/≤14),卡那霉素(≥18/≤12),四环素(≥19/≤14),放线菌素(≥15/≤12),红霉素(≥23/≤13)。
[0067]
本发明菌株117-3对万古霉素、放线菌素、卡那霉素、四环素耐药,表明该菌株可以和以上抗生素共同使用;对红霉素敏感,表明该菌株可以被安全使用。
[0068]
综上,本发明提供的短乳杆菌lactobacillus brevis117-3,可以耐受胃肠极端环境,具有良好的表面黏附特性,在肠道中定殖能力强,并具有良好的α-糖苷酶抑制活性、降胆固醇能力和抗氧化活性,抗生素抗性特征明确,可用于制备调节血糖血脂及肠道菌群的功能食品、保健品和药品。
[0069]
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
[0070]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
