一种深海细菌来源的
α-葡萄糖苷酶qsgh13及其编码基因与应用
技术领域
1.本发明涉及一种α-葡萄糖苷酶,具体涉及一种深海细菌来源的α-葡萄糖苷酶qsgh13及其编码基因与应用,属于基因工程技术领域。
背景技术:
2.α-葡萄糖苷酶(α-glucosidases或α-d-glucoside glucohydrolase)(α-葡萄糖苷水解酶,葡萄糖基转移酶),它能将多糖的非还原末端的α-1,4-糖苷键切开,并水解释放出α-d-葡萄糖(水解作用),或将游离的葡萄糖残基与低聚糖中的α-1,4-糖苷键结合生成α-1,6-糖苷键(转糖苷作用),从而得到非发酵型的低聚糖。α-葡萄糖苷酶种类繁多,广泛分布于所有的生命体内,由于不同生命体生存的环境不同,导致不同来源的α-葡萄糖苷酶理化特征、生理功能各不相同。α-葡萄糖苷酶在临床检测、疾病的预防与治疗、生命体的代谢机理研究、酒精发酵、糖类水解以及化学合成等化工领域应用广泛。
3.微生物产生的α-葡萄糖苷酶种类多,不同来源的α-葡萄糖苷酶具有多方面不同性质,从而导致各具特色的应用范围。因而需要持续不断地开发新特性α-葡萄糖苷酶以更好的满足工业需要。海洋来源的α-葡萄糖苷酶通常具有与海洋环境相关的优良性质,例如温度稳定性、耐盐性、耐碱性、耐低温、以及优异的手性选择性等。因此,从海洋微生物中筛选出独具特性的α-葡萄糖苷酶就成为开发新型工业酶制剂的一个重要方向。宏基因组技术可从海洋环境中直接获取酶资源而不依赖于海洋微生物菌株的培养,已成为海洋糖苷酶获取的重要手段。
技术实现要素:
4.本发明的目的是为克服上述现有技术的不足,提供一种深海细菌来源的α-葡萄糖苷酶qsgh13及其编码基因与应用。
5.为实现上述目的,本发明采用下述技术方案:
6.1、α-葡萄糖苷酶qsgh13的编码基因,所述基因具有以下任意一种核苷酸序列:
7.(1)与seq id no.1所示序列一致;
8.(2)对seq id no.1所示序列进行取代、添加和/或缺失一个或两个以上核苷酸但能获得编码保留α-葡萄糖苷酶qsgh13蛋白生物学特性的突变基因。
9.优选的,所述突变基因至少与seq id no.1所示序列具有90%以上的同源性。
10.进一步优选的,所述突变基因至少与seq id no.1所示序列具有95%以上的同源性。
11.更进一步优选的,所述突变基因至少与seq id no.1所示序列具有99%以上的同源性。
12.2、携带上述编码基因的载体。
13.3、利用上述载体转化或转染原核生物或真核生物宿主。
14.优选的,宿主包括细菌、真菌或哺乳动物细胞。
15.进一步优选的,宿主为大肠杆菌、酿酒酵母或裸鼠卵巢细胞。
16.更进一步优选的,宿主为大肠杆菌。
17.4、经上述编码基因表达得到的α-葡萄糖苷酶qsgh13,其氨基酸序列如seq id no.2所示;或者对seq id no.2所示的序列,远离活性位点d202(202位天冬氨酸残基),e266(266位谷氨酸残基),d329(329位天冬氨酸残基)位置的氨基酸序列进行各种取代、添加和/或缺失一个或几个氨基酸获得具有α-葡萄糖苷酶qsgh13活性的衍生蛋白质。
18.优选的,所述衍生蛋白质至少与seq id no.2所示的氨基酸序列具有90%以上的同源性。
19.进一步优选的,所述衍生蛋白质至少与seq id no.2所示的氨基酸序列具有95%以上的同源性。
20.更进一步优选的,所述衍生蛋白质至少与seq id no.2所示的氨基酸序列具有99%以上的同源性。
21.5、上述载体、宿主或α-葡萄糖苷酶qsgh13在催化糖类水解或转糖苷中的应用。
22.优选的,所述的糖类含有α-1,4-糖苷键。
23.进一步优选的,所述α-1,4-糖苷键是多糖的非还原末端的α-1,4-糖苷键。
24.更进一步优选的,能够水解多糖的非还原末端的α-1,4-糖苷键或将游离的葡萄糖残基与低聚糖中的α-1,4-糖苷键结合生成α-1,6-糖苷键。
25.本发明的有益效果:
26.本发明涉及一种来源于新型深海细菌qipengyuania seohaensis sp.sw-135的α-葡萄糖苷酶qsgh13及其编码基因与应用,从太平洋海山深海沉积物宏基因组文库中筛选获得新的α-葡萄糖苷酶基因,发现了该基因编码蛋白具有优良的酶学特性,耐盐、耐碱。本发明获得的α-葡萄糖苷酶基因可克隆到合适的宿主中实现可溶性高效表达,实现工业化生产α-葡萄糖苷酶,为后续的工业应用提供成本低廉的α-葡萄糖苷酶原始材料。该酶在临床检测、疾病的预防与治疗、生命体的代谢机理研究,以及酒精发酵、糖类水解、化学合成等化工领域应用广泛,具有重要的经济和社会价值。
27.本发明通过特异性底物(α-d-吡喃葡萄糖苷)筛选获得一种新的α-葡萄糖苷酶基因qsgh13,经pcr、酶切、克隆和测序,α-葡萄糖苷酶基因qsgh13的核苷酸序列如seq id no.1所示。α-葡萄糖苷酶基因qsgh13大小为1587bp,碱基组成为:308a(19.41%)、283t(17.83%)、534c(33.65%)和462g(29.11%),编码蛋白含528个氨基酸残基,其氨基酸序列如seq id no.2所示,获得的α-葡萄糖苷酶qsgh13表达量高、可溶性好、酶学活性高,当底物为α-d-吡喃葡萄糖苷时催化活性最高,酶活vmax达25.14u/mg,米氏常数km为0.2952mm。
28.qsgh13在ph 8.0-ph 11.0条件下,能够保持80%以上的活性,非常耐碱。此外,在添加大部分金属离子的反应体系中仍保持较高活性,特别是在na
+
、mg
2+
条件下,酶学活性增大。而且,在低浓度有机溶剂中也可以保持较高活性。该α-葡萄糖苷酶酶学活性高,耐盐、耐碱,成本低廉,在临床检测、疾病的预防与治疗、生命体的代谢机理研究,以及酒精发酵,糖类水解、化学合成等化工领域应用广泛。
29.将该基因序列在genbank中进行同源搜索,与之相似性最高的α-葡萄糖苷酶来源于bacteria;proteobacteria;alphaproteobacteria;sphingomonadales;
erythrobacteraceae;erythrobacter/porphyrobacter group;erythrobacter;unclassified erythrobacter,相似性为79%(其在genbank数据库中的注册号为mba4765397.1)。系统发育分析结果表明,α-葡萄糖苷酶qsgh13属于糖苷酶家族中的gh13家族。氨基酸多序列比对分析结果显示,α-葡萄糖苷酶qsgh13具有d202(202位天冬氨酸残基),e266(266位谷氨酸残基),d329(329位天冬氨酸残基)组成的催化活性中心。综上所述,qsgh13应为α-葡萄糖苷酶家族中的一名新成员。
30.在不影响α-葡萄糖苷酶qsgh13蛋白活性前提下,可对seq id no:2所示的活性中心氨基酸d202、e266、d329等进行各种氨基酸替换、增添和/或缺失一个或几个氨基酸获得具有α-葡萄糖苷酶qsgh13活性的衍生蛋白质。一般来说,蛋白质的生物学活性和其功能结构域密切相关的。只有发生在功能结构域的位点突变可能对蛋白质的二级和三级结构产生影响,从而影响其生物学活性。而对于非功能结构域的氨基酸位点突变,并不会对蛋白质的生物学活性产生实质性影响,从而能够基本保留原蛋白质的生物学功能。
31.利用分子克隆技术,将α-葡萄糖苷酶qsgh13基因全长1587bp连接到psmt3(+)载体上(li,j.et al.(2012).the rip1/rip3 necrosome forms a functional amyloid signaling complex required for programmed necrosis.cell 150(2),339-350.),使用cacl2法转化到大肠杆菌bl21(de3)plus高效表达融合蛋白α-葡萄糖苷酶qsgh13。本发明优先选择了使用大肠杆菌的原核细胞表达系统(但不排除其他的表达系统,如真核生物宿主包括酵母(如酿酒酵母)及哺乳动物细胞(如裸鼠卵巢细胞)等)。
32.将本发明筛选到的α-葡萄糖苷酶基因qsgh13通过pcr扩增后,并利用bamhi和saci酶切位点连接到可溶性表达载体psmt3(+)上,使用cacl2法转化到大肠杆菌bl21(de3)plus中,转接重组表达菌株于含有50μg/ml卡那霉素和34μg/ml氯霉素的lb液体培养基中,37℃,200rpm/min振荡培养至od
600
达到0.8时加入终浓度为0.5mm的iptg进行诱导表达,16℃,200rpm/min振荡培养20小时后通过5,000rpm/min离心收集细菌,将离心收集的可溶性表达菌以适量缓冲液(50mm tris,ph 8.0;500mm nacl;1%(v/v)甘油;10mm咪唑;1mmβ-me;0.2mm pmsf)悬菌,使用超声破碎仪裂解菌体,以12,000rpm/min高速离心20分钟去除沉淀。将离心后上清液与ni-nta亲和介质结合后,用50mm tris,ph 8.0;500mm nacl;1%(v/v)甘油;50mm咪唑;1mmβ-me的缓冲液冲洗介质,去除杂蛋白。最终用50mm tris,ph 8.0;500mm nacl;1%(v/v)甘油;250mm咪唑;1mmβ-me的洗脱液将目的蛋白从亲和介质上洗脱下来,以50kda截留的浓缩管将洗脱液浓缩。将浓缩后的蛋白溶液进一步用凝胶过滤层析(superdex200,16/600)的方法纯化,使用的缓冲液为20mm tris,ph 7.4;100mm nacl;2mm dtt。得到高活性的α-葡萄糖苷酶。通过糖苷酶活力测定表明,α-葡萄糖苷酶qsgh13或上述能表达α-葡萄糖苷酶qsgh13的宿主菌可用于水解α-葡萄糖苷。
33.α-葡萄糖苷酶qsgh13催化水解温度范围为4℃-60℃,优选温度为40℃-55℃(维持80%以上活性);所述水解的ph值为ph 6.0-ph 13.0,优选为ph 8.0-ph 11.0(80%)。在添加na
+
或mg
2+
金属离子条件下,酶学活性增大;对有机溶剂,nacl有较高的耐受性。
附图说明
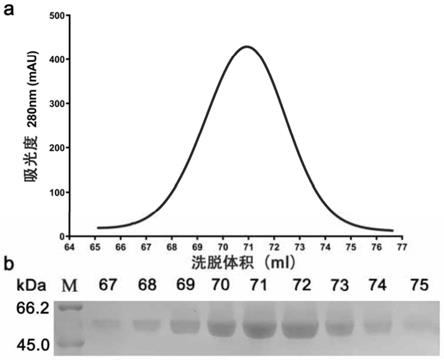
34.图1为α-葡萄糖苷酶qsgh13的十二烷基磺酸钠-聚丙烯酰胺凝胶电泳分析图。
35.图2为α-葡萄糖苷酶qsgh13的底物特异性图。对硝基苯酚-β-d-纤维二糖苷(g1),
对硝基苯酚-β-d-乳糖苷(g2),对硝基苯酚-α-d-葡萄糖苷(g3),对硝基苯酚-β-d-葡萄糖苷(g4),对硝基苯酚-α-d-半乳糖苷(g5),对硝基苯酚-β-d-半乳糖苷(g6),对硝基苯酚-β-d-甘露糖苷(g7),对硝基苯酚-β-d-木糖苷(g8),对硝基苯酚-α-l-阿拉伯吡喃糖苷(g9),定义底物为对硝基苯酚-α-d-葡萄糖苷时测定值为100%。
36.图3为α-葡萄糖苷酶qsgh13最适反应温度图。
37.图4为α-葡萄糖苷酶qsgh13最适反应ph图。
38.图5为金属阳离子对α-葡萄糖苷酶qsgh13活性影响图。
39.图6为有机溶剂对α-葡萄糖苷酶qsgh13活性影响图。
40.图7为去垢剂对α-葡萄糖苷酶qsgh13活性影响图。
41.图8为α-葡萄糖苷酶qsgh13对nacl的耐受性图。
具体实施方式
42.下面结合附图和实施例对本发明进行进一步的阐述,应该说明的是,下述说明仅是为了解释本发明,并不对其内容进行限定。
43.实施例1
44.α-葡萄糖苷酶qsgh13基因qsgh13的获取
45.深海沉积物样品于2008年由深海可视多管取样器采集自太平洋海山边缘。宏基因组文库由合作单位国家海洋局第二海洋研究所提供。
46.针对目的片段的序列,基于ncbi orf finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)分析获得目的片段中开放阅读框信息,通过blastx(http://blast.ncbi.nlm.nih.gov/)比对序列与数据库中已知糖苷酶基因序列的同源性。经数据库比对分析获得qsgh13基因,大小为1587bp,碱基组成为:308a(19.41%)、283t(17.83%)、534c(33.65%)和462g(29.11%),其核苷酸序列如seq id no.1所示。编码蛋白含528个氨基酸残基,其氨基酸序列如seq id no.2所示。将该基因序列在genbank中进行同源搜索,而与之相似性最高的α-葡萄糖苷酶来源于赤杆菌属的未知菌种,相似性为79%(其在genbank数据库中的注册号为mba4765397.1)。
47.系统发育分析结果表明,α-葡萄糖苷酶qsgh13属于糖苷酶家族中的gh13家族。氨基酸序列分析结果显示,α-葡萄糖苷酶qsgh13具有d202(202位天冬氨酸残基),e266(266位谷氨酸残基),d329(329位天冬氨酸残基)组成的催化活性中心。综上所述,qsgh13应为α-葡萄糖苷酶家族中的一名新成员。
48.实施例2
49.α-葡萄糖苷酶基因qsgh13的重组表达质粒和重组菌株的构建
50.将本发明获得的α-葡萄糖苷酶基因qsgh13克隆到表达载体上,构建重组表达菌株。基于ncbi orf finder的orf分析获得的α-葡萄糖苷酶基因的开放阅读框序列,设计引物用于扩增α-葡萄糖苷酶基因。引物包括:
51.上游引物qsgh13 f(forward):5
’‑
ggcggatccatgagcggcaagctgccttg-3’,如seq id no.3所示;
52.下游引物qsgh13 r(reverse):5
’‑
gcggagctctcatgtgtcggtctccaggatga-3’,如seq id no.4所示。
53.进行pcr扩增获得dna片段,采用双酶切的方法构建表达质粒。即用bamhi和saci对pcr产物及质粒psmt3分别进行双酶切,用dna连接酶进行连接,采用cacl2转化法转化连接产物至e.coli dh5α(thermo fisher scientific,美国)中,卡那霉素抗性筛选阳性克隆。采用质粒抽提试剂盒(axygen,美国)提取阳性克隆的质粒,经bamhi和saci双酶切鉴定,获得1587bp的dna片段,经测序鉴定为α-葡萄糖苷酶基因qsgh13。将重组表达质粒转化到e.coli bl21(de3)plus表达菌株中,通过抗性筛选获得重组表达菌株。
54.实施例3
55.重组蛋白α-葡萄糖苷酶qsgh13的表达
56.将预培养的5ml重组表达菌株转接到1000ml含有50mg/ml卡那霉素和34mg/ml氯霉素的lb液体培养基中,37℃,200rpm/min振荡培养至od
600
达到0.8时加入终浓度为0.5mm的iptg进行诱导表达,16℃,200rpm/min振荡培养20小时后通过5,000rpm/min离心收集细菌,将离心收集的菌体重悬于适量缓冲液(50mm tris(三羟甲基氨基甲烷),ph 8.0;500mm nacl;1%(v/v)甘油;10mm咪唑;1mmβ-me(β-巯基乙醇);0.2mm pmsf(苯甲基磺酰氟)),在冰上使用超声破碎仪裂解菌体,4℃,12,000rpm/min高速离心20分钟去除沉淀。采用ni-nta亲和层析进行蛋白纯化。所表达的重组蛋白n端含有6
×
his标签,可亲和吸附到层析柱上,经过不同浓度的咪唑溶液梯度洗脱(用50mm tris,ph 8.0;500mm nacl;1%(v/v)甘油;50mm咪唑;1mmβ-me的缓冲液冲洗介质,去除杂蛋白;最终用50mm tris,ph 8.0;500mm nacl;1%(v/v)甘油;250mm咪唑;1mmβ-me的洗脱液将目的蛋白从亲和介质上洗脱下来),收集洗脱液,以50kda截留的浓缩管将洗脱液浓缩。将浓缩后的蛋白溶液进一步用凝胶过滤层析(superdex200,16/600)的方法纯化,使用的缓冲液为20mm tris,ph 7.4;100mm nacl;2mm dtt。将洗脱下来的目的蛋白进行浓缩至浓度为15-30mg/ml,经sds-page检测,得到α-葡萄糖苷酶蛋白qsgh13,分子量约59.3kda,与预测值一致(图1,其中,a为蛋白qsgh13经凝胶过滤层析(superdex20016/600)纯化的紫外吸收图谱,横坐标对应洗脱体积;b为对应体积的蛋白凝胶电泳图)。
57.实施例4
58.重组蛋白α-葡萄糖苷酶qsgh13的酶动力学检测
59.利用对硝基苯酚法测定纯化的重组蛋白α-葡萄糖苷酶qsgh13的活性。具体操作:100μl20mm甘氨酸-氢氧化钠缓冲液(ph 10.0)反应体系中分别含0.025mm,0.125mm,0.25mm,0.50mm,1.0mm,2.0mm的对硝基苯酚-α-d-葡萄糖苷,加入1.84μg蛋白qsgh13,采用酶标仪(thermo scientific multiskan fc,美国)于45℃条件下连续测定吸光值od
405 2分钟,使用失活的酶液作为对照用于调零。用软件graphpad对数据进行拟合,获得的α-葡萄糖苷酶活性为25.41u/mg,米氏常数km为0.2952mm。一个酶活力单位定义为每分钟从对硝基苯酚-α-d-葡萄糖苷催化产生lμmol对硝基苯酚所需要的酶量。
60.实施例5
61.重组蛋白α-葡萄糖苷酶qsgh13底物特异性分析
62.α-葡萄糖苷酶qsgh13的底物特异性分析同样采用100μl体系,含:20mm甘氨酸-氢氧化钠缓冲液(ph 10.0),1mm底物,1.84μg蛋白qsgh13,在45℃下连续测定吸光值od
405 2分钟。测定采用的底物为:对硝基苯酚-β-d-纤维二糖苷(g1),对硝基苯酚-β-d-乳糖苷(g2),对硝基苯酚-α-d-葡萄糖苷(g3),对硝基苯酚-β-d-葡萄糖苷(g4),对硝基苯酚-α-d-半乳糖
苷(g5),对硝基苯酚-β-d-半乳糖苷(g6),对硝基苯酚-β-d-甘露糖苷(g7),对硝基苯酚-β-d-木糖苷(g8),对硝基苯酚-α-l-阿拉伯吡喃糖苷(g9)(图2)。结果表明,α-葡萄糖苷酶qsgh13只对对硝基苯酚-α-d-葡萄糖苷具有催化活性,说明qsgh13能够特异性地将多糖的非还原末端的α-1,4-糖苷键切开,并水解底物释放葡萄糖。
63.实施例6
64.重组蛋白α-葡萄糖苷酶qsgh13最适反应条件分析
65.α-葡萄糖苷酶qsgh13最适反应温度在4℃-70℃范围内测定,同样采用100μl体系,含:20mm甘氨酸-氢氧化钠缓冲液(ph 10.0),1mm对硝基苯酚-α-d-葡萄糖苷,1.84μg蛋白qsgh13,分别在4℃、20℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃、70℃条件下连续测定吸光值od
405 2分钟。测定结果表明qsgh13的反应温度范围为4℃-70℃,最适反应温度为45℃,在温度40-55℃范围内具有80%以上的活性(图3)。
66.α-葡萄糖苷酶qsgh13最适反应ph在ph 3.0-ph 13.0范围内测定。具体操作为:在100μl不同ph缓冲体系中加入1mm对硝基苯酚-α-d-葡萄糖苷,1.84μg蛋白qsgh13,在45℃下连续测定吸光值od
405 2分钟。测定使用的缓冲液为:20mm柠檬酸-柠檬酸钠缓冲液(ph3.0-ph 6.0),20mm磷酸盐缓冲液(ph 6.0-ph 8.0),20mm tris-盐酸缓冲液(ph 8.0-ph 9.0)和20mm甘氨酸-氢氧化钠缓冲液(ph 9-ph 13.0)。测定结果表明,α-葡萄糖苷酶qsgh13最适反应ph为ph 10.0,在ph 5.0-ph 13.0范围内具有活性(图4)。
67.实施例7
68.重组蛋白α-葡萄糖苷酶qsgh13酶学稳定性分析
69.金属阳离子对α-葡萄糖苷酶qsgh13活性影响的测定具体操作为:在100μl反应体系中分别加入10mm na
+
、k
+
、fe
2+
、fe
3+
、zn
2+
、co
2+
、cu
2+
、ni
2+
、ca
2+
、mg
2+
、sr
2+
、ba
2+
、mn
2+
和乙二胺四乙酸(edta),测定酶活性。检测酶活性的体系为:20mm甘氨酸-氢氧化钠缓冲液(ph10.0),1mm对硝基苯酚-α-d-葡萄糖苷,加入1.84μg纯酶蛋白,于45℃下连续测定吸光值od
405 2分钟。测定结果表明,α-葡萄糖苷酶qsgh13活性会被cu
2+
完全抑制,在ni
2+
、zn
2+
和co
2+
存在下活性较低、而在k
+
、fe
2+
、fe
3+
、ca
2+
、sr
2+
、ba
2+
和mn
2+
存在下仍能保持较强活性,在mg
2+
存在下活性增大(图5)。
70.有机溶剂对α-葡萄糖苷酶qsgh13活性影响的测定具体操作为:在反应体系中分别加入10%(v/v)有机溶剂(甲醇、甲酸、乙醇、异丙醇、乙腈、丙酮、二甲基亚砜)然后测定酶的活性。检测酶活性的体系为:20mm甘氨酸-氢氧化钠缓冲液(ph10.0),1mm对硝基苯酚-α-d-葡萄糖苷,加入1.84μg纯酶蛋白,于45℃下连续测定吸光值od
405 2分钟。测定结果表明,α-葡萄糖苷酶qsgh13活性会被甲酸完全抑制,而在甲醇、乙醇、异丙醇、乙腈、丙酮、二甲基亚砜存在时可保持较高活性(图6)。
71.去垢剂对α-葡萄糖苷酶qsgh13活性影响的测定具体操作为:在反应体系中分别加入1%去垢剂(v/v)(sds、tritonx-114、tritonx-110、吐温20或吐温80)然后测定酶的活性。检测酶活性的体系为:20mm甘氨酸-氢氧化钠缓冲液(ph10.0),1mm对硝基苯酚-α-d-葡萄糖苷,加入1.84μg纯酶蛋白,于45℃下连续测定吸光值od
405 2分钟。测定结果表明,α-葡萄糖苷酶qsgh13活性会被sds、triton-114、triton-110、吐温20和吐温80抑制。(图7)
72.nacl对α-葡萄糖苷酶qsgh13活性影响的测定具体操作为:在反应体系中分别加入1m,2m,3m,4m,5m nacl水溶液,然后测定酶的活性。检测酶活性的体系为:20mm甘氨酸-氢氧
化钠缓冲液(ph10.0),1mm对硝基苯酚-α-d-葡萄糖苷,加入1.84μg纯酶蛋白,于45℃下连续测定吸光值od
405 2分钟。测定结果表明,α-葡萄糖苷酶qsgh13活性随着nacl的浓度升高活性逐渐降低,总体来说,有非常好地耐盐性。(图8)
73.上述虽然结合附图对本发明的具体实施方式进行了描述,但并非对本发明保护范围的限制,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围以内。
