1.本发明属于药物学技术领域,具体涉及一类依巴斯汀的盐及其制备方法和应用。
背景技术:
2.依巴斯汀(ebastine,化学名称为1-[4-(1,1-二甲基乙基)苯基]-4-[4-(二苯基甲氧基)-1-哌啶基]-1-丁酮),是一种长效、非镇静型的第二代组胺h1受体拮抗剂,对h1受体有高度的选择性,而无中枢抑制作用。在临床上用于变应性疾病的治疗,包括季节性、过敏性鼻炎及慢性特发性荨麻疹、湿疹、皮肤瘙痒等疾病;与西替利嗪相比,效果更加显著,且嗜睡作用小。
[0003]
目前市售的依巴斯汀制剂多为口服片剂,由于依巴斯汀分子结构中含有多个疏水基团,导致其在水中不溶,片剂溶出度不佳,生物利用率低,体内难以吸收,限制了依巴斯汀的治疗效果。变应性疾病症状部位多在皮肤、鼻咽、眼部等,通过溶液剂、喷雾剂、洗剂、擦剂、软膏剂、滴眼剂、膏剂、眼用凝胶剂等药物制剂直接给药于症状部位,具有吸收迅速、起效快、剂量低、副作用小等优点;但是,这类制剂也对原料药的水溶性提出了一定要求。
技术实现要素:
[0004]
针对现有技术中存在的问题,本发明要解决的一个技术问题在于提供一类依巴斯汀的盐,该盐可以提高依巴斯汀水溶性。本发明要解决的另一个技术问题在于提供一类依巴斯汀的盐的制备方法,该制备方法简单易行,产率高,纯度好,适合工业化生产。本发明要解决的技术问题还有一个在于提供一类依巴斯汀的盐在制备用于组胺h1受体拮抗剂的药物中的应用,以及在制备用于治疗过敏性鼻炎、过敏性哮喘、过敏性皮炎或过敏性结膜炎药物中的应用,依巴斯汀盐具有较好的组胺h1受体拮抗的生物活性以及水溶性,便于制备各类液体制剂,使依巴斯汀的制剂范围得到拓展,能够更好地应用于制备各类变应性疾病药物中。
[0005]
为了解决上述问题,本发明所采用的技术方案如下:
[0006]
一类依巴斯汀的盐,具有以下通式(i):
[0007][0008]
其中,通式(i)中的酸为盐酸、硫酸、苯磺酸、马来酸或苹果酸中的任一种。
[0009]
上述依巴斯汀的盐的制备方法,将1-[4-(1,1-二甲基乙基)苯基]-4-[4-(二苯基甲氧基)-1-哌啶基]-1-丁酮溶解于溶剂中,在20
–
90℃条件下,加入酸或酸的溶液,搅拌反应,随后采用柱层析、薄层层析、重结晶或打浆的方式纯化得1-[4-(1,1-二甲基乙基)苯
基]-4-[4-(二苯基甲氧基)-1-哌啶基]-1-丁酮盐;所述酸为盐酸、硫酸、苯磺酸、马来酸或苹果酸中的一种。反应通式如下:
[0010][0011]
所述依巴斯汀的盐的制备方法,所述溶剂为甲醇、乙醇、丙醇、异丙醇、乙腈、丙酮、甲基叔丁基酮、乙酸乙酯、乙醚、四氢呋喃、二氯甲烷、三氯甲烷、甲苯、水、二甲基亚砜或二甲基甲酰胺中的任一种或多种的混合物。
[0012]
所述依巴斯汀的盐的制备方法,所述溶剂为乙醇或丙酮。
[0013]
所述依巴斯汀的盐的制备方法,所述溶剂与1-[4-(1,1-二甲基乙基)苯基]-4-[4-(二苯基甲氧基)-1-哌啶基]-1-丁酮的用量比为1.5
–
6.0ml:1g(该溶剂用量指的只是溶解依巴斯汀的用量);所述酸与1-[4-(1,1-二甲基乙基)苯基]-4-[4-(二苯基甲氧基)-1-哌啶基]-1-丁酮的摩尔比为1.0:1
–
2.0:1。
[0014]
所述依巴斯汀的盐的制备方法,所述溶剂与1-[4-(1,1-二甲基乙基)苯基]-4-[4-(二苯基甲氧基)-1-哌啶基]-1-丁酮的用量比为1.5
–
4.0ml:1g(该溶剂用量指的只是溶解依巴斯汀的用量);所述酸与1-[4-(1,1-二甲基乙基)苯基]-4-[4-(二苯基甲氧基)-1-哌啶基]-1-丁酮的摩尔比为1.05:1
–
1.6:1。
[0015]
所述依巴斯汀的盐的制备方法,反应温度为20
–
50℃。
[0016]
所述依巴斯汀的盐的制备方法,所述纯化方式为重结晶或打浆。
[0017]
上述依巴斯汀的盐在制备用于组胺h1受体拮抗剂的药物中的应用。
[0018]
上述依巴斯汀的盐在制备用于治疗过敏性鼻炎、过敏性哮喘、过敏性皮炎或过敏性结膜炎药物中的应用。
[0019]
有益效果:与现有的技术相比,本发明的优点包括:
[0020]
本发明提供的依巴斯汀盐的制备方法具有操作简单高效,反应条件温和,反应安全易控的特点;此方法获得的依巴斯汀盐后处理简单方便,收率高,纯度高,适合工业化生产。
[0021]
本发明依巴斯汀盐具有较好的组胺h1受体拮抗的生物活性以及水溶性,便于制备各类液体制剂,使依巴斯汀的制剂范围得到拓展,能够更好地应用于制备各类变应性疾病药物中,适应不同部位的用药需求,这对充分发挥药品疗效具有很重大的现实意义。
附图说明
[0022]
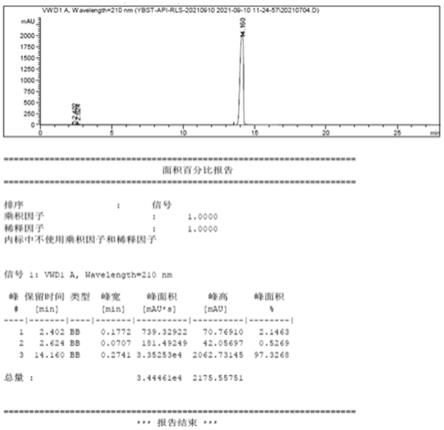
图1为依巴斯汀盐酸盐的hplc图谱;
[0023]
图2为依巴斯汀硫酸盐的hplc图谱;
[0024]
图3为依巴斯汀苯磺酸盐的hplc图谱;
[0025]
图4为依巴斯汀苹果酸盐的hplc图谱;
[0026]
图5为依巴斯汀马来酸盐的hplc图谱;
[0027]
图6为依巴斯汀及其盐竞争性结合人重组h1受体拟合曲线图;
[0028]
图7为依巴斯汀抗组胺诱导豚鼠离体回肠收缩拟合曲线图;
[0029]
图8为依巴斯汀抗组胺诱导豚鼠离体气管收缩拟合曲线图。
具体实施方式
[0030]
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合具体实施例对本发明的具体实施方式做详细的说明。以下实施例中依巴斯汀盐的高效液相色谱分析方法:液相色谱仪:agilent 1260;色谱柱:agilent eclipse plus c18 100
×
4.6mm 3.5μm;流动相:流动相a为磷酸盐缓冲液(取十二水合磷酸氢二钠3.58g,加水溶解并稀释至1000ml,用磷酸调节ph值至6.3,加入十二烷基硫酸钠1.92g,混匀)
–
乙腈(80:20),流动相b为乙腈。按照表1进行线性梯度洗脱。溶剂:乙腈
–
水(75:25)检测波长:210nm柱温:40℃流速:1.0ml/min,进样量:10μl。
[0031]
表1洗脱参数
[0032]
时间(分钟)流动相a(%)流动相b(%)0604035545132971282971
[0033]
实施例1
[0034]
依巴斯汀盐酸盐的制备:
[0035][0036]
(1)将依巴斯汀(10.0g,21.3mmol,1.0equiv.)置于100ml圆底烧瓶中,加入乙醇(15ml)。将氯化氢乙醇溶液(20%in etoh,5.8g,32.0mml,1.5equiv.)于室温25℃下滴入依巴斯汀溶液中,溶液逐渐变澄清。加毕后继续搅拌10min,减压蒸去溶剂,得胶状盐酸依巴斯汀粗品;
[0037]
(2)向步骤(1)中所获得的盐酸依巴斯汀粗品中加入己烷(15ml),加热回流,逐步滴入乙酸乙酯(55ml),继续回流1h,随后自然冷却至室温搅拌过夜,过滤,滤饼以己烷/乙酸乙酯(1:1,5ml
×
3)洗涤,60℃下干燥3h,得白色固体盐酸依巴斯汀9.91g,产率92%,根据hplc测试结果显示纯度为97.32%;
[0038]
所得依巴斯汀盐酸盐的鉴定数据如下:
[0039]1h nmr(500mhz,dmso-d6):δ10.82(1h,t),7.92(2h,t),7.90
–
7.53(2h,m),7.41
–
7.32(8h,m),7.27
–
7.24(2h,m),5.68(1h,d),3.73
–
3.57(1h,m),3.47
–
3.44(1h,dd),3.30
–
3.31(2h,m),3.18
–
3.02(5h,m),2.90(1h,q),2.16
–
1.92(6h,m),1.30(9h,s);
[0040]
13
c nmr(125mhz,dmso-d6):δ198.7,156.8,143.2,134.4,128.8,128.4,127.8,127.1,127.1,126.0,80.0,79.7,70.9,66.9,55.7,55.2,50.2,47.7,35.7,35.3,31.3,28.9,27.1,18.5,18.4;
[0041]
lc-ms(esi,m/z):470.3(m+h
+
).
[0042]
实施例2
[0043]
依巴斯汀硫酸盐的制备:
[0044][0045]
(1)将依巴斯汀(10.0g,21.3mmol,1.0equiv.)置于100ml圆底烧瓶中,加入丙酮(15ml),室温25℃搅拌下将硫酸(98%,2.3g,22.4mmol,1.05equiv.)溶于丙酮(5ml)中滴入,溶液并放热并逐渐变澄清。加毕后继续搅拌10min,减压蒸去溶剂,得胶状硫酸依巴斯汀粗品;
[0046]
(2)向步骤(1)中所获得的硫酸依巴斯汀粗品中加入己烷(15ml),加热回流,逐步滴入乙酸乙酯(20ml),继续加热回流1h,随后搅拌冷却至室温,过滤,滤饼以己烷/乙酸乙酯(1:1,5ml
×
3)洗涤,60℃下干燥3h,得白色固体硫酸依巴斯汀9.60g,产率79.6%,根据hplc测试结果显示纯度为97.67%;
[0047]
所得依巴斯汀硫酸盐的鉴定数据如下:
[0048]1h nmr(500mhz,dmso-d6):δ10.67(1h,s),7.91(2h,d),7.53(2h,d),7.40
–
7.32(8h,m),7.26
–
7.23(2h,m),5.68(1h,s),3.70
–
3.42(2h,m),3.15(3h,t),3.07
–
2.89(4h,m),2.02
–
1.93(6h,m),1.30(9h,s);
[0049]
13
c nmr(125mhz,dmso-d6):δ198.7,156.8,143.2,134.4,128.8,128.4,127.8,127.1,126.0,79.9,71.1,67.3,55.5,50.3,48.0,35.7,35.3,31.3,28.9,27.4,18.6;
[0050]
lc-ms(esi,m/z):470.3(m+h
+
).
[0051]
实施例3
[0052]
依巴斯汀苯磺酸盐的制备
[0053][0054]
(1)将依巴斯汀(10.0g,21.3mmol,1.0equiv.)置于100ml圆底烧瓶中,加入乙醇(20ml),加热至50℃溶清,搅拌下将苯磺酸(3.5g,22.4mmol,1.05equiv.)溶于乙醇(10ml)中滴入。加毕后继续搅拌10min,减压蒸去溶剂,得苯磺酸依巴斯汀粗品;
[0055]
(2)向步骤(1)中所获得的苯磺酸依巴斯汀粗品中加入丙酮(15ml),加热至80℃溶解,搅拌下冷却至0℃,析出白色固体,继续搅拌1h。过滤,滤饼以丙酮(5ml
×
3)洗涤,60℃下干燥3h,得白色固体苯磺酸依巴斯汀11.62g,产率87.4%,根据hplc测试结果显示纯度为98.89%;
[0056]
所得依巴斯汀苯磺酸盐的鉴定数据如下:
[0057]1h nmr(500mhz,dmso-d6):δ9.03(1h,s),7.91
–
7.89(2h,m),7.62
–
7.54(4h,m),
7.41
–
7.24(13h,m),5.69(1h,d),3.72
–
3.57(1h,m),3.53
–
3.50(2h,m),3.40
–
3.34(1h,m),3.16
–
3.01(5h,m),2.95(1h,q),2.50(1h,m),2.22
–
1.96(3h,m),1.85(1h,t),1.68(1h,q),1.30(9h,s);
[0058]
13
c nmr(125mhz,dmso-d6):δ198.6,156.9,148.6,143.2,143.1,134.3,129.0,128.9,128.4,128.2,127.8,127.2,127.1,126.0,80.0,79.8,70.6,66.5,55.8,55.3,50.6,48.2,35.3,35.2,31.3,29.4,27.3,18.8,18.6;
[0059]
lc-ms(esi,m/z):470.3(m+h
+
).
[0060]
实施例4
[0061]
依巴斯汀苹果酸盐的制备
[0062][0063]
(1)将依巴斯汀(10.0g,21.3mmol,1.0equiv.)置于100ml圆底烧瓶中,加入乙醇(20ml),室温25℃搅拌下将苹果酸(3.14g,23.4mmol,1.1equiv.)溶于乙醇(5ml)中滴入。加毕后继续搅拌10min,减压蒸去溶剂,得苹果酸依巴斯汀粗品;
[0064]
(2)向步骤(1)中所获得的苹果酸依巴斯汀粗品中加入丙酮(15ml),加热至80℃溶解,搅拌下冷却至0℃,析出白色固体,继续搅拌1h。过滤,滤饼以丙酮(5ml
×
3)洗涤,60℃下干燥3h,得白色固体苹果酸依巴斯汀12.41g,产率96.6%,根据hplc测试结果显示纯度为98.72%;
[0065]
所得依巴斯汀苹果酸盐的鉴定数据如下:
[0066]1h nmr(500mhz,dmso-d6):δ9.00(1h,s),7.91(2h,d),7.54(2h,d),7.39
–
7.38(4h,m),7.35
–
7.32(4h,m),7.26
–
7.23(m,2h),5.67(1h,s),3.60
–
2.99(12h,m),2.07
–
1.92(6h,m),1.30(9h,s);
[0067]
13
c nmr(125mhz,dmso-d6):δ198.2,156.8,143.5,134.5,128.8,128.4,127.8,127.1,126.0,79.8,71.0,67.3,55.7,50.3,48.2,35.7,35.3,31.3,29.0,27.4,18.8;
[0068]
lc-ms(esi,m/z):470.3(m+h
+
).
[0069]
实施例5
[0070]
依巴斯汀马来酸盐的制备
[0071][0072]
(1)将依巴斯汀(10.0g,21.3mmol,1.0equiv.)置于100ml圆底烧瓶中,加入乙酸乙酯(40ml),室温25℃搅拌下将马来酸(4.9g,42.6mmol,2.0equiv.)溶于乙酸乙酯(40ml)中滴入,过程中有轻微放热,溶液变澄清。加毕后继续搅拌15min,减压蒸去溶剂,得马来酸依巴斯汀粗品;
[0073]
(2)向步骤(1)中所获得的马来酸依巴斯汀粗品中加入乙醇(20ml),加热至80℃溶
解,搅拌下冷却至0℃,析出白色固体,继续搅拌20min。过滤,滤饼以乙醇(5ml
×
4)洗涤,60℃下干燥3h,得白色马来酸依巴斯汀10.40g,产率83.5%,根据hplc测试结果显示纯度为100%;
[0074]
所得依巴斯汀马来酸盐的鉴定数据如下:
[0075]1h nmr(500mhz,dmso-d6):δ9.13(1h,br),7.90(2h,d),7.55(2h,d),7.40
–
7.24(10h,m),6.03(2h,s),5.68(1h,s),3.80
–
3.20(3h,m),3.12(4h,t),3.10
–
2.80(2h,m),2.30
–
2.10(1h,m),2.10
–
1.90(3h,m),1.90
–
1.50(2h,m),1.31(9h,s);
[0076]
13
c nmr(125mhz,dmso-d6):δ198.6,167.7,156.9,143.1,136.5,134.4,128.8,128.4,127.8,127.1,126.0,79.9,70.7,66.8,55.5,50.6,48.2,35.3,35.2,31.3,29.6,27.6,18.8;
[0077]
lc-ms(esi,m/z):470.3(m+h
+
).
[0078]
实施例6
[0079]
依巴斯汀盐溶解度测定
[0080]
依照《中华人民共和国药典》2020版凡例第十五条给定实验方法进行测试,结果如表2所示。由表2可得出以下结论:将依巴斯汀制备成本发明所述的盐后,其水溶性得到明显的增强。
[0081]
表2依巴斯汀及其盐在水中溶解度(25℃,mg/ml)
[0082]
名称溶解度依巴斯汀0依巴斯汀盐酸盐1.21依巴斯汀硫酸盐0.78依巴斯汀苯磺酸盐0.72依巴斯汀苹果酸盐0.51依巴斯汀马来酸盐0.63
[0083]
实施例7
[0084]
注射用液的制备:
[0085]
表3注射用液的制备
[0086][0087]
*依巴斯汀先用1.5ml dmso溶解,再按下述方法制备依巴斯汀盐注射液。
[0088]
制备方法:将依巴斯汀盐加入适量注射用水中,加入甘露醇20mg,充分混合溶解,加注射用水至500ml,用除尘过滤器过滤该混合物,并以5ml每份封装入安瓿瓶中,热压灭菌,得100只安瓿,浓度为5ml:2mg(以依巴斯汀计),用于后续动物实验中。
[0089]
实施例8
[0090]
依巴斯汀盐与组胺h1受体拮抗活性测定
[0091]
取中国仓鼠卵巢细胞(cho),稳转人重组h1受体,检测依巴斯汀及其盐与[3h]-mepyramine竞争性结合h1受体的能力。膜蛋白(0.2至0.3mg)与4nm的[3h]-mepyramine共孵育于50mm tris/hcl,ph 7.4,2mm mgcl2缓冲液中,并加入不同浓度的受试物(5.72nm至6mm),其中非特异性结合孔加入10μm西替利嗪。37℃条件下孵育120min,用浸泡在0.05%聚乙烯亚胺的gf/c过滤板过滤,从游离配体中分离出与受体结合的[3h]-mepyramine。用8ml预冷的缓冲液洗涤gf/c板。烘干后用封底膜将gf/c板底部封上,每孔加50μl闪烁液,然后用透明封板膜封住盖子。用microbeta读板,用graphpad prism 5.0进行数据分析。%抑制率=100
×
[1-(样品孔值
–
低信号孔平均值)/(高信号孔平均值-低信号孔平均值)],用graphpad prism 5.0中的“log(inhibitor)vs.response-variable slope”模型进行拟合,拟合曲线如图6所示,计算出ic
50
及ki值。每次试验每一受试物设置2个重复,并重复3次取平均值。
[0092]
表4依巴斯汀及其盐竞争性结合人重组h1受体ic
50
与ki值
[0093]
受试物名称ic
50
(μm)ki(μm)依巴斯汀0.77170.2473依巴斯汀盐酸盐2.8091.473依巴斯汀硫酸盐2.6361.254依巴斯汀苯磺酸盐0.19710.9373依巴斯汀马来酸盐189.1109.1依巴斯汀苹果酸盐52.6724.13
[0094]
表4结果表明:与依巴斯汀相比,依巴斯汀苯磺酸盐竞争性拮抗h1受体作用最优,依巴斯汀马来酸盐拮抗作用最弱,拮抗组胺h1受体作用排序:依巴斯汀苯磺酸盐》依巴斯汀》依巴斯汀硫酸盐》依巴斯汀盐酸盐》依巴斯汀苹果酸盐》依巴斯汀马来酸盐。
[0095]
实施例9
[0096]
依巴斯汀盐对组胺所致豚鼠离体回肠收缩的影响
[0097]
20只成年雄性豚鼠(400至500g,维通利华实验动物技术有限公司)置实验环境中适应性饲养4天,备用。实验前豚鼠禁食12h。
[0098]
实验当天将豚鼠击头处死后立即打开腹腔,取出一段长约8cm的回肠,置于4℃tyrode溶液中,去除回肠周围脂肪组织,用tyrode溶液冲洗干净,剪成长约1.5cm的回肠片段。放入含20ml 37℃预热并充氧(95%o2/5%co2)tyrode平衡液的浴槽中,将每个回肠片段一端固定于通气钩,另一端与张力换能器连接,连接多通道生物信号采集处理系统记录张力变化。置于37℃的tyrode平衡液中孵育,并持续给予1.2g的初始静息张力。预孵育40min至1h,记录每个回肠片段组胺累积浓度
–
响应曲线,待基线平稳开始正式实验。依次在浴槽中加入3.8nm至1mm磷酸组胺溶液,记录组胺收缩曲线,直至最大响应(记录此时的响应为100%收缩峰值amax)。然后用tyrode溶液冲洗3次,待基线恢复至用药前水平,稳定后加入0.1至1000μm的受试物,对照组加入溶媒,孵育30min,再次记录组胺累计浓度
–
响应曲线。
[0099]
参考加入受试物后引起的收缩高度相当于峰值的百分率(a/amax),计算pa2值(pa2=log[a/amax-1]-log[c],c为加入受试物的浓度)。
[0100]
表5依巴斯汀及其盐抗组胺诱导豚鼠离体回肠收缩的活性检测
[0101]
受试物名称pa2依巴斯汀7.5依巴斯汀盐酸盐7.2依巴斯汀硫酸盐7.2依巴斯汀苯磺酸盐8.0依巴斯汀马来酸盐6.2依巴斯汀苹果酸盐6.9
[0102]
注:pa2=将双剂量激动剂的反应降低到单剂量(用于竞争性拮抗)所需拮抗剂浓度(moi/l)的负对数。
[0103]
上述结果表明:与依巴斯汀相比,依巴斯汀苯磺酸盐、硫酸盐、盐酸盐、马来酸盐、苹果酸盐均具有拮抗组胺诱导豚鼠离体回肠收缩的作用。
[0104]
实施例10
[0105]
依巴斯汀盐对组胺所致豚鼠离体气管收缩的影响
[0106]
豚鼠(400至500g,维通利华实验动物技术有限公司)处死后,取甲状软骨以下至气管分叉处整条气管,放入37℃预热并充氧(95%o2/5%co2)的krebs平衡液中,轻柔快速分离肌层,制备长度约为0.5cm的气管环,将气管环与肌张力换能器连接,置于37℃的krebs平衡液中孵育,并持续给予1g的初始张力。预孵育40min至1h后,待气管环达到最佳且稳定的收缩状态,开始正式实验。依次在浴槽中加入3.8nm至1mm组胺,待气管环张力达到平台期后(记录此时的肌张力作为100%收缩力)。然后用krebs平衡液冲洗3次,待基线恢复至用药前水平,稳定后加入0.1至1000μm的受试物,对照组加入溶媒,孵育30min。记录不同浓度受试化合物抑制离体气管环收缩的剂量效应曲线,并计量各化合物的pa2值。
[0107]
表6依巴斯汀及其盐抗组胺诱导豚鼠离体气管收缩的活性检测
[0108]
受试物名称pa2依巴斯汀7.1依巴斯汀盐酸盐6.9依巴斯汀硫酸盐6.8依巴斯汀苯磺酸盐7.5依巴斯汀马来酸盐5.8依巴斯汀苹果酸盐6.2
[0109]
上述结果表明:与依巴斯汀相比,依巴斯汀苯磺酸盐、硫酸盐、盐酸盐、马来酸盐、苹果酸盐均具有拮抗组胺诱导豚鼠离体气管收缩的作用。
[0110]
实施例11
[0111]
依巴斯汀盐对组胺诱导的豚鼠支气管收缩和心动过速的影响
[0112]
成年雄性豚鼠(400至500g,维通利华实验动物技术有限公司)置实验环境中适应性饲养4天。实验前称重分组,每组5只,分组情况见表7。
[0113]
试验当天,按照分组分别静脉注射给予豚鼠相应剂量的实施例7所制备的依巴斯汀盐注射液,1h后静脉注射给予10μg/kg的0.1%组胺,组胺诱导前后均使用体积扫描仪监测潮气量,使用电生理监护仪监测各导联波形。
[0114]
表7依巴斯汀盐对组胺诱导的豚鼠支气管收缩(h1受体)和心动过速(h2受体)影响试验的分组及结果
[0115][0116]
$
为依巴斯汀的等摩尔剂量,从上到下分子量分别为:469.30、505.27、567.27、627.30、585.31、603.32g/mol。
[0117]
#
阴性对照组为等体积的含0.004%甘露醇的注射用水,组胺诱导引起的支气管收缩记为100%。
[0118]
上述结果表明:1mg/kg依巴斯汀及其等摩尔剂量的依巴斯汀盐均可有效抑制组胺诱导的豚鼠支气管收缩,但对组胺诱导的心动过速无明显抑制作用。
[0119]
实施例12
[0120]
依巴斯汀盐对大鼠过敏性鼻炎的影响
[0121]
35只sd大鼠(180至250g,维通利华实验动物技术有限公司)置实验环境中适应性饲养4天。实验前称重分组,每组5只,分组情况见表8。
[0122]
day 1腹腔注射30mg/kg环磷酰胺+1mg ova(溶于含10mg明矾的生理盐水中)。day 8用1%ova鼻内刺激,day 15、day 22分别用2%ova鼻内刺激一次。按照分组情况于day22刺激前1h灌胃给予动物相应剂量的受试物。鼻刺激后立即记录10min内大鼠打喷嚏和鼻摩擦的次数。
[0123]
表8依巴斯汀盐对大鼠过敏性鼻炎影响试验分组及结果(mean
±
sd)
[0124][0125][0126]
注:
$
为依巴斯汀的等摩尔剂量,从上到下分子量分别为:469.30、505.27、567.27、
627.30、585.31、603.32g/mol。
[0127]
#
阴性对照组灌胃给予等体积的0.5%羧甲基纤维素钠。
[0128]
*p《0.05,**p《0.01,***p《0.001,各组均与阴性对照组比。
[0129]
上述结果表明:10mg/kg依巴斯汀及其等摩尔剂量的依巴斯汀盐均可有效抑制ova刺激的大鼠鼻过敏性鼻炎反应,各组与阴性对照组比,均具有显著性差异。
[0130]
实施例13
[0131]
依巴斯汀盐对大鼠荨麻疹的影响
[0132]
35只sd大鼠(180至250g,维通利华实验动物技术有限公司)置实验环境中适应性饲养4天。实验前一天day 1大鼠称重、剃毛并分组,每组5只,分组情况见表9。
[0133]
试验当天day 1于大鼠剃毛区域皮下注射5μg组胺诱导荨麻疹模型。组胺诱导前1h灌胃给予动物相应剂量的受试物。组胺诱导后20min处死动物,统计各组大鼠皮肤出现荨麻疹面积。
[0134]
表9依巴斯汀盐对大鼠荨麻疹影响试验分组及结果(mean
±
sd)
[0135][0136]
注:
$
为依巴斯汀的等摩尔剂量,从上到下分子量分别为:469.30、505.27、567.27、627.30、585.31、603.32g/mol。
[0137]
#阴性对照组灌胃给予等体积的0.5%羧甲基纤维素钠。
[0138]
*p《0.05,**p《0.01,***p《0.001,各组均与阴性对照组比。
[0139]
上述结果表明:10mg/kg依巴斯汀及其等摩尔剂量的依巴斯汀盐均可有效减少组胺诱导的大鼠荨麻疹面积。依巴斯汀马来酸盐组有减少荨麻疹面积的趋势,其余各组与阴性对照组比,具有显著性差异。
