1.本发明涉及生物技术领域,尤其涉及一种降解苯甲酰二甲基铵类化合物的方法。
背景技术:
2.有研究表明,苯甲酰二甲基铵类化合物对大型溞、光合细菌和微藻等水生生物的半数有效浓度浓度范围为普遍低于200μg/l,而其在污水中的最高检出浓度高达2800μg/l,一旦含苯甲酰二甲基铵类化合物的废水被排入水生态系统后将会严重抑制水生生物的生长、繁殖,进而影响水生态系统的稳定性。因此开发出一种在苯甲酰二甲基铵类化合物融入生态环境前将其降解的方法十分重要。
3.近些年采用的离子吸附等物理化学方法处理苯甲酰二甲基铵类化合物虽有较好进展,但操作成本较高及处理效果易受废水其他成分影响,可考虑从微生物方法方面入手。目前有关处理苯甲酰二甲基铵类化合物的微生物方法的研究较少,已经报道的苯甲酰二甲基铵类化合物降解菌种类非常有限,且其对苯甲酰二甲基铵类化合物的降解效率较低,仅为70%~80%。
技术实现要素:
4.有鉴于此,本发明实施例通过提供一种苯甲酰二甲基铵类化合物降解菌团的筛选方法及其应用,用于解决现有降解苯甲酰二甲基铵类化合物的方法存在降解效率低的问题。
5.为了解决上述问题,本发明实施例提供了一种苯甲酰二甲基铵类化合物降解菌团的筛选方法,包括以下步骤:
6.s1,将能够在含苯甲酰二甲基铵类化合物的废水中正常生长的藻菌共生培养体系的沉积物为种子株;
7.所述藻菌共生培养体系为公开内容,市场上可用于处理废水的藻菌共生培养体系都可以用于本发明。
8.s2,将种子株接入苯甲酰二甲基铵类化合物和jtuk 12培养基中进行驯化,得到混合菌液;
9.s3,将混合菌液通过稀释平板法进行分离,挑取单菌落重新接种至液体jtuk 12培养基中扩培,得到菌团;
10.jtuk 12培养基为含有0.1-10g/l酵母提取物、10-50g/l葡萄糖、1.5-2.0g/lk2hpo4·
3h2o的bg 11培养基。
11.bg 11培养基包括硝酸钠1.5g/l、三水磷酸氢二钾0.04g/l、七水硫酸镁0.075g/l、二水氯化钙0.036g/l、柠檬酸0.006g/l、柠檬酸铁铵0.006g/l、edta0.001g/l、碳酸钠0.02g/l、硼酸0.00286g/l、一水氯化锰0.00181g/l、七水硫酸锌0.000222g/l、五水硫酸铜0.000079g/l、二水钼酸钠0.00039g/l、六水硝酸钴0.000049g/l,调节ph值7.1
±
0.1。
12.可选地,s1中,废水中苯甲酰二甲基铵类化合物浓度为0.1-160mg/l。
13.可选地,s2中,苯甲酰二甲基铵类化合物浓度为0.1-160mg/l。
14.可选地,菌团包括拟青霉属、威克汉姆酵母属、隐球菌属、毛霉属、曲霉属以及产碱杆菌属。
15.可选地,jtuk 12培养基中,葡萄糖的浓度为10g/l。
16.可选地,jtuk 12培养基中,酵母提取物的浓度为2g/l。
17.本发明还公开了用上述方法筛选得到的菌团在降解苯甲酰二甲基铵类化合物中的应用。
18.可选地,用上述方法筛选得到的菌团在降解苯甲酰二甲基铵类化合物中的应用,包括以下步骤:将上述方法得到的菌团接种至含有苯甲酰二甲基铵类化合物的废水中,接入jtuk 12培养基,无光照下培养。
19.可选地,菌团接种至jtuk 12培养基中,培养时间不小于6天,对苯甲酰二甲基铵类化合物的降解率可达92%以上。
20.可选地,废水中苯甲酰二甲基铵类化合物的浓度为0.1-160mg/l,在此范围内,本发明的方法能够高效降解苯甲酰二甲基铵类化合物,降解率可达92%以上。
21.本发明得到的菌团中不仅包括无色杆菌、绿脓杆菌等细菌,还包括拟青霉属(purpureocillium sp.)、威克汉姆酵母属(wickerhamomyces sp.)、隐球菌属(cutaneotrichosporon sp.)、毛霉属(mucor sp.)、曲霉属(aspergillus sp.)等真菌,丰富了苯甲酰二甲基铵类化合物降解菌种库。
22.相比现有的方法,本发明提供的方法能够高效降解高浓度苯甲酰二甲基铵类化合物,降解率高达92%以上。
23.上述说明仅是本技术技术方案的概述,为了能够更清楚了解本技术的技术手段,而可依照说明书的内容予以实施,并且为了让本技术的上述和其它目的、特征和优点能够更明显易懂,以下特举本技术的具体实施方式。
附图说明
24.图1为本发明实施例中菌株在50mg/l苯甲酰二甲基铵类化合物下的生长情况;其中,(a)显示种子株接种10天后培养基中出现较为明显的白色菌,(b)显示种子株接种15天后培养基的白色菌细胞密度显著提高,培养基已经变得浑浊;(c)显示种子株接种20天后,菌液开始变黄,而且出现大量丝状菌团。
25.图2为本发明实施例中菌团在不同浓度的k2hpo4·
3h2o下的菌斑形态;其中,1~6分别代表k2hpo4·
3h2o浓度为0g/l、0.5g/l、1.0g/l、1.5g/l、2.0g/l、2.5g/l的培养基。
具体实施方式
26.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
27.实施例1
28.本发明实施例提供了一种苯甲酰二甲基铵类化合物降解菌团的筛选方法,包括以
下步骤:
29.s1,将能够在苯甲酰二甲基铵类化合物浓度为47.0mg/l的市政废水中正常生长的藻菌共生培养体系的沉积物为种子株;
30.所述藻菌共生培养体系为公开内容,市场上可用于处理废水的藻菌共生培养体系都可以用于本发明。
31.s2,将其接入含50mg/l苯甲酰二甲基铵类化合物和jtuk 12培养基中进行多次驯化,每次驯化条件不变,第一次驯化20天,生长情况如图1所示,第二次驯化10天,第三次驯化6天,第四次驯化2天,然后得到混合菌液;
32.s3,将混合菌液通过稀释平板法进行分离,挑取单菌落重新接种至液体jtuk 12培养基中扩培,120rpm,30℃,无光照下振荡培养,得到菌团。
33.其中,jtuk 12培养基为含有1.0g/l酵母提取物、1.0g/l葡萄糖、1.5g/lk2hpo4·
3h2o的bg 11培养基。
34.bg 11培养基包括硝酸钠1.5g/l、三水磷酸氢二钾0.04g/l、七水硫酸镁0.075g/l、二水氯化钙0.036g/l、柠檬酸0.006g/l、柠檬酸铁铵0.006g/l、edta0.001g/l、碳酸钠0.02g/l、硼酸0.00286g/l、一水氯化锰0.00181g/l、七水硫酸锌0.000222g/l、五水硫酸铜0.000079g/l、二水钼酸钠0.00039g/l、六水硝酸钴0.000049g/l,调节ph值7.1
±
0.1。
35.取50ml菌液,离心,倒掉上清液,沉淀置于-20℃预冷2h,然后置于-70℃冷冻,保存菌种。待所有测验结束后统一进行高通量基因测序。
36.由测序结果可知,菌团中包含拟青霉属、威克汉姆酵母属、隐球菌属、毛霉属、曲霉属以及产碱杆菌属。
37.s4,将菌团接入液体jtuk 12培养基中,加入50mg/l苯甲酰二甲基铵类化合物,并设置3个平行。摇匀后置于恒温气浴摇床上培养(30℃,120rpm,无光照)。
38.连续6天,每天测定培养液中菌液密度、苯甲酰二甲基铵类化合物浓度、tn、tp、tc、tic、toc以及菌团对苯甲酰二甲基铵类化合物去除率。测定方法如下,苯甲酰二甲基铵类化合物浓度测定:参考冯泳兰的方法,采用修改后的镉试剂法测定;tp:钼酸铵分光光度法;tn:碱性过硫酸钾消解紫外分光光度法;tc、tic、toc:采用toc仪(elementar,enviro,德国)进行测定;菌液密度:以菌液在600nm下的吸光值(od
600
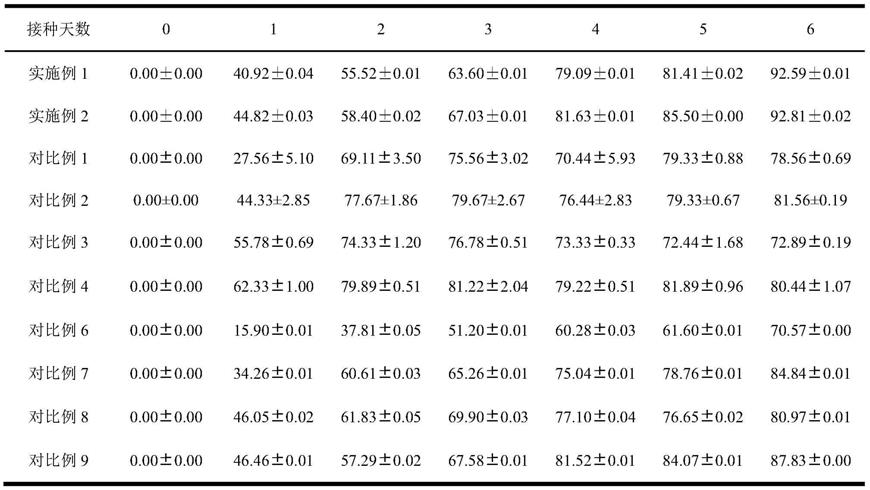
)表征菌液密度;菌团对苯甲酰二甲基铵类化合物去除率根据培养液中苯甲酰二甲基铵类化合物的浓度进行计算。菌团的形态如图2所示;菌团对苯甲酰二甲基铵类化合物去除率如表1所示。
39.表1实施例1-2和对比例1-9中菌团对苯甲酰二甲基铵类化合物去除率情况变化表
[0040][0041]
经过6天培养后,培养液中菌液密度(od
600
)、tn、tp、tc、tic、toc浓度依次从0.1、328.46mg/l、5.43mg/l、4006.42mg/l、2.26mg/l和4004.16mg/l变化为1.40、164.16mg/l、2.98mg/l、116.22mg/l、1520.45mg/l和1636.67mg/l。实施例1中的菌团对苯甲酰二甲基铵类化合物去除率为92.59%。
[0042]
实施例2
[0043]
同实施例1,所不同的是本实施例的培养基中,k2hpo4·
3h2o的浓度为2.0g/l。菌团的形态如图2所示;菌团对苯甲酰二甲基铵类化合物去除率如表1所示。实施例2中的菌团对苯甲酰二甲基铵类化合物去除率为92.81%。
[0044]
由测序结果可知,菌团中包含拟青霉属、威克汉姆酵母属、隐球菌属、毛霉属、曲霉属以及产碱杆菌属。
[0045]
对比例1
[0046]
同实施例1,所不同的是本对比例的培养基中,不包括酵母提取物,不额外添加k2hpo4·
3h2o,葡萄糖浓度为10g/l。
[0047]
菌团对苯甲酰二甲基铵类化合物去除率如表1所示;测序结果如表2-3所示。
[0048]
由测序结果可知,菌团中包含子囊菌门(ascomycota)、毛霉菌门(mucoromycota)、担子菌门(basidiomycota)和未分类菌门,菌数目相对丰度百分比分别为77.25%、5.53%、17.07%和0.15%。
[0049]
对比例1的菌团中真菌属包括含威克汉姆酵母属(wickerhamomyces sp.)、隐球菌属(cutaneotrichosporon sp.)、毛霉属(mucor sp.)、未分类属和其它属,不包括拟青霉属(purpureocillium sp.)和曲霉属(aspergillus sp.)。
[0050]
对比例1以威克汉姆酵母属(wickerhamomyces sp.)、隐球菌属(cutaneotrichosporon sp.)和毛霉属(mucor sp.)为主,菌数目相对丰度百分比分别为77.25%、17.07%和5.53%。
[0051]
表2对比例1-6菌团中的真菌门多样性
[0052][0053]
表3对比例1-6菌团中的真菌属多样性
[0054][0055][0056]
对比例2
[0057]
同对比例1,所不同的是本对比例的培养基中葡萄糖浓度为20g/l。菌团对苯甲酰二甲基铵类化合物去除率如表1所示;测序结果如表2-3所示。
[0058]
由测序结果可知,对比实施例1,当葡萄糖浓度提高到20g/l时,菌团中毛霉菌门(mucoromycota)和担子菌门(basidiomycota)消失,子囊菌门占比达99.8%以上,另外还有少于0.2%的未分类菌门;菌团中毛霉菌门(mucoromycota)和担子菌门(basidiomycota)消失,不包括威克汉姆酵母属(wickerhamomyces sp.)、隐球菌属(cutaneotrichosporon sp.)、毛霉属(mucor sp.)和曲霉属(aspergillus sp.),拟青霉属(purpureocillium sp.)
占比达99.9%以上。
[0059]
对比例3
[0060]
同对比例1,所不同的是本对比例的培养基中额外添加了浓度为1.0g/l的酵母提取物。菌团对苯甲酰二甲基铵类化合物去除率如表1所示;测序结果如表2-3所示。
[0061]
对比例4
[0062]
同对比例3,所不同的是本对比例的培养基中酵母提取物的浓度为2.0g/l。菌团对苯甲酰二甲基铵类化合物去除率如表1所示;测序结果如表2-3所示。
[0063]
结合对比例3和对比例4来看,添加1g/l和2g/l酵母提取物后,菌团真菌门多样性与对比例2的情况类似,子囊菌门占比达98%以上。不同点在于随着酵母提取物浓度升高未分类真菌门相对丰度变高。
[0064]
尽管添加1g/l和2g/l酵母提取物后,菌团中真菌在门水平上的多样性不明显,但属水平上差异十分明显,当添加2g/l酵母提取物时,拟青霉属(purpureocillium sp.)、威克汉姆酵母属(wickerhamomyces sp.)、隐球菌属(cutaneotrichosporon sp.)和曲霉属(aspergillus sp.),相对丰度百分比分别为72.35%、24.5%、1.99%和1.17%。但酵母提取物添加量为1g/l时菌团中真菌有98.28%为拟青霉属(purpureocillium sp.)。
[0065]
对比例5
[0066]
同对比例3,所不同的是本对比例的培养基中额外添加了浓度为0.5g/l的k2hpo4·
3h2o。测序结果如表2-3所示。
[0067]
结合对比例5和实施例1的测序结果来看,k2hpo4·
3h2o的浓度升高时,子囊菌门(ascomycota)、毛霉菌门(mucoromycota)、担子菌门(basidiomycota)和未分类菌门的相对丰度百分比分别为84.88%、3.63%、7.67%和3.82%。
[0068]
添加不同浓度k2hpo4·
3h2o时,菌团中真菌属多样性差异也分明显。添加0.5g/l k2hpo4·
3h2o时,以威克汉姆酵母属(wickerhamomyces sp.)、毛霉属(mucor sp.)和曲霉属(aspergillus sp.)为主,相对丰度百分比分别为75.15%、13.31%和11.33%。当添加1.5g/l k2hpo4·
3h2o时,以拟青霉属(purpureocillium sp.)、威克汉姆酵母属(wickerhamomyces sp.)、隐球菌属(cutaneotrichosporon sp.)和毛霉属(mucor sp.)为主,相对丰度百分比分别为59.82%、25.06%、7.67%和3.63%。
[0069]
对比例6
[0070]
同实施例1,所不同的是本对比例的培养基中不添加k2hpo4·
3h2o。菌团的形态如图2所示;菌团对苯甲酰二甲基铵类化合物去除率如表1所示;测序结果如表2-3所示。
[0071]
对比例7
[0072]
同实施例1,所不同的是本对比例的培养基中k2hpo4·
3h2o的浓度为0.5g/l。菌团的形态如图2所示;菌团对苯甲酰二甲基铵类化合物去除率如表1所示。对比例7的菌团中菌属为威克汉姆酵母属、毛霉属、曲霉属为主。
[0073]
对比例8
[0074]
同实施例1,所不同的是本对比例的培养基中k2hpo4·
3h2o的浓度为1.0g/l。菌团的形态如图2所示;菌团对苯甲酰二甲基铵类化合物去除率如表1所示。对比例8的菌团中菌属为拟青霉属、威克汉姆酵母属、隐球菌属、毛霉属、曲霉属为主。
[0075]
对比例9
[0076]
同实施例1,所不同的是本对比例的培养基中k2hpo4·
3h2o的浓度为2.5g/l。菌团的形态如图2所示;菌团对苯甲酰二甲基铵类化合物去除率如表1所示。对比例9的菌团中菌属为拟青霉属、隐球菌属、毛霉属为主。
[0077]
由表1可知,实施例1和实施例2得到的菌团在该筛选方法下,培养6天后,对废水中的苯甲酰二甲基铵类化合物的去除率高达92%以上,显著高于对比例1-9。由此可见,利用本发明的筛选方法筛选得到的菌团对苯甲酰二甲基铵类化合物的去除率能够显著高于对比例得到的菌团对苯甲酰二甲基铵类化合物的去除率。
[0078]
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
