一株唐菖蒲伯克霍尔德氏菌p8及其应用
技术领域
1.本发明涉及微生物技术领域,特别是涉及一株唐菖蒲伯克霍尔德氏菌p8及其应用。
背景技术:
2.磷在植物生长中具有重要的作用,是植物能量传递、信号传导、大分子生物合成、光合作用和呼吸作用等代谢过程中的主要营养元素,同时磷元素还是促进根系生长发育的重要营养元素,其缺乏严重制约了植物的生长。酸性土壤本身磷含量很高,但由于酸性土壤对磷有强烈固化作用,使得土壤中大部分的磷被钙、铝或铁矿物结合,形成难溶性的磷酸盐,进而使得土壤中有效磷含量很低,只要少量的有效磷能够提供给植物。平均而言,土壤溶液中的大多数矿质养分以毫摩尔量存在,而磷仅以微摩尔或更少的量存在,植物缺少磷时,就会出现根系发育迟缓,侧根不发达,植株生长缓慢,抵抗力弱。向土壤中施用磷肥是补充植物对磷的需求的一个重要途径,但是磷肥的价格昂贵且利用率低,施用磷肥过量还会造成环境污染和土壤板结等问题。因此,需要在低磷或缺磷土壤中寻找一种环境友好、经济可行的方法来提高植物产量。解磷微生物普遍存在于大多数土壤中,尤其是在根际土壤中,其种类和含量更多,这些解磷微生物能够将土壤中难溶性的磷转化为可以被植物吸收的有效磷,替代化学肥料的使用,解决土壤有效磷低的问题,是一种很有前途的生物肥料。
3.土壤中存在着大量的自养型和异养型的微生物,它们均具有溶解难溶性磷的能力,不同的土壤其解磷微生物的种类和数量也不同,目前已经被报道过的解磷微生物的种类包括假单胞菌(pseudomonas)、阴沟肠杆菌(enterobacter)、芽孢杆菌(bacillus)、根瘤菌(rhizobium)、土壤农杆菌(agrobacterium)、欧文氏菌(erwinia)、链霉菌(streptomyces)、诺卡氏菌属(nocardia)、曲霉菌(aspergillus)、青霉属(penicillium)、木霉属(trichoderma)、鱼腥藻属(anabaena)、念珠藻属(nostoc)、眉藻属(calothrix)、伪枝藻属(scytonema)等。尽管多数研究均表明其筛选到的解磷微生物具有较强的解磷能力,但是很多解磷微生物施入土壤中并没有稳定的效果,有时并没有使作物增产和磷素积累量增加。菌株在实验室中具有较好的解磷能力,但是将其施入到土壤中后解磷能力减弱或者完全消失,主要原因有以下几方面:(1)土壤具有复杂的环境,解磷微生物施入土壤中后无法在土壤中生存和定殖;(2)解磷微生物与土壤微生物之间竞争;(3)解磷微生物对土壤中营养物质的利用能力;(4)解磷微生物解磷能力的退化;(5)土壤的质地,ph、含水量和有机质的含量等都会影响解磷微生物的生长繁殖和其定殖效果。解磷微生物在土壤中能否生存和成功定殖,与土壤中的温度、ph、盐浓度等环境因素有关,同时土壤中的碳源和氮源等营养物质通过影响解磷微生物菌体的繁殖和分泌有机酸的含量,也会对解磷微生物的解磷能力造成影响。
4.望天树(parashorea chinensis wang hsie.)又名擎天树,是龙脑香科柳安属植物,热带雨林标志种及濒危树种,国家一级重点保护野生植物,云南和广西为其主要分布地区。望天树具有很高的科学价值和经济价值,是造船、建筑、桥梁、乐器等制造的优质木材,
应用发展前景可观。根据前期的调查研究和试验发现,望天树在幼苗时根系生长缓慢,侧根不发达,进而使其在幼苗时期生长迟缓,抵抗力弱,死亡率高,磷素对根系的生长发育至关重要,解磷微生物是提高土壤有效磷的主要途径,所以从望天树人工林中分离、筛选高效解磷细菌,是解决望天树苗期和幼树根系发育迟缓、生长缓慢的问题的有效办法。
技术实现要素:
5.本发明的目的是提供一株唐菖蒲伯克霍尔德氏菌p8及其应用,以解决上述现有技术存在的问题,该菌株可以有效将难溶性磷转化为能够被植物吸收的有效磷,并能分泌植物激素和铁载体,促进植物生长。
6.为实现上述目的,本发明提供了如下方案:
7.本发明提供一种唐菖蒲伯克霍尔德氏菌(burkholderia gladioli)p8,保藏于中国微生物菌种保藏中心管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所),保藏日期为2021年07月13日,保藏登记号为cgmcc no.22825。
8.本发明还提供一种上述的唐菖蒲伯克霍尔德氏菌p8的应用,用于将土壤中难溶性的磷转化为可以被植物吸收的有效磷。
9.进一步地,所述难溶性的磷为难溶性的有机磷。
10.本发明还提供一种上述的唐菖蒲伯克霍尔德氏菌p8的应用,用于望天树人工林栽培。
11.进一步地,用于提高望天树苗期和幼树根系发育,促进生长。
12.本发明还提供一种微生物菌剂,包括上述的唐菖蒲伯克霍尔德氏菌p8。
13.本发明公开了以下技术效果:
14.本发明从不同造林年份的望天树人工林中,分离、筛选、鉴定望天树根际高效解磷细菌,对其解磷效果、解磷机理、最佳解磷条件以及菌株分泌相关植物激素和铁载体能力进行研究,以评估解磷细菌将土壤中难溶性的磷转化为可以被植物吸收的有效磷的能力。本发明表明,该菌株在温度为35℃、ph为7.5、碳源为葡萄糖、氮源为硫酸铵、c/n为40:1、盐浓度为1.5%时解无机磷效果最好,其能够分泌磷酸酶和植酸酶,溶解难溶性有机磷,并分泌植物激素和铁载体,促进植物光合作用、呼吸作用、物质和能量代谢,可用于解决望天树苗木根系发育迟缓、幼苗生长缓慢的问题。
附图说明
15.图1为解磷细菌系统发育树的构建;
16.图2为ph值对解有机磷细菌解磷能力的影响;
17.图3为ph值对解无机磷细菌解磷能力的影响;
18.图4为温度对解有机磷细菌解磷能力的影响;
19.图5为温度对解无机磷细菌解磷能力的影响;
20.图6为碳源值对解有机磷细菌解磷能力的影响;
21.图7为碳源值对解无机磷细菌解磷能力的影响;
22.图8为氮源值对解有机磷细菌解磷能力的影响;
23.图9为氮源值对解无机磷细菌解磷能力的影响;
24.图10为c/n值对解有机磷细菌解磷能力的影响;
25.图11为c/n值对解无机磷细菌解磷能力的影响;
26.图12为盐浓度对解有机磷细菌解磷能力的影响;
27.图13为盐浓度值对解无机磷细菌解磷能力的影响;
28.图14为解有机磷细菌解磷能力的动态变化;
29.图15为解无机磷细菌解磷能力的动态变化;
30.图16为解有机磷细菌菌液ph的动态变化;
31.图17为解无机磷细菌菌液ph的动态变化;
32.图18为解有机磷细菌解磷量与ph的的关系;
33.图19为解无机磷细菌解磷量与ph的关系;
34.图20为解无机磷细菌在不同磷源培养基中解磷量;
35.图21为解有机磷细菌分泌酸性磷酸酶活性;
36.图22为解有机磷细菌分泌碱性磷酸酶活性;
37.图23为解有机磷细菌分泌植酸酶活性;
38.图24为解磷细菌分泌iaa含量;
39.图25为解磷细菌分泌赤霉素含量;
40.图26为解磷细菌分泌铁载体活性。
具体实施方式
41.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
42.实施例1望天树根际解磷细菌的分离、筛选与鉴定
43.1.1解磷细菌的分离
44.于2019年8月,在广西南宁树木园,分别选择1978、2011、2012、2017、2018、2019年造林的望天树人工林,收集望天树根系及粘附在根际上的土样。
45.利用卵磷脂有机磷培养基和磷酸钙无机磷培养基从不同造林年份的望天树根际土壤中分离解磷细菌,共获得68个分离物,其中有30个分离物在有机磷或无机磷固体培养基上能够形成明显的透明圈,说明这30株菌株具有溶解难溶性有机磷或无机磷的能力,将该30株能够产生溶磷圈的菌株编号为p1~p30。
46.1.2解磷细菌的筛选
47.1.2.1解磷细菌的初筛
48.将上述分离出的p1~p30共30株菌株分别接种到有机和无机磷固体培养基中,对其产生的透明圈的直径(d)与菌落直径(d)之间的比值进行测定,结果如表1所示,在有机磷固体培养基中,d/d》2.0的有10株,分别为p1、p2、p5、p7、p8、p14、p22、p27、p28、p30,占菌株总数的33.3%,说明该10株菌株解有机磷能力较强,1.5《d/d《2.0的有6株,占菌总数的20%,1.0《d/d《1.5的有14株,占菌株总数的46.7%,在30株菌株中,菌株p14在有机磷固体培养基上d/d值最大,为2.15,菌株p23d/d值最小,为1.05。
49.在无机磷培养基中,不同菌株其d/d存在显著的差异性,d/d》2.0的有8株,分别为
p4、p8、p10、p12、p15、p23、p25、p30,占菌株总数的26.7%,1.5《d/d《2.0的有8株,占菌总数的26.7%,1.0《d/d《1.5的有14株,占菌株总数的46.6%,在30株菌株中,菌株p12在无机磷培养基上的d/d值最大为2.16,菌株p13d/d值最小为1.061。
50.表1解磷细菌初筛的结果
51.[0052][0053]
注:d/d表示解磷细菌解磷圈的直径/解磷细菌菌株直径,表内数据为平均值
±
标准误,同列数值后相同字母表示差异不显著(p》0.05),不同字母表示差异显著(p《0.05)。
[0054]
1.2.2解磷细菌的复筛
[0055]
对固体培养基上解磷菌株产生的解磷圈的观察,只是定性测定菌株解磷能力的一种方法,为了能够更准确的判断菌株的解磷能力,将初筛得到的解磷能力较强的菌株,即d/d》2.0的10株解有机磷菌株和8株解无机磷菌株进行复筛,用液体培养法对菌株培养液中有效磷含量进行定量测定。
[0056]
分别配制有机和无机磷液体培养基,将供试菌株接种到牛肉膏蛋白胨固体培养基上30℃活化24h,接种一环活化后的菌体于lb液体培养基中,30℃振荡培养24h制成种子液,用灭菌的移液枪准确量取1ml的种子液接种到经过灭菌的有机和无机磷的液体培养基里,对照(ck)为不接种菌液,每个菌3个重复,接种后置于摇床中,摇床的温度为30℃,转速为180r/min,振荡培养7d,7d后取出,有机磷培养液12000r/min离心30min,无机磷培养10000r/min离心15min,吸取上清液,用钼锑抗比色法测定含磷量,计算解磷率,结果如表2和表3所示。
[0057]
由表2可知,在以卵磷脂为有机磷源培养基中,10株菌株培养液中有效磷含量均显著高于对照ck(6.38mg/l),说明该10株菌株在有机磷液体培养基中均具有一定的解磷能力,各菌株溶解有机磷的量介于16.18~41.58mg/l之间,不同菌株之间解磷量差异显著,菌株p7解磷量最高为41.58mg/l,菌株p14解磷量最低为16.18mg/l。与ck相比,培养液中有效磷增量在9.8mg/l~35.20mg/l之间,增幅为ck的1.54~5.52倍。各菌株培养液中有效磷含量从大到小依次为p7》p8》p5》p1》p28》p30》p2》p22》p27》p14,10株菌株解磷率介于1.96%~7.04%之间,解磷率大于5%的有4株,分别为菌株p1、p5、p7和p8,说明该4株菌株解有机磷能力较强,该4株菌株中菌株p1来源于2019年造林的望天树根际土壤,菌株p5和p7均来源于2018年造林的望天树根际土壤,菌株p8来源于2017年造林的望天树根际土壤。
[0058]
由表3可知,在磷酸钙无机磷液体培养基中,8株解无机磷细菌培养液中有效磷含量均显著高于对照ck(21.44mg/l),不同菌株培养液中有效磷含量差异显著。8株解无机磷细菌培养液中有效磷含量在305.33mg/l~598.89mg/l之间,解磷率介于5.68%~11.55%之间。与ck相比,有效磷增量在283.89mg/l~577.45mg/l之间,增幅为ck的13.24~26.93倍。各菌株培养液中有效磷含量从大到小依次为p30》p8》p4》p12》p23》p15》p10》p25,菌株p4、p8、p12和p30解磷量较高,培养液中有效磷含量分别高达552.87mg/l、559.78mg/l、548.53mg/l和598.89mg/l,解磷率分别为10.63%、10.77%、10.54%和11.55%,解磷率达到10%以上,说明菌株p4、p8、p12和p30溶解无机磷能力较强,菌株p4来源于2019年造林的望天树根际土壤,菌株p8和p12来源于2017年造林的望天树根际土壤,菌株p30来源于1987年造林的望天树根际土壤,该4株菌株可以考虑作为研制微生物肥料的重点菌种。
[0059]
表2解有机磷细菌复筛
[0060]
造林年份菌株号有效磷含量(mg/l)解磷率(%)2019p133.08
±
1.02b5.342019p218.87
±
0.06de2.502018p533.39
±
1.31b5.402018p741.58
±
0.64a7.042017p839.53
±
0.79a6.632017p1416.18
±
0.20f1.962011p2217.16
±
1.11ef2.161978p2716.67
±
0.47ef2.061978p2821.52
±
0.42c3.031978p3020.74
±
0.64cd2.87 ck6.38
±
0.91g0
[0061]
表3解无机磷细菌复筛
[0062][0063][0064]
1.3解磷细菌的鉴定
[0065]
1.3.1菌体形态学鉴定和生理生化鉴定
[0066]
将筛选好的解磷细菌划线纯化后,观察菌落大小、颜色等特征,进行革兰氏染色、氧化酶试验、接触酶试验、吲哚试验、vp、柠檬酸盐、明胶液化、硫化氢、甲基红等生理生化试验。
[0067]
对上述分离筛选出的4株解有机磷能力较强的菌株p1、p5、p7、p8和4株解无机磷能力较强的菌株p4、p8、p12、p30的细胞形态和菌落特征进行观察,其中p8既具有解有机磷能力又具有解无机磷的能力,各菌株菌落形态特征观察结果见表4。
[0068]
表4解磷细菌形态观察
[0069][0070][0071]
对解磷细菌的各项生理生化鉴定项目包括:柠檬酸盐试验、明胶水解试验、接触酶试验、v-p反应、吲哚试验、淀粉水解试验、硝酸盐还原试验、产h2s试验等,菌株测试的各个项目的结果如表5所示,各个测试项目均做了3个重复,测定的结果比较稳定。实验结果表明,菌株p1和p30的特征相同,均表现为能利用柠檬酸盐,能使明胶水解、接触酶反应为阳性、能产生吲哚,能使淀粉水解和硝酸盐还原,菌株p5、p7、p8、p4和p12的特征相同,均表现为能利用柠檬酸盐、能使明胶水解、接触酶反应为阳性,能使硝酸盐还原,根据菌株的形态学和生理生化特性可以初步断定菌株p1和p30可能为芽孢杆菌属,菌株p5、p7、p8、p4和p12可能为伯克霍尔德氏菌属。
[0072]
表5解磷细菌的生理生化鉴定
[0073]
测试项目p1p5p7p8p4p12p30柠檬酸盐+++++++明胶水解试验+++++++接触酶反应+++++++v-p反应+
‑‑‑‑‑
+吲哚试验+
‑‑‑‑‑
+淀粉水解试验+
‑‑‑‑‑
+硝酸盐还原试验+++++++h2s
‑‑‑‑‑‑‑
[0074]
注:+表示阳性,-表示阴性
[0075]
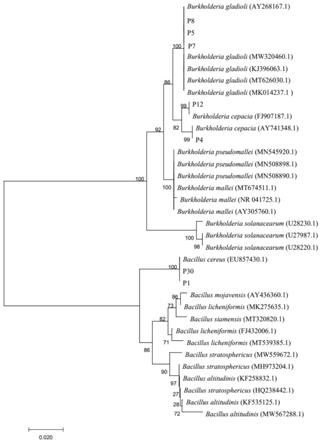
为了验证根据形态学和生理生化特性对菌株做出的猜测是否准确,本发明又对菌株做了分子生物学的鉴定。将菌株所测的16srdna序列(本发明的唐菖蒲伯克霍尔德氏菌p7的16srdna碱基序列,如seq id no.1所示)与genbank核酸数据库中其它的16srdna序列进行同源性对比,运用clustalx进行分析,利用mega7.0采用neighbor joining法构建系统发育树,7个菌株通过blast比对,都能在数据库中找到同源性非常高的相似菌株序列。菌株p1和p30与芽孢杆菌属具有较高的序列相似性,菌株p4、p5、p7、p8和p12与伯克霍尔德氏菌属具有较高的序列相似性,从图1的系统发育树可以看出,菌株p5、p7和p8与burkholderia gladioli位于同一分支,菌株p4和p12与burkholderia cepacia位于同一分支,菌株p1和p30与bacillus cereus位于同一分支,亲缘关系较近,因此,综合各菌株的形态特征、生理生化特性和系统发育分析结果,分别将菌株p5、p7和p8鉴定为唐菖蒲伯克霍尔德氏菌(burkholderia gladioli),菌株p4和p12鉴定为洋葱伯克霍尔德菌(burkholderia cepacia),菌株p1和p30鉴定为蜡状芽孢杆菌(bacillus cereus)。
[0076]
1.4解磷细菌的保藏
[0077]
唐菖蒲伯克霍尔德氏菌p7于2021年07月13日保藏于中国微生物菌种保藏中心管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所),保藏登记号为cgmcc no.22824。
[0078]
实施例2望天树根际解磷细菌最佳解磷条件的筛选
[0079]
经实施例1试验筛选出来的解有机磷细菌p1、p5、p7和p8,解无机磷细菌p4、p8、p12和p30作为试验材料,进一步研究解磷细菌的解磷条件。
[0080]
2.1ph值对解磷细菌解磷能力的影响
[0081]
分别配制有机磷和无机磷液体培养基,初始ph分别设置为3.5、4.5、5.5、6.5、7.5和8.5,分装于150ml三角瓶中,每瓶30ml,121℃高温灭菌20min。分别吸取解有机磷细菌种子液1ml接种于不同ph的有机磷液体培养基中,吸取解无机磷细菌种子液1ml接种于不同ph的无机磷液体培养基中,每个处理设3个重复,置180r/min、30℃摇床培养7d,7d后对菌液进行离心,吸取上清液,测定菌液中有效磷含量,结果如图2和图3。
[0082]
如图2可知,4株解有机磷细菌在不同ph条件下解磷能力不同,ph为3.5时4株菌株均表现为较低的解磷能力,说明ph为3.5时,菌株的解磷能力已受到限制,随着ph的升高,各菌株菌液中有效磷含量均呈现先升高后降低的趋势,菌株p5最适的ph范围为6.0~7.0之间,在ph为6.5时菌液中有效磷含量达到最高为43.01mg/l,说明菌株p5在偏酸性环境中培养,其解磷能力较强。菌株p1、p7和p8的最适ph范围均为7.0~8.0,3株菌株均在ph为7.5时解磷效果最好,菌液中有效磷含量分别为41.86mg/l、44.19mg/l和45.43mg/l,说明菌株p1、p7和p8在偏碱性环境中具有较强的解磷能力。
[0083]
如图3可知,4株解无机磷细菌在不同ph条件下解磷能力不同,ph为3.5时4株菌株同样表现为较低的解磷能力,说明强酸性环境下不适合菌株的生长和发挥其解磷能力,随着ph的升高,各菌株菌液中有效磷含量均呈现先升高后降低的趋势。菌株p30和p4的最适ph均为6.5,在ph为6.5时,菌株p30和p4菌液中有效磷含量均最高,分别为577.37mg/l和551.83mg/l。其中菌株p30在ph4.5~7.5之间菌液中有效磷含量变化不大且菌液中有效磷含量始终很高,说明菌株p30对环境的酸碱度具有较强的适应能力和较广的ph适应范围。菌株p8和p12的最适ph为7.5,两菌株均在ph为7.5时,菌液中有效磷含量达到最高,分别为
579.74mg/l和551.90mg/l,说明菌株p8和p12在偏碱性环境中解磷能力较强。
[0084]
2.2温度对解磷细菌解磷能力的影响
[0085]
分别配制有机磷和无机磷液体培养基,分装于150ml三角瓶中,每瓶30ml,121℃高温灭菌20min。分别吸取解有机磷细菌种子液1ml接种于有机磷液体培养基中,吸取解无机磷细菌种子液1ml接种于无机磷液体培养基中,置于10℃、15℃、20℃、25℃、30℃、35℃、40℃、45℃下摇床培养7d,每个处理设3个重复,7d后对菌液进行离心,吸取上清液,测定菌液中有效磷含量,结果如图4和图5。
[0086]
如图4可知,4株解有机磷细菌在不同温度培养条件下其菌液中有效磷含量不同,4株菌株均在温度为10℃时菌液中有效磷含量最低,菌株p5、p8和p7均在35℃时解磷效果最好,其菌液中有效磷含量分别为39.05mg/l、42.40mg/l和45.31mg/l,其次为30℃,菌液中有效磷含量分别为33.39mg/l、39.53mg/l和41.58mg/l,菌株p1在30℃时解磷效果最好,其菌液中有效磷含量为33.08mg/l,其次为35℃,有效磷含量为29.96mg/l。4株有解有机磷细菌在30℃和35℃培养条件下菌液中有效磷含量高于其各自其它温度处理,说明30℃~35℃为4株解有机磷细菌的最适解磷温度范围,其中菌株p1的最佳解磷温度30℃,菌株p5、p7和p8的最佳解磷温度为35℃。
[0087]
如图5可知,菌株p12和p4在25℃~35℃之间解磷量均较高,且在30℃时菌液中有效磷含量最高,分别为548.53mg/l和552.87mg/l,其次为35℃和25℃,p12和p4在35℃时的解磷量分别为477.74mg/l和500.98mg/l,在25℃时解磷量分别为437.71mg/l和472.68mg/l。菌株p30在30℃时菌液中有效磷含量最高为598.89mg/l,其次为35℃为517.09mg/l。菌株p8在35℃时菌液中有效磷含量最高为623.71mg/l,其次为30℃有效磷含量为559.78mg/l。菌株p12和p4在25℃、30℃和35℃时菌液中有效磷含量显著高于各自其它温度处理,说明菌株p12和p4的最适解磷温度范围为25~35℃,菌株p30和p8在30℃和35℃时菌液中有效磷含量显著高于各自其它温度处理,说明菌株p30和p8的最适解磷温度范围为30℃~35℃,综上4株解无机磷细菌中菌株p30、p12和p4的最佳解磷温度为30℃,菌株p8的最佳解磷温度为35℃。
[0088]
2.3碳源对解磷细菌解磷能力的影响
[0089]
将有机磷和无机磷液体培养基中的葡萄糖用含碳量相等的乳糖、蔗糖、可溶性淀粉、甘露醇替换,分装于150ml三角瓶中,每瓶30ml,121℃高温灭菌20min,不同碳源培养基中的接种量和摇床培养条件同2.1,培养7d后测定菌液中有效磷含量,结果如图6和图7。
[0090]
由图6可知,不同碳源对4株解有机磷细菌的解磷能力影响显著,在5种不同的碳源中,4株解有机磷细菌解磷能力依次为:p5:葡萄糖》蔗糖》乳糖》可溶性淀粉》甘露醇,p8:葡萄糖》乳糖》蔗糖》可溶性淀粉》甘露醇,p1:蔗糖》葡萄糖》乳糖》可溶性淀粉》甘露醇,p7:葡萄糖》蔗糖》乳糖》可溶性淀粉》甘露醇,整体上来看,在葡萄糖、蔗糖、乳糖时4株菌株解磷效果较好,在可溶性淀粉和甘露醇为碳源时解磷效果较差,菌株p5、p8和p7均在葡萄糖为碳源时解磷量最高,分别为33.39mg/l、39.53mg/l和41.58mg/l,菌株p1在蔗糖为碳源时解磷量最高为23.64mg/l,因此菌株p5、p8和p7选择葡萄糖,菌株p1选择蔗糖作为最佳碳源。
[0091]
由图7可知,4株解无机磷细菌在不同碳源条件下解磷能力不同,在5种不同的碳源中,4株解无机磷细菌解磷能力依次为:p30:蔗糖》葡萄糖》乳糖》可溶性淀粉》甘露醇,p12:乳糖》葡萄糖》蔗糖》可溶性淀粉》甘露醇,p8:葡萄糖》乳糖》蔗糖》可溶性淀粉》甘露醇,p4:
乳糖》葡萄糖》蔗糖》可溶性淀粉》甘露醇,尽管4株菌株在不同碳源条件下解磷能力各不相同,但从图中可以看出,4株菌株均在以葡萄糖、蔗糖和乳糖为碳源时解磷效果较好,以甘露醇为碳源时解磷量最低,与解有机磷细菌规律相同,说明无论是解有机磷细菌还是解无机磷细菌对碳源的利用均以单糖和双塘为主,对多糖的利用效率较低。菌株p30在以蔗糖为碳源时解磷量最高为651.10mg/l,菌株p12和p4均在以乳糖为碳源时解磷量最高分别为489.39mg/l和500.98g/l,菌株p8在以葡萄糖为碳源时解磷量最高为559.78mg/l,说明菌株p30的最佳碳源为蔗糖,菌株p12和p4的最佳碳源为乳糖,菌株p8的最佳碳源为葡萄糖。
[0092]
2.4氮源对解磷细菌解磷能力的影响
[0093]
将有机磷和无机磷液体培养基中的硫酸铵,用含氮量相等的尿素、硝酸钾、硝酸钠、草酸铵替换,分装于150ml三角瓶中,每瓶30ml,121℃高温灭菌20min。不同氮源培养基中的接种量和摇床培养条件同2.1,培养7d后测定菌液中有效磷含量,结果如图8和图9。
[0094]
由图8可知,不同氮源显著影响着菌株的解磷能力,在5种不同的氮源中,4株解有机细菌解磷能力依次为:p5:硫酸铵》草酸铵》尿素》硝酸钠》硝酸钾,p8:硫酸铵》草酸铵》尿素》硝酸钠》硝酸钾,p1:硝酸钾》硫酸铵》草酸铵》硝酸钠》尿素,p7:硫酸铵》草酸铵》尿素》硝酸钾》硝酸钠,菌株p5、p8和p7均在硫酸铵为氮源时解磷量最高分别为33.39mg/l、39.53mg/l和41.58mg/l且显著高于其它氮源,菌株p1在以硝酸钾为氮源时解磷量最高为32.98mg/l,菌株p5在以硝酸钾为氮源时解磷量最低为10.56mg/l,菌株p8和p7在以硝酸钠为氮源时解磷量最低分别为16.61mg/l和19.09mg/l,菌株p1在以尿素为氮源时的解磷量最低为6.16mg/l,由图中可以明显的看出,铵态氮与硝态氮对菌株的解磷能力有不同程度的影响,菌株p5、p8和p7在以硫酸铵和草酸铵为氮源时解磷量较高,在以硝酸钾和硝酸钠为氮源时解磷效果较差,菌株p1在以硝酸钾和硫酸铵为氮源时解磷效果较好,说明菌株p5、p8和p7在以铵态氮为氮源时解磷效果较尿素和硝态氮好,而菌株p1在铵态氮和硝态氮中均能发挥较好的解磷能力,尤其是硝态氮,效果更突出。因此菌株p5、p8和p7的最适氮源为硫酸铵,菌株p1的最适氮源为硝酸钾。
[0095]
由图9可知,不同氮源对4株解无机磷细菌解磷能力影响显著,在5种不同的氮源中,4株解无机磷细菌解磷能力依次为:p30:硫酸铵》硝酸钾》硝酸钠》草酸铵》尿素,p12:草酸铵》硫酸铵》尿素》硝酸钾》硝酸钠,p8:硫酸铵》草酸铵》尿素》硝酸钾》硝酸钠,p4:草酸铵》硫酸铵》尿素》硝酸钠》硝酸钾,菌株p30在以硫酸铵为氮源时解磷量最高,为598.89mg/l,其次为硝酸钾解磷量为556.82mg/l,略低于其在硫酸铵中的解磷量,菌株p12和p4均在以草酸铵为氮源时解磷量最高,分别为461.45mg/l和477.37mg/l,菌株p8在以硫酸铵为氮源时解磷量最高为559.78mg/l。从图中可以看出,菌株p12、p8和p4均在以硫酸铵和草酸铵为氮源解磷效果较好,以尿素为氮源次之,在以硝酸钾和硝酸钠为氮源时解磷量最低,说明菌株p12、p8和p4在以铵态氮为氮源时有最佳的解磷效果,菌株p30在以硫酸铵和硝酸钾为氮源时解磷效果较好,说明菌株p30对硝态氮和铵态氮均能较好的利用,但在硫酸铵中解磷量略高于在硝酸钾中,在尿素中有效磷含量最低为。综上可知,菌株p30和p8的最佳氮源为硫酸铵,菌株p12和p4的最佳氮源为草酸铵,4株菌株均在以铵态氮为氮源时解磷效果较好。
[0096]
2.5c/n比对解磷细菌解磷能力的影响
[0097]
以有机磷和无机磷液体培养基中葡萄糖和硫酸铵为碳源、氮源,将c/n比调至40:1、20:1和8:1,分装于150ml三角瓶中,每瓶30ml,121℃高温灭菌20min。不同c/n培养基中接
种量和摇床培养条件同2.1,培养7d后测定菌液中有效磷含量,结果如图10和图11。
[0098]
如图10可知,菌株p5在c/n为20:1和40:1条件下的解磷能力显著高于c/n为8:1,在c/n为40:1条件下解磷量为34.52mg/l略高于20:1,但二者差异不显著,说明菌株p5在c/n为20:1和40:1条件下均具有较好的解磷能力,但最适c/n为40:1。菌株p8的解磷量随着c/n的增加而显著增加,当c/n为40:1时菌株p8的解磷能力最强,解磷量为45.94mg/l,相当于c/n为8:1时的1.74倍。菌株p1在c/n为20:1时解磷量最高为33.08mg/l,显著高于c/n为8:1和40:1条件下的解磷量,分别是c/n为8:1和40:1时解磷量的1.61和1.73倍,在8:1和40:1时p1的解磷量差异不显著。菌株p7在c/n为40:1时解磷量最高为50.21mg/l,显著高于c/n为8:1和20:1时的解磷量,菌株在8:1和20:1时解磷量差异不显著。由以上可知,菌株p5、p8和p7的最适c/n均为40:1,菌株p1的最适c/n为20:1。
[0099]
如图11可知,菌株p30、p12和p4均在c/n为20:1时解磷量最高,分别为581.89mg/l、493.71mg/l和501.44mg/l,其次为40:1,在c/n为8:1时3株菌株的解磷量均最低,在c/n为20:1时3株菌株解磷量分别是c/n为8:1时解磷量的2.07倍、2.42倍和2.28倍。菌株p8在c/n为40:1时解磷量最高为532.61mg/l,其次为20:1,在c/n为8:1时解磷量最低,p8在c/n为40:1时解磷量是20:1的2.36倍,从图中可以看出,4株菌株在c/n为40:1和20:1时均有较好的解磷能力,其中菌株p30、p12和p4的最适c/n为20:1,p8的最适c/n为40:1,而在c/n为8:1时解磷量均最低,说明c/n为8:1的培养条件不利于菌株发挥其解磷能力。
[0100]
2.6盐浓度对解磷细菌解磷能力的影响
[0101]
配制盐浓度为0、1%、2%、3%、4%、5%的有机磷和无机磷液体培养基,分装于150ml三角瓶中,每瓶30ml,121℃高温灭菌20min。不同盐浓度培养基中接种量和摇床培养条件同2.1,培养7d后测定菌液中有效磷含量,结果如图12和图13。
[0102]
由图12可知,不同盐浓度对4株解有机磷细菌解磷能力影响显著,4株菌株在盐浓度为5%和10%时解磷能力显著降低,说明盐浓度过高会显著的抑制菌株的解磷能力,在不同的盐浓度中,菌株p5、p8和p1表现出相同的规律,均在1.5%盐浓度下解磷量最高分别为28.43mg/l,34.58mg/l和27.27mg/l,且显著高于其各自其它盐浓度处理下的解磷量,在盐浓度为0.5%和1.5%时菌株解磷量差异不显著,在盐浓度为10%时3株菌株的解磷量均最低分别为1.16mg/l,1.02mg/l和1.13mg/l。菌株p7与其他3株菌株不同,p7在盐浓度为2.5%时解磷量为40.63mg/l显著高于该菌株在其它盐浓度处理下解磷量,在盐浓度为10%时解磷量最低为1.25mg/l,因此可知菌株p5、p8和p1的最适盐浓度为1.5%,菌株p7的最适盐浓度为2.5%。
[0103]
由图13可知,当盐浓度达到2.5%时,4株菌株菌液仍具有较高的有效磷含量,说明4株菌株在盐浓度为2.5%仍具有较好的耐盐能力,当盐浓度继续升高,达到5%时,菌株p30仍具有较高的解磷能力,菌液中有效磷含量为117.79mg/l而菌株p12、p8和p4菌液中有效磷含量显著降低,分别为11.12mg/l、16.76mg/l和13.36mg/l,说明与其它3株菌株相比,菌株p30表现出强耐盐能力,当盐浓度达10%时,4株菌株有效磷含量均降至最低,由此可知菌株具有一定的最适盐浓度范围,过高浓度的nacl会显著的抑制菌株的解磷能力。从图中可以看出,菌株p12、p8和p4的最适盐浓度范围均为0~2.5%,其中菌株p12和p4在盐浓度为0.5%时解磷能力最强,菌液中有效磷含量分别为3235.35mg/l和349.15mg/l,说明菌株p12和p4的最适盐浓度为0.5%,两菌株在盐浓度为0.5%时的解磷量分别是盐浓度为10%时解
磷量的79.06倍,菌株p8在盐浓度为1.5%时解磷能力最强,解磷量为400.70mg/l,是盐浓度为10%时解磷量的66.67倍,说明菌株p8的最适盐浓度为1.5%,菌株p30的最适盐浓度范围为0~5%,其中p30在盐浓度为1.5%时解磷能力最强,菌液中有效磷含量高达450.33mg/l,是盐浓度为10%时的47.40倍,说明菌株p30的最适盐浓度为1.5%。综上可知,不同菌株其最适盐浓度不同,菌株p30的适盐浓度为1.5%,菌株p12和p4的最适盐浓度为0.5%,菌株p8的最适盐浓度为1.5%。
[0104]
实施例3望天树根际解磷细菌解磷机理
[0105]
3.1试验方法
[0106]
3.1.1解磷细菌解磷能力和菌液ph的测定
[0107]
供试菌株在牛肉膏蛋白胨固体培养基上30℃活化24h,接种一环活化后的菌体于30ml lb液体培养基中,摇床培养24h,转速为180r/min,温度为30℃。吸取培养过夜的各菌株种子液1ml分别接种到30ml有机磷和无机磷液体培养基中(解有机磷细菌接种到有机磷液体培养基中,解无机磷细菌接种到无机磷液体培养基中),每个处理设3个重复,于30℃,180r/min振荡培养7d,每天定时检测菌液中可溶性磷含量和ph值,有效磷含量采用钼锑抗比色法进行测定,ph使用ph计进行测定,并记录每天菌液中有效磷含量和菌液ph值。
[0108]
3.1.2解磷细菌分泌有机酸种类和含量的测定
[0109]
将解无机磷细菌分别接种到无机磷液体培养基中,摇床培养7d,7d后对培养液进行离心,离心条件为8000r/min,离心时间为15min,离心后保留上清液,用0.22μm的滤膜对收集的上清液和各个有机酸标准品进行过滤,去除杂质,超声脱气10min,然后进行高效液相色谱分析。设定与标准有机酸测定相同的色谱条件,同种物质在相同的色谱条件下具有同样的出峰时间,根据这个规律,将菌液中各有机酸出峰时间与标准有机酸对比,即可确定菌液中有机酸的种类,根据菌液中各有机酸的峰面积,对比标准有机酸浓度与峰面积之间的标准曲线,即可求出菌液中各有机酸的含量。
[0110]
3.1.3解磷细菌分泌磷酸酶活性的测定
[0111]
将解有机磷细菌接种到有机磷液体培养基中摇床培养7d,7d后吸取上清液1ml加入ph为6.5的缓冲溶液4ml,然后再加入1ml 0.025mol/l对硝基苯磷酸二钠溶液和4ml 0.5mol/l的氢氧化钠,将上述溶液混匀后于8000r/min离心15min,检测其上清液在420nm处的吸光值,碱性磷酸酶的测定同上将ph为6.5的缓冲液换成ph为11的缓冲液。酶活性的计算以1ml培养液12h催化苯磷酸二钠产生0.1mg苯酚为1个磷酸酶酶活性单位。
[0112]
3.1.4解磷细菌分泌植酸酶活性的测定
[0113]
37℃,ph5.5条件下,1min内从5mmol/l的植酸钠溶液中释放1umol可溶性磷所需要的酶量定义为一个酶活单位。
[0114]
吸取1ml培养7d的有机磷细菌菌液于4000r/min离心10min,将离心后的上清液进行稀释,吸取1ml植酸钠溶液加入25ml的容量瓶中,然后向容量瓶中加入稀释后的菌液,对照为先加入三氯乙酸1ml再加入稀释后的菌液,然后于30℃条件下反应30min,30min后加入tca使反应终止,定容后在710nm下检测其吸光值,同时计算菌液中可溶性磷含量,植酸酶活性的计算公式为:
[0115]
[0116]
其中,n:菌液稀释的倍数;pi:稀释样品中可溶性磷含量mg/l;p0:稀释样品对照中可溶性磷含量mg/l。
[0117]
3.2结果
[0118]
(1)结果如图14~19,如图可知,4株解有机磷细菌中,菌株p1和p5在培养72h~96h时解磷能力最强,菌株p7和p8在培养48h~72h时解磷能力最强,4株菌株均在培养120h菌液中有效磷含量最高,在整个培养过程中菌株p7解磷量均最高,4株菌株解磷量与菌液ph均无显著的相关性。4株解无机磷细菌均在培养48h~72h时解磷能力最强,菌株p30在培养第144h时解磷量最高,菌株p12、p8和p4均在培养第120h解磷量最高,在整个培养过程中菌株p30解磷量均最高,4株解无机磷细菌解磷量与菌液ph均呈极显著负相关。
[0119]
(2)结果如图20,如图可知,菌株p30、p8和p4在三种培养基中的解磷量均表现为磷酸钙》磷酸铁》磷酸铝,菌株p12溶解量表现为磷酸铁》磷酸铝》磷酸钙。4株菌株解磷量相比,在磷酸钙和磷酸铁培养基中4株菌株溶磷量大小顺序为p30》p8》p4》p12,在磷酸铝培养基中4株菌株溶磷量为p30》p12》p8》p4。
[0120]
(3)结果如表6~8。
[0121]
表6解无机磷细菌在磷酸钙培养基中分泌有机酸的种类和含量
[0122]
有机酸种类p30p12p8p4草酸399.27
±
5.77a119.07
±
0.28c168.98
±
0.01b96.01
±
0.01d酒石酸603.22
±
0.58a135.32
±
0.58b102.65
±
0.06c79.97
±
0.01d苹果酸80.85
±
0.01-60.07
±
0.01-乳酸4287.96
±
5.20a413.61
±
6.35c1169.71
±
58.3b392.13
±
6.35c乙酸1863.88
±
0.58
‑‑
119.52
±
1.15柠檬酸174.66
±
0.58
‑‑
551.84
±
17.32丁二酸2145.63
±
0.52a-1056.03
±
9.24b947.15
±
6.35c丙酸212.92
±
5.19a135.23
±
8.66b197.76
±
8.76a-戊二酸182.08
±
6.35b1372.64
±
6.35a179.75
±
0.58b-有机酸总量9950.50
±
5.12a2175.88
±
22.52c2934.95
±
59.55b2186.61
±
31.19c
[0123]
注:表中数据均为平均值
±
标准差,不同小写字母表示不同菌株在0.05水平上差异显著(p《0.05),
“‑”
表示在菌液中没有检测到相应的有机酸,下同。
[0124]
表7解无机磷细菌在磷酸铝培养基中分泌有机酸的种类和含量
[0125]
有机酸种类p30p12p8p4草酸2205.45
±
0.60a70.83
±
5.72d536.23
±
0.64b85.64
±
5.83c酒石酸42.11
±
0.58c-106.17
±
2.89a69.56
±
4.62b苹果酸-35.36
±
1.15c95.91
±
5.77b221.88
±
3.46a乳酸1472.44
±
3.46
‑‑‑
乙酸-503.30
±
1.73131.42
±
1.73-柠檬酸100.58
±
5.78
‑‑‑
丁二酸430.57
±
5.89c-626.31
±
3.46b818.55
±
4.62a丙酸637.44
±
2.891657.44
±
5.77
‑‑
戊二酸
‑‑‑‑
有机酸总量4855.36
±
19.19a2266.93
±
14.38b1496.03
±
14.49c1195.63
±
18.53d
[0126]
表8解无机磷细菌在磷酸铁培养基中分泌有机酸的种类和含量
[0127]
有机酸种类p30p12p8p4草酸3602.58
±
2.31a445.57
±
0.58c863.67
±
17.32b150.78
±
5.78d酒石酸-336.09
±
4.62b31.56
±
1.15c469.07
±
6.93a苹果酸345.49
±
1.73
‑‑‑
乳酸
‑‑‑
411.45
±
5.77乙酸-924.16
±
4.62266.12
±
2.89-柠檬酸-52.34
±
0.58169.89
±
1.15-丁二酸
‑‑
1109.29
±
0.58350.85
±
2.89丙酸2448.65
±
1.15
‑‑‑
戊二酸134.45
±
17.322560.29
±
3.46
‑‑
有机酸总量6556.17
±
14.43a4318.46
±
11.55b2440.54
±
13.86c1382.15
±
4.04d
[0128]
如表可知,在磷酸钙培养基中菌株分泌有机酸总含量大小顺序为p30》p8》p4》p12,在磷酸铝培养基中菌株分泌有机酸总含量大小顺序为p30》p12》p8》p4,在磷酸铁培养基中菌株分泌有机酸总含量大小顺序为p30》p12》p8》p4,除磷酸铁外,菌株在其它两种培养基中解磷量与菌株分泌的有机酸总含量均相对应,说明有机酸的产生是决定菌株解磷量的重要因素,在磷酸钙、磷酸铝和磷酸铁中菌株p30分泌的有机酸总量均最高,分别为9950.50mg/l,4855.36mg/l和6556.17mg/l。在磷酸钙培养基中,菌株p30菌液中检测到有9种有机酸,其中乳酸含量最高,菌株p12检测到5种有机酸,戊二酸含量最高,菌株p8检测到有7种有机酸,乳酸含量最高,菌株p4检测到有6种有机酸,丁二酸含量最高。在磷酸铝培养基中,菌株p30产生6种有机酸,其中草酸含量最高,菌株p12产生4种有机酸中丙酸含量最高,菌株p8和p4分别分泌5种和4种有机酸均为丁二酸含量最高。在磷酸铁培养基中,菌株p30产生4种有机酸中草酸含量最高,菌株p12产生5种有机酸中戊二酸含量最高,菌株p8产生的5种有机酸中丁二酸含量最高,菌株p4产生的4种有机酸中酒石酸含量最高。
[0129]
(4)结果如图21~23,如图可知,4株解有机磷细菌在溶解有机磷过程中均能够分泌磷酸酶和植酸酶,其中菌株p7和p8分泌的酸性磷酸酶和碱性磷酸酶活性显著高于p5和p1,菌株p7分泌的酸性磷酸酶活性为16.61u/ml,碱性磷酸酶活性为11.26u/ml,菌株p8分泌的酸性磷酸酶活性为15.08u/ml,碱性磷酸酶活性为10.83u/ml,菌株p7分泌的植酸酶活性显著高于其它菌株,其菌液中植酸酶活性为0.80u/ml,整体来看,菌株溶解有机磷的量与菌液中酶活性基本成正相关关系。
[0130]
实施例4望天树根际解磷细菌分泌植物激素和铁载体能力的研究
[0131]
4.1试验方法
[0132]
将供试菌株在牛肉膏蛋白胨琼脂斜面培养基上30℃活化24h,用牙签挑取部分菌株接种于30ml lb液体培养基中,摇床培养24h,转速为180r/min,温度为30℃制成种子液。
[0133]
分别取解有机磷和无机磷细菌培养过夜的种子液1ml接种于有机磷和无机磷液体培养基中,于30℃温度下180r/min振荡培养7d。然后将菌液于4000r/min离心20min,将离心后的上清液与salkowsk比色液等体积混合,避光反应30min后测定其在540nm处的吸光值,得出iaa的含量。
[0134]
分别取解有机磷和无机磷细菌培养过夜的种子液1ml接种于有机磷和无机磷液体
培养基中,于30℃温度下180r/min振荡培养7d,7d后离心取1ml试液测定412nm处的吸光值,求出其赤霉素的含量。
[0135]
将供试菌株在牛肉膏蛋白胨琼脂斜面培养基上30℃活化24h后用牙签挑取部分菌
[0136]
株接种于30ml lb液体培养基中,转速为180r/min,温度为30℃振荡过夜,使菌液od600=1,在mkb液体培养基中接种1ml菌液,于30℃180r/min摇床培养48h,48h后将菌液于5000r/min离心10min,吸取离心后的菌液与cas检测液体各3ml混合均匀,反应1h后于630nm处测其吸光度,以不接菌液的mkb液体培养基为对照,铁载体的计算公式为:
[0137]
u(%)=(ar-as)/ar
×
100
[0138]
其中,u:铁载体活性;as:混合液在630nm处的吸光度;ar:不接菌液的mkb液体培养基的吸光度。
[0139]
4.2结果
[0140]
结果如图24~26。由图24可知,4株解有机磷细菌均具有分泌iaa的能力,其iaa分泌量在61.57mg/l~100.75mg/l之间,4株解有机磷细菌分泌iaa含量大小顺序为p7>p8>p5>p1。其中菌株p7 iaa分泌量最高为100.75mg/l,显著高于其它菌株,其次为菌株p8,菌株p5和p1分泌的iaa含量较低,二者差异不显著,菌株p7 iaa分泌量较p5、p8和p1分别高出30.19%、8.89%和38.90%。4株解无机磷细菌同样也具有分泌iaa的能力,4株解无机磷细菌分泌iaa含量大小顺序为p30>p8>p12>p4。其中菌株p30 iaa分泌量最高,为103.27mg/l,其次为菌株p8,其iaa分泌量为91.80mg/l,菌株p4 iaa分泌量最低为22.47mg/l。菌株p30 iaa分泌量分别较菌株p12、p8和p4高出33.66%、78.24%和11.1%,4株菌株之间分泌iaa的量差异显著。
[0141]
由图25可知,4株解有机磷细菌均能够分泌赤霉素,其赤霉素分泌量在19.60mg/l~57.20mg/l之间,4株菌株分泌赤霉素含量大小顺序为p8>p7>p5>p1,其中菌株p7和p8赤霉素分泌量较高,分别为52.99mg/l和57.20mg/l,二者差异不显著,其次为菌株p5,赤霉素分泌量为32.86mg/l,菌株p1赤霉素分泌量最低为19.60mg/l,菌株p7较p5和p1分别高出37.9%和63.0%,菌株p8较p5和p1分别高出42.6%和65.7%,综上4株解有机磷细菌中菌株p8和p7分泌赤霉素能力较强。4株解无机磷细菌赤霉素分泌量具有显著差异,4株菌株分泌赤霉素含量大小顺序为p30>p8>p12>p4,菌株p30和p8赤霉素分泌量较高,分别为57.65mg/l和55.28mg/l,显著高于其它2株菌株,菌株p12和p4赤霉素分泌量分别为23.17mg/l和17.59mg/l,菌株p30较p12和p4分别高出59.8%和69.5%,菌株p8较菌株p12和p4分别高出58.1%和68.2%。综上,4株菌株中菌株p30和p8分泌赤霉素能力较强。
[0142]
从图26可知,4株菌株分泌铁载体活性大小顺序为p7>p8>p5>p1,p7和p8铁载体活性较高,分别为59.32%和61.47%,二者铁载体活性显著高于菌株p5和p1,菌株p5和p1铁载体活性较低,分别为24.14%和24.04%,二者铁载体活性差异不显著,综上,4株解有机磷细菌株中菌株p7和p8分泌铁载体能力较强。4株解无机磷细菌分泌铁载体活性差异显著,其分泌铁载体活性大小顺序为p8》p30》p4》p12,菌株p8菌液中铁载体活性最强为59.58%,其次为p30,铁载体活性为48.28%,菌株p4和p12铁载体活性较低分别为和24.14%和17.16%,综上4株解无机磷细菌中菌株p8分泌铁载体能力最强。
[0143]
本试验对筛选的解磷菌株进行激素分泌能力分析,4株解有机磷细菌相比,菌株p7产生的iaa含量和铁载体活性均最高,分别为100.75mg/l和61.47%,菌株p8分泌的赤霉素
含量最高为57.20mg/l。4株解无机磷细菌中菌株p30分泌的iaa和赤霉素含量最高,分别为103.27mg/l,57.65mg/l,菌株p8菌液中铁载体活性最高为59.58%。本发明筛选的菌株具有较好分泌iaa、赤霉素和铁载体的能力,将其制成微生物菌肥施入土壤中能够很好的解决土壤有效磷含量低,望天树苗木根系发育迟缓,幼苗生长缓慢的问题。
[0144]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
