一种sillen-aurivillius层状结构材料bi4sbo8cl及合成方法
技术领域
1.本发明涉及一种层状结构窄带隙半导体材料,属于纳米材料的制备领域。
背景技术:
2.sillen-aurivillius层状结构材料是一类复合氧化铋的层状材料,由—bi2o2—层和—mo
x
—类钙钛矿层叠加而成(其中m为其它金属元素),具有优异的光电性能,应用领域广泛,具有显著的经济和社会效益。目前已成功合成的sillen-aurivillius层状结构材料有bi4nbo8cl、bi4tao8cl等,其中—mo
x
—类钙钛矿层中m元素包括nb、ta、v、w、pb等,但这些材料主要存在禁带宽度较宽,电子空穴复合率高,导带位置不满足满足h2/h
+
还原电位要求,或者m元素昂贵等问题,亟待解决。
技术实现要素:
3.本发明目的在于克服以上技术问题的不足,提出了一种sillen-aurivillius层状结构材料bi4sbo8cl及其合成方法。
4.为了实现上述发明目的,本发明提供以下技术方案:一种sillen-aurivillius层状结构材料bi4sbo8cl,其微观结构为—cl—bi2o2—sbo4—bi2o2—cl—,能够吸收波长小于500 nm的可见光和紫外光,且导带位置满足h2/h
+
电位要求。
5.本发明还提出了一种sillen-aurivillius层状结构材料bi4sbo8cl的合成方法,包括以下步骤:(1)将sb2o4以及含有bi和cl的氧化物或其盐类进行研磨,所得混合物进行高温固相反应;(2)将步骤(1)所得反应物继续研磨一段时间,再次进行高温固相反应。
6.较佳的,步骤(1)中,sb2o4采用高温固相法制备,其步骤为:将sb2o5研磨一段时间,然后进行高温固相反应得到sb2o4。
7.具体的,研磨5min~30min。
8.具体的,高温固相反应条件为:煅烧温度为700~1000
º
c,反应时间为1h~6h,升温速率为3~7
ꢀº
c/min。
9.较佳的,步骤(1)中,sb2o4采用水热法制备,其步骤为:将sbcl3和尿素溶解在水里,调节ph至10,水热反应一段时间得到sb2o4。
10.具体的,sbcl3和尿素的摩尔比为1:1。
11.具体的,水热反应温度为150 ℃,水热反应时间为18h。
12.较佳的,步骤(1)中,研磨5min~30min。
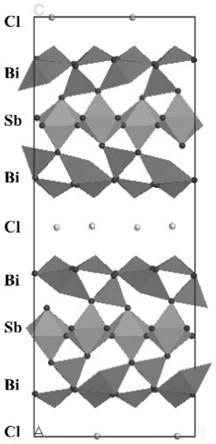
13.较佳的,步骤(1)中,bi和cl的氧化物或其盐类,包括bi2o3,nh4cl,biocl和bicl3。
14.较佳的,步骤(1)中,高温固相反应条件为:煅烧温度为700~900
º
c,反应时间为1h~20h,升温速率为3~7
ꢀº
c/min。
15.较佳的,步骤(2)中,研磨5min~30min。
16.较佳的,步骤(2)中,高温固相反应条件为:煅烧温度800~1000
º
c,反应时间为1h~20h,升温速率为3~7
ꢀº
c/min。
17.较佳的,步骤(2)中,再次进行高温固相反应1~3次。
18.与现有技术相比,本发明具有如下的有益效果:本发明所提供的sillen-aurivillius层状结构材料bi4sbo8cl的微观结构为—cl—bi2o2—sbo4—bi2o2—cl—,可以吸收波长小于500 nm的可见光和紫外光,且导带位置满足h2/h
+
电位要求。该材料可应用于染料、二氧化碳还原、分解水制氢、固氮等领域。
附图说明
19.图1 为本发明bi4sbo8cl微观结构图。
20.图2 为本发明所制备的sb2o4的x射线衍射图。
21.图3 为本发明所制备的bi4sbo8cl的x射线衍射图。
22.图4 为本发明所制备的bi4sbo8cl的紫外可见光吸收谱图。
23.图5 为本发明所制备的bi4sbo8cl的分解水制氢性能图。
具体实施方式
24.下面结合附图和实施例对本发明进行进一步阐述。
25.本发明的创新点体现在于:1)在能带结构上,利用sb取代nb,bi4sbo8cl导带位置满足了h2/h
+
还原电位要求。2)在合成方面,sb源必须使用sb2o4,如sb2o5经过950℃,4h的高温固相反应或者将sbcl
3 在碱性条件下150 ℃水热反应18h转变为sb2o4之后,才能进一步与含bi、cl化合物混合反应制得sillen-aurivillius层状结构材料bi4sbo8cl。
26.实施例1通过高温固相合成sb2o4进而制备光催化剂bi4sbo8cl的过程如下:(1)称取2 g的sb2o5研磨10 min,然后经过950℃,4h的高温固相反应得到sb2o4,x射线衍射图见图2。
27.(2)将sb2o4(0.312 g)与bi2o3(0.932 g)、nh4cl(0.108 g)量取研磨10 min,在马弗炉经过800 ℃,6 h高温固相反应。
28.(3)将得混合物再次经过10 min研磨,然后在马弗炉经过850℃,6h的高温固相反应得到最终产物bi4sbo8cl,其微观结构图见图1,x射线衍射图见图3。所得bi4sbo8cl的紫外可见光吸收谱见附图4,光催化分解水制氢性能见图5。
29.实施例2通过水热法合成sb2o4进而制备光催化剂bi4sbo8cl的过程如下:(1)称取0.005 mol的sbcl3和0.005 mol的尿素溶解在50 ml水里,用氨水调节ph至10,将混合溶液移至反应釜里,反应温度150 ℃,反应时间18h,待反应结束,用去离子水洗涤离心烘干,得到sb2o4,x射线衍射图见图2。
30.(2)将sb2o4(0.312 g)与bi2o3(1.864 g)、nh4cl(0.108 g)量取研磨10 min,在马弗炉经过800 ℃,6 h高温固相反应。
31.(3)将得混合物再次经过10 min研磨,然后在马弗炉经过850℃,6h的高温固相反
应得到最终产物bi4sbo8cl,其x射线衍射图见图3,光催化分解水制氢性能见图5。从图5可知,实施例1制备的bi4sbo8cl光催化分解水制氢性能比实施例2的高十几倍,可能是用两种方法合成出来的sb2o4微观特性(颗粒尺寸,表面缺陷等)有区别,导致最终合成的bi4sbo8cl的微观特性有所不同。
32.对比例1sb2o5未经高温煅烧直接与含bi、cl化合物混合反应。
33.(1)将sb2o5(0.167 g)与bi2o3(0.932 g)、nh4cl(0.054 g)量取研磨10 min,在马弗炉经过800 ℃,6 h高温固相反应。
34.(2)将得混合物再次经过10 min研磨,然后在马弗炉经过850℃,6h的高温固相反应,所得产物主要成分是bisbo4,其x射线衍射图见图3,与实施例1和2对比可知,sb2o5未经高温煅烧直接与含bi、cl化合物混合反应未能得到sillen-aurivillius层状结构材料bi4sbo8cl。与实施例1和2相同的光催化分解水制氢测试条件下,未检测到氢气的生成。
