基于dna载体和复制型痘苗病毒载体的新冠病毒复合型疫苗
技术领域
1.本发明涉及医学生物技术领域,具体涉及dna-痘苗病毒载体复合型新冠疫苗,其能够诱导高水平的抗新型冠状病毒的体液和细胞免疫应答,预防新型冠状病毒感染。
背景技术:
2.新冠肺炎的病原体是新型冠状病毒-2(sars-cov-2),在本发明中也被简称为新冠病毒。sars-cov-2属于冠状病毒科的β-冠状病毒属,是一类有囊膜的单股正链rna病毒,具有较高的突变率,其基因组长度约为30kb。基因组的前2/3是非结构基因orf1a/b,主要编码与病毒复制相关的酶(rna依赖的 rna聚合酶,rdrp),后1/3依次编码四种结构蛋白:刺突蛋白(s),包膜蛋白(e),膜蛋白(m)和核衣壳蛋白(n)。自2021年1月首次发现b.1.1.7(alpha) 变异株后,全球相继报道了b.1.351(beta),p.1(gamma)以及b.1.617.2(delta) 等变异株。变异株的突变位点大多集中在刺突蛋白的受体结合区、剪切位点等,突变提高了病毒的复制能力,与受体结合的亲合力,从而增强了病毒的感染力,最终降低了现有covid-19疫苗的保护效果。
3.冠状病毒表面刺突蛋白(spike protein,s蛋白)是决定病毒嗜性和进入宿主细胞的关键蛋白,由s1和s2两个亚基组成。s1亚基的rbd(receptor-bindingdomain,受体结合域)与受体ace2蛋白结合,s2介导病毒包膜与细胞膜的融合。现有已上市covid-19疫苗,包括灭活疫苗、亚单位疫苗、mrna疫苗以及腺病毒疫苗,除灭活疫苗包含多种病毒抗原外,其他疫苗均仅包含s 蛋白或s基因。迄今发现的sars-cov-2的s基因突变,已使现有疫苗的保护效果大打折扣。因此,要诱导更强大的免疫应答,疫苗需包含除s蛋白外更多的结构蛋白。
4.在sars-cov-2的自然感染过程中,先前的感染只能减轻nhp和雪貂的临床症状,不能预防再次感染。大多数人感染sars-cov-2后,体内出现的抗体在半年后逐渐消减,而t细胞反应存在时间相对较长。有研究表明,sars 感染者的t细胞反应可持续17年之久。由于新冠病毒特异的中和抗体持续存在时间可能较短,诱导持久的t细胞免疫反应才是广谱有效疫苗的关键所在。
5.n蛋白(nucleocapsidprotein)是冠状病毒的核衣壳蛋白,不仅能诱导特异的抗体,还能诱导特异的细胞毒t细胞活性。核衣壳蛋白(n)在小鼠和家兔有很强的免疫原性,诱导的t细胞免疫与动物来源冠状病毒有交叉反应性。sars 感染者体内的n特异性t细胞与sars-cov-2的n蛋白有交叉反应也进一步支持了这一观点。因此,n基因可诱导持久且具有交叉反应活性的细胞免疫,可作为复合新冠疫苗的重要抗原。
6.鉴于现有技术新冠病毒疫苗还存在着免疫保护持续时间短,保护力度低,以及缺乏对变异毒株的广谱保护,本发明的目的在于提供针对新冠病毒感染的基于dna载体和复制型痘苗病毒载体的新冠病毒复合型疫苗,以解决现有技术存在的问题。
技术实现要素:
7.基于上述目的,本发明首先提供了一种同时表达新冠病毒的s基因的胞外区段和n
基因全长区段的重组痘苗病毒,在痘苗病毒天坛株基因组中胸腺苷激酶编码区的位置整合入所述新冠病毒s基因的胞外区段和n基因全长区段,其中,所述s基因的胞外区段和n基因全长区段以5’端相对的方式连接,并分别连接在不同的启动子下游。所述痘苗病毒天坛株(vaccinia virustiantan strain,vtt),保藏号:cctcc:v200416。痘苗病毒天坛株作为疫苗在中国消灭天花的运动中发挥过重要作用,目前在活载体疫苗研究应用也十分活跃。痘苗病毒具有载体容量大,免疫原性强,安全性高等优点,本发明中,痘苗病毒天坛株被选择作为新冠复合疫苗的载体。
8.在一个优选的实施方案中,所述s基因的胞外区段位于痘苗病毒启动子 pe/l的下游,所述n基因全长区段位于痘苗病毒启动子p7.5的下游。
9.更为优选地,所述s基因的胞外区段、启动子pe/l、n基因全长区段和启动子p7.5以串联形式连接,所述串联后的序列如seq id no.3所示。在本发明中的一个优选的重组痘苗病毒技术方案被命名为vtt-2019ncov-sn。
10.在本发明的一个具体的可选择的实施方案中,所述同时表达新冠病毒的s 基因的胞外区段和n基因全长区段的重组痘苗病毒保藏分类命名为“vtt-2019ncov-sn”,保藏号为cgmcc no. 21955,保藏日期为2021年09月28 日,保藏单位为中国微生物菌种保藏管理委员会普通微生物中心,地址为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮政编码:100101。
11.其次,本发明还提供了上述重组痘苗病毒在制备新冠病毒疫苗中的应用。
12.本发明提供的作为新冠病毒疫苗的重组痘苗病毒包含一种穿梭载体,所述载体包含可操纵地连接于启动子的编码sars-cov-2的核壳蛋白(n)的多核苷酸和编码sars-cov-2的刺突蛋白(s)胞外段的多核苷酸。在一个具体的实施方式中,所述dna载体与痘苗病毒天坛株的胸苷激酶(tk)区重组,复制型痘苗病毒基因组的插入编码新冠病毒的核壳蛋白和刺突蛋白的多核苷酸。
13.第三,本发明还提供了含有上述的重组痘苗病毒的免疫接种试剂盒,所述免疫接种试剂盒还含有表达新冠病毒的s基因的胞外区段的dna疫苗,以及表达新冠病毒n基因全长区段的dna疫苗。
14.在一个优选的实施方案中,所述表达新冠病毒n基因全长区段的dna疫苗中的n基因全长区段的核苷酸序列如seq id no.1所示,所述表达新冠病毒的s基因的胞外区段的dna疫苗中的s基因的胞外区段的核苷酸序列如 seq id no.2所示。本发明中的一个具体实施方式中,表达新冠病毒的s基因的胞外区段的dna疫苗被命名为p3.0-sa,表达新冠病毒n基因全长区段的 dna疫苗被命名为p3.0-n,重组痘苗病毒被命名为vtt-2019ncov-sn。
15.在一个更为优选的实施方案中,构建所述dna疫苗p3.0-sa和p3.0-n,的dna载体pdrvi 3.0含有可转录产生具有免疫激活功能的ssrna的序列如 seq id no.4所示的dna。
16.更为优选地,所述表达新冠病毒的s基因的胞外区段的dna疫苗,以及表达新冠病毒n基因全长区段的dna疫苗被制备为注射剂,所述重组痘苗病毒被制备为注射剂或滴鼻剂。
17.第四,本发明还提供了一种制备上述的重组痘苗病毒的方法,所述方法包括将新冠病毒s基因的胞外区段和n基因全长区段以同源重组的方式整合于痘苗病毒基因组中的步骤,在所述同源重组中,以携带有痘苗病毒同源重组序列tkl和tkr的穿梭质粒作为新冠
病毒s基因的胞外区段和n基因全长区段的 dna载体,所述穿梭质粒携带有筛选标记neo基因和gfp基因,以及tkr的重复序列。所述tkr的重复序列,可以使重组痘苗病毒发生二次分子内同源重组,以去掉筛选标记neo基因和gfp基因。因此,本发明提供的作为新冠病毒疫苗的重组痘苗病毒不含有选择标记基因。
18.在本发明的一个具体实施方式中,选用的穿梭质粒pvi75-gfpdr-sn的 tkl和tkr区与痘苗病毒发生同源重组,使目的基因s和n与标记基因neo和 gfp一同重组到痘苗病毒基因组的tk序列中。在g418存在的条件下,由于选择压力分子内未发生同源重组,标记基因neo和gfp暂时保留在基因组中,在荧光显微镜下可以挑取既含目的基因又表达gfp的重组痘苗病毒(未发生重组的痘苗病毒因g418的存在而被抑制生长)。接着在无g418的条件下筛选, gfp+重组痘苗病毒因携带一小段约200bp的tkr重复片段,与完整的tkr发生分子内的二次同源重组,从而丢失neo基因和gfp基因而得到了只含目的基因的重组痘苗病毒。本领域技术人员应当知道,使用本领域其它已知的穿梭质粒,按照本发明提供的基因序列和设计,结合本领域的技术常识,也能够达到本发明的目标,即获得在痘苗病毒基因组中胸腺苷激酶(tk)编码区的位置整合入所述新冠病毒s基因的胞外区段和n基因全长区段并能同时表达的重组痘苗病毒。
19.第五,本发明提供了一种用于制备上述免疫接种试剂盒中表达新冠病毒n 基因全长区段的dna载体中的n基因全长区段的多核苷酸分子,所述多核苷酸分子的序列如seq id no.1所示。
20.第六,本发明提供了一种用于制备上述免疫接种试剂盒中表达新冠病毒s 基因的胞外区段的dna载体中的s基因的胞外区段的多核苷酸分子,所述多核苷酸分子的序列如seq id no.2所示。
21.最后,本发明提供了一种用于制备上述的被整合入重组痘苗病毒天坛株基因组中的编码新冠病毒的s基因的胞外区段和n基因全长区段的多核苷酸分子,所述多核苷酸分子的序列如seq id no.3所示。
22.本发明提供的免疫接种试剂盒可以作为预防新冠病毒感染的复合型疫苗使用,通过0、2、4周的时间顺序对实验动物分别接种p3.0-sa+p3.0-n, p3.0-sa+p3.0-n以及vtt-2019ncov-sn,可以诱导实验动物产生针对新冠病毒 n,s1,s2蛋白特异的cd4,cd8 t细胞反应,且cd8 t细胞反应高于cd4 t 细胞反应,诱导的t细胞免疫可持续至少3个月,结合抗体持续至6个月未见明显下降,表明复合疫苗可以诱导针对sars-cov-2持久的免疫应答,该疫苗诱导的中和抗体具有交叉反应活性,可在一定程度上预防新冠病毒多种变异株的感染。
23.本发明提供的复合型新冠疫苗,所选用的编码抗原的多核苷酸经密码子优化改造,适合在哺乳动物细胞中高效率表达,易于产业化,具有工业实用性。
附图说明
24.图1.dna疫苗载体pdrvi3.0结构示意图;
25.图2.dna疫苗质粒p3.0-sa结构示意图;
26.图3.p3.0-sa酶切鉴定电泳图谱;
27.图4.dna疫苗质粒p3.0-n结构示意图;
28.图5.p3.0-n酶切鉴定电泳图谱;
enc值为53.253,优化后30.354。在基因读码区起始密码子前添加sd序列和kozak序列,后面添加一个终止子。在合成基因的5’端添加sali酶切位点,3’端添加ecorv酶切位点。
50.合成基因序列n全长基因见seqidno:1、s基因的胞外区见seqidno:2。
51.1.3p3.0-sa疫苗的构建
52.以sali和ecorv双酶切合成基因sa,插入载体pdrvi3.0,得到的质粒命名为p3.0-sa。经ncoi酶切可得8.1kb和1.2kb片段(图2,图3)。经测序验证后,基因插入正确。
53.1.4p3.0-n的构建
54.以sali和ecorv双酶切合成基因n片段,插入载体pdrvi3.0,得到的质粒命名为p3.0-n。经ecorv+sali酶切可得5.7kb和3.6kb片段(图4,图5)。经测序验证后,基因插入正确。
55.1.5dna疫苗抗原表达验证
56.p3.0-sa和、p3.0-n质粒各50μg分别转染50ml293f细胞,72小时后裂解细胞,分别用抗s蛋白多抗和n蛋白单抗进行westernblotting检测。结果表明,p3.0-sa、p3.0-n表达的抗原蛋白能够特异性地与抗体结合,表达产物的分子量为134kda,45kda,与预期结果一致(图6)。
57.实施例2:重组痘苗病毒疫苗的构建及鉴定
58.本研究使用载体是痘苗病毒天坛株(保藏号:(cctcc:v200416))。痘苗病毒具有载体容量大,免疫原性强,安全性高等优点,因此我们选择其作为新冠复合疫苗的载体。
59.2.1合成基因
60.重组痘苗病毒疫苗表达的抗原基因为s和n,s基因仅包含sars-cov-2s基因的胞外区,不含跨膜区和胞内区,n抗原是sars-cov-2的n全长基因。以新冠病毒株nc_045512.2的s基因和n基因的氨基酸序列为模板,按照哺乳动物细胞密码子偏好进行调整并基因合成,同时进行的基因优化包括:gc含量、cpg含量、mrna二级结构、隐性剪切位点、pola前成熟位点、内部chi位点、核糖体结合位点、cpg阴性岛、rna不稳定基序、重复序列和酶切位点,并在基因前面添加kozak序列,消除痘苗病毒早期启动子提前终止信号,s和n基因以“back-to-back(背靠背)”的方式分别置于痘苗病毒启动子pe/l、p7.5下游,合成基因s-p-p-n结构示意图如图7所示,序列如seqidno.3所示。
61.2.2穿梭质粒构建及鉴定
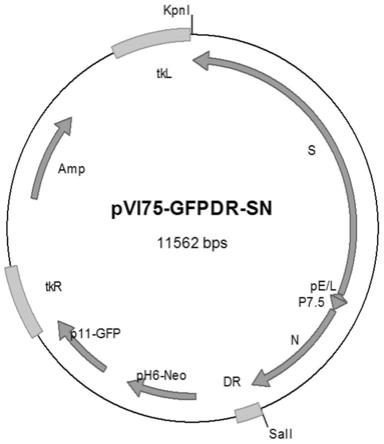
62.将sars-cov-2的抗原基因克隆到穿梭载体上构建穿梭质粒。穿梭载体pvi75gfp-dr由中国疾病预防控制中心性病艾滋病预防控制中心病毒免疫室构建,结构示意图如图8所示。该载体可与痘苗病毒发生重组,构建不带筛选标记的重组痘苗病毒疫苗株。pvi75gfp-dr的序列见seqidno.5,其主要包含以下元件:
①
两个筛选标记:gfp基因和neo基因;
②
同源重组序列tkl和tkr:tkl和tkr是痘苗病毒胸腺苷激酶(tk)的部分片段;
③
dr序列:与tkr末端的200bp的重复序列,能使重组痘苗病毒发生二次分子内同源重组,从而丢掉筛选标记;
④
多克隆位点。
63.将合成的s-p-p-n基因片段,通过kpni和sali限制性内切酶位点克隆入穿梭载体pvi75-gfpdr,获得穿梭质粒pvi75-gfpdr-sn(图9)。
64.2.3重组病毒的筛选和鉴定
65.2.3.1.转染
66.痘苗病毒天坛株感染80-90%成片的鸡胚成纤维细胞(cef)moi=0.01~0.1, 37℃吸附1小时后,弃去培养上清,并用无血清mem培养基洗细胞2次。穿梭质粒pvi75-gfpdr-sn转染病毒感染的cef细胞,方法见试剂盒说明书 (invitrogen lipofectamine 2000)。37℃co2孵箱培养24h,冻融三次后收获转染的病毒液。
67.2.3.2重组病毒筛选
68.穿梭质粒pvi75-gfpdr-sn(鉴定图谱参见图10)的tkl和tkr区与痘苗病毒发生同源重组,使目的基因s和n与标记基因neo和gfp一同重组到痘苗病毒基因组的tk序列中。在g418存在的条件下,由于选择压力分子内未发生同源重组,标记基因neo和gfp暂时保留在基因组中,在荧光显微镜下可以挑取既含目的基因又表达gfp的重组痘苗病毒(未发生重组的痘苗病毒因g418的存在而被抑制生长)。接着在无g418的条件下筛选,gfp+重组痘苗病毒因携带一小段约200bp的tkr重复片段,与完整的tkr发生分子内的二次同源重组,从而丢失neo基因和gfp基因而得到了只含目的基因的重组痘苗病毒。
69.病毒筛选过程见图11。成片的cef细胞先用含0.4mg/ml g418的mem培养基预培养24h,收获的转染病毒液5倍系列稀释后接种到g418预处理的cef细胞, 2小时后吸走病毒感染液,37℃培养48小时(mem培养基含有0.4mg/ml g418,1%低熔点琼脂糖)。挑取5个gfp阳性噬斑至1ml mem维持液中。反复冻融3次, 5倍系列稀释后接种到g418预处理的cef细胞。重复上述过程,单斑连续纯化4 代,得到第四代gfp+噬斑共7株。此时挑取的病毒含有sars-cov-2n和s目的基因、标记基因gfp和neo。7株第四代gfp+噬斑经免疫组化检测,均为阳性。
70.选取2株(sng1-4-1-1,sng5-3-1-1)免疫组化信号强、噬斑较大的gfp+ 重组病毒进行白斑筛选。挑斑液反复冻融3次后,系列稀释后感染六孔板培养的cef细胞,2小时后吸弃病毒液,用低熔点琼脂糖mem培养基37℃培养72小时。从sng1-4-1-1挑取无荧光噬斑54个,从sng5-3-1-1挑取无荧光噬斑63个,为第一代白斑病毒。免疫组化检测第一代白斑病毒细胞,snw18,snw31, snw49,snw78明显阳性。将阳性重组病毒单斑连续纯化6代,得到第6代白色噬斑共15株。
71.免疫组化检测显示15株重组病毒均表达目的基因,其中snw31-3-1-1-1-1; snw31-5-1-1-1-3病斑数量明显高于其他毒种。提取snw31-3-1-1-1-1; snw31-5-1-1-1-3的病毒基因组dna,扩增sars-cov-2的s和n基因,测序结果显示,s、n基因序列与预期序列完全一致。重组病毒snw31-3-1-1-1-1命名为vtt-2019ncov-sn。
72.免疫组化检测抗原表达方法如下:
73.a)重组病毒感染cef,培养48小时后倾去培养上清;
74.b)甲醇:丙酮(1:1)溶液固定细胞2min;
75.c)pbs漂洗两次;
76.d)用含3%胎牛血清的pbs 1:1000稀释2019-ncov np antibody(fb-bio,货号fb2019nr);
77.e)每孔加入0.1ml;摇摆平台上室温孵育1h;
78.f)pbs漂洗两次;每次2min。
79.g)3%胎牛血清pbs 1:5000稀释goat-anti-rabbit igg-hrp(货号
ꢀ‑
4030-05);
80.h)每孔加入0.1ml,摇摆平台上室温孵育30-45min;
81.i)pbs漂洗两次;每次2min。
82.j)加入显色底物dab;室温孵育5-10min。噬斑显色后终止反应。
83.2.3.3.重组病毒的鉴定
84.重组病毒的鉴定包括pcr方法检测sars-cov-2目的基因、测序、westernblot方法检测目的基因表达。
85.(1)pcr检测sars-cov-2目的基因
86.以qiaamp dnablood mini kit(250(51106)试剂盒提取重组病毒 vtt-2019ncov-sn、天坛株的基因组dna,pcr扩增目的基因s和n。引物序列如下:
87.s基因扩增引物:
88.2020cosf:5’atggaccgggccaagttattactg 3’;
89.2020cosr:5’tcactcctgcagatcgatcaggct 3’。
90.n基因扩增引物:
91.2020conf:5’atgtctgacaacggccctcagaac 3’。
92.2020conr:5’tcaggcctgggtgctatcggcgc 3’。
93.结果显示,vtt-2019ncov-sn可特异性扩增出3.6kb和1.3kb的片段,证实重组病毒vtt-2019ncov-sn含有目的基因s和n,如图12所示。
94.(2)测序
95.在重组痘病毒同源重组区的外侧设计pcr引物,扩增s、n基因和启动子片段,纯化后送公司测序。
96.扩增序列为:
97.2020tklf:5’agcttttgggatcaataaatggatc 3’98.2020tkrr2:5’gtcactagagtcacatcacgcaatc 3’99.测序结果与设计序列一致,证实s和n基因未发生突变,启动子序列完整。
100.(3)western blot检测重组病毒vtt-2019ncov-sn目的基因的表达
101.vtt-2019ncov-sn以1pfu/cell的剂量感染cef细胞,培养24小时后收获细胞,加入1ml的蛋白提取缓冲液(1%sds,1mmol/l pmsf,20mmol/l tris-clph7.0,1%β-巯基乙醇),立即混匀,反复冻融三次。加等体积的2
×
上样缓冲液,混匀煮沸10min。page电泳并转膜,5%的脱脂奶室温封闭2h。5%的脱脂奶 1:1000稀释抗新冠s蛋白兔血清(万泰,6mg/ml),或fb-bio的2019-ncov np兔单抗(货号fb2019nr),1:1000稀释,室温孵育2h。pbs洗膜3次,每次10min。加入相应的辣根过氧化物酶标记的兔二抗,5%的脱脂奶按1:1000稀释,室温孵育1h。pbs洗膜3次,每次10min。加入显色底物dab。显色后,蒸馏水漂洗终止反应。
102.结果如图13所示,vtt-2019ncov-sn表达的s蛋白分子量为134kda.(图 13左),n蛋白的分子量为45kda(图13右)。
103.实施例3:dna-痘苗病毒载体复合型新冠疫苗免疫原性研究
104.3.1小鼠实验
105.6-8周龄的雌性balb/c小鼠,分为3组,免疫程序见表1。0周、2周时肌肉注射dna疫苗p3.0-sa和p3.0-n(50ug/dose/质粒),4周肌肉或滴鼻方式接种重组痘病毒载体疫苗vtt-2019ncov-sn(107pfu/dose)。对照组在相应时间点注射等体积生理盐水。末次免疫后9天,眼眶取血后,断颈处死小鼠,取小鼠脾脏制备脾细胞悬液,检测小鼠新冠特异性体液免疫和细胞免疫。
106.表1.小鼠免疫程序
[0107][0108]
3.1.1细胞免疫(elispot)
[0109]
sars-cov-2的s1、s2、n抗原overlapping肽库浓度为50ug/肽/ml。将新鲜制备的脾细胞悬液调整浓度为2.5
×
106cells/ml,每孔中加入100ul浓度为 2ug/ml的s1、s2或n肽库,再加入100ul脾细胞悬液,使每孔细胞数为2.5
×
105个,37℃的co2的孵箱中培养16-18h。按mouse ifn-γelispot试剂盒(cat: 551083,bd公司)说明书方法进行检测。
[0110]
新冠复合疫苗在小鼠诱导了强烈的针对s1、s2、n的细胞免疫反应,实验组小鼠阳性反应率为100%。dna疫苗初免,vtt-2019ncov-sn经肌肉途径加强免疫,分泌ifn-γ的脾细胞均数达到2793sfc/106cells,显著高于 vtt-2019ncov-sn经鼻腔途径免疫(681sfc/106cells)诱导的免疫反应(p《0.0) (图14)。
[0111]
3.1.2细胞免疫(ics)
[0112]
我们同时采用ics方法检测小鼠的细胞免疫,荧光标记抗体如表2。
[0113]
表2.小鼠ics检测抗体
[0114][0115]
实验结果显示,新冠复合疫苗可以同时诱导特异性cd4,cd8免疫应答,且cd8反应强度高于cd4。肌肉组诱导的分泌ifn-γ、tnf-α的cd8+t细胞百分比分别为1.57%和0.57%,ifn-γ和tnf-α双阳性的cd8+t细胞百分比 0.5%。滴鼻组反应强度低于肌肉组(图15)。
[0116]
3.1.3体液免疫
[0117]
纯化的rbd蛋白和n蛋白分别包被elisa板(包被浓度1ug/ml),检测小鼠血清(1:100)的特异性抗体。新冠复合疫苗在小鼠诱导了rbd、n特异性igg抗体。肌肉组小鼠抗体反应均一性好,反应强度高(anti-rbd平均od 2.15,anti-n平均od 1.83)。滴鼻组组内差异大,反应强度(anti-rbd平均od 1.03,anti-n平均od 1.50)显著低于肌肉组(图16)。
[0118]
随后我们使用新型冠状病毒中和抗体检测试剂盒(热景生物),按说明书方法检测小鼠血清的中和抗体。该试剂盒基于磁微粒化学发光免疫分析技术,采用竞争法检测血液样本中的新型冠状病毒中和抗体。通过计算s/co值,进行结果判读,s/co值《1为阳性。实验结果显示,肌肉组rbd中和抗体阳性率为100%、滴鼻组40%动物产生了中和抗体(图17)。
[0119]
3.1.4免疫持久性研究
[0120]
6-8周龄的雌性balb/c小鼠,0周、2周时肌肉注射dna疫苗p3.0-sa 和p3.0-n(50ug/dose/质粒),4周肌肉接种重组痘病毒载体疫苗 vtt-2019ncov-sn(107pfu/dose)。对照组在相应时间点注射等体积生理盐水。末次免疫后2周,1个月,3个月和6个月分别眼眶取血后,断颈处死小鼠,取小鼠脾脏制备脾细胞悬液,检测小鼠新冠特异性体液免疫和细胞免疫。检测方法同前。dna-重组痘苗载体复合疫苗诱导的t细胞免疫可持续至少3个月,结合抗体持续至6个月未见明显下降,表明复合疫苗可以诱导针对 sars-cov-2持久的免疫应答(图18)。
[0121]
3.2家兔免疫实验
[0122]
1.5-2kg日本大耳白兔2只,0周、3周时肌肉注射dna疫苗p3.0-sa和p3.0-n(200ug/dose/质粒),6周肌肉注射接种重组痘病毒载体疫苗 vtt-2019ncov-sn(108pfu/dose)。10周耳缘静脉采血,检测新冠特异性中和抗体。
[0123]
活病毒中和实验:10周采集的兔血清系列稀释后与sars-cov-2活病毒株(nc_045512.2)、b.1.351(beta株)、p.1(gamma株)或b.1.617.2(delta 株),37℃共同孵育2小时,加入消化后的vero细胞悬液,于37℃,5%co2 孵箱中静置培养7天,观察细胞病变情况。中和抗体效价以能中和相应病毒而阻止细胞不病变的血清最高稀释度计算。
[0124]
表3.兔免疫血清的中和活性
[0125][0126]
实验结果显示,复合疫苗诱导产生的血清可以中和新冠病毒原始毒株及多种变异毒株,针对原始毒株的最高效价为1:192。尽管针对变异毒株的效价有所下降,但仍能有效中和beta株、gamma株和delta株,表明该疫苗诱导的中和抗体具有交叉反应活性,可在一定程度上应对新冠病毒变异。
