1.本发明属于均相催化和精细化学品合成的化学领域,涉及一种含贵金属化合物的催化剂催化不饱和烃和甲酸反应制备羧酸的方法。
背景技术:
2.羧酸是一类重要的有机化学品,还可以衍生出酰卤、酸酐、酯、酰胺等化学物质,这些化学品在化学工业中有广泛的应用。例如丙烯酸,作为一种α,β-不饱和羧酸,是重要的有机化工原料,其衍生物聚丙烯酸、聚丙烯酸酯等可以广泛应用于造纸、橡胶、洗涤剂、纺织、材料等领域。目前,丙烯酸的制备方法主要采用石油基的丙烯氧化法(工业催化,2017,25(3),7-12)和乙炔羰化氢羧化法。reppe等人采用羰基镍(ni(co)4)作为催化剂,在卤化物存在下以乙炔、一氧化碳和水(乙炔羰化氢羧化法)反应制备丙烯酸(us2925436a和us3023237a)。另有文献报道过渡金属钯催化剂催化炔烃、一氧化碳和水通过羰化氢羧化反应制备α,β-不饱和羧酸的方法[kushino y.,itoh k.,et al.journal of molecular catalysis,1994,89(1-2):151-158;yang d.,liu y.,et al.green chemistry,2019,21(19):5336-5344.]。通过不饱和烃的羰化氢羧化反应制备羧酸的方法,一方面需要使用毒性的一氧化碳气体,同时底物水的引入会显著损坏过渡金属配合物催化剂的活性和稳定性。另外,还存在水和不饱和烃发生水合副反应的情况。因此,发展一种避免使用一氧化碳和水的氢羧化反应过程尤为重要。甲酸作为生物质降解的主要副产物还可以通过二氧化碳加氢制备,具有廉价易得、可循环再生的特性。alper课题组首次报道了以甲酸代替水参与过渡金属钯催化的炔烃和一氧化碳的羰化氢羧化反应,用于制备α,β-不饱和羧酸(ali b.e.,vasapollo g.,alper h.journal of organic chemistry,1993,58(17):4739-4741;zargarian d.,alper h.organometallics,1993,12(3):712-724)。周其林课题组(cn 105693498 a)和傅尧课题组(cn 105566021 a)也相继开发出金属镍催化剂催化炔烃和甲酸反应制备α,β-不饱和羧酸的方法。
技术实现要素:
[0003]
本发明的目的是提供一种含贵金属化合物的催化剂催化不饱和烃和甲酸反应制备羧酸的方法。
[0004]
本发明所述的一种含贵金属化合物的催化剂催化不饱和烃和甲酸反应制备羧酸的方法,是在催化剂作用下,不饱和烃和甲酸为反应原料制备一元羧酸的过程。所述催化剂由贵金属化合物、配体及助剂构成。催化剂作用下反应条件温和、催化效率高。本发明涉及的方法具有反应条件温和,所述催化剂有良好活性、化学和区域选择性高,和稳定的寿命。
[0005]
实现本发明目的的具体技术方案是:
[0006]
一种含贵金属化合物的催化剂催化不饱和烃和甲酸反应制备羧酸的方法,该方法是在催化剂作用下,以不饱和烃和甲酸为原料进行反应生成有机羧酸的过程,具体为:在聚
四氟乙烯内衬的不锈钢高压反应釜中依次加入催化剂、不饱和烃、甲酸和溶剂,在确保反应釜装置气密性后,在50~150℃下反应1~24小时,反应结束后,冷却至室温,分离出产物,有机羧酸的收率为50~90%;其中,所述不饱和烃包括末端烯烃、1,3-丁二烯、末端炔烃;所述催化剂为均相催化剂,由贵金属化合物、配体及助剂构成,配体与贵金属化合物的摩尔比为0.1~100:1;助剂与贵金属化合物的摩尔比为0.1~100:1;不饱和烃与贵金属化合物的摩尔比为50~10000:1;甲酸与不饱和烃的摩尔比为1~100:1。
[0007]
所述贵金属化合物选自钯化合物、钌化合物、铑化合物、钴化合物中的至少一种。
[0008]
所述钯化合物选自二氯化钯、双(乙腈)二氯化钯、醋酸钯、三氟乙酸钯、双(三苯基膦)二氯化钯、(1,5-环辛二烯)二氯化钯、烯丙基氯化钯、四三苯基膦钯、二(乙酰丙酮)钯、双(二亚苄基丙酮)钯以及三(二亚苄基丙酮)二钯中的一种或多种。
[0009]
所述钌化合物选自三(三苯基膦)二氯化钌、二氯双(4-甲基异丙基苯基)钌、二(三苯基膦)环戊二烯基氯化钌、二氯(均三甲苯)钌二聚体、三水合三氯化钌、十二羰基三钌或双-(2-甲基烯丙基)环辛-1,5-二烯钌其中一种或者多种组合。
[0010]
所述铑化合物选自二羰基乙酰丙酮铑、双(1,5-环辛二烯)氯化铑二聚体、三(三苯基膦)氯化铑、乙酰丙酮铑、二聚醋酸铑、双(三苯基膦)合氯化羰基铑其中一种或者多种组合。
[0011]
所述钴化合物选自醋酸钴、氯化钴、乙酰丙酮钴、三(三苯基膦)氯化钴、环烷酸钴、硫酸钴或八羰基二钴其中一种或者多种组合。
[0012]
所述配体选自三苯基膦、三苯基氧化膦、三苯基膦三间磺酸钠盐、2-二苯基膦苯甲醛、2-二苯基膦苯甲酸、1,1-双(二苯基膦)甲烷、1,2-双(二苯基膦)乙烷、1,3-双(二苯基膦)丙烷、1,4-双(二苯基膦)丁烷、1,1'-双(二苯基膦)二茂铁、r-(+)-1,1'-联萘-2,2'-双二苯膦,4,5-双(二苯基膦)-9,9-二甲基氧杂蒽、4,6-二(二苯基膦)吩嗪、1,2-双(二叔丁基膦甲基)苯、1,1'-双(二叔丁基膦甲基)二茂铁、2,2'-双(二苯基磷)联苯、一氧化碳、环辛二烯、邻羟基吡啶、间羟基吡啶、邻菲罗啉、n-甲基咪唑的其中一种或多种组合。
[0013]
所述助剂选自乙酸酐、丙酸酐、丁酸酐、苯甲酸酐、三氟乙酸酐、甲酸钠、甲酸钾、甲酸铵、乙酸钠、乙酸钾、三乙胺、碳酸钠、碳酸钾、碳酸铯、氢氧化钠、氢氧化钾、氢氧化铯、异丙醇锂、乙醇钠、乙醇钾、叔丁醇钠、叔丁醇钾、四氟硼酸钠、四氟硼酸铵、1,8-二偶氮杂双螺环[5.4.0]十一-7-烯(dbu)中的一种或多种组合。
[0014]
所述溶剂选自n-甲基吡咯烷酮、n,n-二甲基甲酰胺,甲苯、二甲基亚砜、四氢呋喃、乙腈、二氧六环、醋酸咪唑、四氟硼酸1-丁基-3-甲基咪唑、氟磷酸1-丁基-3-甲基咪唑、氯化1-丁基-3-甲基咪唑、1-乙基-2,3-二甲基咪唑鎓双(三氟甲磺酰)亚胺或1-正丁基-3-甲基吡啶鎓二(三氟甲基磺酰)亚胺盐等有机溶剂中的一种或其中几种的混合溶剂。
[0015]
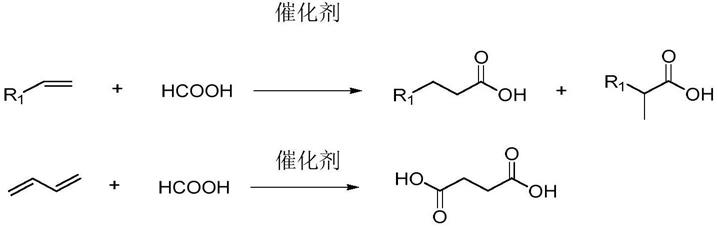
本发明在催化剂作用下,当以末端烯烃或1,3丁二烯和甲酸为反应原料制备一元羧酸的具体过程为:
[0016]
[0017]
r1选自氢h、烷基、环烷基、含有官能团的烷基或芳基或含有取代基的芳基,所述官能团为羟基、酮基、醛基或酯基,所述取代基为卤素、磺酸基、羧基、胺基、羟基、甲氧基、甲基、三氟甲基或硝基。
[0018]
本发明在催化剂作用下,当以末端炔烃和甲酸为反应原料制备α,β-不饱和羧酸的具体过程为:
[0019][0020]
r2选自氢h、烷基、环烷基、含有官能团的烷基或芳基或含有取代基的芳基,所述官能团为羟基、酮基、醛基或酯基,所述取代基为卤素、磺酸基、羧基、胺基、羟基、甲氧基、甲基、三氟甲基或硝基。
[0021]
本发明提供的一种含贵金属化合物的催化剂催化不饱和烃和甲酸反应制备羧酸的绿色合成方法,具有如下优点:
[0022]
(1)反应具有100%原子经济性。
[0023]
(2)使以廉价易得、可循环再生和环境友好的甲酸原料,无需使用一氧化碳和水作为原料,避免使用有毒、高压一氧化碳带来的风险,同时避免炔烃水合副反应。
[0024]
(3)所述制备方法羧酸收率良好。
[0025]
(4)反应过程为一锅法均相合成过程,合成工艺简单,反应条件温和,具有工业合成价值。
具体实施方式
[0026]
本发明结合以下实施例作更细致的描述。但是这些实施例仅限于说明本发明,并不对本发明构成任何形式的限制。实施例中涉及的试剂均为常用的市售产品。
[0027]
实施例1-10
[0028]
(1)不同钯化合物和含膦配体对苯乙炔和甲酸反应制备苯基丙烯酸的反应结果
[0029]
具体实验步骤:向不锈钢釜50ml的聚四氟乙烯内衬中依次加入0.025mmol钯化合物、0.025mmol双齿膦配体、15mmol甲酸、1.5mmol乙酸酐、5mmol苯乙炔、0.5mmol乙酸钠和5ml n-甲基吡咯烷酮溶剂。密封后用氮气置换反应釜中的空气,在80℃下反应3小时,反应结束后,冷却至室温,通过gc-ms计算苯乙炔的转化率及产物α,β-不饱和羧酸的收率和选择性。
[0030]
[0031][0032]
注:xantphos,4,5-双(二苯基膦)-9,9-二甲基氧杂蒽;dppp,1,3-双(二苯基膦)丙烷
[0033]
实施例11-15
[0034]
(2)不同钌化合物对苯乙炔和甲酸反应制备苯基丙烯酸的反应结果
[0035]
具体实验步骤:向不锈钢釜50ml的聚四氟乙烯内衬中依次加入0.025mmol钌化合物、0.025mmol双齿膦配体、15mmol甲酸、1.5mmol乙酸酐、5mmol苯乙炔、0.5mmol乙酸钠和5ml n-甲基吡咯烷酮溶剂。密封后用氮气置换反应釜中的空气,在80℃下反应3小时,反应结束后,冷却至室温,通过gc-ms计算苯乙炔的转化率及产物α,β-不饱和羧酸的收率和选择性。
[0036][0037]
注:r-binap,r-(+)-1,1'-联萘-2,2'-双二苯膦
[0038]
实施例16-20
[0039]
(3)不同铑化合物对苯乙炔和甲酸反应制备苯基丙烯酸的反应结果
[0040]
具体实验步骤:向不锈钢釜50ml的聚四氟乙烯内衬中依次加入0.025mmol铑化合物、0.025mmol双齿膦配体、15mmol甲酸、1.5mmol乙酸酐、5mmol苯乙炔、0.5mmol乙酸钠和5ml n-甲基吡咯烷酮溶剂。密封后用氮气置换反应釜中的空气,在80℃下反应3小时,反应结束后,冷却至室温,通过gc-ms计算苯乙炔的转化率及产物α,β-不饱和羧酸的收率和选择性。
[0041][0042]
注:r-binap,r-(+)-1,1'-联萘-2,2'-双二苯膦
[0043]
实施例21-25
[0044]
(4)不同钴化合物对苯乙炔和甲酸反应制备苯基丙烯酸的反应结果
[0045]
具体实验步骤:向不锈钢釜50ml的聚四氟乙烯内衬中依次加入0.025mmol钴化合物、0.025mmol双齿膦配体、15mmol甲酸、1.5mmol乙酸酐、5mmol苯乙炔、0.5mmol乙酸钠和5ml n-甲基吡咯烷酮溶剂。密封后用氮气置换反应釜中的空气,在80℃下反应3小时,反应结束后,冷却至室温,通过gc-ms计算苯乙炔的转化率及产物α,β-不饱和羧酸的收率和选择性。
[0046][0047]
注:r-binap,r-(+)-1,1'-联萘-2,2'-双二苯膦
[0048]
实施例25-31
[0049]
(5)含钯化合物的催化剂催化不同烯烃和甲酸反应制备不同一元羧酸的反应结果
[0050]
具体实验步骤:向不锈钢釜50ml的聚四氟乙烯内衬中依次加入0.025mmol钯化合物、0.025mmol双齿膦配体4,5-双(二苯基膦)-9,9-二甲基氧杂蒽(xantphos)、一氧化碳配体(0.5mpa)、15mmol甲酸、5mmol不饱和烃、0.5mmol乙酸钠和5ml n-甲基吡咯烷酮溶剂。密封后用氮气置换反应釜中的空气,在80℃下反应3小时,反应结束后,冷却至室温,通过gc-ms计算苯乙炔的转化率及产物α,β-不饱和羧酸的收率和选择性。
[0051]
[0052][0053]
注:xantphos,4,5-双(二苯基膦)-9,9-二甲基氧杂蒽
[0054]
实施例32
[0055]
催化剂使用寿命考察结果。
[0056]
催化剂包括pd(oac)2、xantphos双齿膦配体和naoac,在苯乙烯和甲酸反应制备2-苯基丙烯酸过程中循环使用6次仍保持良好的活性和稳定性。具体实验步骤:向200ml的聚四氟乙烯内衬中依次加入四氢呋喃(thf)溶剂30ml、0.2mmol的pd(oac)2、0.012mmol的xantphos配体、苯乙炔20mmol和甲酸40mmol。将内衬放于高压反应釜中,密封后检验装置气密性,用一氧化碳置换反应釜中的空气。然后通入一氧化碳气体并充压至1.0mpa,在恒温加热套中70℃反应12h,冷却至室温后缓慢泄压,然后再次加入苯乙炔20mmol和20mmol甲酸,密封后再次冲入1.0mpa一氧化碳气体,70℃反应12h。重复上述实验步骤6次后,通过gc-ms计算产物2-苯基丙烯酸的收率。
