1.本发明涉及光致变色材料领域,提供一种多取代苯并色烯类光致变色化合物。
背景技术:
2.光致变色是指当向某些化合物照射包含紫外线的光时,颜色迅速改变,当停止照射光而置于暗处时,就恢复到原来的颜色的可逆作用的现象。具有该性质的化合物被称为光致变色化合物,光致变色材料在变色眼镜、光信息存储、分子开关以及防卫识别技术等领域具有广泛应用前景,一直是化学及材料科学领域的研究热点之一。
3.已知报道萘并吡喃是在多或单色光如uv光影响下能够改变颜色的光致变色的化合物。照射停止时,或者在温度和/或不同于初始光的多或单色光的影响下,该化合物回到其初始颜色。萘并吡喃在各种领域均有应用,例如在眼镜片、隐形镜片、太阳镜、滤光片、光学照相机或其它光学器件以及观测装置、玻璃窗和装饰性物体的制造中。2h-色烯在某些情况下在uv照射后具有中性灰色或褐色,这在变色镜中使用时尤其感兴趣,因为它不要求使用不同颜色的染料混合物以获得所需色调。事实上,不同颜色的染料可能具有不同的抗uv老化特性,不同的褪色动力学或不同的热依存性,导致使用期间镜片的色调发生改变。例如,对于眼镜片,出于视觉舒适性和安全原因(例如开车时),需要光致变色制品在光照消失后快速脱色。
技术实现要素:
4.本发明研究者在研究萘并吡喃类化合物时,发现当在2h萘并[1,2-b]吡喃(苯并色烯)的苯环上引入吸电子基团时,化合物具有较短的褪色半衰期。并且当两个苯并色烯类化合物通过不同的给电子基团连结起来后,能显著缩短褪色半衰期并能提升耐老化性能。这类化合物具有良好的开发前景。
[0005]
本发明的技术方案如下:
[0006]
一种光致变色化合物,该化合物的结构如式(i)所示:
[0007][0008]
其中:
[0009]
r1、r2、r5、r6各自选自氢、甲基、甲氧基、甲硫基、芳基、卤素、cn、 no2、cf3或cf2h;
[0010]
r3、r4、r7、r8各自选自氢、甲基、甲氧基、甲硫基、卤素、cn、no2、 cf3或cf2h,且r3、r4、r7、r8中至少一个为吸电子基团;
[0011]
a为c1-c8直链烷基、c1-c8支链烷基、c1-c8环状烷基、芳基、杂原子或 c1-c8含杂原子烷基。
[0012]
如上所述的光致变色化合物化合物,优选地,所述a为其中,l 为c1-c8直链烷基、c1-c8支链烷基、c1-c8环状烷基、c6-c12芳基、羰基、或 c1-c8含杂原子烷基,x、y各自选自o、nh或s。
[0013]
如上所述的光致变色化合物化合物,优选地,所述化合物为:
[0014]
[0015][0016]
另一方面,本发明提供一种光致变色组合物,该组合物中其包含如上所述的光致变色化合物。
[0017]
再一方面,本发明提供一种光致变色材料,其包含结合到有机材料中的如上所述的化合物,该有机材料为聚合物材料、低聚物材料合/或单体材料。
[0018]
又一方面,本发明提供如上所述的光致变色化合物作为光致变色材料的应用。
[0019]
可将式i的化合物结合到各种聚合物基质中,最终用于制备各种不同的制品。通常,其中结合有式i的化合物或者涂覆有式i的化合物的聚合物基质在其初始状态无色或者略微着色,当曝露于uv光(365nm)或者在日光类光源下快速形成强烈的颜色。一旦照射停止聚合物基质重新回到其初始颜色。式i的化合物可以单独使用或者与其它光致变色材料联用。也考虑使用两种或更多种式i的化合物来制备制品。
[0020]
本发明作为光致变色材料使用的聚合物的例子包括但不限于:烷基、环烷基、 (聚或低聚)乙二醇、芳基或芳基烷基单、二、三或四丙烯酸酯或单、二、三或四甲基丙烯酸酯,它们可任选地卤代或者包括至少一个醚和/或酯和/或碳酸酯和/或氨基甲酸酯和/或硫代氨基甲酸酯和/或脲和/或酰胺基团,聚苯乙烯,聚醚,聚酯,聚碳酸酯(例如,双酚-a聚碳酸酯,二烯丙基二甘醇聚碳酸酯),聚氨基甲酸酯,聚环氧化物,聚脲,聚氨酯,聚硫氨酯,聚硅氧烷,聚丙烯腈,聚酰胺,脂族或芳族聚酯,乙烯基(vinylic)聚合物,醋酸纤维素,三醋酸纤维素,醋酸-丙酸纤维素或聚乙烯醇缩丁醛。也可使用由上述材料衍生的均聚物和共聚物。
[0021]
作为使本发明光致变色化合物分散在上述高分子固体基质中的方法,可以采用一
般的方法。例如可举出:将上述热塑性树脂与光致变色化合物在熔融状态下捏合,使光致变色化合物分散到树脂中的方法。或者可举出使光致变色化合物溶解到上述聚合性单体中后,加入聚合催化剂,通过热或光使其聚合,从而使光致变色化合物分散到树脂中的方法。另外可举出,通过将光致变色化合物染色到上述热塑性树脂以及热固性树脂的表面,使光致变色化合物分散到树脂中的方法等。
[0022]
本发明的光致变色化合物可以作为光致变色材料在广范的范围内利用,可作为记忆材料、调光材料、光致变色透镜材料、光学过滤器材料、显示器材料、光信息器件、光开关元件、光刻胶材料、光量计或装饰材料。所述记忆材料可以是复印材料、印刷用感光体、阴极射线管用记忆材料、激光用感光材料或全息摄影用感光材料。
[0023]
本发明中所用术语“烷基”是指具有1至8个碳原子的直链或支链的单价饱和烃基,其实例包括,但不限于甲基、乙基、1-丙基、2-丙基、1-丁基、2-甲基-1-丙基、 2-丁基、2-甲基-2-丙基、叔丁基、1-己基、2-乙基丁基等。
[0024]
本发明中所用术语“环状烷基”是指3至8个碳原子的环烷基,但不限于环丙基、环丁基、环戊基、环己基、烷基取代环烷基。
[0025]
本发明中所用术语“芳基”其本身或作为另一取代基的一部分是指单价芳族烃基团,其由从母体芳族环体系的单个碳原子去掉一个氢原子而获得。芳基涵盖5
‑ꢀ
和6-元的碳环芳族环,例如,苯;双环环体系,其中至少一个环是碳环和芳族的,例如,萘、茚满和四氢萘;以及三环环体系,其中至少一个环是碳环和芳族的,例如,芴。芳基涵盖具有至少一个稠合到至少一个碳环芳族环、环烷基环、或者杂环烷基环的碳环芳族环的多环体系。
[0026]
本发明中所用术语“卤素”指氟、氯或溴。
[0027]
本发明化学式中表示取代基从该处连接。
[0028]
本发明的式i化合物可采用如下方法制备:
[0029]
1.方案一
[0030][0031]
本方案包括如下步骤:
[0032]
(1)将化合物i-1与乙炔基锂反应得到化合物i-2;
[0033]
(2)化合物i-2与化物i-3在樟脑酸存在下环合得到化合物i-4;
[0034]
(3)将化合物i-5与乙炔基锂反应得到化合物i-6;
[0035]
(4)化合物i-6与化物i-7在樟脑酸存在下环合得到化合物i-8;
[0036]
(5)将化合物i-4和i-8通过dead和三苯基膦条件下室温反应得到化合物 i-9。
[0037]
2.方案二
[0038][0039]
本方案包括如下步骤:
[0040]
(1)将化合物i-1与乙炔基锂反应得到化合物i-2;
[0041]
(2)化合物i-2与化和物i-3在樟脑酸存在下环合得到化合物1-4;
[0042]
(3)将化合物1-4在碱性条件下与br-l-br进行亲核取代得到化合物ii-2;
[0043]
(4)化合物ii-2与化合物i-8在碱性条件下进行亲核取代得到化合物ii-3。
[0044]
3.方案三
[0045][0046]
本方案包括如下步骤:
[0047]
(1)将化合物1-2与化合物iii-1在樟脑酸存在下环合得到化合物iii-2;
[0048]
(2)化合物1-6与化合物1ii-5在樟脑酸存在下环合得到化合物iii-6;
[0049]
(3)化合物iii-2和iii-3在钯催化下偶联得到化合物iii-4;
[0050]
(4)化合物iii-4和iii-6在二硼酸频那醇酯、碳酸钾和四(三苯基膦)钯存在下进行金属偶联反应得到化合物iii-7。
甲氧基苯基)-2h-苯并[h]色烯-5-醇a-7(180mg,白色固体),产率:22%。esi-ms m/z:479[m+h]
+
。
[0063]
3.制备中间体a-9:8,10-二氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-醇
[0064][0065]
将1,1-双(4-甲氧基苯基)丙-2-炔-1-醇a-3(450mg,1.68mmol)溶于甲苯(10 ml),加入8,10-二氟萘-1,3-二醇a-8(349mg,2.01mmol)和樟脑磺酸(89mg,0.5 mmol),然后60℃搅拌2小时,反应结束后,浓缩,粗产物用硅胶柱色谱纯化,得到8,10-二氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-醇a-9(220mg,白色固体),产率:29%。esi-ms m/z:447[m+h]
+
。
[0066]
4.制备中间体a-12:10-氟-2,2-双(4-硫代甲基苯基)-2h-苯并[h]色烯-5-醇
[0067][0068]
将4,4
’‑
二甲硫基二苯甲酮a-10(500mg,1.82mmol)溶解于10ml乙二胺中,加入乙炔锂乙二胺络合物a-2(491mg,5.46mmol)。氮气气氛下,室温搅拌2小时。反应结束后,用冰水淬灭,反应液用乙酸乙酯萃取。有机层用水、饱和氯化钠洗涤,无水硫酸钠干燥。浓缩,粗产物用硅胶柱色谱纯化,得到1,1-双(4-甲硫基苯基) 丙-2-炔-1-醇a-11(400mg,白色固体),产率:73%。esi-ms m/z:301[m+h]
+
。
[0069]
将1,1-双(4-甲硫基苯基)丙-2-炔-1-醇a-11(400mg,1.33mmol)溶于甲苯(10 ml),加入8-氟萘-1,3-二醇a-4(284mg,1.6mmol)和樟脑磺酸(92mg,0.4mmol),然后60℃搅拌2小时,反应结束后,浓缩,粗产物用硅胶柱色谱纯化,得到10-氟-2,2
‑ꢀ
双(4-甲硫基苯基)-2h-苯并[h]色烯-5-醇a-12(174mg,白色固体),产率:28%。 esi-ms m/z:461[m+h]
+
。
[0070]
5.制备中间体a-14:5-溴-10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯
[0071][0072]
将1,1-双(4-甲氧基苯基)丙-2-炔-1-醇a-3(450mg,1.68mmol)溶于甲苯(10 ml),加入1-羟基-3-溴-8-氟萘a-13(482mg,2.01mmol)和樟脑磺酸(89mg,0.5 mmol),然后60℃
搅拌2小时,反应结束后,浓缩,粗产物用硅胶柱色谱纯化,得到5-溴-10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯a-14(120mg,白色固体),产率:14%。esi-ms m/z:491[m+h]
+
。
[0073]
实施例1:制备5,5
′‑
氧双(10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯)
[0074][0075]
将10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-醇a-5(200mg,0.47mmol) 溶于四氢呋喃(5ml)中,加入偶氮二甲酸二乙酯(dead,35mg,0.2mmol)和三苯基膦(52mg,0.2mmol),反应16小时,反应结束后,浓缩,经硅胶制备板分离得到5,5
′‑
氧双(10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯)(75mg,白色固体),产率:38%。esi-ms m/z:839[m+h]
+
。
[0076]1h-nmr(400mhz,dmso-d6):δ7.83-7.62(m,2h),7.47-7.32(m,10h), 7.30-7.15(m,2h),6.88-6.70(m,10h),6.58(d,j=7.2hz,2h),6.39(d,j=7.2hz,2h), 3.52(s,12h)。
[0077]
实施例2:制备5,5
′‑
氧双(10-三氟甲基-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯)
[0078][0079]
将10-三氟甲基-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-醇a-7(200mg,0.42 mmol)溶于四氢呋喃(5ml)中,加入偶氮二甲酸二乙酯(dead,31mg,0.18mmol) 和三苯基膦(47mg,0.18mmol),反应16小时,反应结束后,浓缩,经硅胶制备板分离得到5,5
′‑
氧双(10-三氟甲基-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯)(50mg,白色固体),产率:23%。esi-ms m/z:939[m+h]
+
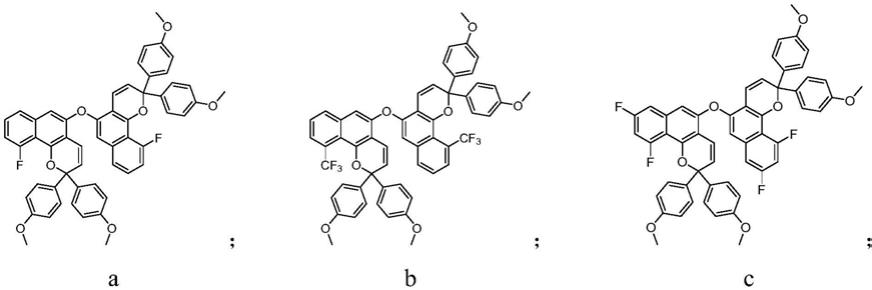
。
[0080]1h-nmr(400mhz,dmso-d6):δ8.12-7.65(m,2h),7.55-7.37(m,10h),7.32
‑ꢀ
7.12(m,2h),6.89-6.72(m,10h),6.57(d,j=7.2hz,2h),6.41(d,j=7.2hz,2h), 3.55(s,12h)。
[0081]
实施例3:制备5,5
′‑
氧双(8,10-二氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯)
[0082][0083]
将8,10-二氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-醇a-9(200mg,0.45 mmol)溶于四氢呋喃(5ml)中,加入偶氮二甲酸二乙酯(dead,39mg,0.22mmol) 和三苯基膦(58mg,0.22mmol),将反应液室温16小时,反应结束后,浓缩,经硅胶制备板分离得到5,5
′‑
氧双(8,10-二氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯) (42mg,白色固体),产率:21%。esi-ms m/z:875[m+h]
+
。
[0084]1h-nmr(400mhz,dmso-d6):δ7.92-7.72(m,2h),7.45-7.31(m,8h),7.33-7.12 (m,2h),6.91-6.73(m,10h),6.57(d,j=7.2hz,2h),6.38(d,j=7.2hz,2h),3.52(s, 12h)。
[0085]
实施例4:制备5,5
′‑
氧双(10-氟-2,2-双(4-硫代甲基苯基)-2h-苯并[h]色烯)
[0086][0087]
将10-氟-2,2-双(4-甲硫基苯基)-2h-苯并[h]色烯-5-醇a-12(200mg,0.43mmol) 溶于四氢呋喃(5ml)中,加入偶氮二甲酸二乙酯(dead,38mg,0.22mmol) 和三苯基膦(57mg,0.22mmol),将反应液室温16小时,反应结束后,浓缩,经硅胶制备板分离得到5,5
′‑
氧双(10-氟-2,2-双(4-甲硫基苯基)-2h-苯并[h]色烯)(35 mg,白色固体),产率:18%。esi-ms m/z:903[m+h]
+
。
[0088]1h-nmr(400mhz,dmso-d6):δ7.82-7.62(m,2h),7.47-7.32(m,10h), 7.30-7.15(m,2h),6.88-6.70(m,10h),6.58(d,j=7.2hz,2h),6.38(d,j=7.2hz,2h), 2.42(s,12h)。
[0089]
实施例5:制备1,3-双((10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-基)氧基)丙烷
[0090][0091]
将10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-醇a-5(500mg,1.17mmol) 溶于乙腈(5ml)中,加入碳酸钾(194mg,1.4mmol),室温搅拌0.5h,然后加入1,3-二溴丙烷(2.36g,11.7mmol),室温搅拌16小时。反应结束后,加水20ml,乙酸乙酯萃取,有机相经饱和氯化钠洗涤,无水硫酸钠干燥后,浓缩,粗产物用硅胶柱色谱纯化,得到5-(3-溴丙氧基)-10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯 a-15(400mg,白色固体),产率:62%。esi-ms m/z:549,551[m+h]
+
。
[0092]
将10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-醇a-5(154mg,0.36mmol) 溶于乙腈(5ml)中,加入碳酸钾(50mg,0.36mmol),室温搅拌0.5h,然后加入5-(3-溴丙氧基)-10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯a-15(200mg,0.36 mmol),室温搅拌16小时。反应结束后,加水10ml,乙酸乙酯萃取,有机相经饱和氯化钠洗涤,无水硫酸钠干燥后,浓缩,粗产物用硅胶柱色谱纯化,得到1,3
‑ꢀ
双((10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-基)氧基)丙烷(45mg,白色固体),产率:14%。esi-ms m/z:897[m+h]
+
。
[0093]1h-nmr(400mhz,dmso-d6):δ7.82-7.61(m,2h),7.46-7.33(m,10h), 7.32-7.16(m,2h),6.87-6.75(m,10h),6.61(d,j=7.2hz,2h),6.38(d,j=7.2hz,2h), 4.32(t,j=8.2hz,4h),3.52(s,12h),2.21-2.19(m,2h).
[0094]
实施例6:制备1,3-双((10-三氟甲烷-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-基)氧基)丙烷
[0095][0096]
将10-三氟甲基-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-醇a-7(500mg,1.05 mmol)溶于乙腈(5ml)中,加入碳酸钾(173mg,1.25mmol),室温搅拌0.5h,然后加入1,3-二溴丙烷(2.12g,10.5mmol),室温搅拌16小时。反应结束后,加水20ml,乙酸乙酯萃取,有机相经饱和氯化钠洗涤,无水硫酸钠干燥后,浓缩,粗产物用硅胶柱色谱纯化,得到5-(3-溴丙氧基)-10-三氟甲基-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯a-16(300mg,白色固体),产率:48%。esi-ms m/z:599, 601[m+h]
+
。
[0097]
将10-三氟甲基-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-醇a-7(100mg,0.21 mmol)溶于乙腈(5ml)中,加入碳酸钾(28mg,0.21mmol),室温搅拌0.5h,然后加入5-(3-溴丙氧基)-10-三氟甲基-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯a-16 (126mg,0.21mmol),室温搅拌16小时。反应结束后,加水10ml,乙酸乙酯萃取,有机相经饱和氯化钠洗涤,无水硫酸钠干燥后,浓缩,粗产物用硅胶柱色谱纯化,得到1,3-双((10-三氟甲基-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-基)氧基) 丙烷(35mg,白色固体),产率:19%。esi-ms m/z:997[m+h]
+
。
[0098]1h-nmr(400mhz,dmso-d6):δ8.13-7.65(m,2h),7.55-7.37(m,10h), 7.32-7.12(m,2h),6.88-6.73(m,10h),6.62(d,j=7.2hz,2h),6.38(d,j=7.2hz,2h), 4.33(t,j=8.2hz,4h),3.52(s,12h),2.23-2.19(m,2h).
[0099]
实施例7:2,2
′‑
双((10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-基)氧基)二氧二乙醚
[0100][0101]
将10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-醇a-5(500mg,1.17mmol) 溶于乙腈(5ml)中,加入碳酸钾(194mg,1.4mmol),室温搅拌0.5h,然后加入2,2
′‑
二溴二乙醚(2.71g,11.7mmol),室温搅拌16小时。反应结束后,加水20 ml,乙酸乙酯萃取,有机相经饱和氯化钠洗涤,无水硫酸钠干燥后,浓缩,粗产物用硅胶柱色谱纯化,得到5-(2-(2-溴乙氧基)乙氧基)-10-氟-2,2-双(4-甲氧基苯基)-2h苯并[h]色烯a-17(300mg,白色固体),产率:44%。esi-ms m/z:579, 581[m+h]
+
。
[0102]
将10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-醇a-5(154mg,0.36mmol) 溶于乙腈(5ml)中,加入碳酸钾(50mg,0.36mmol),室温搅拌0.5h,然后加入5-(2-(2-溴乙氧基)乙氧基)-10-氟-2,2-双(4-甲氧基苯基)-2h苯并[h]色烯a-17 (208mg,0.36mmol),室温搅拌16小时。反应结束后,加水10ml,乙酸乙酯萃取,有机相经饱和氯化钠洗涤,无水硫酸钠干燥后,浓缩,粗产物用硅胶柱色谱纯化,得到2,2
′‑
双((10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-基)氧基)二氧二乙醚(32mg,白色固体),产率:10%。esi-ms m/z:927[m+h]
+
。
[0103]1h-nmr(400mhz,dmso-d6):δ7.81-7.61(m,2h),7.46-7.33(m,10h), 7.32-7.16(m,2h),6.87-6.75(m,10h),6.62(d,j=7.2hz,2h),6.37(d,j=7.2hz,2h), 4.42(t,j=8.0hz,4h),3.77(t,j=8.0hz,4h),3.51(s,12h).
[0104]
实施例8:1,4-双(10-氟-5-((4-((10-氟-2,2-双(4-甲氧基苯基)-2h苯并[h]色烯-5-基)氧基)环己基)氧基)
[0105][0106]
将10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-醇a-5(500mg,1.17mmol) 溶于乙腈(5ml)中,加入碳酸钾(194mg,1.4mmol),室温搅拌0.5h,然后加入1,4-二溴环己烷(2.83g,11.7mmol),室温搅拌16小时。反应结束后,加水20ml,乙酸乙酯萃取,有机相经饱和氯化钠洗涤,无水硫酸钠干燥后,浓缩,粗产物用硅胶柱色谱纯化,得到5-((4-溴环己基)氧基)-10-氟-2,2-双(4-甲氧基苯基)
ꢀ‑
2h苯并[h]色烯a-18(300mg,白色固体),产率:44%。esi-ms m/z:589,591 [m+h]
+
。
[0107]
将10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-醇a-5(154mg,0.36mmol) 溶于乙腈(5ml)中,加入碳酸钾(50mg,0.36mmol),室温搅拌0.5h,然后加入5-((4-溴环己基)氧基)-10-氟-2,2-双(4-甲氧基苯基)-2h苯并[h]色烯a-18 (212mg,0.36mmol),室温搅拌16小时。反应结束后,加水10ml,乙酸乙酯萃取,有机相经饱和氯化钠洗涤,无水硫酸钠干燥后,浓缩,粗产物用硅胶柱色谱纯化,得到1,4-双(10-氟-5-((4-((10-氟-2,2-双(4-甲氧基苯基)-2h苯并[h]色烯-5-基)氧基)环己基)氧基)(55mg,白色固体),产率:17%。esi-ms m/z:937 [m+h]
+
。
[0108]1h-nmr(400mhz,dmso-d6):δ7.84-7.60(m,2h),7.46-7.32(m,10h), 7.33-7.16(m,2h),6.88-6.75(m,10h),6.61(d,j=7.2hz,2h),6.38(d,j=7.2hz,2h), 3.64-3.55(m,2h),3.52(s,12h),1.92-1.83(m,8h).
[0109]
实施例9:1,4-双(10-氟-5-((4-((10-氟-2,2-双(4-甲氧基苯基)-2h苯并[h]色烯-5-基) 氧基)双环[2.2.2]辛烷)氧基)
[0110]
[0111][0112]
将10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-醇a-5(500mg,1.17mmol) 溶于乙腈(5ml)中,加入碳酸钾(194mg,1.4mmol),室温搅拌0.5h,然后加入1,4-二溴双环[2.2.2]辛烷(3.32g,11.7mmol),室温搅拌16小时。反应结束后,加水20ml,乙酸乙酯萃取,有机相经饱和氯化钠洗涤,无水硫酸钠干燥后,浓缩,粗产物用硅胶柱色谱纯化,得到5-((4-溴双环[2.2.2]辛烷-1-基)氧基)-10-氟-2,2
‑ꢀ
双(4-甲氧基苯基)-2h苯并[h]色烯a-19(200mg,白色固体),产率:28%。esi-msm/z:615,617[m+h]
+
。
[0113]
将10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-醇a-5(154mg,0.36mmol) 溶于乙腈(5ml)中,加入碳酸钾(50mg,0.36mmol),室温搅拌0.5h,然后加入5-((4-溴双环[2.2.2]辛烷-1-基)氧基)-10-氟-2,2-双(4-甲氧基苯基)-2h苯并 [h]色烯a-19(221mg,0.36mmol),室温搅拌16小时。反应结束后,加水10ml,乙酸乙酯萃取,有机相经饱和氯化钠洗涤,无水硫酸钠干燥后,浓缩,粗产物用硅胶柱色谱纯化,得到1,4-双(10-氟-5-((4-((10-氟-2,2-双(4-甲氧基苯基)-2h 苯并[h]色烯-5-基)氧基)双环[2.2.2]辛烷)氧基)(36mg,白色固体),产率: 10%。esi-ms m/z:963[m+h]
+
。
[0114]1h-nmr(400mhz,dmso-d6):δ7.85-7.60(m,2h),7.46-7.31(m,10h), 7.33-7.16(m,2h),6.88-6.74(m,10h),6.62(d,j=7.2hz,2h),6.37(d,j=7.2hz,2h), 3.51(s,12h),1.88-1.23(m,12h).
[0115]
实施例10:制备1,3-双(10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-基)苯
[0116][0117]
将5-溴-10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯a-14(200mg,0.41mmol) 溶于甲苯(5ml)和水(0.5ml)中,依次加入1,3-双苯二硼酸频那醇酯(66mg,0.2 mmol),碳酸钾(85mg,0.61mmol)和四(三苯基膦)钯(46mg,0.04mmol),氮气氛围下,加热至80℃反应4小时。反应结束后,冷却至室温,乙酸乙酯萃取,有机相经水洗,无水硫酸钠干燥,浓缩,粗产物用硅胶柱色谱纯化,得到1,3-双(10
‑ꢀ
氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-基)苯(30mg,白色固体),产率: 16%。esi-ms m/z:899[m+h]
+
。
[0118]1h-nmr(400mhz,dmso-d6):δ8.03-7.62(m,3h),7.57-7.13(m,13h), 6.91-6.71(m,
12h),6.56(d,j=7.2hz,2h),6.40(d,j=7.2hz,2h),3.51(s,12h).
[0119]
实施例11:4,4
′‑
双(10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-基)联苯
[0120][0121]
将5-溴-10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯a-14(200mg,0.41mmol) 溶于甲苯(5ml)和水(0.5ml)中,依次加入4,4
′‑
联苯基二硼酸二(频那醇酯) (81mg,0.2mmol),碳酸钾(85mg,0.61mmol)和四(三苯基膦)钯(46mg,0.04 mmol),氮气氛围下,加热至80℃反应4小时。反应结束后,冷却至室温,乙酸乙酯萃取,有机相经水洗,无水硫酸钠干燥,浓缩,粗产物用硅胶柱色谱纯化,得到4,4
′‑
双(10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-基)联苯(42mg,白色固体),产率:21%。esi-ms m/z:975[m+h]
+
。
[0122]1h-nmr(400mhz,dmso-d6):δ8.08-7.60(m,3h),7.58-7.11(m,17h), 6.94-6.72(m,12h),6.52(d,j=7.2hz,2h),6.41(d,j=7.2hz,2h),3.52(s,12h).
[0123]
实施例12:2,7-双(10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-基)萘
[0124][0125]
将5-溴-10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯a-14(200mg,0.41mmol) 溶于甲苯(5ml)和水(0.5ml)中,依次加入2,7-双(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)萘(76mg,0.2mmol),碳酸钾(85mg,0.61mmol)和四(三苯基膦)钯(46mg,0.04mmol),氮气氛围下,加热至80℃反应4小时。反应结束后,冷却至室温,乙酸乙酯萃取,有机相经水洗,无水硫酸钠干燥,浓缩,粗产物用硅胶柱色谱纯化,得到2,7-双(10-氟-2,2-双(4-甲氧基苯基)-2h-苯并[h]色烯-5-基)萘(53mg,白色固体),产率:14%。esi-ms m/z:949[m+h]
+
。
[0126]1h-nmr(400mhz,dmso-d6):δ8.04-7.61(m,3h),7.57-7.13(m,15h), 6.94-6.71(m,12h),6.52(d,j=7.2hz,2h),6.41(d,j=7.2hz,2h),3.52(s,12h).
[0127]
实施例13:制备光致变色材料
[0128]
分别取实施例1-12得到的色烯化合物0.04质量份、二甲基丙烯酸四甘醇酯13 质
量份、2,2-双[4-(甲基丙烯酰氧基乙氧基)苯基]丙烷48质量份、聚乙二醇单烯丙基醚2质量份、三羟甲基丙烷三甲基丙烯酸酯20质量份、甲基丙烯酸缩水甘油酯9质量份、α-甲基苯乙烯6质量份、a-甲基苯乙烯二聚物2质量份、以及作为聚合引发剂的叔丁基过氧化2-乙基己酸酯1质量份充分混合,制备光致变色固化性组合物。接着,将得到的光致变色固化性组合物注入到由玻璃板和乙烯-乙酸乙烯酯共聚物制成的垫片(gasket)构成的模具中,进行铸塑聚合。聚合过程如下:使用空气炉,用 18小时缓慢地从30℃升温至90℃,在90℃下保持2小时。聚合结束后,将聚合物从模具的玻璃模子中取出,得到由实施例1-12化合物制备的光致变色材料样品。
[0129]
实验例1:溶液中光致变色特性评价
[0130]
采用in mass法进行光致变色固化物(光致变色光学制品)的评价。将实施例13 得到的各组聚合物(厚2mm,光致变色固化物(光学制品))作为试样,将光照射时间设定为1秒,除此以外,评价光致变色特性和退色半衰期。其结果示于表1。
[0131]
最大吸收波长(amax):为由(株)大琢电子工业制的分光光度计(瞬间多通道光电探测器mcpd2000m)求得的显色后的最大吸收波长,是显色时的色调的指标。
[0132]
显色浓度(abs):为上述最大吸收波长中的光照射0.5秒后的吸光度,是显色浓度的指标。可以说,该值越高,由光照射引起的着色变化越大,光致变色性越好。
[0133]
退色半衰期(t1/2):为当停止照射光时,试样的上述最大吸收波长中的吸光度降低至一半的值所需要的时间,是退色速度的指标。该时间越短,表示褪色速度越快。
[0134]
黄变度(yi):为了评价聚合固化后的黄变度,对于上述聚合固化后的试样,使用试验机(株)制的色差计(sm-4)测定色差。yi的值越小,聚合固化体(包括固化膜) 的透明度越高,或评价化合物的劣化度越小。
[0135]
残存率(a
50
/a0x 100):为了评价光照射引起的显色的耐久性,进行以下的劣化促进试验。通过试验机(株)制氙弧耐候机x25使得到的聚合物(试样)进行促进劣化50 小时。其后,在试验的前后进行上述显色浓度的评价,测定试验前的显色浓度(a0)及试验后的显色浓度(a
50
),将其比(a
50
/a0)作为残存率,设定为显色的耐久性的指标。残存率越高,显色的耐久性越高。
[0136]
表1:
[0137]
[0138][0139]
对比例1
[0140]
为了进一步比较,采用实施例13相同的方法,用以下式a~式h化合物制备光致变色固化薄膜,用实验例1方法评价得到的光致变色塑料透镜的特性,其结果见表2:
[0141]
[0142]
[0143][0144]
表2
[0145][0146]
由实验结果表明,本发明化合物在苯环上引入吸电子基团的同时将不同取代的苯并色烯通过给电子基团连接,发现实施例化合物具有实用的退色半衰期和良好的耐老化性能,具有一旦停止光照射颜色瞬间消失的光致变色性。
[0147]
因此,当使用本发明的光致变色化合物制作光致变色材料,例如光致变色透镜时,可以制造出具有这样一种性质的光致变色透镜,当来到室外时迅速显色,从室外返回室内时迅速退色并恢复到原来的色调,并且可以长时间使用。
[0148]
本发明的光致变色化合物由于显示出以上优异的效果,可适用于各种各样的用途,例如,记忆材料、调光材料、光致变色透镜材料、光学过滤器材料、显示器材料、光信息器件、光开关元件、光刻胶材料、光量计或装饰材料等。
