基于n,n
’‑
二取代二氢吩嗪化合物及其制备方法与应用
技术领域
1.本发明属于材料学技术领域,具体地说,涉及一种基于n,n
’‑
二取代二氢吩嗪化合物及其制备方法与应用。
背景技术:
2.近年来,具有特殊电子激发态现象的荧光团引起了研究者们的广泛关注,如极大的斯托克斯位移或多重荧光发射。这一类荧光分子可以在全色显示器、生物成像、单分子器件、光学存储等领域发挥重要的作用。在这一类分子中,n,n
’‑
二取代二氢吩嗪有着得天独厚的优势,它具有不同寻常的光物理性质,在一般溶剂中吸收波长位于350nm而发射波长稳定在610nm附近,且几乎不随极性变化,展现出极大的斯托克斯位移。其原理为该类分子在溶液中能够发生激发态分子平面化振动,使得分子由初始的弯曲激发态结构振动到平面激发态结构,大大延伸了分子内π电子离域,导致共轭体系急剧增加。该机制有别于常见分子转动发光机制(chen j,etal.chem.mater.,2003,15:1535
–
1546;mei j,etal.adv.mater.,2014,26:5429
–
5479;bu f,etal.angew.chem.int.ed.,2015,54:14492
–
14497)。它不仅意味着发射增强,而且与分子内转动造成的非辐射失活无关,是分子本身固有的本征发光特性。众多优点使得关于n,n
’‑
二取代二氢吩嗪及其的研究异常活跃,并且在可调控多色荧光发光材料、生物成像、化学传感器等领域具有广阔的应用前景(okamoto t,et al.org lett,2003,5:373
–
376)。
3.虽然n,n
’‑
二取代二氢吩嗪类化合物的物理性能研究已经取得巨大进展,但是仍然存在一些问题亟待解决以适应实际应用需要。其中一个亟需但是研究很不充分的是基于n,n
’‑
二取代二氢吩嗪类化合物的光电性能的实际应用,该性能在超高密度光信息存储、光控分子导线、分子逻辑设备及光驱动器件等光电领域是必不可少的。并且通过构象变化调控分子光电性质的研究与应用也是屈指可数的,因此n,n
’‑
二取代二氢吩嗪类化合物在这一领域有着广阔的应用前景(zhang z,et al.j.am.chem.soc.,2015,137,8509-8520;zhang z,et al.chem.sci.,2020,11,7525-7537;zhang z,et al.adv.funct.mater.,2020,30,1902803)。
技术实现要素:
4.本发明的目的是提供一种基于n,n
’‑
二取代二氢吩嗪化合物。
5.本发明的第二目的是提供一种所述基于n,n
’‑
二取代二氢吩嗪化合物的制备方法。
6.本发明的第三目的是提供一种所述基于n,n
’‑
二取代二氢吩嗪化合物在制备荧光探针或单分子器件中的应用。
7.为了实现上述目的,本发明采用的技术方案如下:
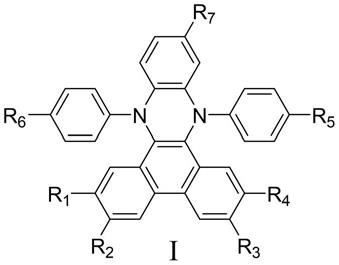
8.本发明提供了一种基于n,n
’‑
二取代二氢吩嗪化合物,结构如通式i所示:
[0009][0010]
其中,
[0011]
r1选自氢、
[0012][0013]
r2选自氢、
[0014][0015]
r3选自氢、
[0016][0017]
r4选自氢、
[0018][0019]
r5选自氢、
[0020][0021]
r6选自氢、
[0022][0023]
r7选自氢、
[0024][0025]
n为0、1、2、3;
[0026]
或者,r5与r6与碳或氧原子组成以下的基团:
[0027]
优选的,所述基于n,n
’‑
二取代二氢吩嗪化合物结构为以下结构的一种:
[0028][0029]
本发明的第二方面提供了一种所述基于n,n
’‑
二取代二氢吩嗪化合物的制备方法,包括以下步骤:
[0030][0031]
将摩尔比为1:4:4的化合物ii、苯胺、吡啶加入二氯甲烷中混合,在0℃下加入四氯化钛,化合物ii与四氯化钛的摩尔比为1:4,自然升温到室温,搅拌1~24小时,蒸干溶剂后加入四氢呋喃,加入钯碳、硼氢化钠,化合物ii与钯碳、硼氢化钠的摩尔比为1:0.1:10,反应结束重结晶纯化得到化合物iii;
[0032]
将摩尔比为1:3:0.25:1的化合物iii、碳酸钾、硫酸铜、取代碘苯溶于三氯苯中混合,160~220℃下反应1~24小时,反应结束后柱层析纯化,得到化合物iv;
[0033]
或,将摩尔比为1:1的化合物iii、取代碘苯溶于n,n-二甲基甲酰胺中混合,加入催化量的氯(2-二环己基膦基-2,4,6-三异丙基-1,1-联苯)[2-(2-氨基乙基苯基)]钯(ii)和双(二亚芐基丙酮)钯,常温下反应1~24小时,反应结束后柱层析纯化,得到化合物iv;
[0034]
将摩尔比为1:3的化合物iv与取代硼酸化合物溶于四氢呋喃中,加入四三苯基膦钯,化合物iv与四三苯基膦钯的摩尔比为100:1,在温度为20~110℃的条件下偶联反应1~24小时,所得产物柱层析提纯,得到通式i所示基于n,n
’‑
二取代二氢吩嗪化合物。
[0035]
所述化合物ii选自2,7-二溴菲醌、3,6-二溴菲醌、菲醌、3-溴-菲醌。
[0036]
所述取代碘苯选自1,2-二氟-4-碘苯、碘苯。
[0037]
所述取代硼酸化合物选自4-甲硫基苯硼酸、4-甲硫基苯基硼酸哪醇酯、4-甲硫基-4-联苯硼酸、4-甲硫基-4-硼酸哪醇酯。
[0038][0039]
将摩尔比为1:1的化合物iv与溴水加入醋酸中,0℃下反应1~24小时,获得化合物v;
[0040]
将摩尔比为1:3的化合物v与取代硼酸化合物溶于四氢呋喃中,加入四三苯基膦钯,化合物v与四三苯基膦钯的摩尔比为100:1,在温度为20~110℃的条件下偶联反应1~24小时,所得产物柱层析提纯,得到通式i所示基于n,n
’‑
二取代二氢吩嗪化合物。
[0041][0042]
将摩尔比为1:10的化合物iv与三氯氧磷溶于n,n-二甲基甲酰胺中,70~90℃下进行偶联反应1~24h,获得化合物vi;
[0043]
将摩尔比为1:3的化合物vi与4-甲硫基苯硼酸溶于四氢呋喃中,加入四三苯基膦钯,化合物vi与四三苯基膦钯的摩尔比为100:1,70~90℃下进行偶联反应1~24h,获得化合物vii;
[0044]
将摩尔比为1:0.1:10的化合物vii、钯碳、硼氢化钠溶于四氢呋喃中反应1~24h,得到化合物viii;
[0045]
将摩尔比为1:10的化合物viii与氢化钠溶于四氢呋喃中,加入1,2-二(溴甲基)苯,化合物viii与1,2-二(溴甲基)苯的摩尔比为1:1,70~90℃下进行偶联反应1~24h,获得通式i所示基于n,n
’‑
二取代二氢吩嗪化合物。
[0046]
本发明的第三方面提供了一种所述基于n,n
’‑
二取代二氢吩嗪化合物在制备荧光探针或单分子器件中的应用。
[0047]
所述荧光探针尤其指的是比率型荧光探针。
[0048]
本发明的第四方面提供了一种所述基于n,n
’‑
二取代二氢吩嗪化合物在制备有机多功能光电材料或有机分子开关中的应用。
[0049]
本发明的第五方面提供了一种所述基于n,n
’‑
二取代二氢吩嗪化合物在制备可调控的多色发光分子材料、光控有机分子开关、速率可控电子传输材料、化学传感器、多寻址光电分子开关、分子发光器件、光电信息存储设备、分子导线元件中的应用。
[0050]
所述基于n,n
’‑
二取代二氢吩嗪化合物在极性、粘度、温度等环境调控下,蓝色发射和红色发射会有比率型的变化,形成具有可调控功能的多色发光材料。以化合物i-1为例:固相状态下,化合物呈现出本征固有的蓝色发光(450nm),在溶液态时(四氢呋喃中),化合物呈现出激发态的红色发光(600nm),并且可以通过改变环境的极性、粘度、温度等条件,使得化合物两种发光比例改变,例如,将溶剂换为极性更强的甲苯,化合物激发态红光位移至610nm。此外,在溶剂中加入聚四氢呋喃改变溶剂粘度,化合物本征蓝光会逐渐提升,体现在荧光颜色变化上表现为从红到蓝。并且,化合物荧光颜色也会随着温度产生变化,在低温下表现为蓝色的本征发射,高温时则为红色发射。这些性质可以加以利用,从而得到可调控的多色发光分子材料。
[0051]
在构象限制调控分子发光性能中的应用,以i-5为例:固相状态下,化合物呈现出本征固有的蓝色发光(440nm),在溶液态时,化合物依然呈现出蓝色发光(440nm),并且改变溶剂极性,加入聚四氢呋喃等手段均无法恢复其激发态红光发射,即化合物的发光位置不会发生明显的改变,从而达到了限制荧光发射的目的,成功的将激发态的红色发光锁定。
[0052]
所述基于n,n
’‑
二取代二氢吩嗪化合物在单分子电荷传输材料领域的应用,以i-1为例:能够与ag或au电极直接接触相连,能够成为单分子导线的组成元件。并且本发明拥有通过分子构象变化导致的电子云密度变化,从而可以通过光照调控分子电导率性质,能够作为一类新型的有机分子开关。化合物在光照前后的电子云密度会发生明显的变化,从而造成了电荷传输效率的变化,表现为单分子电导值的变化,在三甲苯溶剂中,其在254nm光照前的电导值为2.1ns(10-4.75
g0),光照后上升至3.7ns(10-4.32
g0)。可以应用于光控有机分子开关、速率可控电子传输材料等。
[0053]
构象限制的分子在单分子电荷传输性能中的应用,以i-5为例:通过化学成键的方式限制了吩嗪类化合物的构象变化,其荧光发射被固定在440nm,同时在254nm光照前后,电导值稳定在3.4ns(10-4.36
g0),可以更好的解释说明通式i中其他化合物的光激发振动工作机制,也可利用其构象限制的特征以制备紫外光稳定的新型单分子器件。
[0054]
所述基于n,n
’‑
二取代二氢吩嗪化合物可以与离子配合,从而限制激发态平面化过程,限制其在溶液态下的红色荧光发射,实现对特殊离子的特异性响应。其在化学传感器领域的应用,以i-3为例:在部分二价离子作用下,如cu
2+
,材料形成配合物导致多色发光性能被限制,化合物在溶液状态时无法产生红色荧光,加入edta,排除离子干扰后,化合物溶液的红色荧光得以恢复。
[0055]
本发明可以在纯有机溶液(如:四氢呋喃、乙腈、二甲基亚砜、甲醇、乙醇、二氯甲烷)中实现上述的多功能光电材料性质,具有很强的普适性。
[0056]
综上所述,这类化合物在制备多寻址光电分子开关、分子发光器件、光电信息存储、分子导线元件等领域均可应用。
[0057]
由于采用上述技术方案,本发明具有以下优点和有益效果:
[0058]
本发明的基于n,n
’‑
二取代二氢吩嗪类化合物可以直接与ag或au等金属电极锚定的端基(如甲硫基、氨基、苯甲硫基等)相连,其合成方法简单,而且原料成本低廉,工艺易于工业化生产,产品提纯高效便捷,所制备的有机多功能光电材料具有高的光转化效率、良好的热稳定性和出色的耐疲劳度。并在比率型荧光探针、可调控多色发光材料、单分子电子传输材料、分子导线、化学传感器等实际应用领域起到重要的作用。
[0059]
本发明的制备方法简单高效,经济性好,且具有大规模生产的价值,对环境友好。目标化合物的合成步骤已大幅缩短,并且在多步反应后均可维持60%左右的总收率,具有良好的经济价值。本发明具独特的有机多色调控发光性能,能对极性,环境,温度等外界条件进行响应性的荧光反馈,表现为荧光发射的位置和强度发生明显改变。同时,该类化合物具有单分子电荷传输性质,r取代基(甲硫基,氨基等)的引入使得其可以直接与ag和au等金属电极结合,实现对单分子尺度下的电导性质的直接测量,可在分子导线中应用。此外,本发明还可以在光照刺激下对分子内电荷传输能力进行响应性的调控,造成电导率的变化。这类响应型的荧光分子的光谱性能在光电信息领域有非常重要的作用,可用于制备多寻址光电分子开关、分子导线、oled器件、分子传感器。
[0060]
本发明提供的基于n,n
’‑
二取代二氢吩嗪化合物,解决了现有技术中的合成路线复杂、成本较高的技术问题,同时实现材料的多功能复合特性。
附图说明
[0061]
图1是实施例2中有机光电材料i-1在不同溶剂中的吸收与发射光谱示意图。
[0062]
图2是实施例2中有机光电材料i-1的荧光热稳定性示意图。
[0063]
图3是实施例2中有机光电材料i-1的可见光下的抗疲劳性示意图。
[0064]
图4是实施例2中有机光电材料i-1的电导率调控变化示意图。
具体实施方式
[0065]
为了更清楚地说明本发明,下面结合优选实施例对本发明做进一步的说明。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
[0066]
本发明实施例中所说的室温是:25-28℃;所用原料及试剂均为市售品或采用文献常规的方法制备。
[0067]
实施例1
[0068]
有机多功能光电材料化合物i-1的合成
[0069][0070]
所用2,7-二溴菲醌、苯胺等原料为商业化产品。
[0071]
将化合物ii-1即2,7-二溴菲醌(3.66g,0.01mol)与苯胺(3.72g,0.04mol)、吡啶(3.16g,0.04mol)混合后加入300ml二氯甲烷中,在0℃下加入4ml四氯化钛并于室温下搅拌24小时,蒸干溶剂后加入50ml四氢呋喃,加入10%钯碳(1.06g,1mmol)、硼氢化钠(3.7g,0.1mol)还原2h,反应结束后倒入水中析出固体,所得固体用乙醇重结晶纯化,得到5.1g化合物iii-1,产率98%。
[0072]
将化合物iii-1(5.16g,0.01mol)与碳酸钾(4.14g,0.03mol)、硫酸铜(0.4g,2.5mmol)、三氯苯(18g,11mol)和碘苯(2.04g,0.01mol)混合,180℃下反应24小时,反应结束后用柱层析(洗脱剂为石油醚:二氯甲烷=2:1的混合液)的方式纯化,得到3.8g化合物iv-1,产率64%。
[0073]
将化合物iv-1(5.92g,0.01mol)与4-甲硫基苯硼酸(5.04g,0.03mol)和四三苯基膦钯(0.12g,0.1mmol)溶于50ml四氢呋喃中,80℃下进行偶联反应12h,所得产物用柱层析(洗脱剂为石油醚:二氯甲烷=2:1的混合液)的方式提纯,得有机多功能光电材料化合物i-1,平均总产率60%。1h nmr(400mhz,chloroform-d)δ8.71-8.68(m,2h),8.02-8.00(m,2h),
7.70(dd,j=5.9,3.5hz,2h),7.60-7.55(m,6h),7.50-7.47(m,2h),7.31-7.28(m,2h),7.15-7.12(m,4h),6.94-6.88(m,6h),6.75-6.70(m,2h),2.40(s,6h)。
13
c nmr(101mhz,chloroform-d)δ145.9,138.3,137.6,137.2,133.4,132.7,132.2,129.6,128.1,127.3,126.8,125.7,125.6,125.2,124.0,123.7,119.6,116.2,14.8。hrms(esi+,m/z):[m]
+
calcd for c
46h34
n2s2,678.2163;found,678.3663。
[0074]
实施例2
[0075]
有机多功能光电材料化合物i-1的光谱性质:
[0076]
将实施例1制备的化合物i-1溶于均三甲苯中,配置成浓度为10μmoll-1
的均三甲苯溶液。在带有搅拌的1cm
×
1cm
×
4cm石英比色皿中加入2.5ml的待测溶液,采用紫外
–
可见分光光度计测定吸收光谱,并采用365nm单色激发光源对待测溶液进行照射测定其荧光发射光谱,结果如图1所示,图1是实施例2中有机光电材料i-1在不同溶剂中的吸收与发射光谱示意图,横坐标为波长,纵坐标为吸光度和发射强度。其吸收峰位于360nm,但双发射分别位于450nm和600nm,证明了大斯托克斯位移的存在。双发射的存在同时证明了其可以用于比率型荧光探针,可调控多色发光等材料领域的比率型荧光发射的性能。此外,该化合物的荧光量子效率为15.7%,和其他双发射探针相比,有一定的优势。
[0077]
化合物i-1在三甲苯溶液中,在不同热稳定下测定的荧光发射曲线,如图2所示,图2是实施例2中有机光电材料i-1的荧光热稳定性示意图。该化合物在20-80℃的温度变化范围内,荧光强度几乎没有变化,在很大的温度范围区间内保持了良好的热稳定性质。
[0078]
化合物i-1在三甲苯溶剂中,经过20w白光led灯持续照射不同时间后的450nm和600nm处的荧光发射峰与初始二个位置的发射峰强度的比值。如图3所示,图3是实施例2中有机光电材料i-1的可见光下的抗疲劳性示意图,在可见光照射下,化合物i-1依然可以长时间的保持自身发光性质,有着良好的抗疲劳型和光稳定性,为设计双发射比率型荧光探针提供了一种策略。
[0079]
有机多功能光电材料化合物i-1的电导率调控性质:
[0080]
吩嗪衍生物最外层电子在溶液中受到光照跃迁到激发态,通过分子内部振动使结构趋于平面化,增大了共轭程度,其蓝光发射红移至橙红光发射。这类化合物拥有超大斯托克斯位移和荧光双发射两个特征,本发明充分利用了该类化合物的振动特性,利用弯曲态与平面态电子云密度的不同排列影响分子电导率的特点,采用光照调控分子电导,制备了一系列具有光调控性质的分子开关/导线。其单分子器件的电导性能表征利用stm-bj技术来测量。stm-bj技术是目前构建金属-分子-金属单分子结(metal-molecule-metal junction),并实现常温常压及常见溶液环境中测量单个分子电导有效方法之一,其数据基于统计分析,因此在测量可靠性方面具有显著优势。
[0081]
该方法首先使金质stm探针逼近金镀膜衬底直至发生撞击,探针与衬底的接触电导保持至少5g0(量子电导g0=2e2/h,~77.5μs),然后以一定速度(17nm/s)后撤探针,探针后撤过程中附近的目标分子可以连接探针与衬底之间的纳米间隙而形成探针-分子-衬底分子结,在保持100mv偏电压条件下,能够测量单分子结的电导(g=i/v)。由于单分子器件及测试平台具有非常出色的稳定性,所以该过程可以重复成千上万次,从而获得具有统计学意义的大量有效数据。为系统研究单分子尺度下的吩嗪衍生物结构与振动诱导发光性能的关系提供了良好的平台,找到合适的规律为后续该类化合物的进一步改性提供参考价
值,同时现有的化合物拥有良好的发光性质和光控电导率变化性质,可以成功应用于单分子电学器件。
[0082]
将实施例1制备的化合物i-1溶解在均三甲苯溶剂中,配制成0.1mm的溶液,然后将该溶液引入到衬底上,构建以功能分子为核心的单分子器件。图4是实施例2中有机光电材料i-1的电导率调控变化示意图。在254nm光照时,电导值由2.1ns(10-4.75
g0)上升到3.7ns(10-4.32
g0),撤掉光照可恢复至初态。该类化合物具有一定的电导性质,具有在单分子导线领域的应用价值,并且该分子可以通过光控的方式调节电导值,不仅自身是一个良好的单分子器件,也为设计新型的分子开关提供思路。
[0083]
实施例3
[0084]
有机多功能光电材料化合物i-2的合成
[0085][0086]
所用3,6-二溴菲醌、苯胺等原料为商业化产品。
[0087]
将化合物ii-2即3,6-二溴菲醌(3.66g,0.01mol)与苯胺(3.72g,0.04mol)、吡啶(3.16g,0.04mol)混合后加入300ml二氯甲烷中,在0℃下加入4ml四氯化钛并于室温下搅拌24小时,蒸干溶剂后加入50ml四氢呋喃,加入10%钯碳(1.06g,1mmol)、硼氢化钠(3.7g,0.1mol)还原2h,反应结束后倒入水中析出固体,所得固体用乙醇重结晶纯化,得到4.9g化合物iii-2,产率89%。
[0088]
将化合物iii-2(5.16g,0.01mol)与碳酸钾(4.14g,0.03mol)、硫酸铜(0.4g,2.5mmol)、三氯苯(18g,11mol)和碘苯(2.04g,0.01mol)混合,180℃下反应24小时,反应结束后用柱层析(洗脱剂为石油醚:二氯甲烷=2:1的混合液)的方式纯化,得到3.9g化合物iv-2,产率66%。
[0089]
将化合物iv-2(5.92g,0.01mol)与4-甲硫基苯硼酸(5.04g,0.03mol)和四三苯基膦钯(0.12g,0.1mmol)溶于50ml四氢呋喃中,80℃下进行偶联反应12h,所得产物用柱层析(洗脱剂为石油醚:二氯甲烷=2:1的混合液)的方式提纯,得有机多功能光电材料化合物i-2,平均总产率61%。1h nmr(400mhz,chloroform-d)δ9.27-9.25(m,2h),8.37-8.35(m,2h),8.31-8.29(m,2h),8.01-7.99(m,4h),7.40-7.37(m,4h),7.27-7.24(m,4h),7.15-7.12(m,4h),7.04-7.02(m,4h),6.75-6.70(m,2h),2.38(s,6h)。13c nmr(101mhz,chloroform-d)δ145.9,138.3,137.6,137.2,133.4,132.7,130.3,129.6,128.1,127.3,127.2,126.8,125.7,125.2,124.2,124.0,115.4,14.6。hrms(esi+,m/z):[m]+calcd for c
46h34
n2s2,678.2163;found,678.2613。
[0090]
其双发射分别位于450nm和615nm,量子效率为18.3%。
[0091]
实施例4
[0092]
有机多功能光电材料化合物i-3的合成
[0093][0094]
所用菲醌、苯胺等原料为商业化产品。
[0095]
将化合物ii-3即菲醌(2.08g,0.01mol)与苯胺(3.72g,0.04mol)、吡啶(3.16g,0.04mol)混合后加入300ml二氯甲烷中,在0℃下加入4ml四氯化钛并于室温下搅拌24小时,蒸干溶剂后加入50ml四氢呋喃,加入10%钯碳(1.06g,1mmol)、硼氢化钠(3.7g,0.1mol)还原2h,反应结束后倒入水中析出固体,所得固体用乙醇重结晶纯化,得到3.4g化合物iii-3,产率94%。
[0096]
将化合物iii-3(3.60g,0.01mol)与碳酸钾(4.14g,0.03mol)、硫酸铜(0.4g,2.5mmol)、三氯苯(18g,11mol)和碘苯(2.04g,0.01mol)混合,180℃下反应24小时,反应结束后用柱层析(洗脱剂为石油醚:二氯甲烷=2:1的混合液)的方式纯化,得到2.9g化合物iv-3,产率67%。
[0097]
将化合物iv-3(4.34g,0.01mol)与溴水(1.60g,0.01mol)混合后加入50ml醋酸中,0℃下反应24小时,反应结束后用柱层析(洗脱剂为石油醚:二氯甲烷=4:1的混合液)的方式纯化,得到5.9g化合物v-3,产率92%。
[0098]
将化合物v-3(5.92g,0.01mol)与4-甲硫基苯硼酸(5.04g,0.03mol)和四三苯基膦钯(0.12g,0.1mmol)溶于50ml四氢呋喃中,80℃下进行偶联反应12h,所得产物用柱层析(洗脱剂为石油醚:二氯甲烷=2:1的混合液)的方式提纯,得有机多功能光电材料化合物i-2,平均总产率58%。1h nmr(400mhz,chloroform-d)δ9.01-8.98(m,2h),8.14-8.20(m,2h),7.98-7.96(m,4h),7.69-7.67(m,2h),7.63-7.62(m,2h),7.55-7.53(m,4h),7.41-7.37(m,4h),7.31-7.29(m,4h),7.06-7.04(m,2h),6.92-6.90(m,2h),2.39(s,6h)。
13
c nmr(101mhz,chloroform-d)δ144.8,138.3,138.2,137.2,133.4,132.7,131.7,128.8,128.1,127.3,126.7,126.6,124.1,123.2,122.4,14.8。hrms(esi+,m/z):[m]+calcd for c
46h34
n2s2,678.9120;found,678.9255。
[0099]
其双发射分别位于450nm和600nm,量子效率为18.1%。
[0100]
实施例5
[0101]
有机多功能光电材料化合物i-4的合成
[0102][0103]
所用3-溴菲醌、苯胺等原料为商业化产品。
[0104]
将化合物ii-4即3-溴菲醌(2.87g,0.01mol)与苯胺(3.72g,0.04mol)、吡啶(3.16g,0.04mol)混合后加入300ml二氯甲烷中,在0℃下加入4ml四氯化钛并于室温下搅拌24小时,蒸干溶剂后加入50ml四氢呋喃,加入10%钯碳(1.06g,1mmol)、硼氢化钠(3.7g,0.1mol)还原2h,反应结束后倒入水中析出固体,所得固体用乙醇重结晶纯化,得到4.18g化合物iii-4,产率95%。
[0105]
将化合物iii-4(4.39g,0.01mol)与1,2-二氟-4-碘代苯(2.4g,0.01mol)、氯(2-二环己基膦基-2,4,6-三异丙基-1,1-联苯)[2-(2-氨基乙基苯基)]钯(ii)(x-phos)(0.47g,1mmol)和双(二亚芐基丙酮)钯(pd(bda)2)(0.57g,1mmol)混合,加入n,n-二甲基甲酰胺50ml,常温下反应24小时,反应结束后用柱层析(洗脱剂为石油醚:二氯甲烷=2:1的混合液)的方式纯化,得到3.9g化合物iv-4,产率66%。
[0106]
将化合物iv-4(6.39g,0.01mol)与4-甲硫基苯硼酸(5.04g,0.03mol)和四三苯基膦钯(0.12g,0.1mmol)溶于50ml四氢呋喃中,80℃下进行偶联反应12h,所得产物用柱层析(洗脱剂为石油醚:二氯甲烷=2:1的混合液)的方式提纯,得有机多功能光电材料化合物i-4,平均总产率61%。1h nmr(400mhz,chloroform-d)δ8.86(s,2h),8.10(d,j=8.4hz,2h),7.72
–
7.61(m,8h),7.37
–
7.32(m,2h),7.31
–
7.26(m,2h),7.21(m,2h),7.05
–
6.89(m,8h),6.74(t,j=7.0hz,2h),2.49(s,6h)。
13
c nmr(101mhz,chloroform-d)δ145.9,138.3,137.6,137.2,134.7,133.4,132.7,132.3,131.7,130.6,129.6,128.3,128.1,127.3,127.2,126.8,126.7,126.6,125.7,125.2,124.2,123.2,122.4,14.8。hrms(esi+,m/z):[m]+calcd for c
46h34
n2s2,678.9120;found,678.9221。
[0107]
其双发射分别位于460nm和620nm,量子效率为15.9%。
[0108]
实施例6
[0109]
有机多功能光电材料化合物i-5的合成
[0110][0111]
所用2,7-二溴菲醌、苯胺等原料为商业化产品。
[0112]
将化合物ii-5即2,7-二溴菲醌(3.66g,0.01mol)与苯胺(3.72g,0.04mol)、吡啶(3.16g,0.04mol)混合后加入300ml二氯甲烷中,在0℃下加入4ml四氯化钛并于室温下搅拌24小时,蒸干溶剂后加入50ml四氢呋喃,加入10%钯碳(1.06g,1mmol)、硼氢化钠(3.7g,0.1mol)还原2h,反应结束后倒入水中析出固体,所得固体用乙醇重结晶纯化,得到5.1g化合物iii-5,产率98%。
[0113]
将化合物iii-5(5.16g,0.01mol)与碳酸钾(4.14g,0.03mol)、硫酸铜(0.4g,2.5mmol)、三氯苯(18g,11mol)和碘苯(2.04g,0.01mol)混合,180℃下反应24小时,反应结束后用柱层析(洗脱剂为石油醚:二氯甲烷=2:1的混合液)的方式纯化,得到3.8g化合物iv-5,产率64%。
[0114]
将化合物iv-5(5.92g,0.01mol)与三氯氧磷(15.3g,0.1mol)混合,溶于50ml n,n-二甲基甲酰胺中,80℃下进行偶联反应12h,反应结束后加水析出固体,抽滤得6.3g化合物vi-5,产率97%。
[0115]
将化合物vi-5(6.48g,0.01mol)与4-甲硫基苯硼酸(5.04g,0.03mol)和四三苯基膦钯(0.12g,0.1mmol)溶于50ml四氢呋喃中,80℃下进行偶联反应12h,所得产物用柱层析(洗脱剂为石油醚:二氯甲烷=2:1的混合液)的方式提纯,得5.22g化合物vii-5,产率71%。
[0116]
将化合物vii-5(7.34g,0.01mol)中加入10%钯碳(1.06g,1mmol)、硼氢化钠(3.7g,0.1mol)和50ml四氢呋喃,室温下还原2h,反应结束后倒入水中析出固体,所得固体用乙醇重结晶纯化,得到7.34g化合物viii-5,产率99%。
[0117]
将化合物viii-5(7.39g,0.01mol)与氢化钠(2.4g,0.1mol)、1,2-二(溴甲基)苯(2.63g,0.01mol)混合后加入50ml四氢呋喃,80℃下反应24h,所得产物用柱层析(洗脱剂为石油醚:二氯甲烷=3:1的混合液)的方式提纯,得有机多功能光电材料化合物i-5,平均总产率43%。1h nmr(600mhz,cdcl3)δ8.76(d,j=8.6hz,2h),8.41(d,j=1.8hz,2h),7.88(dd,j=8.4,2.0hz,2h),7.71(dd,j=5.8,3.6hz,2h),7.57
–
7.53(m,4h),7.36(dd,j=5.9,3.4hz,2h),7.32(dd,j=5.6,3.4hz,2h),7.29
–
7.26(m,4h),7.18
–
7.16(m,2h),6.77(d,j=8.5hz,4h),6.63(d,j=8.3hz,4h),4.25(s,4h),3.86
–
3.81(m,4h),2.45(s,6h).
13
c nmr
(151mhz,cdcl3)δ148.53,146.56,141.13,140.76,139.67,139.35,138.38,138.19,137.44,135.80,134.10,130.47,129.32,129.18,128.89,127.85,126.98,126.21,126.07,124.84,123.81,122.00,115.25,71.60,66.63,31.92,29.71,14.13.hrms(esi,m/z):[m+h]
+
calcd.for c
56h44
n2o2s2,841.2922,found:841.2922.
[0118]
该化合物其中一个发射被成功抑制,单个发射位于440nm,量子效率为19.1%。在不同光刺激下,其电导率能稳定为3.4ns。
[0119]
对比例1
[0120][0121]
以现有的芴基化合物c1作为对比,端甲基硫化物寡芴分子的电导分布非常广泛,这是由于其围绕au-s键旋转的扭转势能面相对平坦,电导通过π耦合态具有很强的取向效应(sagan c,et al.j.phys.chem.c,2017,45:24945
–
24953)。此外,该化合物具有一定的蓝光发射,但信号微弱,量子效率低。
[0122]
本发明中的化合物,以化合物i-1为例,具有明显的双发射性质,可以作为比率型荧光探针,同时也可以利用450nm与600nm的双荧光发射峰来检测单分子的电导性质,使得该类化合物材料功能不再单一,具有多功能可调控的性质(利用光,热,粘度,极性调控发射以及电导率)。与化合物c1相比,化合物i-1有着双发射性质,可以实现比率型荧光检测。同时红光在能量传递,探测器检测等方面更为重要,并且化合物i-1量子效率为15.7%,有良好红光发射效率。就单分子电导性质而言,本发明中的化合物普遍电导值为3.5ns左右,均具有分子导线性质。同时,化合物还可以通过外界环境手段调控其电导值变化,化合物i-1的电导值在254nm光照后,电导值由2.1ns(10-4.75
g0)上升到3.7ns(10-4.32
g0),具有一定的光开关性质。这种多功能复合的新型有机光电材料同时具备合成路线清晰简洁,有良好比率型荧光和可调节电导值的性质,目前,在现有的技术中,未发现其它材料可以实现该类机制作用下的相关性能。
[0123]
以上所述仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭露如上,然而并非用以限定本发明,任何熟悉本专利的技术人员在不脱离本发明技术方案范围内,当可利用上述提示的技术内容作出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明方案的范围内。
