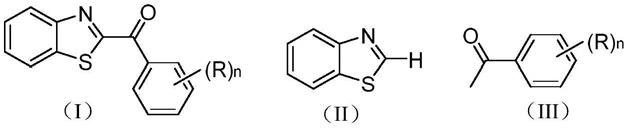
苯并噻唑与如式(ⅲ)所示的取代苯乙酮混合,加入溶剂中,然后加入氧化剂二(三氟乙酸)碘苯、添加剂氢氧化钾,进行加热搅拌反应,tlc监测至反应结束,反应液分离纯化制得如式(ⅰ)所示的c2取代2h-苯并噻唑酰基化衍生物;
[0007][0008]
式(i)和式(iii)中,苯乙酮环上的h被取代基r单取代或不被取代;n为0或1,n表示苯乙酮环上取代基r的个数;当n=0时,表示苯乙酮环上的h不被取代;当n=1时,表示苯乙酮环上的h被取代基r单取代。
[0009]
进一步地,所述取代基r为氢、甲基、卤素、硝基、羟基、苯基或c1-c2烷氧基。
[0010]
进一步地,如式(ⅱ)所示的苯并噻唑、如式(ⅲ)所示的取代苯乙酮、氧化剂二(三氟乙酸)碘苯以及添加剂氢氧化钾的投料物质的量之比为1:0.1~1.0:0.5~3.0:0.05~0.25,优选为1:0.3~0.7:0.8~1.6:0.08~0.18。
[0011]
进一步地,溶剂为dmso和h2o的混合溶剂,dmso与h2o的体积比为1~5:1,优选为1~3:1。
[0012]
进一步地,加热温度为20℃~120℃,优选为30℃~60℃;搅拌反应的时间为4~20小时,优选为8~12小时。
[0013]
进一步地,反应液分离纯化的方法为:反应结束后,反应液浓缩除去溶剂,浓缩液经柱层析分离得到如式(ⅰ)所示的c2取代2h-苯并噻唑酰基化衍生物,柱层析采用的洗脱剂为体积比10~5:1的石油醚与乙酸乙酯混合溶剂。
[0014]
本发明的有益效果在于:提供了一种以pifa为氧化剂、koh为添加剂,经加热合成c2取代2h-苯并噻唑酰基化衍生物的新方法,该方法原子经济性高、催化体系简单、产物收率高、底物范围广。
具体实施方式
[0015]
下面结合实施例对本发明做进一步地说明,但本发明的保护范围并不仅限于此。
[0016]
以下实施例中,衍生物ia-is的结构式如式(ⅰ)所示,并在相应实施例中分别公开了取代基(r)n的具体类型
[0017][0018]
实施例1 衍生物ⅰa(n=0,(r)n=氢)的合成
[0019]
称取2h-苯并噻唑(0.45mmol,60.8mg)、苯乙酮(0.14mmol,16.8mg)、二(三氟乙酸)碘苯pifa(0.36mmol,154.8mg)和koh(0.04mmol,2.3mg)混合物溶解在dmso/h2o(3:2ml)溶液于10ml反应管中,置于30℃室温下搅拌反应,tlc监测,约12h后反应结束,反应液浓缩除去溶剂,浓缩液经柱层析分离(洗脱剂为体积比10:1的石油醚-乙酸乙酯混合溶剂)得到黄色固体30.1mg,即衍生物ⅰa,收率90%。
[0020]
该化合物的1h nmr和
13
c nmr分析数据如下所述,
[0021]1h nmr(500mhz,cdcl3)δ8.58(dd,j=8.5,1.0hz,2h),8.28
–
8.25(m,1h),8.07
–
8.03(m,1h),7.72
–
7.67(m,1h),7.63
–
7.56(m,4h);
13
c nmr(125mhz,cdcl3)δ185.40,167.17,153.94,137.06,135.03,133.91,131.31,128.53,127.64,126.95,125.77,122.19。
[0022]
实施例2 衍生物ⅰb(n=1,(r)n=对甲基)的合成
[0023]
称取2h-苯并噻唑(0.45mmol,60.8mg)、对甲基苯乙酮(0.32mmol,42.9mg)、pifa(0.72mmol,309.6mg)和koh(0.08mmol,4.5mg)混合物溶解在dmso/h2o(6:2ml)溶液于20ml反应管中,置于60℃沙浴下搅拌反应,tlc监测,约8h后反应结束,反应液浓缩除去溶剂,浓缩液经柱层析分离(洗脱剂为体积比10:1的石油醚-乙酸乙酯混合溶剂)得到黄色固体77.7mg,即衍生物ⅰb,收率96%。
[0024]
该化合物的1h nmr和
13
c nmr分析数据如下所述,
[0025]1h nmr(500mhz,cdcl3)δ8.50(d,j=8.5hz,2h),8.28
–
8.24(m,1h),8.05
–
8.02(m,1h),7.62
–
7.54(m,2h),7.38(d,j=8.0hz,2h),2.49(s,3h);
13
c nmr(125mhz,cdcl3)δ184.94,167.50,153.94,145.01,137.01,132.47,131.44,129.28,127.49,126.85,125.69,122.16,21.85。
[0026]
实施例3 衍生物ⅰc(n=1,(r)n=间甲基)的合成
[0027]
称取2h-苯并噻唑(0.45mmol,60.8mg)、间甲基苯乙酮(0.32mmol,42.9mg)、pifa(0.72mmol,309.6mg)和koh(0.08mmol,4.5mg)混合物溶解在dmso/h2o(6:2ml)溶液于20ml反应管中,置于60℃沙浴下搅拌反应,tlc监测,约9h后反应结束,反应液浓缩除去溶剂,浓缩液经柱层析分离(洗脱剂为体积比10:1的石油醚-乙酸乙酯混合溶剂)得到黄色固体75.3mg,即衍生物ic,收率93%。
[0028]
该化合物的1h nmr和
13
c nmr分析数据如下所述,
[0029]1h nmr(500mhz,cdcl3)δ8.40(d,j=7.5hz,1h),8.30(s,1h),8.29
–
8.26(m,1h),8.05
–
8.03(m,1h),7.63
–
7.57(m,2h),7.51
–
7.45(m,2h),2.50(s,3h);
13
c nmr(125mhz,cdcl3)δ185.69,167.29,153.94,138.35,137.06,134.76,131.50,128.69,128.43,127.59,126.91,125.78,122.19,21.47。
[0030]
实施例4 衍生物ⅰd(n=1,(r)n=邻甲基)的合成
[0031]
称取2h-苯并噻唑(0.45mmol,60.8mg)、邻甲基苯乙酮(0.22mmol,29.5mg)、pifa(0.54mmol,232.2mg)和koh(0.06mmol,3.38mg)混合物溶解在dmso/h2o(4:2ml)溶液于10ml反应管中,置于50℃沙浴下搅拌反应,tlc监测,约10h后反应结束,反应液浓缩除去溶剂,浓缩液经柱层析分离(洗脱剂为体积比8:1的石油醚-乙酸乙酯混合溶剂)得到黄色固体53.4mg,即衍生物ⅰd,收率96%。
[0032]
该化合物的1h nmr和
13
c nmr分析数据如下所述,
[0033]1h nmr(500mhz,cdcl3)δ8.21(dd,j=9.0,1.5hz,1h),8.03(td,j=7.5,1.0hz,2h),7.60
–
7.54(m,2h),7.52
–
7.48(m,1h),7.37(t,j=7.5hz,2h),2.55(s,3h);
13
c nmr(126mhz,cdcl3)δ189.27,167.61,153.86,139.11,137.2,135.25,132.03,131.58,131.37,127.69,126.95,125.86,125.35,122.26,20.68。
[0034]
实施例5 衍生物ⅰe(n=1,(r)n=对氯)的合成
[0035]
称取2h-苯并噻唑(0.45mmol,60.8mg)、对氯苯乙酮(0.14mmol,21.6mg)、pifa
(0.72mmol,309.6mg)和koh(0.04mmol,2.3mg)混合物溶解在dmso/h2o(4:3ml)溶液于20ml反应管中,置于40℃沙浴下搅拌反应,tlc监测,约11h后反应结束,反应液浓缩除去溶剂,浓缩液经柱层析分离(洗脱剂为体积比10:1的石油醚-乙酸乙酯混合溶剂)得到黄色固体37.1mg,即衍生物ⅰe,收率97%。
[0036]
该化合物的1h nmr和
13
c nmr分析数据如下所述,
[0037]1h nmr(500mhz,cdcl3)δ8.58(d,j=8.5hz,2h),8.26(d,j=8.0hz,1h),8.05(d,j=7.5hz,1h),7.64
–
7.54(m,4h);
13
c nmr(125mhz,cdcl3)δ184.06,166.86,153.89,140.67,137.10,133.33,132.76,128.91,127.82,127.08,125.80,122.23。
[0038]
实施例6 衍生物ⅰf(n=1,(r)n=间氯)的合成
[0039]
称取2h-苯并噻唑(0.45mmol,60.8mg)、间氯苯乙酮(0.14mmol,21.6mg)、pifa(0.36mmol,154.8mg)和koh(0.08mmol,4.5mg)混合物溶解在dmso/h2o(3:2ml)溶液于10ml反应管中,置于30℃室温下搅拌反应,tlc监测,约10h后反应结束,反应液浓缩除去溶剂,浓缩液经柱层析分离(洗脱剂为体积比10:1的石油醚-乙酸乙酯混合溶剂)得到黄色固体34.8mg,即衍生物ⅰf,收率91%。
[0040]
该化合物的1h nmr和
13
c nmr分析数据如下所述,
[0041]1h nmr(500mhz,cdcl3)δ8.58(t,j=2.0hz,1h),8.50(d,j=8.0hz,1h),8.28(d,j=7.5hz,1h),8.05(d,j=7.5hz,1h),7.67
–
7.51(m,4h);
13
c nmr(125mhz,cdcl3)δ184.05,166.48,153.86,137.11,136.50,134.73,133.80,131.19,129.82,129.45,127.90,127.11,125.91,122.22。
[0042]
实施例7 衍生物ⅰg(n=1,(r)n=邻氯)的合成
[0043]
称取2h-苯并噻唑(0.45mmol,60.8mg)、邻氯苯乙酮(0.32mmol,49.5mg)、pifa(0.36mmol,154.8mg)和koh(0.04mmol,2.3mg)混合物溶解在dmso/h2o(4:2ml)溶液于20ml反应管中,置于60℃沙浴下搅拌反应,tlc监测,约8h后反应结束,反应液浓缩除去溶剂,浓缩液经柱层析分离(洗脱剂为体积比10:1的石油醚-乙酸乙酯混合溶剂)得到黄色固体83.0mg,即衍生物ⅰg,收率95%。
[0044]
该化合物的1h nmr和
13
c nmr分析数据如下所述,
[0045]1h nmr(500mhz,cdcl3)δ8.21
–
8.17(m,1h),8.06
–
8.01(m,1h),7.80
–
7.76(m,1h),7.60
–
7.51(m,4h),7.47
–
7.43(m,1h);
13
c nmr(125mhz,cdcl3)δ187.61,165.95,153.76,137.45,136.07,132.63,132.36,130.79,130.55,127.97,127.07,126.49,125.97,122.33。
[0046]
实施例8 衍生物ⅰh(n=1,(r)n=对溴)的合成
[0047]
称取2h-苯并噻唑(0.45mmol,60.8mg)、对溴苯乙酮(0.3mmol,59.7mg)、pifa(0.36mmol,154.8mg)和koh(0.04mmol,2.3mg)混合物溶解在dmso/h2o(4:2ml)溶液于20ml反应管中,置于50℃沙浴下搅拌反应,tlc监测,约9h后反应结束,反应液浓缩除去溶剂,浓缩液经柱层析分离(洗脱剂为体积比5:1的石油醚-乙酸乙酯混合溶剂)得到黄色固体87.2mg,即衍生物ⅰh,收率92%。
[0048]
该化合物的1h nmr和
13
c nmr分析数据如下所述,
[0049]1h nmr(500mhz,cdcl3)δ8.49(d,j=8.5hz,2h),8.25(d,j=7.5hz,1h),8.04(d,j=7.5hz,1h),7.72(d,j=8.5hz,2h),7.63
–
7.56(m,2h);
13
c nmr(125mhz,cdcl3)δ184.27,166.80,153.88,137.10,133.74,132.80,131.89,129.53,127.83,127.08,125.81,122.23。
[0050]
实施例9 衍生物ⅰi(n=1,(r)n=邻溴)的合成
[0051]
称取2h-苯并噻唑(0.45mmol,60.8mg)、邻溴苯乙酮(0.3mmol,59.7mg)、pifa(0.72mmol,309.6mg)和koh(0.08mmol,4.5mg)混合物溶解在dmso/h2o(6:2ml)溶液于20ml反应管中,置于30℃室温下搅拌反应,tlc监测,约12h后反应结束,反应液浓缩除去溶剂,浓缩液经柱层析分离(洗脱剂为体积比5:1的石油醚-乙酸乙酯混合溶剂)得到黄色固体85.3mg,即衍生物ⅰi,收率90%。
[0052]
该化合物的1h nmr和
13
c nmr分析数据如下所述,
[0053]1h nmr(500mhz,cdcl3)δ8.19(d,j=9.5hz,1h),8.04(d,j=9.5hz,1h),7.73(t,j=7.5hz,2h),7.60
–
7.55(m,2h),7.50(td,j=7.5,1.0hz,1h),7.44(td,j=8.0,1.5hz,1h);
13
c nmr(125mhz,cdcl3)δ188.31,165.67,153.76,138.09,137.50,133.70,132.37,130.71,128.00,127.09,127.05,125.99,122.34,120.64。
[0054]
实施例10 衍生物ⅰj(n=1,(r)n=对氟)的合成
[0055]
称取2h-苯并噻唑(0.45mmol,60.8mg)、对氟苯乙酮(0.3mmol,41.4mg)、pifa(0.72mmol,309.6mg)和koh(0.04mmol,2.3mg)混合物溶解在dmso/h2o(6:2ml)溶液于20ml反应管中,置于40℃沙浴下搅拌反应,tlc监测,约10h后反应结束,反应液浓缩除去溶剂,浓缩液经柱层析分离(洗脱剂为体积比10:1的石油醚-乙酸乙酯混合溶剂)得到黄色固体73.2mg,即衍生物ⅰj,收率95%。
[0056]
该化合物的1h nmr和
13
c nmr分析数据如下所述,
[0057]1h nmr(500mhz,cdcl3)δ8.70(dd,j=9.0,5.5hz,2h),8.29
–
8.24(m,1h),8.06
–
8.02(m,1h),7.60(dtd,j=15.0,7.0,1.5hz,2h),7.26(t,j=9hz,2h);
13
c nmr(125mhz,cdcl3)δ183.56,167.45,167.06,165.40,153.87,137.03,134.21,134.14,131.33,131.31,127.70,126.99,125.71,122.18,115.82,115.64。
[0058]
实施例11 衍生物ⅰk(n=1,(r)n=间氟)的合成
[0059]
称取2h-苯并噻唑(0.45mmol,60.8mg)、间氟苯乙酮(0.3mmol,41.4mg)、pifa(0.72mmol,309.6mg)和koh(0.04mmol,2.3mg)混合物溶解在dmso/h2o(6:2ml)溶液于20ml反应管中,置于30℃室温下搅拌反应,tlc监测,约10h后反应结束,反应液浓缩除去溶剂,浓缩液经柱层析分离(洗脱剂为体积比8:1的石油醚-乙酸乙酯混合溶剂)得到黄色固体70.2mg,即衍生物ⅰk,收率91%。
[0060]
该化合物的1h nmr和
13
c nmr分析数据如下所述,
[0061]1h nmr(500mhz,cdcl3)δ8.41(d,j=7.8hz,1h),8.37-8.34(m,1h),8.28(d,j=7.5hz,1h),8.05(d,j=7.5hz,1h),7.64
–
7.55(m,3h),7.41-7,37(m,1h);
13
c nmr(125mhz,cdcl3)δ183.97,166.62,153.90,137.13,130.19,130.13,127.89,127.11,125.90,122.23,121.03,120.86,118.26,118.07。
[0062]
实施例12 衍生物ⅰl(n=1,(r)n=邻氟)的合成
[0063]
称取2h-苯并噻唑(0.45mmol,60.8mg)、邻氟苯乙酮(0.3mmol,41.4mg)、pifa(0.36mmol,154.8mg)和koh(0.08mmol,4.5mg)混合物溶解在dmso/h2o(3:3ml)溶液于20ml反应管中,置于60℃沙浴下搅拌反应,tlc监测,约8h后反应结束,反应液浓缩除去溶剂,浓缩液经柱层析分离(洗脱剂为体积比8:1的石油醚-乙酸乙酯混合溶剂)得到黄色固体74.8mg,即衍生物ⅰl,收率97%。
[0064]
该化合物的1h nmr和
13
c nmr分析数据如下所述,
[0065]1h nmr(500mhz,cdcl3)δ8.20(d,j=7.5hz,1h),8.06
–
8.01(m,2h),7.64
–
7.55(m,3h),7.34(t,j=8.0hz,1h),7.25(dd,j=18.0,8.0hz,1h);
13
c nmr(125mhz,cdcl3)δ185.33,166.21,162.26,160.22,153.72,137.29,134.44,134.37,131.91,127.86,127.04,125.86,124.93,124.84,124.02,124.99,122.29,116.77,116.60。
[0066]
实施例13 衍生物ⅰm(n=1,(r)n=邻碘)的合成
[0067]
称取2h-苯并噻唑(0.45mmol,60.8mg)、邻碘苯乙酮(0.3mmol,73.8mg)、pifa(0.36mmol,154.8mg)和koh(0.08mmol,4.5mg)混合物溶解在dmso/h2o(3:3ml)溶液于10ml反应管中,置于30℃室温下搅拌反应,tlc监测,约11h后反应结束,反应液浓缩除去溶剂,浓缩液经柱层析分离(洗脱剂为体积比10:1的石油醚-乙酸乙酯混合溶剂)得到黄色固体104.0mg,即衍生物ⅰm,收率95%。
[0068]
该化合物的1h nmr和
13
c nmr分析数据如下所述,
[0069]1h nmr(500mhz,cdcl3)δ8.18(d,j=8.0hz,1h),8.08
–
8.04(m,1h),7.97(d,j=7.5hz,1h),7.74(dd,j=8.0,2.0hz,1h),7.60
–
7.55(m,1h),7.52
–
7.44(m,2h),7.19(td,j=8.0,1.5hz,1h);
13
c nmr(126mhz,cdcl3)δ167.98,140.66,136.18,131.52,131.30,128.25,126.40,125.59,123.77,121.57,96.35。
[0070]
实施例14 衍生物ⅰn(n=1,(r)n=对甲氧基)的合成
[0071]
称取2h-苯并噻唑(0.45mmol,60.8mg)、对甲氧基苯乙酮(0.3mmol,45mg)、pifa(0.72mmol,309.6mg)和koh(0.04mmol,2.3mg)混合物溶解在dmso/h2o(6:2ml)溶液于20ml反应管中,置于60℃沙浴下搅拌反应,tlc监测,约9h后反应结束,反应液浓缩除去溶剂,浓缩液经柱层析分离(洗脱剂为体积比10:1的石油醚-乙酸乙酯混合溶剂)得到黄色固体73.4mg,即衍生物ⅰn,收率91%。
[0072]
该化合物的1h nmr和
13
c nmr分析数据如下所述,
[0073]1h nmr(500mhz,cdcl3)δ8.64(d,j=7.5hz,2h),8.22(d,j=6.5hz,1h),8.00(d,j=6.5hz,1h),7.59
–
7.50(m,2h),7.03(d,j=7.5hz,2h),3.91(s,3h);
13
c nmr(125mhz,cdcl3)δ185.30,167.81,164.32,153.84,136.86,133.81,127.70,127.31,126.73,125.54,122.15,113.87,55.54。
[0074]
实施例15 衍生物ⅰo(n=1,(r)n=对乙氧基)的合成
[0075]
称取2h-苯并噻唑(0.45mmol,60.8mg)、对乙氧基苯乙酮(0.3mmol,49.2mg)、pifa(0.72mmol,309.6mg)和koh(0.04mmol,2.3mg)混合物溶解在dmso/h2o(6:2ml)溶液于20ml反应管中,置于50℃沙浴下搅拌反应,tlc监测,约9h后反应结束,反应液浓缩除去溶剂,浓缩液经柱层析分离(洗脱剂为体积比10:1的石油醚-乙酸乙酯混合溶剂)得到黄色固体75.6mg,即衍生物ⅰo,收率89%。
[0076]
该化合物的1h nmr和
13
c nmr分析数据如下所述,
[0077]1h nmr(500mhz,cdcl3)δ8.64(d,j=7.5hz,2h),8.24(d,j=7.0hz,1h),8.01(d,j=6.5hz,1h),7.60
–
7.51(m,2h),7.03(d,j=7.5hz,2h),4.16(q,j=6.0hz,2h),1.48(t,j=6.0hz,3h);
13
c nmr(125mhz,cdcl3)δ185.20,167.95,163.83,153.81,136.86,133.84,127.50,127.37,126.73,125.54,122.06,114.25,63.82,14.61。
[0078]
实施例16 衍生物ⅰp(n=1,(r)n=对硝基)的合成
[0079]
称取2h-苯并噻唑(0.45mmol,60.8mg)、对硝基苯乙酮(0.3mmol,49.5mg)、pifa(0.72mmol,309.6mg)和koh(0.04mmol,2.3mg)混合物溶解在dmso/h2o(6:2ml)溶液于20ml反应管中,置于30℃室温下搅拌反应,tlc监测,约9h后反应结束,反应液浓缩除去溶剂,浓缩液经柱层析分离(洗脱剂为体积比8:1的石油醚-乙酸乙酯混合溶剂)得到黄色固体80.1mg,即衍生物ⅰp,收率94%。
[0080]1h nmr(500mhz,cdcl3)δ8.74(d,j=7.5hz,2h),8.40(d,j=7.5hz,2h),8.26(d,j=6.5hz,1h),8.05(d,j=6.5hz,1h),7.65
–
7.85(m,2h);
13
c nmr(125mhz,cdcl3)δ183.80,165.85,153.71,150.53,139.71,137.26,132.34,128.36,127.30,125.97,123.55,122.35。
[0081]
实施例17 衍生物ⅰq(n=1,(r)n=对羟基)的合成
[0082]
称取2h-苯并噻唑(0.45mmol,60.8mg)、对羟基苯乙酮(0.3mmol,40.8mg)、pifa(0.72mmol,309.6mg)和koh(0.04mmol,2.3mg)混合物溶解在dmso/h2o(6:2ml)溶液于8ml反应管中,置于60℃沙浴下搅拌反应,tlc监测,约10h后反应结束,反应液浓缩除去溶剂,浓缩液经柱层析分离(洗脱剂为体积比10:1的石油醚-乙酸乙酯混合溶剂)得到黄色固体72.7mg,即衍生物ⅰq,收率95%。
[0083]1h nmr(500mhz,cdcl3)δ10.77(s,1h),8.48(d,j=7.5hz,2h),8.27
–
8.20(m,2h),7.66
–
7.58(m,2h),6.98(d,j=8.4hz,2h);
13
c nmr(125mhz,cdcl3)δ182.23,167.85,163.58,153.32,136.06,133.84,127.76,127.25,125.59,125.15,122.71,115.62。
[0084]
实施例18 衍生物ⅰi(n=1,(r)n=对苯基)的合成
[0085]
称取2h-苯并噻唑(0.45mmol,60.8mg)、对苯基苯乙酮(0.3mmol,58.8mg)、pifa(0.72mmol,309.6mg)和koh(0.04mmol,2.3mg)混合物溶解在dmso/h2o(6:2ml)溶液于20ml反应管中,置于30℃室温下搅拌反应,tlc监测,约10h后反应结束,反应液浓缩除去溶剂,浓缩液经柱层析分离(洗脱剂为体积比10:1的石油醚-乙酸乙酯混合溶剂)得到黄色固体86.0mg,即衍生物ⅰi,收率91%。
[0086]1h nmr(500mhz,cdcl3)δ8.64(d,j=6.5hz,2h),8.25(d,j=6.5hz,1h),8.00(d,j=6.5hz,1h),7.77(d,j=7.0hz,2h),7.66(d,j=6.5hz,2h),7.60
–
7.51(m,2h),7.50
–
7.44(m,2h),7.42-7.39(m,1h);
13
c nmr(125mhz,cdcl3)δ184.72,167.25,153.82,146.59,139.82,136.92,133.62,131.82,128.91,128.35,127.69,127.34,127.11,126.92,125.74,122.16。
[0087]
本说明书所述的内容仅仅是对发明构思实现形式的列举,本发明的保护范围不应当被视为仅限于实施例所陈述的具体形式。
