靶向ccr1和nkg2d配体的嵌合抗原受体及其应用
技术领域
1.本发明涉及分子生物技术领域,特别是涉及一种靶向ccr1和nkg2d配体的嵌合抗原受体及其应用。
背景技术:
2.近年来,嵌合抗原受体t细胞(car t)疗法在肿瘤治疗中展现出非常好的疗效。car-t疗法的全称是chimeric antigen receptor t cell therapy,即嵌合抗原受体t细胞疗法,原理是应用患者自身的t淋巴细胞,经过实验室重新改造,装载上具有识别肿瘤抗原的受体及共刺激分子,体外扩增后再次回输入患者体内,从而识别并攻击自身的肿瘤细胞。t细胞也叫t淋巴细胞,是人体白细胞的一种,来源于骨髓造血干细胞,在胸腺中成熟,然后移居到人体血液、淋巴和周围组织器官,发挥免疫功能,其能够抵御和消灭感染、肿瘤、外来异物等。在实验室,技术人员通过基因工程技术,将t细胞激活,并装上定位导航装置car(嵌合抗原受体),将t细胞改造成car-t细胞,其利用嵌合抗原受体,专门识别体内肿瘤细胞,并通过免疫作用释放大量的多种效应因子,它们能高效地杀灭肿瘤细胞,从而达到治疗恶性肿瘤的目的。
3.但是,目前的嵌合抗原受体存在较大的抗原逃逸问题,影响了肿瘤治疗的效果。
技术实现要素:
4.基于此,有必要提供一种能够减少抗原逃逸的嵌合抗原受体。
5.一种靶向ccr1和nkg2d配体的嵌合抗原受体,其包括从氨基端到羧基端依次连接的抗原结合结构域、铰链区、跨膜结构域、共刺激结构域和信号转导结构域;所述抗原结合结构域包括抗ccr1单链抗体和nkg2d。
6.本发明构建了一种同时靶向ccr1及nkg2d配体的嵌合抗原受体,其包括抗原结合结构域、铰链区、跨膜结构域、共刺激结构域和信号转导结构域,抗原结合结构域包括了抗ccr1单链抗体和nkg2d分子。利用本发明上述同时靶向ccr1及nkg2d配体的嵌合抗原受体构建的car-t细胞,对ccr1及nkg2d配体阳性肿瘤细胞具有特异性靶向作用,体外杀伤作用显著,能够有效清除ccr1及nkg2d配体单/双阳性肿瘤细胞,减少抗原逃逸,在肿瘤治疗领域具有重要意义。
7.在其中一个实施例中,所述抗ccr1单链抗体包括抗ccr1抗体轻链可变区和抗ccr1抗体重链可变区,所述抗ccr1抗体轻链可变区的氨基酸序列如seq id no:1所示,所述抗ccr1抗体重链可变区的氨基酸序列如seq id no:2所示。
8.在其中一个实施例中,所述nkg2d的氨基酸序列如seq id no:3所示。
9.在其中一个实施例中,所述铰链区选自以下至少一种蛋白的铰链区:cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd134、cd137、icos和cd154;和/或
10.所述跨膜结构域选自以下至少一种蛋白的跨膜区:t细胞受体的α、β或ζ链、cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137、
cd154、kirds2、ox40、cd2、cd27、icos、gitr、cd40、baffr、hvem、slamf7、nkp80、cd160、cd19、il2rβ、il2rγ、il7rα、itga1、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、itgb7、tnfr2、dnam1、slamf4、cd84、cd96、ceacam1、crtam、ly9、psgl1、cd100、slamf6、slam、blame、selplg、ltbr、pag/cbp、nkp44、nkp30、nkp46、nkg2d、和nkg2c;和/或
11.所述共刺激结构域选自以下至少一种蛋白的胞内结构域:cd27、cd28、4-1bb、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原-1、cd2、cd7、light、nkg2c和b7-h3;和/或
12.所述信号转导结构域选自以下至少一种蛋白的胞内结构域:fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd3ζ、cd22、cd79a、cd79b和cd66d。
13.在其中一个实施例中,所述嵌合抗原受体的氨基酸序列如seq id no:4或seq id no:5所示。
14.在其中一个实施例中,所述嵌合抗原受体的氨基端还具有信号肽。
15.本发明还提供了一种核酸,其编码如上所述的嵌合抗原受体。
16.在其中一个实施例中,所述核酸的核苷酸序列如seq id no:6或seq id no:7所示。
17.本发明还提供了一种重组载体,所述重组载体含有如上所述的核酸。
18.本发明还提供了一种car-t细胞,其含有如上所述的核酸或被如上所述的重组载体所转化。
19.本发明还提供了如上所述的嵌合抗原受体、核酸、重组载体或car-t细胞在制备用于治疗癌症的药物中的应用,例如多发性骨髓瘤、急性髓系白血病及多种实体肿瘤等。
20.本发明还提供了一种药物组合物,其包括如上所述的car-t细胞,以及药学上可接受的辅料。
附图说明
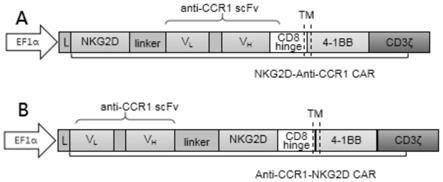
21.图1为本发明实施例1中的两种嵌合抗原受体的结构示意图,其中a为nkg2d-ccr1 car,b为ccr1-nkg2d car;
22.图2为本发明实施例1中的nkg2d-ccr1 car的表达载体结构示意图;
23.图3为本发明实施例1中的ccr1-nkg2d car的表达载体结构示意图;
24.图4为本发明实施例2中的肿瘤细胞表达ccr1的检测结果;
25.图5为本发明实施例2中的nci-h929细胞表达nkg2d配体的检测结果;
26.图6为本发明实施例2中的k562和u937细胞表达nkg2d配体的检测结果;
27.图7为本发明实施例4中的流式检测各组car-t细胞car表达情况数据;
28.图8为本发明实施例5中elisa检测各组car-t细胞杀伤肿瘤靶细胞数据。
具体实施方式
29.为了便于理解本发明,下面将对本发明进行更全面的描述,并给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
30.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
31.本发明一实施例的靶向ccr1和nkg2d配体的嵌合抗原受体,其包括从氨基端到羧基端依次连接的抗原结合结构域、铰链区、跨膜结构域、共刺激结构域和信号转导结构域;上述抗原结合结构域包括抗ccr1单链抗体和nkg2d。
32.ccr1属于β趋化因子受体家族成员,全长由355个氨基酸构成,是具有七次跨膜型结构的g蛋白偶联受体。其配体通常包括人巨噬细胞炎症蛋白1α(ccl3)、活化正常t表达和分泌蛋白(ccl5)、单核细胞趋化蛋白2(ccl8)、髓系祖细胞抑制因子1、ccl14、ccl15和ccl16等。ccl1及其配体介导的信号转导是有效免疫细胞向炎症部位募集的关键,在癌症进展、宿主抗炎症反应、免疫反应等方面起着重要作用。
33.例如多发性骨髓瘤(mm)是一种浆细胞恶性肿瘤,其特征是mm细胞异常定位于骨髓(bm),恶性增殖并诱导骨溶解。ccr1对于mm细胞归巢或迁移到bm以接收必要的生存信号至关重要,因此常作为治疗多发性骨髓瘤(mm)疾病的重要靶点。其中,ccr1和ccl3在mm和mm诱导的溶骨性骨病的发病机制中起核心作用,二者结合后一方面能通过上调细胞粘附和细胞因子分泌直接和间接刺激瘤细胞生长;此外,它们还可通过诱导破骨细胞分化和抑制成骨细胞功能来调节破骨细胞/成骨细胞平衡,加速疾病进展。有数据表明,当采用ccr1特异性拮抗药物处理后能明显减少mm引起破骨细胞生成和破骨细胞吸收现象,可明显降低mm引发的溶骨性病变。另外,急性髓系白血病(aml)细胞通常表现出多种趋化因子的组成型释放,并在细胞表面具有多种趋化因子受体,这些趋化因子/趋化因子受体表达模式可能对白血病发生和治疗反应敏感性至关重要,与cd34+正常细胞相比,aml病人样本中的趋化因子ccr1、cxcr4、ccr2等上调明显。趋化因子ccl23及其相应受体ccr1在kmt2a-mllt3(km3)aml中高度上调,ccl23/ccr1轴信号可能通过β-阻遏蛋白介导的途径激活aml细胞系中的erk1/2促进aml疾病的发展;同时,研究发现ccr1-ccl3组成的通路也可直接促进aml细胞的增殖和集落形成,当特异性阻断ccr1-ccl3通路时可抑制aml细胞的生长,延缓aml的发作。此外,趋化因子受体ccr1及其配体也在多种实体瘤如肝癌、直肠癌、肺癌、乳腺癌的恶性增殖转移及肿瘤微环境抑制等过程中发挥重要作用。
34.nkg2d是固有免疫系统中一个重要的激活性c型凝集素受体,它通过识别靶细胞表面诱导产生的配体来传递活化信号并激活免疫系统,从而对靶细胞发挥杀伤作用。所有的nk细胞、cd8阳性t细胞、大多数nkt细胞、巨噬细胞和γδt细胞都表达nkg2d。nkg2d的配体主要有两类:一是mhci类链相关的a/b分子(mhc class i chain-related molecules a/b,mica/b),另一类配体是ul16结合蛋白(ul16 binding proteins,ulbps)。nkg2d配体主要在大多数上皮源性肿瘤细胞上表达,如卵巢癌、结肠癌、白血病等,在正常细胞上表达极少。一般情况下,nkg2d的配体在正常细胞中不表达或者表达量非常少,但是当细胞受到感染或者发生癌变时,这些配体的表达量会大幅度上升,使得nkg2d的配体成为一个潜在的car-t治疗的靶点。
35.鉴于ccr1和nkg2d配体参与到多种血液癌症及实体肿瘤的发生及进展过程,都可作为治疗多种癌症的良好靶点,本发明创新性构建了可同时靶向ccr1和nkg2d配体的双特
异性car结构,经改造后的嵌合抗原受体及相应的car-t细胞可专一性、高效杀灭肿瘤细胞,有效清除ccr1及nkg2d配体单/双阳性肿瘤细胞,减少抗原逃逸,可以对肿瘤更有效和全面的覆盖,以消除绝大部分血液和实体肿瘤,降低肿瘤复发的风险,在肿瘤治疗领域具有重要意义。
36.在一个具体示例中,抗ccr1单链抗体包括抗ccr1抗体轻链可变区和抗ccr1抗体重链可变区,抗ccr1抗体轻链可变区的氨基酸序列如seq id no:1所示,抗ccr1抗体重链可变区的氨基酸序列如seq id no:2所示。
37.在一个具体示例中,nkg2d的氨基酸序列如seq id no:3所示。
38.在一个具体示例中,抗ccr1抗体轻链可变区、抗ccr1抗体重链可变区和nkg2d之间均通过连接肽连接。可选地,连接肽选自(g4s)3和gstsgsgkpgsgegstkg中的一种或多种。
39.在一个具体示例中,抗原结合结构域从氨基端到羧基端依次包括上述抗ccr1抗体轻链可变区、抗ccr1抗体重链可变区和nkg2d。在一个具体示例中,抗原结合结构域从氨基端到羧基端依次包括上述nkg2d、抗ccr1抗体轻链可变区和抗ccr1抗体重链可变区。
40.在一个具体示例中,上述铰链区选自以下蛋白的hinge区:cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd134、cd137、icos和cd154。
41.在一个具体示例中,上述跨膜结构域选自以下蛋白的跨膜区:t细胞受体的α、β或ζ链、cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137、cd154、kirds2、ox40、cd2、cd27、icos、gitr、cd40、baffr、hvem、slamf7、nkp80、cd160、cd19、il2rβ、il2rγ、il7rα、itga1、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、itgb7、tnfr2、dnam1、slamf4、cd84、cd96、ceacam1、crtam、ly9、psgl1、cd100、slamf6、slam、blame、selplg、ltbr、pag/cbp、nkp44、nkp30、nkp46、nkg2d、和nkg2c。
42.在一个具体示例中,上述共刺激结构域选自以下蛋白的胞内结构域:cd27、cd28、4-1bb、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原-1、cd2、cd7、light、nkg2c和b7-h3。
43.在一个具体示例中,上述信号转导结构域选自以下蛋白的胞内结构域:fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd3ζ、cd22、cd79a、cd79b和cd66d。
44.优选地,上述铰链区为人cd8α的hinge区。优选地,上述跨膜结构域为人cd8的跨膜区。优选地,上述共刺激结构域为人4-1bb的胞内结构域。优选地,上述信号转导结构域为人cd3ζ的胞内结构域。
45.在一个具体示例中,该嵌合抗原受体的氨基酸序列如seq id no:4或seq id no:5所示。
46.在一个具体示例中,上述嵌合抗原受体的氨基端还具有信号肽。
47.可以理解,本发明的各段多肽(例如信号肽、单链抗体、铰链区、跨膜结构域、共刺激结构域和信号转导结构域)可以独立地选自相同或者不同的种属来源,例如鼠(小鼠、大鼠)、兔、绵羊、山羊、马、鸡、牛、犬以及人,优选种属来源为人。
48.本发明一实施例的核酸,其编码如上所述的靶向ccr1和nkg2d配体的嵌合抗原受体。
49.在一个具体示例中,该核酸的核苷酸序列如seq id no:6或seq id no:7所示。可
以理解,由于密码子的简并性,能够表达同一蛋白的核酸序列具有多种形式,以上为经过密码子优化的核酸序列,用于实现目的蛋白的高效表达,但具体序列形式不限于此。
50.本发明一实施例的重组载体,其含有如上所述的核酸。可以理解,核酸可为dna或rna。
51.在一个具体示例中,上述重组载体选自逆转录病毒载体、慢病毒载体、腺病毒载体、腺病毒相关病毒载体或crispr/cas质粒。优选地,上述重组载体为慢病毒载体。慢病毒载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达目的序列的效果。在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的基因治疗效果。对于一些较难转染的细胞,如原代细胞、干细胞、不分化的细胞等,使用慢病毒载体,能大大提高目的基因的转导效率,且目的基因整合到宿主细胞基因组的几率大大增加,能够比较方便快捷地实现目的基因的长期、稳定表达。可以理解,载体的类型并不限于此,可根据具体需要进行调整。此外,载体还可包含基因工程中常用的调控元件,例如增强子、启动子等及其他表达控制元件(例如转录终止信号、或者多腺苷酸化信号和多聚u序列等)。
52.本发明一实施例的car-t细胞,其含有如上所述的核酸或被如上所述的重组载体所转化。
53.在一个具体示例中,上述car-t细胞的类型为辅助t细胞、细胞毒性t细胞、记忆t细胞、调节性t细胞、mait细胞和γδt细胞中的任意一种。可选地,上述car-t细胞的类型为cd3+t细胞、cd3+cd4+t细胞或cd3+cd8+t细胞。
54.本发明一实施例的药物组合物,包括如上所述的car-t细胞,以及药学上可接受的辅料。
55.在一个具体示例中,辅料包括稀释剂、防腐剂、缓冲剂、崩解剂、抗氧剂、助悬剂、着色剂和赋形剂中的一种或多种。
56.一个具体示例中,稀释剂选自聚乙二醇、丙二醇、植物油和矿物油中的一种或多种。在一个具体示例中,防腐剂选自山梨酸、山梨酸甲酯、对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、对羟基苯甲酸丙酯、对羟基苯甲酸丁酯、对羟基苯甲酸苄酯、对羟基苯甲酸甲酯钠、苯甲酸和苯甲醇中的一种或多种。在一个具体示例中,缓冲剂选自磷酸氢钠、磷酸二氢钠、枸橼酸钠、酒石酸钠和醋酸钠中的一种或多种。在一个具体示例中,抗氧剂选自乙二胺四乙酸、乙二胺四乙酸二钠盐、二丁基羟基甲苯、甘氨酸、肌醇、抗坏血酸、抗坏血酸钠、卵磷脂、苹果酸、氢醌、枸橼酸、琥珀酸和焦亚硫酸钠中的一种或多种。
57.本发明一实施例的car-t细胞的制备方法,包括以下步骤:采集外周血单个核细胞;从上述外周血单个核细胞中分选出t细胞如cd3+t细胞;对t细胞进行激活培养,使用含有上述核酸的病毒感染t细胞,然后再进行扩增培养。
58.下面将结合具体实施例以及附图对本发明的实施方案进行详细描述。
59.实施例1载体构建
60.本实施例构建的两种嵌合抗原受体的结构如图1所示,a为nkg2d-ccr1car,b为ccr1-nkg2d car。根据嵌合抗原受体的氨基酸序列,在广州艾基生物技术有限公司进行全基因合成,并构建至慢病毒表达载体中,nkg2d-ccr1car和ccr1-nkg2d car的载体结构分别如图2和图3所示,序列信息如下所示。
61.nkg2d-ccr1 car(sp-nkg2d-linker-anticcr1 vl-(g4s)
3-vh-cd8hinge-cd8tm-4-1bb-cd3z)氨基酸序列:mdmrvpaqllgllllwlrgarclfnqevqipltesycgpcpknwicyknncyqffdesknwyesqascmsqnasllkvyskedqdllklvksyhwmglvhiptngswqwedgsilspnlltiiemqkgdcalyassfkgyiencstpntyicmqrtvgstsgsgkpgsgegstkgdvvmtqtprslpvslgdqasiscrsrqslihsngitflhwylqkagqspklliykvsnrfsgvpdrfsgsgsgtdftlrisrveaedlgvyfcsqgthvpptfgggtkleikggggsggggsggggsqvqlkqsgpglvqpsqslsitctvsgfslnnygvhwvrqppgkglewlgviwsagttvynaafisrlsiskddsksqvffkmnslqagdtaiyycakdgsryytamdywgqgtsvtvsstttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr*
62.nkg2d-ccr1 car核苷酸序列:atggatatgcgcgttcctgctcaactcctcggtctgctcctgctgtggctcagaggagcccgctgcctctttaaccaggaggtgcaaattccactgactgaatcctattgcggcccttgtcccaagaactggatttgttataagaacaactgttatcaattcttcgatgagtctaagaactggtatgaaagccaagcatcctgtatgtcccagaacgcttcactcctgaaggtctacagcaaagaagatcaggacctcctcaagctggtgaaatcatatcactggatgggactggtgcacatccctacaaacggctcatggcagtgggaggacggctccatcctgagcccaaatctgctcacaatcattgaaatgcagaagggtgattgcgctctctacgcaagctcttttaaaggctacatagagaactgctccactcccaatacatacatttgtatgcagcgcactgtgggatcaaccagcggaagcgggaagcctggttccggagaaggatcaactaaaggcgatgtggtcatgactcagactccaaggagcctgcccgtgtccctcggagatcaggcaagcatcagctgccggagcaggcagagtctgattcacagtaatggaataacttttctccactggtacctgcagaaggccggtcagagtcctaagctcctgatatacaaagtgagtaacagattcagtggagtgcctgacagattctcaggatccggctcagggaccgacttcaccctgcggattagcagagtggaggcagaagacctcggcgtctacttttgtagtcaagggactcacgtgccacctacatttggtggcgggactaaactggaaatcaagggcggaggcggttcaggcggaggcggctcaggcggtggcggttcacaagtgcagctcaagcagtcagggccaggcctcgtccagccaagtcaaagtctgagcattacctgcactgtgagtggttttagcctgaacaattatggagtgcattgggttaggcagccacctggaaagggcctggaatggctgggcgtgatttggtctgccggcactactgtgtacaacgccgcattcatctccagactcagcatcagtaaagacgactccaaatcccaggtgttcttcaaaatgaactcactgcaagctggagatacagcaatctactactgcgctaaagacggctctcggtattacactgcaatggactactgggggcaagggacatccgtgaccgtgagctcaactacgacccctgcaccgcggccgcctactcctgcacctacaatcgcaagtcagccactgagtctcagacccgaagcatgccgccctgctgcaggcggagctgtccatacacgcggactggactttgcatgcgatatatacatctgggcaccactggccggcacttgcggcgtgctgctcctgtccctcgtgattaccctgtactgcaaacgcggcaggaagaagctcctgtatatctttaaacagcccttcatgaggccagtgcagaccactcaagaggaagacggttgtagctgccggtttcccgaggaagaagagggaggctgcgagctccgcgtgaagttctcccgctcagccgatgcacccgcctatcagcaagggcagaaccagctgtacaatgagctcaacctgggaagaagggaggaatatgacgttctggataaacggcgcggtcgcgatcccgaaatgggtgggaagcctcgcaggaagaatcctcaggaagggctctacaatgagctgcagaaagacaaaatggcagaggcctattctgaaatcggcatgaagggcgagcgccgcagaggcaaaggacacgacggcctgtaccagggcctgtctacagccaccaaggacacctatgacgctctccacatgcaagccctgccaccaaggtga
63.ccr1-nkg2d car(sp-anticcr1 vl-(g4s)
3-vh-linker-nkg2d
‑‑
cd8hinge-cd8tm-4-1bb-cd3ζ)氨基酸序列:mdmrvpaqllgllllwlrgarcdvvmtqtprslpvslgdqasiscrsrqslihsngitflhwylqkagqspklliykvsnrfsgvpdrfsgsgsgtdftlrisrveaedlgvyfcsqgthvpptfgggtk
ulbp2/5/6)(r&d systems品牌)检测靶细胞k562、nci-h929、u937表达抗原情况。结果如图5和图6所示,k562细胞ccr1阴性表达,nkg2dl、mica、ulbp2/5/6阳性表达;nci-h929细胞ccr1强阳性表达,nkg2dl、mica、ulbp2/5/6都阴性表达;u937细胞为ccr1阳性表达,nkg2dl、ulbp2/5/6阳性表达,mica阴性表达。
68.表1肿瘤靶细胞ccr1和nkg2d配体(nkg2dl)表达情况
[0069] k562nci-h929u937所用检测抗体nkg2dl++-+++pe-nkg2d-fcmica+
‑‑
apc-anti-micaulbp2/5/6+-+++pe-anti-ulbp2/5/6ccr1-++++anti-ccr1
[0070]
实施例3抗ccr1、nkg2d双靶点car-t细胞的制备
[0071]
(1)分离pbmc
[0072]
采集50ml外周血;在超净工作台中向2支50ml灭菌离心管中分别加入15ml淋巴细胞分离液,将25~30ml外周血缓慢注入含有淋巴细胞分离液的离心管中,按照淋巴细胞分离液的使用说明,将离心管在700g下室温离心20min,升速1,降速2,若血液储存超过2小时,将离心时间增至30min;
[0073]
离心后,血液分为4层,由血浆(上层)、血浆和分离液之间的单个核细胞(第2层)、分离液(第3层)和红细胞(底层)构成,用吸管将第2层单个核细胞收集至新的离心管中,加入20ml pbs稀释细胞悬液,500g离心10min;移除上清液,加入20ml pbs稀释细胞悬液,混匀,取20μl细胞悬液计数,余下悬液500g离心10min备用。
[0074]
(2)t细胞增殖
[0075]
加入10ml t激培养基重悬pbmc,t激活培养基包含gt-t551 h3培养基、2ml灭活自体血浆、适宜浓度il-2等;取20μl细胞悬液计数;将上述细胞悬液转入细胞培养瓶中,用t激活培养基调整细胞密度至(2~3)
×
106个/ml,37℃、5%co2培养箱中培养3~4天。
[0076]
(3)慢病毒包装
[0077]
分别对前述实施例中的慢病毒表达载体进行慢病毒包装,采用四质粒系统,具体步骤如下:四质粒系统分别表达慢病毒载体包装所需的gag/pol、rev、包膜质粒及本发明构建的pbg-nkg2d-ccr1 car、pbg-ccr1-nkg2d car载体;将质粒进行瞬时转染293t细胞,dna含量为2μg/ml;将上述质粒与pei转染试剂混合,加入至一定体积的无血清的dmem中,混匀后放置15分钟,将上述混合液加入至铺有293t细胞的细胞的t75培养瓶中,轻轻混匀,于37℃、5%co2细胞培养箱培养6h;6h后更换新鲜培养基,继续进行培养,并且加入10mm的丁酸钠溶液,72小时后收集慢病毒的培养上清进行纯化并检测。
[0078]
(4)慢病毒感染和扩大培养
[0079]
t细胞激活3~4天后,将包含car基因的病毒过夜感染;感染后更换t细胞扩增培养基(含10%血清,500iu/ml il-2等),调整细胞密度为(1~2)
×
106个/ml;每2~3天观察细胞生长状态;扩大培养7天后,将培养瓶中的细胞悬液移入培养袋,添加t细胞扩增培养基在37℃、5%co2培养箱中继续培养;培养至第10天,收集细胞进行检测。
[0080]
实施例4流式检测抗ccr1、nkg2d双靶点car-t表达
[0081]
采用流式细胞仪检测制备的ccr1 car-t、nkg2d-ccr1 car-t、ccr1-nkg2d car-t
细胞表面car分子的表达,利用apc-anti-cd3抗体标记t细胞群,然后用fitc-protein l(acrobiosystems公司)检测car表达阳性率。结果如图7所示,慢病毒感染继续培养3天,ccr1 car-t细胞的car阳性率为25.2%;nkg2d-ccr1 car-t细胞、ccr1-nkg2d car-t细胞的car表达率分别为18.30%和64.30%。
[0082]
实施例5elisa检测抗ccr1、nkg2d双靶点car-t杀伤肿瘤靶细胞时分泌ifnγ和il2的情况
[0083]
分别将未转导的t细胞(tm)、ccr1 car-t、nkg2d-ccr1 car-t、ccr1-nkg2d car-t细胞与靶细胞u937-luc、thp-1-luc、jurkat-luc、h929-luc、k562-luc共孵育,效靶比(e:t)分别设置为1:3和1:1,接种至黑色96孔板,共孵育4~6h后,加入荧光素酶底物(promega,bright-glotmluciferase assay system),每孔取50μl上清液酶联免疫法检测ifn-γ和il-2,荧光值代表相应的杀伤率,越高代表细胞杀伤越强。
[0084]
结果如图8所示,ccr1 car-t能有效杀伤ccr1阳性表达的u937-luc、thp-1-luc和h929-luc细胞;而对ccr1阴性表达的jurkat-luc和k562-luc细胞无杀伤作用。两种双靶点的car-t(ccr1-nkg2d car-t和nkg2d-ccr1car-t)细胞能杀伤u937-luc、thp-1-luc和h929-luc细胞;此外,还能杀伤ccr1阴性的k562-luc细胞(表达nkg2d配体)。说明ccr1、nkg2d双靶点car-t细胞对ccr1阴性靶细胞也有显著杀伤效果,能有效清除ccr1和/或nkg2d配体阳性肿瘤细胞,进而减少抗原逃逸。
[0085]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0086]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
