靶向rage的纳米抗体及其应用
技术领域
1.本发明属于免疫学或分子生物学技术领域,尤其涉及一种靶向rage的纳米抗体及其应用。
背景技术:
[0002] rage(the receptor for advanced glycation end products),中文名称为晚期糖基化终末产物受体,是糖化终产物(advanced glycation end products,ages)的细胞表面受体。细胞和组织内的ages积累是衰老的重要分子特征,当细胞内蛋白存活时间过长时,age蛋白修饰就会发生,从而导致修饰后的蛋白相互交联失去功能。age修饰是一个不可逆的过程,随着时间推移,ages积累增多,rage通路被激活,并导致rage的表达不断升高。除age外,疾病发生过程中的重要蛋白如阿尔茨海默症(ad)相关的abeta蛋白和癌症相关的hmgb1蛋白都被证实为rage的配体,且这些配体-受体信号通路对疾病预测和疾病发展关系密切。
[0003]
rage在ad疾病进展中主要在血液循环系统和中枢神经系统中发挥作用。在血液循环系统中,rage可作为abeta受体促进其向大脑中的转运,从而引起abeta沉积;在中枢神经系统中,rage激活可以促进神经炎性反应、abeta生成增加、和tau磷酸化加剧,是ad病理改变的关键调控因子。在ad动物模型和ad病人中,rage的表达水平都显著升高,且有证据表明rage表达量升高是先于abeta plaque发生的。这些结果暗示了rage激活可能是衰老相关的生理改变向ad病理改变的关键因素。
[0004]
纳米抗体可通过靶向各种疾病重要靶点,阻断或激活相应靶蛋白和信号通路,从而起到治疗作用,caplacizumab是第一款经美国fda批准的用于治疗血栓性血小板减少性紫癜的纳米抗体药物(acquired thrombotic thrombocytopenic purpura,atpp)。此外,纳米抗体还可以作为靶向工具,在体内帮助药物或者诊断分子定位到疾病相关靶蛋白,其中靶向肿瘤生物标记物的纳米抗体被不断鉴定出来,如 egfr1或egfr2(或分别为 her1 和 her2)、vegfr2、c-met 和 cxcr7等蛋白的纳米抗体已经被报道。但到目前为止,尚未见到靶向rage的纳米抗体被发现。
[0005]
此外,在恶性肿瘤(包括肾癌、前列腺癌、胃癌、乳腺癌和结肠癌等)中,rage的表达水平显著升高,这一现象被证实与癌症的转移和不良预后相关,因此rage也可以作为癌症诊断标志物,将rage纳米抗体与具有成像效果的纳米材料结合,具有癌症成像诊断的应用价值。肿瘤发展过程中高表达的hmgb1被证实通过结合rage受体激活p38 mapk,p42/p44,以及jnk等信号通路,进而激活纤维蛋白溶解酶,使得癌细胞更易发生迁徙和转移。癌细胞中age-rage信号通路还影响了细胞凋亡、坏死和自噬,通过抑制rage受体的激活,可以增加细胞凋亡,并减少癌细胞抗药性的产生。因此,基于rage纳米抗体的靶向性药物也具有癌症临床治疗的应用价值。
技术实现要素:
[0006]
针对以上技术问题,本发明公开了一种靶向rage的纳米抗体及其应用,与rage具有很强的结合力,可以用于有关阿尔茨海默症和癌症的rage的各种成像和治疗的药物。
[0007]
对此,本发明采用的技术方案为:靶向rage的纳米抗体,所述靶向rage的纳米抗体的氨基酸序列的互补决定区为如seq id no:2所示的cdr1、如seq id no:4所示的cdr2、如seq id no:6所示的cdr3;具体而言,如seq id no:2所示的cdr1序列为:aaagiafssyila,如seq id no:4所示的cdr2序列为:lvsaswrgdsty,如seq id no:6所示的cdr3序列为:kefprwltlspldydh;或如seq id no:9所示的cdr1、如seq id no:11所示的cdr2、如seq id no:13所示的cdr3;具体而言,如seq id no:9所示的cdr1序列为:evsggafsryavg,如seq id no:11所示的cdr2序列为:faaaiswsgnnty,如seq id no:13所示的cdr3序列为:mlvstydy;或如seq id no:16所示的cdr1、如seq id no:18所示的cdr2、如seq id no:20所示的cdr3。具体而言,如seq id no:16所示的cdr1序列为:vvsgftfrsyams,如seq id no:18所示的cdr2序列为:wvsaitsggests,如seq id no:20所示的cdr3序列为:rrvgspgs。
[0008]
作为本发明的进一步改进,所述靶向rage的纳米抗体的氨基酸序列的框架区为seq id no:1所示的fr1、如seq id no:3所示的fr2、如seq id no:5所示的fr3、如seq id no:7所示的fr4;或所述靶向rage的纳米抗体的氨基酸序列的框架区为seq id no:8所示的fr1、如seq id no:10所示的fr2、如seq id no:12所示的fr3、如seq id no:14所示的fr4;或所述靶向rage的纳米抗体的氨基酸序列的框架区为seq id no:15所示的fr1、如seq id no:17所示的fr2、如seq id no:19所示的fr3、如seq id no:21所示的fr4。
[0009]
作为本发明的进一步改进,所述靶向rage的纳米抗体的氨基酸序列如seq id no:22所示。
[0010]
作为本发明的进一步改进,所述靶向rage的纳米抗体的氨基酸序列如seq id no:23所示。
[0011]
作为本发明的进一步改进,所述靶向rage的纳米抗体的氨基酸序列如seq id no:24所示。
[0012]
上述通过大量选择得到的靶向rage的纳米抗体,具有阻断rage与配体结合的潜力,可以有效缓解abeta和tau的病理改变,具有临床治疗的应用价值。此外,通过将纳米抗体与纳米材料进行组装,增加纳米抗体的血脑屏障通透性,同时借助纳米材料的荧光和ct成像特性,以及纳米抗体的靶向性,可以实现rage纳米抗体在大脑内的靶向成像,具有ad临床诊断的应用价值。
[0013]
本发明还公开了一种核酸,所述核酸为:编码如上任意一项所述的靶向rage的纳米抗体的核酸或其互补序列。
[0014]
本发明还公开了一种表达载体,其包含如上所述的核酸。
[0015]
本发明还公开了一种宿主细胞,其包含如上所述的表达载体。
[0016]
本发明还公开了如上所述的靶向rage的纳米抗体的应用,其用作靶向阿尔茨海默症和癌症的rage的检测试剂、靶向阿尔茨海默症和癌症的rage的药物、活体成像探针、嵌合型免疫细胞或双特异性抗体。
[0017]
与现有技术相比,本发明的有益效果为:本发明的技术方案的纳米抗体,与rage有较强结合,可以阻断rage与各种受体的相互作用,可以有效缓解abeta和tau的病理改变,对ad和癌症产生治疗效果;另外将靶向rage的纳米抗体修饰于具有各种成像特征纳米材料上,可特异性成像诊断ad和癌症;而且该纳米抗体具有较小的分子量,具有更好的组织穿透性,可以使用大肠杆菌系统进行表达纯化,制备成本低。
附图说明
[0018]
图1是本发明实施例中野生型和ad小鼠行rage表达量分析图。
[0019]
图2是本发明实施例中rage在正常组织和肾透明细胞癌中的表达量的对比图。
[0020]
图3是本发明实施例中rage在不同肾癌细胞系中的表达量的对比图。
[0021]
图4是本发明实施例中rage表达量与肾癌患者预后关系图。
[0022]
图5是本发明实施例中rage胞外段结构域示意图。
[0023]
图6是本发明实施例的靶向rage的纳米抗体与对比例抗体的蛋白表达分析图。
[0024]
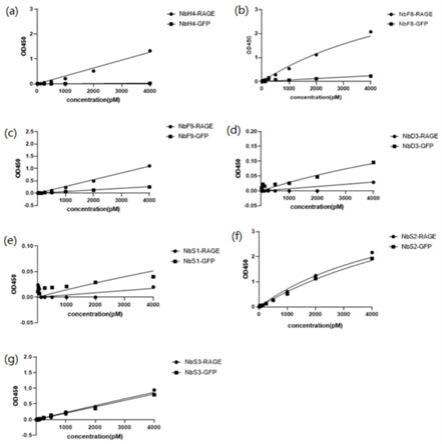
图7是本发明实施例的靶向rage的纳米抗体与对比例抗体的体外elisa亲和性对比图,其中(a)为nbh4纳米抗体,(b)为nbf8纳米抗体,(c)为nbf9纳米抗体,(d)为nbd3纳米抗体,(e)为nbs1纳米抗体,(f)为nbs2纳米抗体,(g)为nbs3纳米抗体。
具体实施方式
[0025]
下面对本发明的较优的实施例作进一步的详细说明。
[0026]
(1)rage在肿瘤细胞和ad脑组织的表达分析根据已有报道,rage在ad疾病状态下表达量升高,所以本实施例首先比较正常和ad小鼠大脑rage的表达量。此外,rage可以在多个肿瘤细胞系中表达,实施例选取肾透明癌细胞及细胞系,分析rage在这些细胞中的表达情况,包括如下步骤:
①ꢀ
rage的组织表达分析:a),收集组织,置于30%蔗糖溶液中4℃过夜脱水;b),次日oct包埋,-80℃保存;c),将冰冻组织块置于冰冻切片机内复温10分钟后进行切片,切片厚度设为10 μm;d),切片稍凉干后,置于预冷丙酮/甲醇(4:1)混合液,-20℃固定5分钟;e),tbs漂洗复温切片10分钟,4%驴血清封闭1小时;f),anti-ha一抗孵育1小时,tbs 缓冲液漂洗3次;g),alexa 488偶联的二抗孵育1小时,tbs漂洗3次;h),使用含有dapi的封闭剂封片,上机检测。
[0027]
②ꢀ
rage的细胞表达分析:培养肾透明癌细胞系a498, a704, caki-1, kmrc1, kmrc20, os-rc2, ut16, ut33a, ut44, vmrc-rcw, vmrc-rcz, 769p, 786o;收集细胞,在4℃条件下使用ripa组织裂解液提取细胞内蛋白质;wb检测不同细胞系中rage表达量。
[0028]
采用上述方法分别在6月龄正常小鼠大脑、4月龄和6月龄 5xfad小鼠模型中检测了rage的表达量,结果如图1所示,可以看出rage在ad小鼠中的表达显著升高。
[0029]
本实施例还比较了正常组织和肾透明细胞癌(kidney renal clear cell carcinoma, kirc)中rage的表达量,如图2所示,rage在肿瘤组织中表达量显著升高。
[0030]
本实施例还检测了rage在不同肾癌细胞系中的表达量,如图3所示,rage在kmrc1, kmrc20, os-rc2, ut16, ut33a, ut44, vmrc-rcw, vmrc-rcz, 769p, 786o细胞系中高表达。如图4所示,通过对比rage表达量和肾癌患者预后发现,rage高表达患者生存率较rage低表达患者显著降低。
[0031]
(2)rage纳米抗体的筛选通过大肠杆菌表达纯化rage的胞外段区域,示意图如图5所示。
[0032]
采用免疫管法对天然的羊驼源噬菌体展示纳米抗体文库进行筛选,所选择的噬菌体展示库容量为2
×
109。筛选步骤如下:a),将目的蛋白按10 μg/ml浓度包被在免疫管上,进行3轮富集筛选;b),使用第三轮噬菌体洗脱液铺板,随机挑取96个单克隆进行elisa验证,以elisa读数大于对应bsa读数3倍且读数大于0.5为阳性标准;c),经过2次噬菌体elisa鉴定的阳性单克隆送公司测序确定序列信息,同时随机挑选3个阴性单克隆作为对照送测序;d),根据测序信息设计并合成筛选到的纳米抗体,通过大肠杆菌进行表达纯化。
[0033]
本实验中,尽管通过噬菌体elisa分析我们发现了17个潜在的阳性克隆,但是噬菌体elisa仅仅是通过随机挑取的192个克隆进行验证,存在潜在的遗漏某些高结合力的克隆的缺点,因此,本实验中进一步对筛选的结果进行了pcr扩增,之后进行深度测序,通过对30m数据的生信分析,提取所有编码纳米抗体的基因序列,共获得六百万条特异性序列,最后通过大量的实验筛选到三个纳米抗体(在纳米抗体c端引入ha标签,便于后续实验的检测),通过大肠杆菌进行表达纯化,三个纳米抗体为nbh4纳米抗体、nbf8纳米抗体、nbf9纳米抗体。
[0034]
nbh4纳米抗体的氨基酸序列的互补决定区为如seq id no:2所示的cdr1、如seq id no:4所示的cdr2、如seq id no:6所示的cdr3,框架区为seq id no:1所示的fr1、如seq id no:3所示的fr2、如seq id no:5所示的fr3、如seq id no:7所示的fr4。所述nbh4纳米抗体的氨基酸序列如seq id no:22所示,即mavqlvesgggsveaggslrlscaaagiafssyilawfrqapgkerelvsaswrgdstyylpsvkgrftisrdnaknmvylqmndlkpedtavyicaakefprwltlspldydhwgqgtqvtvss。
[0035]
nbf8纳米抗体的氨基酸序列的互补决定区为如seq id no:9所示的cdr1、如seq id no:11所示的cdr2、如seq id no:13所示的cdr3;框架区为seq id no:8所示的fr1、如seq id no:10所示的fr2、如seq id no:12所示的fr3、如seq id no:14所示的fr4。nbf8纳米抗体的氨基酸序列如seq id no:23所示,即mavqlvesggglvqaggslrlscevsggafsryavgwfrqapgkerefaaaiswsgnntyyaasvkgrftisrdnakntvylqmnslkpedtaiyycaamlvstydywgqgtqvtvss。
[0036]
nbf9纳米抗体的氨基酸序列的互补决定区为如seq id no:16所示的cdr1、如seq id no:18所示的cdr2、如seq id no:20所示的cdr3,框架区为seq id no:15所示的fr1、如seq id no:17所示的fr2、如seq id no:19所示的fr3、如seq id no:21所示的fr4。nbf9纳米抗体的氨基酸序列如seq id no:24所示,即mavqlvesggglvqpggslrlscvvsgftfrsyamsw
vrqapgkglewvsaitsggestsyagsvkgrftisrdnakntvylqmnslepedtaiyycnarrvgspgswgqgtqvtvss。
[0037]
将上述三条纳米抗体序列与噬菌体elisa阳性克隆序列进行比对,与噬菌体阳性克隆无匹配。
[0038]
(3)纳米抗体亲和力测定下面针对上述三个rage纳米抗体进利用elisa亲和性实验来鉴定纳米抗体的亲和力。
[0039]
本实施例对nbh4纳米抗体、nbf8纳米抗体、nbf9纳米抗体序列进行基因克隆以及蛋白表达分析,并同时对另外四个抗体(nbd3、nbs1、nbs2、nbs3纳米抗体)序列进行基因克隆以及蛋白表达分析,结果如图6所示。其中,nbd3纳米抗体的序列如seq id no:25所示,nbs1纳米抗体的序列如seq id no:26所示,nbs2纳米抗体的序列如seq id no:27所示,nbs3纳米抗体的序列如seq id no:28所示。
[0040]
对上述七个抗体序列进行体外elisa亲和性验证,结果如图7所示,elisa阴性对照为纳米抗体与gfp蛋白的结合强度,如图7(a)~7(c)结果显示,纳米抗体nbh4、nbf8、nbf9与rage有较强结合;如图7(d)~7(g)结果显示,纳米抗体nbd3、nbs1、nbs2、nbs3与rage结合较弱或与阴性对照gfp也有结合。
[0041]
本发明实施例还公开了一种核酸,所述核酸为:编码如上nbh4、nbf8、nbf9纳米抗体的核酸或其互补序列。
[0042]
本发明实施例还公开了一种表达载体,其包含如上所述的核酸。
[0043]
本发明实施例还公开了一种宿主细胞,其包含如上所述的表达载体。
[0044]
本发明实施例还公开了如上所述的靶向rage的纳米抗体的应用,其用作靶向阿尔茨海默症和癌症的rage的检测试剂、靶向阿尔茨海默症和癌症的rage的药物、活体成像探针、嵌合型免疫细胞或双特异性抗体。
[0045]
以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
