1.本发明属于生物制药技术领域,具体涉及猪腹泻相关病毒串联表位蛋白所诱导的卵黄抗体及其应用。
背景技术:
2.猪传染性肠胃炎病毒(tgev)引起猪消化道传染病。在气温较低的季节发病频繁,其通过食物、水、粪便、呼吸道和分泌物等传播,主要的症状有脱水、呕吐、腹泻等。tgev发病率和死亡率非常高,不同年龄症状还有不同,仔猪的脱水症状比较严重,长期脱水就会导致死亡,成年猪出现腹胀、缺乏食欲以及水样腹泻等现象,同时还会出现消化不良的现象,粪便有饲料残留。
3.猪流行性腹泻病毒(pedv)感染各年龄段猪而引发严重腹泻、脱水甚至死亡,1-3日龄患猪的死亡率可达100%,成年患猪体重下降、消瘦,给养猪业造成巨大的经济损失,一般发病于气温比较低的季节,传染途径较为多样,可以通过粪便、食物、水等方式传播,病猪表现四肢无力、腹泻、呕吐、绝食、不活动等现象,患病率较高。pedv属甲型冠状病毒,即alpha冠状病毒,是有包膜的单股正链rna病毒,全长约28kb,至少有7个开放阅读框(orf),每个开放阅读框编码不同的蛋白,如orf2、orf4、orf5和orf6分别编码棘突蛋白s、包膜蛋白e、膜蛋白m和核衣壳蛋白n等4种结构蛋白。pedv之n蛋白是病毒的核衣壳蛋白,也是其主要结构蛋白,能包裹病毒rna形成螺旋核糖核蛋白;该蛋白还参与病毒的转录,抑制宿主细胞生长,激活宿主内质网应激,抑制宿主beta-干扰素的产生以及宿主干扰素刺激基因的表达。
4.猪轮状病毒(porv)引起猪急性肠道传染病,在全球范围内广泛流行,基因型多样,基因可塑性强。在我国范围内均有流行,发病猪多是8周龄以下的仔猪,日龄越小发病率越高,发病率50%~80%。porv主要症状为厌食、呕吐、下痢,随粪便排到外界环境后,污染饲料、饮水、垫草及土壤等经消化道途径传染。中猪和大猪为隐性感染,没有症状,为病毒携带者,造成饲料转化率降低、日增重降低等后果。轮状病毒感染也是人畜共患病。在整个轮状病毒基因组中,目前发现有12个g基因型(分别命名为g1-6;g8-12和g26)和16个种p基因型(分别命名为p1-8;p11;p13;p19;p23;p26-27;p32;p34)。
5.在养殖行业,igy目前被认为是一种有望成为抗生素替代的生物制品。由于igy不含有与补体结合的特点,国内外众多科学家将其igy直接应用于免疫学诊断及抗体药物领域。如利用人肠病毒71型(ev71)灭活苗免疫接种母鸡,收集提取特异性的卵黄抗体,通过口服或者腹腔注射免疫后的igy均能降低实验动物的发病率和死亡率。现有技术制备特异性igy处理后荷毒小鼠,使其体内病毒显著减少。抗弧菌特异性igy抗体在体内外均能够发挥明显的抑菌效果,揭示igy可作为一种抗生素替代或者口服免疫治疗药物。免疫雌性鸵鸟产生抗鸡传染性支气管炎病毒(ibv)的igy,纯化后的igy具有很强的中和作用,注射该igy有助于保护受感染ibv的幼雏。利用卵黄抗体技术研制抗sars-cov病毒igy特异性抗体,在vero上中和病毒效价为1:640,揭示卵黄抗体技术在由冠状病毒引起的人类呼吸道疾病方面的应用前景。
6.igy与病原体相互作用的确切机制尚在进一步研究中,目前比较公认以下几种机制包括凝集细菌、抑制病原体粘附,免疫调理,中和毒素。其中,抑制粘附的主要机制被认为是igy最基本也是最重要的机制。尤其是针对肠道、呼吸道粘膜,特异性igy抗体通过防止病原体附着在肠道和呼吸道,进而阻断与粘膜上皮细胞受体相互作用、干扰粘蛋白结合,还可以中和诸如膜蛋白、脂多糖、菌毛等因子。
7.现有技术中,还没有关于猪传染性肠胃炎病毒、猪流行性腹泻病毒、猪轮状病毒等三种病原生物蛋白表位联合组成的“多联抗原”所诱导的抗体作为有效药物的相关报道。
技术实现要素:
8.本发明的目的在于提供猪腹泻相关病毒所诱导的抗体,特别是免疫母鸡所收集蛋黄抗体,其成本更低、滴度更高、效价更好。
9.本发明的再一目的在于提供上述猪腹泻相关病毒串联表位蛋白所诱导卵黄抗体的制备方法。
10.本发明的再一目的在于提供上述猪腹泻相关病毒串联表位蛋白所诱导卵黄抗体的应用。
11.根据本发明具体实施方式的猪腹泻相关病毒卵黄抗体,所述卵黄抗体由灭活tgev病毒、灭活pedv病毒、灭活porv病毒按照1:1:1的质量比混合后形成“多联多价全抗原”免疫产蛋鸡,收集产蛋鸡的鸡蛋,并从免疫鸡蛋卵黄中分离和纯化得到,也由抗tgev卵黄抗体、抗pedv卵黄抗体与抗porv卵黄抗体按照1:1~2:1~2质量比混合得到。
12.根据本发明具体实施方式的猪腹泻相关病毒卵黄抗体,其中,所述抗tgev卵黄抗体由灭活tgev病毒免疫产蛋鸡,收集产蛋鸡的鸡蛋,并从免疫鸡蛋卵黄中分离和纯化得到;
13.所述抗pedv卵黄抗体由灭活pedv免疫产蛋鸡,收集产蛋鸡的鸡蛋,并从免疫鸡蛋卵黄中分离和纯化得到;
14.所述抗porv卵黄抗体由灭活porv病毒免疫产蛋鸡,收集产蛋鸡的鸡蛋,并从免疫鸡蛋卵黄中分离和纯化得到。
15.具体的,分别将tgev、pedv、porv等三种病毒在vero细胞中培养,温度37℃,co2浓度5%,小牛血清浓度1-5%。当细胞数量达到1
×
109/ml时按照本行业公知的方法灭活病毒,灭活后用生理盐水稀释至1
×
108/ml,得到灭活的tgev、pedv、porv等三种病毒抗原,按照1:1:1的质量比混合后形成“多联多价全抗原”。
16.进一步,将以上所述三种病毒抗原即“多联多价全抗原”纳米氢氧化铝按照质量比为1:0.75~1.0混合乳化后,首次免疫产蛋鸡,再用“多联多价全抗原”与氢氧化铝佐剂按照质量比为1:0.75~1混合乳化后进行第二次、第三次加强免疫,收集鸡蛋;
17.分离纯化卵黄,得到卵黄抗体。
18.其中,若选用球状纳米氢氧化铝,则其粒径为200~300纳米;若选用棒状纳米氢氧化铝短,其短粒径为200~300纳米、长粒径800~900纳米。
19.根据本发明具体实施方式的一种猪腹泻相关病毒串联表位蛋白所诱导的卵黄抗体,所述卵黄抗体由“多联多价表位抗原”为抗原免疫产蛋鸡,收集所述产蛋鸡的鸡蛋,并从免疫鸡蛋卵黄中分离和纯化得到。
20.具体的,选择tgev、pedv与porv的表位蛋白基因,形成重组蛋白s-s-vp7,本发明称
为“多联多价表位抗原”,将多联多价表位抗原作为抗原免疫产蛋鸡,收集所述产蛋鸡的鸡蛋,并从免疫鸡蛋卵黄中分离和纯化得到。
21.根据本发明具体实施方式的猪腹泻相关病毒串联表位蛋白所诱导的卵黄抗体,所述卵黄抗体由包括以下步骤的方法制备得到:
22.(1)制备抗原:选择tgev病毒的s蛋白基因、pedv病毒的s蛋白基因、porv病毒的vp7蛋白基因,制备重组蛋白s-s-vp7,将重组蛋白s-s-vp7作为抗原;
23.(2)免疫蛋鸡:将重组蛋白s-s-vp7与纳米氢氧化铝按照质量比为1:0.75~1混合乳化后,首次免疫产蛋鸡,再用重组蛋白s-s-vp7与氢氧化铝佐剂按照质量比为1:0.75~1混合乳化后进行第二次、第三次加强免疫,收集鸡蛋;
24.(3)分离纯化卵黄,得到卵黄抗体。
25.本发明将tgev病毒的s蛋白基因、pedv病毒的s蛋白基因、porv病毒的vp7蛋白基因予以合成,并在真核载体中表达,进一步,所述真核表达载体为pcdna3.1载体,优选质粒psectag2a-s1-6his。更优选构建并筛选psectag2a-s1-6his/cho-k稳定表达细胞株。
26.根据本发明具体实施方式的猪腹泻相关病毒串联表位蛋白所诱导的卵黄抗体,步骤(3)中,在收集鸡蛋的卵黄液中加入9~10倍体积去离子水稀释,调节ph至5.0,于-20℃冰箱中冷冻过夜;解冻后离心收集上清,过滤,收集滤液,得到卵黄抗体粗提物;对卵黄抗体粗提物进一步纯化,得到卵黄抗体。
27.根据本发明具体实施方式的猪腹泻相关病毒串联表位蛋白所诱导的卵黄抗体,向卵黄抗体粗提物中加入饱和硫酸铵溶液至终浓度的45~75%,最佳是50%,搅拌均匀后4℃过夜,准确存放时间是12小时,4℃条件下离心,之后加入适量pbs溶液重悬,再次缓慢加入饱和硫酸铵溶液至终浓度的45~75%,最佳是50%,搅拌均匀后室温过夜,最佳环境温度是24℃,在室温下离心,用去离子水稀释沉淀至原体积,得到卵黄抗体提取液,得到的卵黄抗体提取液用透析袋充分透析,得到精卵黄抗体。
28.本发明还提供上述猪腹泻相关病毒卵黄抗体在制备猪腹泻相关疾病疫苗方面的应用。
29.同时,本发明提供猪腹泻相关病毒串联表位蛋白所诱导的卵黄抗体在制备猪腹泻相关疾病疫苗方面的应用。
30.本发明还提供一种含有上述卵黄抗体的猪饲料添加剂。
31.具体的,选择免疫鸡蛋,去除蛋壳的蛋黄蛋清300~400重量份,水100~150重量份,淀粉390~450重量份,羧甲基纤维素钠10~20重量份,包衣粉200~300重量份,碳酸钙40~60重量份,得到一种猪饲料添加剂。
32.其中,淀粉可选择玉米淀粉、红薯淀粉等;碳酸钙优选轻质碳酸钙;包衣粉可选用甲基纤维素(mc)、微晶纤维素或强丙基甲基纤维素(hpmc)。
33.本发明的猪饲料添加剂适合于仔猪口服,其在仔猪胃ph环境中不溶解,在仔猪十二指肠ph环境中快速溶解,释放所述抗体,实现中和病毒的目的。
34.本发明还提供一种含有上述卵黄抗体的口服药物制剂,其中,按精制卵黄抗体1%、甲基丙烯酸和丙烯酸乙酯按1:1形成的聚阴离子共聚物,该聚合物在ph》5.6时才会溶解,是优良的肠溶片包衣材料,以此制备该多价卵黄抗体的口服药物制剂。
35.本发明的有益效果:
36.本发明选择灭活的tgev、pedv、porv等三种病毒大分子抗原按照比例组成“多联多价全抗原”,用纳米氢氧化铝为佐剂与之乳化后首次免疫产蛋鸡,可以快速激活母鸡的免疫应答,从而获得tgev、pedv、porv等三种病毒的抗体,比单独使用tgev病毒抗原、pedv病毒抗原、porv病毒抗原所诱导的抗体滴度要高、抗体效价高。
37.本发明还选择纳米氢氧化铝为佐剂,有效负载tgev和pedv之s蛋白、e蛋白、m蛋白和n蛋白等4种结构蛋白的b细胞表位和t细胞表位,进一步优选s蛋白的b细胞表位所组成的“多价抗原”;porv之g蛋白、p蛋白的b细胞表位和t细胞表位所组成的,进一步优选vp7蛋白的b细胞表位所组成的“多价抗原”,进而形成新的“多联多价表位抗原”与该球状纳米氢氧化铝按照质量比为1:0.75~1.0混合乳化后,首次免疫产蛋鸡,优势在于使用“多联多价表位抗原”比单独使用tgev病毒之s蛋白b细胞表位、pedv蛋白之s蛋白b细胞表位、porv病毒之vp7蛋白的b细胞表位所诱导的抗体滴度要高、抗体效价也要高。
附图说明
38.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
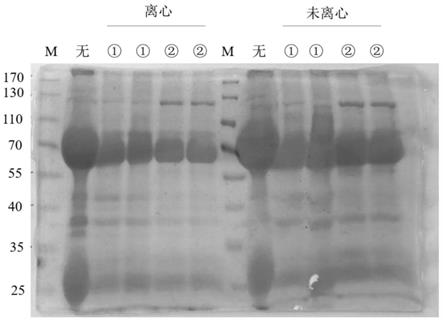
39.图1为猪腹泻相关病毒“多联多价表位抗原”所诱导的卵黄抗体igy的sd-page电泳图,泳道1:国产蛋白marker,泳道2:纯化的猪腹泻相关病毒串联表位蛋白所诱导抗体的卵黄抗体igy;
40.图2为本发明的微丸制剂在猪胃酸性环境和猪十二指肠环境下的保护效果,其中,(1)在ph3.7-5.1的猪胃酸环境下,包衣颗粒裂解的裂解情况;2)在ph6.8-7.0的猪十二指肠环境下,包衣颗粒的裂解情况。
具体实施方式
41.为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
42.原核表达载体pet22b(+)、pet32a(+)购买自英国novagen公司,pgex-6p-1购自美国ge公司,所采用的的鉴定抗体是6
×
his标签抗体、辣根过氧化物酶(hrp)标记的羊抗小鼠igg抗体均购自北京中杉金桥生物公司,抗vp7 cap购自山东绿都生物科技有限公司。所用的细胞株pk-15细胞株,购自深圳百恩维科技有限公司。
43.实施例1制备tgev、pedv、porv三种灭活病毒所诱导的卵黄抗体
44.1.1培养tgev、pedv、porv三种病毒并灭活制备抗原
45.分别将tgev、pedv、porv等三种病毒在vero细胞中培养,温度37℃,co2浓度5%,小牛血清浓度1-5%。当细胞数量达到1
×
109/ml时,灭活病毒,灭活后用生理盐水稀释至1
×
108/ml,得到灭活的tgev、pedv、porv等三种病毒抗原,按照1:1:1比例混合。
46.1.2免疫蛋鸡并收集鸡蛋
47.初次免疫步骤为:将灭活的tgev、pedv、porv三种病毒制备抗原加入等量的弗氏完全佐剂,充分乳化后对母鸡进行注射免疫,优化方案是使用棒状纳米氢氧化铝为佐剂,按照与抗原1:1比列乳化后首次免疫产蛋鸡;
48.加强免疫步骤为:将灭活的tgev、pedv、porv三种病毒抗原加入等量的普通氢氧化铝佐剂,充分乳化后对蛋鸡进行注射免疫,每次免疫间隔14天,完成免疫后第10天开始收集鸡蛋,于4℃冰箱保存。
49.1.3灭活的tgev、pedv、porv三种病毒抗原作为疫苗免疫产前母鸡
50.实验动物:120只100日龄雌性罗曼蛋鸡,随机分为6组,包括5个实验组和1个对照组,每组20只。单次免疫抗原体积为100ul,分别第0d、14d、28d胸部肌肉注射。
51.实验组1:每只鸡胸部肌肉免疫100ul灭活tgev病毒的抗原+普通铝佐剂组;
52.实验组2:每只鸡胸部肌肉免疫100ul灭活pedv病毒的抗原+普通铝佐剂组
53.实验组3:每只鸡胸部肌肉免疫100ul灭活porv病毒的抗原+普通铝佐剂疫苗;
54.实验组4:每只鸡胸部肌肉免疫100ul灭活tgev、pedv、porv三种病毒的抗原+普通铝佐剂组;
55.实验组5:每只鸡胸部肌肉免疫100ul灭活tgev、pedv、porv三种病毒的抗原+棒状纳米铝佐剂疫苗;
56.对照组:每只鸡胸部肌肉免疫100ul生理盐水。
57.首免后第14天采集首免母鸡血清,采用elisa法检测抗体滴度,结果见表1。
58.表1“多联多价全抗原”与不同抗原免疫结果的对比数据
[0059][0060]
结果如表1所示,在首免后的第14天,单一病毒被灭活后的抗原分别与普通铝佐剂所诱导的抗体滴度分别是:tgev病毒的抗原所诱导抗体滴度68.01;pedv病毒抗原所诱导抗体滴度77.6;porv病毒抗原所诱导抗体滴度89.3。而棒状纳米氢氧化铝辅佐灭活的tgev、pedv、porv三种病毒抗原所产生的抗体滴度达246.0,同时,使用普通氢氧化铝辅佐灭活tgev、pedv、porv三种病毒的抗原所产生的抗体滴度只有199.0。因此,tgev、pedv、porv三种病毒组合的多联多价全抗原优于单一病毒抗原所诱导的抗体滴度;同时,棒状纳米氢氧化铝辅佐灭活tgev、pedv、porv三种病毒的多联多价全抗原产生的抗体滴度更高。
[0061]
1.4分离纯化卵黄抗体
[0062]
用酒精将免疫鸡蛋的蛋壳擦拭干净后破壳并分离卵黄,然后对卵黄加入冷却水,稀释10倍。用0.1mol/l盐酸溶液调节ph至5.0,于-20℃冰箱中冷冻过夜,去脂。次日解冻,将卵黄稀释液转入离心管中,10,000r/min,4℃,离心10min,取上清液即为水溶性组分(wsf)
并测量体积。
[0063]
将分离出的卵黄液使用硫酸铵沉淀法进行纯化以获得抗体。根据测量的wsf体积,缓慢加入饱和硫酸铵溶液至终浓度为50%,避免局部盐度过高而造成蛋白质变性,置于磁力搅拌器上搅拌混匀。10,000r/min,4℃离心15min,弃上清液,加入适量pbs溶液重悬,重复上述步骤再次缓慢加入33%的硫酸铵溶液,搅拌混匀后,4℃静置过夜,10,000r/min,4℃离心15min,弃上清液。加入少量pbs溶液重悬,转移入透析袋中。透析袋使用前应在透析液中浸泡,并确定透析袋不漏方可使用。将装有蛋白溶液的透析袋置于透析液中,4℃充分透析,每12h更换透析液一次。待透析完成后,使用0.22μm的过滤器过滤除菌,最终获得的igy溶液,分装存于-20℃冰箱中备用。
[0064]
将过滤后的卵黄抗体液在-80℃条件下预冻2h,然后在真空度20pa下,冷冻干燥,24h后得到纯化的灭活tgev、pedv、porv三种病毒的抗原诱导的卵黄抗体的粗提物。
[0065]
实施例2制备tgev、pedv、porv三种病毒表位蛋白所诱导的卵黄抗体
[0066]
2.1将tgev病毒的s蛋白基因、pedv病毒的s蛋白基因、porv病毒的vp7蛋白基因在真核载体中表达。
[0067]
将测序与酶切正确的重组表达质粒pet22b-s-s-vp7,pet32a-cap和pgex6p-1-s-s-vp7-cap分别加入到100μl事先制备好的dh5α、top10、dh5α(contain vector ptara)、top10(contain vector ptara)、bl21、bl21(plus)和rosetta(de3)感受态细胞中,轻轻混匀,冰上放置30min;然后42℃热击90s,迅速冰浴5min,加600ul无抗生素lb液体培养基,放置37℃摇床,120rpm/min,培养45min。10000rpm/min离心2min,吸弃600μl上清,用100μl lb液体培养基重悬菌体,涂布含氨苄(终浓度为50μg/ml)、lb固体培养基,37℃温箱培养过夜。
[0068]
诱导目标蛋白表达,对重组蛋白(s-s-vp7)做sds-page分析和western blot鉴定。
[0069]
纯化的蛋白分子量约为145kda,与理论分子量一致,且蛋白纯度达到95%以上。用于后续免疫产蛋母鸡的抗原。
[0070]
2.2免疫蛋鸡并收集鸡蛋
[0071]
初次免疫步骤为:将真核载体中表达的三种病毒多个蛋白表位组成的“多联多价表位抗原”加入等量的弗氏完全佐剂,充分乳化后对母鸡进行注射免疫,优化方案是使用球状纳米氢氧化铝佐剂,按照与抗原1:1比列乳化后首次免疫产蛋鸡;
[0072]
加强免疫步骤为:将真核载体中表达的三种病毒多个蛋白多表位组成的“多联多价表位抗原”加入等量的常规氢氧化铝佐剂,充分乳化后对蛋鸡进行注射免疫,每次免疫间隔14天,完成免疫后第10天开始收集鸡蛋,于4℃冰箱保存。
[0073]
2.3多个蛋白多表位组成的“多联多价表位抗原”免疫产前母鸡
[0074]
实验动物:120只100日龄雌性罗曼蛋鸡,随机分为6组,包括5个实验组和1个对照组,每组20只。单次免疫抗原体积为100μl,分别第0d、14d、28d胸部肌肉注射。
[0075]
实验组1:每只鸡胸部肌肉免疫100μl真核载体中表达的tgev病毒s蛋白b细胞表位抗原+普通铝佐剂组;
[0076]
实验组2:每只鸡胸部肌肉免疫100μl真核载体中表达的pedv病毒s蛋白b细胞表位抗原+普通铝佐剂组;
[0077]
实验组3:每只鸡胸部肌肉免疫100μl真核载体中表达的porv病毒vp7蛋白b细胞表位抗原+普通铝佐剂组;
[0078]
实验组4:每只鸡胸部肌肉免疫100μl真核载体中表达的三种病毒多个蛋白多表位组成的“多联多价表位抗原”+普通铝佐剂组;
[0079]
实验组5:每只鸡胸部肌肉免疫100μl真核载体中表达的三种病毒多个蛋白多表位组成的“多联多价表位抗原”+球状纳米铝佐剂组;
[0080]
对照组1:每只鸡胸部肌肉免疫100μl生理盐水。
[0081]
首免后的早期(第7天)采集首免母鸡血清,采用elisa法检测抗体滴度的结果见表2。
[0082]
表2“多联多价表位抗原”与不同抗原免疫结果对比数据
[0083]
免疫组别数量抗原剂量抗体滴度实验组1:(tgev病毒s蛋白b细胞表位抗原+普通铝佐剂)20100ul/只.次45.12实验组2:(pedv病毒s蛋白b细胞表位抗原+普通铝佐剂)20100ul/只.次87.23实验组3:(porv病毒vp7蛋白b细胞表位抗原+普通铝佐剂)20100ul/只.次68.12试验组4:(“多联多价表位抗原”+普通铝佐剂)20100ul/只.次187.08试验组5:(“多联多价表位抗原”+球状纳米铝佐剂)20100ul/只.次289.06对照组:(生理盐水)20100ul/只.次0.52
[0084]
结果如表2所示,在首免后的早期(第14天),生理盐水组、tgev病毒s蛋白b细胞表位抗原与普通铝佐剂、pedv病毒s蛋白b细胞表位抗原与普通铝佐剂、porv病毒vp7蛋白b细胞表位抗原分别与普通铝佐剂所诱导的抗体滴度分别是0.52、45.12、87.23、68.12,“多联多价表位抗原”+普通铝佐剂组所诱导的抗体滴度187.08,而本发明采用球状纳米氢氧化铝辅佐的真核载体中表达的三种病毒多个蛋白多表位组成的“多联多价表位抗原”所产生的抗体滴度达289.06,能更有效地引起母鸡产生免疫应答,抗体滴度和抗体效价都高。
[0085]
2.4分离纯化卵黄抗体
[0086]
用酒精将免疫鸡蛋的蛋壳擦拭干净后破壳并分离卵黄,然后对卵黄加入冷却水,稀释10倍。用0.1mol/l盐酸溶液调节ph至5.0,于-20℃冰箱中冷冻过夜,去脂。次日解冻,将卵黄稀释液转入离心管中,10,000r/min,4℃,离心10min,取上清液即为水溶性组分(wsf)并测量体积。
[0087]
将分离出的卵黄液使用硫酸铵沉淀法进行纯化以获得抗体。根据测量的wsf体积,缓慢加入饱和硫酸铵溶液至终浓度为50%,避免局部盐度过高而造成蛋白质变性,置于磁力搅拌器上搅拌混匀。10,000r/min,4℃离心15min,弃上清液,加入适量pbs溶液重悬,重复上述步骤再次缓慢加入33%的硫酸铵溶液,搅拌混匀后,4℃静置过夜,10,000r/min,4℃离心15min,弃上清液。加入少量pbs溶液重悬,转移入透析袋中。透析袋使用前应在透析液中浸泡,并确定透析袋不漏方可使用。将装有蛋白溶液的透析袋置于透析液中,4℃充分透析,每12h更换透析液一次。待透析完成后,使用0.22μm的过滤器过滤除菌,最终获得的igy溶液,分装存于-20℃冰箱中备用。
[0088]
将过滤后的卵黄抗体液在-80℃条件下预冻2h,然后在真空度20pa下,冷冻干燥,24h后得到纯化的灭活tgev、pedv、porv三种病毒的抗原诱导的卵黄抗体的粗提物。
[0089]
实施例3卵黄抗体的效价检测
[0090]
采用间接酶联免疫吸附法(elisa)检测效价,用以tgev、pedv、porv三种病毒的抗原按照1:1:1:的比例形成混合物,该混合物浓度为10mg/ml,以此包被酶标板,每孔100μl,4
℃包被过夜,pbst洗涤5次,后加入含1%bsa的封闭液,37℃封闭4h。洗涤5次后加入倍比稀释的tgev、pedv、porv等三种病毒的“多联多价全抗原”(实施例1)诱导的卵黄抗体,另一组加入倍比稀释的tgev、pedv、porv等重组蛋白(s-s-vp7)“多联多价表位抗原”(实施例2)。同时设置空白对照和阴性对照,阴性对照组使用pbs液;空白对照组使用普通鸡蛋蛋黄液,37℃孵育1h。洗涤5次后,加入辣根过氧化物酶标记的羊抗鸡igy二抗,37℃孵育1h。洗涤5次后,加入tmb显色液,37℃避光显色10min。然后2m h2so4终止反应后用酶标仪读取450nm的od值。
[0091]
待测样品与阴性对照吸光值比值大于2.1判定为阳性,最大阳性稀释度为抗体效价。
[0092]
本发明制备的tgev、pedv、porv等三种病毒的抗原所诱导的卵黄抗体elisa最高效价为1:58000。
[0093]
具体结果见表1、表2。
[0094]
实施例4鉴定卵黄抗体浓度和纯度
[0095]
取纯化蛋白液10ml,稀释10倍后,用bca蛋白浓度测定试剂盒测定浓度,测得蛋白浓度为9.862mg/ml。取蛋白液15μl与等量2
×
loading buffer混匀后沸水浴10min,进行12%还原性sds-page电泳。
[0096]
结果如图1所示,抗体igy的重链,轻链分别位于65kd、28kd条带处,总分子量约为180kd。
[0097]
用ymc-biopro q75阴离子交换填料和ymc-pack diol-200体积排阻色谱柱从蛋黄提取物中分离纯化igy抗体。具体是:首先用ymc-biopro q75阴离子交换填料分离富集;然后用ymc-pack diol-200体积排阻色谱柱分离纯化,进一步用体积排阻色谱法分析获得的纯化物。
[0098]
结果显示:从蛋黄粗提物中分离纯化得到的卵黄抗体igy纯度达到99.3%;抗tgev卵黄抗体igy纯度为98.0%、抗pedv卵黄抗体igy纯度为97.0%、抗porv卵黄抗体igy纯度为97.8%。
[0099]
实施例5本发明所得“多联多价全抗原”所诱导的卵黄抗体igy对病毒的体外中和试验
[0100]
分别将tgev、pedv、porv三种病毒接种于vero细胞。
[0101]
将待检卵黄抗体先在离心管中做4倍稀释(120ul待检样品+360ul细胞维持液),然后在96孔细胞培养板中按照2倍系列稀释(50ul上一稀释度+50ul细胞维持液),稀释后每孔终体积为50μl。然后按50μl/孔加入100ccid50/ml用细胞维持液稀释后的新冠病毒,置二氧化碳培养箱中36.5℃31℃5%二氧化碳培养箱中和2小时。中和结束后向96孔板中加入1.5
×
105细胞/ml的vero细胞悬液100μl,置36.5℃31℃5%二氧化碳培养箱中培养5天。培养结束后从细胞培养箱中取出96孔板,在显微镜下观察细胞病变情况,根据细胞病变情况判断待检卵黄抗体中和效价结果。判定依据如下:
[0102]
(1)当最高稀释度血清的2孔中有1孔出现细胞病变,另1孔不出现细胞病变,该稀释度的倒数计即为该卵黄抗体的中和抗体效价;
[0103]
(2)当最高稀释度血清的2孔完全病变,相邻低稀释度2孔完全不病变,则两者平均稀释度的倒数即为该卵黄抗体的中和抗体效价。
[0104]
(3)独立操作2次试验。
[0105]
结果见表3、4、5。
[0106]
表3“多联多价全抗原”所诱导的卵黄抗体igy中和tgev病毒的效价
[0107][0108]
病毒中和试验表明:加入“多联多价全抗原”所诱导卵黄抗体的一组能明显抑制tgev病毒的繁殖增长,抗体效价分别是1:512和1:768。
[0109]
表4“多联多价全抗原”所诱导的卵黄抗体igy中和pedv病毒的效价
[0110][0111]
病毒中和试验表明:加入“多联多价全抗原”所诱导卵黄抗体的一组能明显抑制tgev病毒的增殖,抗体效价分别是1:768和1:1536。
[0112]
表5“多联多价全抗原”所诱导的卵黄抗体igy中和porv病毒的效价
[0113][0114][0115]
病毒中和试验表明:加入“多联多价全抗原”所诱导卵黄抗体的一组能明显抑制tgev病毒的增殖,抗体效价分别是1:1024和1:768。
[0116]
实施例6多联多价表位抗原所诱导的卵黄抗体igy对病毒的体外中和试验
[0117]
实验过程同实施例5。结果见下表:
[0118]
表6“多联多价表位抗原”所诱导的卵黄抗体igy中和tgev病毒的效价
[0119][0120]
病毒中和试验表明:加入“多联多价表位抗原”所诱导的卵黄抗体的一组能明显抑制tgev病毒的繁殖增长,抗体效价分别是1:1024和1:768。
[0121]
表7“多联多价表位抗原”所诱导的卵黄抗体igy中和pedv病毒的效价
[0122][0123]
病毒中和试验表明:加入“多联多价表位抗原”所诱导的卵黄抗体的一组能明显抑制tgev病毒的增殖,抗体效价分别是1:1024和1:1536。
[0124]
表8“多联多价表位抗原”所诱导的卵黄抗体igy中和porv病毒的效价
[0125][0126]
病毒中和试验表明:加入“多联多价表位抗原”所诱导的卵黄抗体的一组能明显抑制tgev病毒的增殖,抗体效价分别是1:1024和1:1024。
[0127]
实施例7制备包衣抗体药物、包衣饲料添加剂
[0128]
7.1包衣饲料添加剂配方组成
[0129]
包衣抗体添加剂:去除蛋壳的蛋黄蛋清380克,水121克,玉米淀粉406克,羧甲基纤维素钠15克,微晶纤维素254克,轻质碳酸钙50克。
[0130]
7.2包衣饲料添加剂制备方法
[0131]
使用设备:电子天平、不锈钢器皿、打蛋器、称量纸,注射器。
[0132]
制备过程:
[0133]
a.软材的制作:将鸡蛋、玉米淀粉等物质物质按照比例混合,将粉料制成有一定可塑性的物料;
[0134]
b.挤压过程:将物料置于挤出滚圆制丸机中,经螺旋推进(转速=50rpm)挤压方式使物料通过直径为2.5mm的孔,挤压成圆柱形条状挤出物;
[0135]
c.滚圆过程:将上面的挤出物堆卸在滚圆机的自转摩擦板上,挤出物通过自转板(转速=500rpm)旋转,再使用分割板在挤出物转动的过程中,分割成更小的圆柱体,由于自转板的摩擦作用,使圆柱形物料逐渐滚成圆球形;
[0136]
d.微丸干燥:将圆球形的物料置于流化床中,通过流化床下部热空气的作用下,使物料由下层的产品收集室上升至上部沸腾膨胀室,鼓风的温度为45℃下干燥1h;
[0137]
e.过筛:将干燥完成的微丸取出,放入10目的分子筛中,将过小的微丸筛出;
[0138]
f.包衣:将过筛的微丸重新放入流化床,包衣粉(微晶纤维素254g)及溶剂制成包衣液,与上述制备的微丸混合均匀后通过下部热风(温度为45℃)鼓吹至沸腾膨化室,且包衣液通过流化床喷枪的喷雾头旋转(转速=85rpm)喷射出,使其均匀的附着在微丸的外部。
[0139]
实施例8在猪胃ph条件下的稳定性试验
[0140]
8.1模拟猪胃液成分组成:3.2g猪胃蛋白酶,2.0g nacl,7ml浓盐酸,纯化水定容于1000ml。以此方法,通过调整浓盐酸体积,将胃液ph值设置为3.7-5.3,最后调ph值为5.3为本实验条件。
[0141]
8.2取0.2g微丸(实施例7制备得到)置于培养皿中,并加入20ml ph=5.3的模拟胃液且置于39℃的恒温摇床中。
[0142]
作用时间:2h后,观察到微丸未破裂,但外包衣有轻微的溶解,溶液呈红色。
[0143]
倒出模拟胃液,后加入20ml模拟肠液(磷酸盐缓冲液ph=6.8),静置10h后,有部分肠衣开始破裂,持续40分钟左右,之后所有微丸均破裂,轻压且无硬心。
[0144]
表9“多联多价抗原”所诱导的卵黄抗体igy包衣抗体药物在体外模拟猪胃ph条件下的稳定性结果(ph值5.3;作用时间2h)
[0145][0146][0147]
实施例6肠释放试验
[0148]
8.1模拟猪小肠液成分组成:6.8g kh2po4溶于250ml纯化水,振荡,完全溶解后加190ml 0.2mol/l naoh和400ml双蒸水,加猪胰蛋白酶10.0g,混匀,纯化水定容至1000ml,用
0.2mol/l naoh。以此方法,通过调整naoh体积,将小肠液ph值设置为6.0-7.0,最后调ph值为6.8为本实验条件。
[0149]
参考中国药典(2020年版)四部(通则0921)对于肠溶片的方法,对其体外释放进行考察。
[0150]
试验过程:倒出模拟胃液,之后加入20ml模拟肠液(磷酸盐缓冲液ph=6.8),静置10h后,有部分肠衣开始破裂,持续40分钟左右,之后所有微丸均破裂,轻压且无硬心。
[0151]
8.2结论:可以判断该肠溶微丸(本发明所指的包衣抗体药物或饲料添加剂)在模拟肠液中可以溶解,且溶解效果较好。
[0152]
实施例7饲喂仔猪保护试验
[0153]
选仔猪品种组合及分组:长大本三元组合杂交仔猪(长白猪大约克本地荣昌猪),50-60日龄,性别不拘,共300头,随机分为10组,每组30头,接种疫苗组(细分为口服“多联多价全抗原”所诱导的igy药物组、口服“多联多价全抗原”所诱导的igy饲料添加剂组、口服“多联多价表位抗原”所诱导的igy药物组、口服“多联多价表位抗原”所诱导的igy饲料添加剂组和对照组)。未接种疫苗组(细分为口服“多联多价全抗原”所诱导的igy药物组、口服“多联多价全抗原”所诱导的igy饲料添加剂组、口服“多联多价表位抗原”所诱导的igy药物组、口服“多联多价表位抗原”所诱导的igy饲料添加剂组和对照组),见表10
[0154]
9.2病毒株:由cgmcc(中国普通微生物菌种保藏管理中心)提供猪传染性胃肠炎病毒株、猪流行性腹泻病毒株和猪轮状病毒株。
[0155]
9.3接种疫苗:由上海海利生物技术股份有限公司生产的“猪传染性胃肠炎-流行性腹泻-轮状病毒(g5)三联活疫苗(弱毒)”兽药生字(2016)090201097。商品名“卸立净”,10头份/瓶。
[0156]
9.4疫苗接种程序:按瓶签注明头份,用无菌生理盐水将疫苗稀释成1ml/头份,经后海穴位(尾根与肛门中间凹陷的小窝部位)接种,进针深度为0.5cm,对3日龄仔猪做首免,接种剂量为1ml/次/头;断奶前7日做二免,接种剂量为1ml/次/头。
[0157]
9.5饲喂抗体药物或含本发明所指igy抗体饲料添加剂后对仔猪保护试验
[0158]
表10饲喂仔猪分组及保护试验结果
[0159][0160]
表10结果说明:1)接种“卸立净”疫苗对仔猪有保护作用,但是保护作用有限;2)对于没有接种“卸立净”疫苗的仔猪,或者接种失败的案例,使用本发明抗体药物或含有抗体的饲料添加剂则具有明显的保护作用,其发病率明显下降。
[0161]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
