fam83a、kpna2、krt6a和ldha联合作为肺腺癌生物标志物的用途
技术领域
1.本发明涉及生物医药领域,特别是涉及fam83a、kpna2、krt6a和ldha联合作为肺腺癌生物标志物的用途。
背景技术:
2.肺癌是全球发病率及死亡率最高的一种恶性肿瘤,肺癌可分为小细胞肺癌和非小细胞肺癌两大类,而非小细胞肺癌约占肺癌的85%,其中大部分非小细胞肺癌均属于肺腺癌(luad),其五年生存率较低。
3.虽然采用了手术、放化疗、靶向治疗和免疫治疗的综合治疗,但由于局部复发或远处转移,luad的预后仍然很差。肺腺癌的发病与预后机制复杂,涉及多个基因与环境因素共同作用。因此,依靠单一的标志物,难以对肺腺癌进行准确特异地诊断和评估。目前用于肺腺癌诊断的标志物存在灵敏度和特异性不高的问题,易造成假阳性或假阴性的结果,不能很好地应用于肺腺癌的诊断或预测肺癌生存期或肺癌的个性化治疗。因此,亟需开发具有高灵敏度高特异性的肺腺癌检测标志物组合及相关产品。
技术实现要素:
4.鉴于以上所述现有技术的缺点,本发明的目的在于提供fam83a、kpna2、krt6a和ldha基因联合作为肺腺癌生物标志物的用途,用于解决现有技术中的问题。
5.为实现上述目的及其他相关目的,本发明一方面是提供fam83a、kpna2、krt6a和ldha在作为肺腺癌的治疗和/或诊断和/或预后的标志物中的应用。
6.本发明另一方面提供fam83a、kpna2、krt6a和ldha作为肺腺癌标志物在制备治疗肺腺癌的药物和/或肺腺癌诊断和/或预后的产品中的应用。
7.本发明另一方面提供用于检测fam83a、kpna2、krt6a和ldha的物质在制备肺腺癌的治疗和/或诊断和/或预后的产品中的应用。
8.在一些实施方式中,本发明提供用于检测fam83a、kpna2、krt6a和ldha基因的物质在制备试剂盒中的用途,所述试剂盒用于诊断肺腺癌的良恶性或判断肺腺癌的预后。
9.在本发明一些实施方式中,所述物质用于检测新鲜组织、新鲜冷藏组织(fresh frozen)、冰冻切片、石蜡切片、穿刺样本中的一种或多种的组合。
10.在本发明一些实施方式中,所述物质用于检测fam83a、kpna2、krt6a和ldha基因的表达量,优选为特异性检测。
11.在本发明一些实施方式中,所述物质包括fam83a、kpna2、krt6a和ldha的定量pcr引物。
12.在本发明一些实施方式中,所述物质包括序列如seq id no.1所示的fam83a基因定量pcr正向引物和如seq id no.2所示的fam83a基因定量pcr反向引物。
13.在本发明一些实施方式中,所述物质包括序列如seq id no.3所示的kpna2基因定
量pcr正向引物和如seq id no.4所示的kpna2基因定量pcr反向引物。
14.在本发明一些实施方式中,所述物质包括序列如seq id no.5所示的krt6a基因定量pcr正向引物和如seq id no.6所示的krt6a基因定量pcr反向引物。
15.在本发明一些实施方式中,所述物质包括序列如seq id no.7所示的ldha基因定量pcr正向引物和如seq id no.8所示的ldha基因定量pcr反向引物。
16.在本发明一些实施方式中,所述评估肺腺癌的治疗效果和/或判断肺腺癌的预后具体指评估肺腺癌患者的生存率和/或生存时间。
17.本发明另一方面提供用于检测fam83a、kpna2、krt6a和ldha基因的物质在制备试剂盒中的用途,所述试剂盒用于肺腺癌的筛查。
18.本发明另一方面提供fam83a、kpna2、krt6a和ldha抑制剂在制备至少具备以下功效之一的产品中的用途:
19.治疗肺腺癌;
20.抑制肺腺癌生长;
21.抑制肺腺癌细胞的增殖能力或增殖速率;
22.抑制肺腺癌细胞克隆;
23.促进肺腺癌细胞凋亡;
24.抑制肺腺癌细胞迁移;
25.抑制肺腺癌细胞侵袭转移。
26.本发明另一方面提供一种用于靶向肺腺癌标志物fam83a、kpna2、krt6a和ldha的产品。
27.在一些实施方式中,所述产品为肺腺癌联合检测试剂盒,包括用于检测fam83a、kpna2、krt6a和ldha基因的物质。
28.本发明另一方面是提供一种对肺腺癌进行诊断和/或进行预后评估的方法、系统、计算机可读存储介质和计算机处理设备。
29.本发明以fam83a、kpna2、krt6a和ldha基因作为联合检测的生物标志物,提供了理想的表达谱分析策略。通过同时进行多个靶序列的检测,提高了肺腺癌诊断或预后的灵敏度和特异性,操作简单,结果易于判读,对仪器要求不高。本发明可以以试剂盒的形式更方便临床上的推广应用,通过肺腺癌风险评估与预后分析的新的组合型生物标志物试剂盒,可有效用于肺腺癌的预后评估,具有良好的临床应用前景。
附图说明
30.图1显示为本发明实施例2中fam83a、kpna2、krt6a和ldha的差异表达情况示意图。
31.图2显示为本发明实施例2中fam83a、kpna2、krt6a和ldha在癌及癌旁组织中的表达情况示意图。
32.图3显示为本发明实施例3中fam83a的表达水平对病人存活率的影响示意图。
33.图4显示为本发明实施例3中kpna2的表达水平对病人存活率的影响示意图。
34.图5显示为本发明实施例3中krt6a的表达水平对病人存活率的影响示意图。
35.图6显示为本发明实施例3中ldha的表达水平对病人存活率的影响示意图。
36.图7显示为本发明实施例4中fam83a、kpna2、krt6a和ldha共同高表达对病人存活
率的影响示意图。
37.图8显示为本发明实施例4中roc曲线示意图。
具体实施方式
38.本发明发明人经过大量研究发现,fam83a、kpna2、krt6a和ldha基因或蛋白的联合检测与肺腺癌的判断,肺腺癌的预后有着密切关系,在此基础上完成了本发明。本发明针对筛选出的fam83a、kpna2、krt6a和ldha基因进行检测引物设计,建立检测体系检测肺腺癌,具有准确性高、特异性强的优点,在保证检测性能的情况下,能够简单、快速、低成本、标准统一地对样本进行检测。所述fam83a、kpna2、krt6a和ldha基因可以潜在应用于肺腺癌生物标志物检测,以应用于肺腺癌的早期鉴别诊断及动态监测、肺腺癌复发及预后的辅助判断、药物疗效评估及耐药监测等。
39.本发明一方面提供了fam83a、kpna2、krt6a和ldha作为肺腺癌标志物中的用途,所述fam83a、kpna2、krt6a和ldha基因可以用于肺腺癌的早期鉴别诊断、及动态监测、肺腺癌复发及预后的辅助判断、药物疗效评估及耐药监测等。所述fam83a、kpna2、krt6a和ldha标志物是指fam83a、kpna2、krt6a和ldha基因和/或蛋白。本发明人发现,fam83a、kpna2、krt6a和ldha与肺腺癌的预后有着密切关系,存在fam83a、kpna2、krt6a和ldha基因高表达的患者明显相较于其他患者具有更差的预后,反之则具有较佳的预后。
40.本发明还提供了fam83a、kpna2、krt6a和ldha在制备用于肺腺癌的早期鉴别诊断、及动态监测、肺腺癌复发及预后的辅助判断、药物疗效评估及耐药监测等的产品中的用途。
41.本发明另一方面是提供检测fam83a、kpna2、krt6a和ldha的物质在制备用于肺腺癌的早期鉴别诊断、及动态监测、肺腺癌复发及预后的辅助判断、药物疗效评估及耐药监测等的产品中的用途。
42.本发明中,检测fam83a、kpna2、krt6a和ldha的物质可以是用于检测fam83a、kpna2、krt6a和ldha基因的物质或用于检测fam83a、kpna2、krt6a和ldha蛋白的物质。所述用于检测lfam83a、kpna2、krt6a和ldha基因的物质可以是本领域各种适用于检测样品中fam83a、kpna2、krt6a和ldha基因的表达量的产品,通常可以是能够特异性检测样品中fam83a、kpna2、krt6a和ldha基因的表达量的产品,例如,可以是定量pcr引物、定量pcr试剂等,再例如,其所针对的检测样品可以是新鲜组织、石蜡切片等。在本发明一具体实施方式中,所述物质包括序列如seq id no.1所示的fam83a基因定量pcr正向引物和如seq id no.2所示的fam83a基因定量pcr反向引物。在本发明另外具体实施方式中,所述物质包括序列如seq id no.3所示的kpna2基因定量pcr正向引物和如seq id no.4所示的kpna2基因定量pcr反向引物。在本发明另外具体实施方式中,所述物质包括序列如seq id no.5所示的krt6a基因定量pcr正向引物和如seq id no.6所示的krt6a基因定量pcr反向引物。在本发明另外具体实施方式中,所述物质包括序列如seq id no.7所示的ldha基因定量pcr正向引物和如seq id no.8所示的ldha基因定量pcr反向引物。
43.本发明另一方面是提供一种用于肺腺癌的早期鉴别诊断、及动态监测、肺腺癌复发及预后的辅助判断、药物疗效评估及耐药监测等的产品。
44.可选的,所述肺腺癌复发及预后的辅助判断是指肺腺癌复发的几率和预后情况预测,预后风险评估,评估对象是否易发预后性较差的肺腺癌,评估肺腺癌患者的存活率和/
或存活时间,可用于指导临床诊疗。
45.可选的,所述产品包括用于检测所述fam83a、kpna2、krt6a和ldha基因的引物、探针、试剂、试剂盒、基因芯片或检测系统等。所述产品包括但不限于是试剂盒、芯片、核酸膜条、组合物等。
46.在一实施方式中,所述产品为试剂盒。
47.在一实施方式中,所述试剂盒用于判断肺腺癌的预后风险评估或评估对象是否易发预后性较差的肺腺癌;通常来说,检测结果中fam83a、kpna2、krt6a和ldha基因表达量越高,则认为对象易发预后性较差的肺腺癌,反之,则认为对象不易发预后性较差的肺腺癌。
48.本发明中,所述试剂盒优选用于判断肺腺癌的预后具体可以是评估肺腺癌患者的存活率和/或存活时间。
49.对于患者而言,所述样品可以是治疗前和/或治疗后的样品。
50.在一实施方式中,所述试剂盒为肺腺癌联合检测试剂盒,包括用于检测fam83a、kpna2、krt6a和ldha基因的物质。所述用于检测fam83a、kpna2、krt6a和ldha基因的物质可以是本领域各种适用于检测样品中fam83a、kpna2、krt6a和ldha基因的表达量的产品,通常可以是能够特异性检测样品中fam83a、kpna2、krt6a和ldha基因的表达量的产品,例如,可以是定量pcr引物、定量pcr试剂、特异性探针等,再例如,其所针对的检测样品可以是新鲜组织、石蜡切片等。在本发明一具体实施方式中,所述物质包括序列如seq id no.1所示的fam83a基因定量pcr正向引物和如seq id no.2所示的fam83a基因定量pcr反向引物。在本发明另外具体实施方式中,所述物质包括序列如seq id no.3所示的kpna2基因定量pcr正向引物和如seq id no.4所示的kpna2基因定量pcr反向引物。在本发明另外具体实施方式中,所述物质包括序列如seq id no.5所示的krt6a基因定量pcr正向引物和如seq id no.6所示的krt6a基因定量pcr反向引物。在本发明另外具体实施方式中,所述物质包括序列如seq id no.7所示的ldha基因定量pcr正向引物和如seq id no.8所示的ldha基因定量pcr反向引物。
51.优选地,所述试剂盒还包括选自以下一种或多种物质:pcr缓冲液、聚合酶、酶切缓冲液、荧光染料、荧光淬灭剂、荧光报告剂、dntp、限制性内切酶、外切核酸酶、碱性磷酸酶、内标、对照物、标准品等。
52.本发明提供的试剂盒还包含用于一个或多个组分的单独容器(例如小瓶)和/或用于使用所述试剂盒或系统的说明书。
53.本发明还提供了如上所述的试剂盒的用途,用于肺腺癌的早期鉴别诊断、及动态监测、肺腺癌复发及预后的辅助判断、药物疗效评估及耐药监测等。
54.本发明还提供了一种所述试剂盒的使用方法,通常包括如下步骤:
55.1)通过pcr方法特异性扩增fam83a、kpna2、krt6a和ldha目的基因片段;
56.2)获取fam83a、kpna2、krt6a和ldha基因的表达量。
57.本发明中,所述试剂盒的使用方法还可以包括:通过kaplan-meier方法,判断肺腺癌的预后,或评估对象是否易发预后性较差的肺腺癌。
58.在一实施方式中,所述产品为生物芯片,其包含上述检测标志物的试剂,所述标志物包括fam83a、kpna2、krt6a和ldha基因。
59.可选的,所述芯片上固定有如上所述的用于肺腺癌标志物fam83a、kpna2、krt6a和
ldha基因的检测引物。可选的,所述芯片上固定有如上所述的用于肺腺癌标志物fam83a、kpna2、krt6a和ldha的检测探针。可选的,所述芯片上固定有如上所述的用于肺腺癌标志物fam83a、kpna2、krt6a和ldha的检测引物和检测探针。
60.在一个或多个实施方案中,所述基因是rna。
61.在一个或多个实施方案中,所述检测是荧光定量pcr检测。
62.在一个或多个实施方案中,pcr中各引物浓度为100-500nm。
63.在一个或多个实施方案中,pcr中各探针浓度为100-500nm。
64.在一个或多个实施方案中,pcr反应条件为,95℃30秒;95℃10秒,60℃30秒,40个循环。
65.本发明还提供了一种系统,所述系统包含如上所述的试剂盒或芯片,还包含计算机可读介质。
66.本发明所述的引物、试剂盒、芯片、系统等可以被配置用于任何适当的用途或目的。例如,本发明所述的引物、探针、试剂盒、芯片、系统等可以被配置成用于评估受试者中的肺腺癌的良恶性和预后。
67.本发明还提供了一种检测或评估肺腺癌的方法,所述方法采用杂交捕获的方式富集dna,利用如上所述的方法、引物、探针、试剂盒、芯片、系统检测肺腺癌相关标志物的表达,根据检测样本中fam83a、kpna2、krt6a和ldha基因的表达水平,为肺腺癌的检测或评估等提供信息。
68.在一实施方式中,本发明提供的检测或评估肺腺癌的方法,所述方法包括:
69.a)提供来自受试者的样品,所述样品含有所述受试者的fam83a、kpna2、krt6a和ldha靶多核苷酸;
70.b)评估所述靶多核苷酸的表达水平;
71.c)基于所述靶多核苷酸的表达水平来检测或评估肺腺癌,例如评估所述受试者中的是否患有肺腺癌或患有肺腺癌的风险或评估手术后的预后等。
72.本发明中,所述产品的检测对象(样品)可以是哺乳动物的组织、细胞或者体液的样品。所述样品包括但不限于体液(例如血液、血浆、血清、脑脊髓液、滑液、尿液、汗液、精液、粪便、痰、眼泪、粘液、羊水等)、渗出液、骨髓样品、腹水、骨盆冲洗液、胸膜液、脊髓液、淋巴液、眼液、鼻、喉或生殖器拭子的提取物、消化组织的细胞悬浮液、或粪类物质的提取物、以及来自人、动物(例如非人哺乳动物)的组织和器官样品,以及由此衍生出的加工样品。在一个或多个实施方案中,所述样品是肺组织活检物。在一个或多个实施方案中,所述样品是血浆。在一个或多个实施方案中,所述样品来自具有肺腺癌良性或恶性的对象。
73.在一实施方式中,所述受试者为哺乳动物。所述哺乳动物为人或非人哺乳动物,所述非人哺乳动物例如宠物、农场动物、伴侣动物或实验动物。在一实施方式中,所述受试者可以是疑似患有癌症的对象。
74.所述方法还包括从样品中分离所述靶多核苷酸的步骤。
75.所述方法还包括扩增所述靶多核苷酸。可以使用选自下组的方法扩增所述靶多核苷酸:聚合酶链式反应、链置换扩增、转录介导的扩增、连接酶链式反应、基于核酸序列的扩增、引物延伸、滚环扩增、自主序列复制和环介导等温扩增。
76.所述方法还包括纯化所述靶多核苷酸的步骤。
77.所述方法可以依次或同时评估来自多个样品(例如来自多个受试者的多个样品)的靶多核苷酸的状态。
78.所述方法用于受试者中肺腺癌的分析或概况分析的诊断、预后、分层、风险评估或治疗监测。
79.所述方法还包括基于对受试者的癌症或肿瘤形成的评估来治疗所述受试者或改变所述受试者的治疗。
80.所述方法还包括基于对人患者的癌症或肿瘤形成的评估来治疗所述人患者或改变所述人患者的治疗。
81.其中所述治疗为化学疗法、放射疗法、免疫疗法、细胞疗法、手术、用药物(例如小分子药物或大分子药物如抗体药物)的治疗。
82.在一实施方式中,所述pcr扩增采用的引物如seq id no:1~8所示。在一实施方式中,所述pcr扩增采用的引物如seq id no:1~6所示。
83.本发明中,在一些实施方式中,所述产品为治疗药物,所述药物包括但不限于:核酸分子、碳水化合物、脂类、小分子化学药、抗体药、多肽、蛋白或干扰慢病毒。
84.所述核酸包括但不限于:反义寡核苷酸、双链rna(dsrna)、核酶、核糖核酸内切酶iii制备的小干扰rna或者短发夹rna(shrna)。
85.所述治疗药物的施用量为足够降低fam83a、kpna2、krt6a和ldha基因的转录或翻译,或者足够降低人fam83a、kpna2、krt6a和ldha蛋白的表达或活性的剂量,以使fam83a、kpna2、krt6a和ldha基因的表达至少被降低30%、40%、50%、80%、90%、95%或99%。
86.采用前述治疗肺腺癌的产品或方法,主要是通过降低fam83a、kpna2、krt6a和ldha基因的表达水平抑制肺腺癌细胞的增殖来达到治疗的目的。具体的,治疗时,将能有效降低fam83a、kpna2、krt6a和ldha基因表达水平的物质给药于患者。
87.本发明还提供了fam83a、kpna2、krt6a和ldha抑制剂在制备至少具备以下功效之一的产品中的用途:
88.治疗肺腺癌;
89.抑制肺腺癌生长;
90.抑制肺腺癌细胞的增殖能力或增殖速率;
91.抑制肺腺癌细胞克隆;
92.促进肺腺癌细胞凋亡;
93.抑制肺腺癌细胞迁移;
94.抑制肺腺癌细胞侵袭转移。
95.所述产品必然包括fam83a、kpna2、krt6a和ldha抑制剂,并以fam83a、kpna2、krt6a和ldha抑制剂作为前述功效的有效成分。
96.所述产品中,发挥前述功用的有效成分可仅为fam83a、kpna2、krt6a和ldha抑制剂,亦可包含其它可起到前述功用的分子。
97.亦即,fam83a、kpna2、krt6a和ldha抑制剂为所述产品的唯一有效成分或有效成分之一。
98.所述产品可以为单成分物质,亦可为多成分物质。
99.所述产品的形式无特殊限制,可以为固体、液体、凝胶、半流质、气雾等各种物质形
式。
100.所述产品包括但不限于药物、保健品、食品等。
101.所述fam83a、kpna2、krt6a和ldha抑制剂可以为核酸分子、抗体、小分子化合物。本发明所述fam83a、kpna2、krt6a和ldha抑制剂可以为降低肺腺癌细胞中fam83a、kpna2、krt6a和ldha基因表达的核酸分子。具体的,可以是双链rna或shrna。
102.本发明还提供了一种对肺腺癌的评估方法,所述方法包括:
103.根据fam83a、kpna2、krt6a、ldha的表达水平,调用r平台coxph,进行多因素生存预测分析,得到cox模型方程;
104.根据测序方法获得的待测样本的fam83a、kpna2、krt6a、ldha的表达量,代入所述cox模型方程,得到模型预测值,即cox模型风险值,同时获得cox模型风险中位值。
105.如果cox模型风险值大于所述cox模型风险中位值,即预测为肺腺癌高风险,反之,则预测为肺腺癌低风险。
106.在一优选实施方式中,所述cox模型方程y=exp(0.28127791*(x1-15.062156)+0.07286852*(x2-11.591149)+0.14921350*(x3-11.994119)+0.07243095*(x4-8.023319))(x1,x2,x3,x4分贝是指"ldha","fam83a","kpna2","krt6a"的测序表达量)。
107.本发明采用cox回归分析方法,预测fam83a、kpna2、krt6a、ldha共表达的联合效应对病人预后风险的影响,调用r平台coxph(如默认参数值)进行多因素的生存预测分析,fam83a、kpna2、krt6a、ldha多因素预测分析结果展示fam83a、kpna2、krt6a、ldha共同高表达病人具有更差的存活率,这意味着通过检测fam83a、kpna2、krt6a、ldha的基因共表达的联合效应,判断其共表达的联合效应的风险打分,即可预测病人预后风险。如针对实施例1病人,依据fam83a、kpna2、krt6a、ldha的cox模型的风险中位值(0.9887708),将病人划分为高、低风险组,如果风险得分大于fam83a、kpna2、krt6a、ldha的cox模型的风险中位值(0.9887708)的病人(高风险组),即预测为肺腺癌高风险,具有较差的预后,反之,预测为肺腺癌低风险,存活时间较长(如图7)。
108.本发明还提供了一种对肺腺癌进行诊断和/或进行预后评估的系统,所述系统包括:
109.cox模型方程获得模块:用于根据fam83a、kpna2、krt6a、ldha的表达水平,调用r平台coxph,进行多因素生存预测分析,得到cox模型方程;
110.cox模型预测值和风险中位值获得模块:根据测序方法获得的待测样本的fam83a、kpna2、krt6a、ldha的表达量,代入所述cox模型方程,得到cox模型预测值,即cox模型风险值,同时获得cox模型风险中位值;
111.预测模块:如果cox模型风险值大于所述cox模型风险中位值,即预测为肺腺癌高风险,反之,则预测为肺腺癌低风险。
112.本发明还提供了一种计算机可读存储介质,其上存储有计算机程序,该程序被处理器执行时实现如上所述方法的步骤。
113.本发明还提供了一种计算机处理设备,包括处理器及如上所述的计算机可读存储介质,所述处理器执行所述计算机可读存储介质上的计算机程序,实现如上所述方法的步骤。
114.本发明还提供了一种治疗肺腺癌的方法,为向对象施用fam83a、kpna2、krt6a和
ldha抑制剂或药物。
115.所述的对象可以为哺乳动物或哺乳动物的肺腺癌细胞。所述哺乳动物优选为啮齿目动物、偶蹄目动物、奇蹄目动物、兔形目动物、灵长目动物等。所述灵长目动物优选为猴、猿或人。所述肺腺癌细胞可以为离体肺腺癌细胞。
116.所述对象可以是罹患肺腺癌的患者或者期待治疗的肺腺癌的个体。或者所述对象为肺腺癌患者或者期待治疗肺腺癌的个体的离体肺腺癌细胞。
117.所述fam83a、kpna2、krt6a和ldha抑制剂可以在接受肺腺癌治疗前、中、后向对象施用。
118.如本文所用,术语“个体”、“受试者”、“宿主”和“患者”在本发明中可互换地使用,并且表示期望对其进行诊断、治疗或疗法的任何哺乳动物受试者,特别是人。“受试者”可以是对之施用或施加所提供的组合物、方法、试剂盒、装置和系统的生物体或所述生物体的一部分或组分。例如,所述受试者可以是哺乳动物或所述哺乳动物的细胞、组织、器官或一部分。
119.如本文所用,术语“多核苷酸”、“寡核苷酸”、“基因”、“核酸”和“核酸分子”可互换使用,并且它们是指任何长度的核苷酸的聚合形式,无论是脱氧核糖核苷酸还是核糖核苷酸或其类似物。多核苷酸可以具有任何三维结构并且可以执行已知或未知的任何功能。多核苷酸的实例包括但不限于如下这些:基因或基因片段,外显子,内含子,信使rna(mrna),转运rna,核糖体rna,核酶,cdna,dsrna,sirna,mirna,重组多核苷酸,分支多核苷酸,质粒,载体,任何序列的分离的dna,任何序列的分离的rna等。多核苷酸也包含经过修饰的核苷酸,例如的核苷酸和核苷酸类似物。应当进一步理解,本文中提及的dna可包括基因组dna、线粒体dna、附加体dna和/或dna衍生物,例如扩增子、rna转录物、cdna、dna类似物等。
120.如本文所用,“引物”可以是天然的或合成的寡核苷酸,其在与多核苷酸模板形成双链体后能够充当核酸合成的起始点并从其3'端沿模板延伸,从而形成延伸的双链体。在延伸过程中添加的核苷酸的序列由模板多核苷酸的序列决定。引物通常通过聚合酶如dna聚合酶延伸。
121.如本文所用,“扩增”通常是指产生所需序列的多个拷贝的过程。“多个拷贝”是指至少两个拷贝。“拷贝”并不一定意味着与模板序列具有完美的序列互补性或同一性。例如,拷贝可以包括核苷酸类似物如脱氧肌苷,有意的序列改变(例如通过包含与模板可杂交但不互补的序列的引物引入的序列改变),和/或在扩增过程中发生的序列错误。
122.本发明以fam83a、kpna2、krt6a和ldha基因作为联合检测的生物标志物,提供了理想的表达谱分析策略,以及一种用于肺腺癌高风险评估与预后分析的新的组合型生物标志物试剂盒,可有效用于肺腺癌的高风险评估与预后评估,具有良好的临床应用前景。
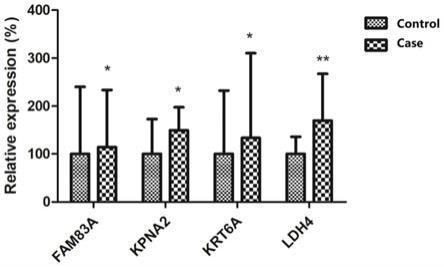
123.以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
124.在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中
另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
125.当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。当实施例给出具体数值时,并非限定本发明的应用范围,应当理解为为了更好更清晰地解释发明的应用而做出的举例说明,在没有脱离本发明的原理下,依据不同的应用场景而得到新的数值,应当认为是在本发明权益的保护范围之内。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
126.除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等molecular cloning:alaboratory manual,second edition,cold spring harbor laboratory press,1989and third edition,2001;ausubel等,current protocols in molecular biology,john wiley&sons,new york,1987and periodic updates;the series methods in enzymology,academic press,san diego;wolffe,chromatin structure and function,third edition,academic press,san diego,1998;methods in enzymology,vol.304,chromatin(p.m.wassarman and a.p.wolffe,eds.),academic press,san diego,1999;和methods in molecular biology,vol.119,chromatin protocols(p.b.becker,ed.)humana press,totowa,1999等。
127.实施例中所使用的肺腺癌的样本数据和临床信息数据均取自公开的tcga数据库。具体指获取tcga数据库中tcga-luad项目的肺腺癌病人的rna-seq转录组表达谱数据(594个文件数据)以及具有完整临床信息的数据(515个文件数据),数据获得的网址信息(https://cancergenome.nih.gov/)。数据具体情况如下:
128.a.tcga-luad-htseq-counts;
129.b.tcga-luad-clinical
130.实施例1
131.在594例肺腺癌数据中分析特定基因的fam83a、kpna2、krt6a和ldha的差异表达情况并绘制成直方图,结果如图1所示;由图1可知,四种基因在肺腺癌患者中均高表达,且具有显著差异(p值分别为1.09
×
10-3
,1.88
×
10-3
,7.98
×
10-4
,4.88
×
10-4
)。
132.其中,control组是tcga数据库的正常组。
133.实施例2
134.取临床确认为肺腺癌的8例病人的癌及癌旁组织样本,匀浆破碎,提取总rna,反转成cdna,基于荧光染料法设计fam83a、kpna2、krt6a和ldha的实时荧光定量pcr实验,进而检测基因fam83a、kpna2、krt6a和ldha在癌及癌旁组织中的表达情况(如图2,其中,normal(control)指的是:癌旁样本(paracancerous)样本数n=8;case指的是:肺腺癌样本(lung adenocarcinoma)样本数n=8),引物序列见下表1。由图2可知,相对于癌旁组织,四种基因在癌组织中均高表达,且有显著差异。
135.表1基因引物序列
[0136][0137]
实施例3
[0138]
下载tcga数据库中肺腺癌病人样本的522例临床存活数据信息。基于kaplan-meier方法分析差异基因fam83a、kpna2、krt6a和ldha的表达水平分别对病人存活率的影响,结果存在fam83a、kpna2、krt6a和ldha基因高表达的患者明显相较于其他患者具有更差的预后,反之则具有较好的预后。并且通过p-value显著性分析,证实该结果具有统计学意义(如图3,如图4,如图5,如图6)。
[0139]
实施例4
[0140]
采用cox回归分析方法,预测fam83a、kpna2、krt6a、ldha共表达的联合效应对病人预后风险的影响,调用r平台coxph(如默认参数值)进行多因素的生存预测分析,得到cox模型方程y=exp(0.28127791*(x1-15.062156)+0.07286852*(x2-11.591149)+0.14921350*(x3-11.994119)+0.07243095*(x4-8.023319))(x1,x2,x3,x4分贝是指"ldha","fam83a","kpna2","krt6a"的测序表达量),将fam83a、kpna2、krt6a、ldha测序表达量代入cox模型方程,得到模型预测值,即cox模型的风险值。
[0141]
依据fam83a、kpna2、krt6a、ldha的cox模型的风险中位值(0.9887708),将病人划分为高、低风险组,如果风险得分大于fam83a、kpna2、krt6a、ldha的cox模型的风险中位值(0.9887708)的病人(高风险组),即预测为肺腺癌高风险,具有较差的预后,反之,预测为肺腺癌低风险,具有较好的预后,针对实施例1的肺腺癌数据的模型预测结果如图7所示。
[0142]
最后本发明利用受试者工作特征曲线(receiver operator characteristic curve,roc曲线)来评价多因素生存分析预测模型,结果展示一年预后auc=0.683;三年预后auc=0.664;五年预后auc=0.639;十年预后auc=0.752,roc曲线的纵坐标为真阳性率(灵敏度),横坐标为假阳性率(1-特异度)(如图8)。
[0143]
本发明人发现fam83a、kpna2、krt6a和ldha共同高表达与高风险肺腺癌的联系,通过检测肺腺癌样本中fam83a、kpna2、krt6a和ldha的共同表达水平,并进一步基于kaplan-meier方法分析公开发表的临床随访等具体病例信息识别肺腺癌的恶性程度。结果表明通过监测fam83a、kpna2、krt6a和ldha的共同表达情况可以进一步预测病人患有肺腺癌的风险,以及预测其生存率和预后情况。
[0144]
综上所述,本发明有效克服了现有技术中的种种缺点而具高度产业利用价值。
[0145]
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
