一种用于烷烃c-h键活化偶联反应的金属有机框架的制备方法及其应用
技术领域
1.本发明涉及一种用于烷烃c-h键活化偶联反应的金属有机框架的制备方法及其应用,属于精细化工技术领域。
背景技术:
2.惰性烷烃c-h键活化是目前有机合成化学的热点之一,与传统的反应相比,该反应过程中原料无需预功能化可直接实现转化。目前c-h键活化在燃料、药物中间体的合成过程中展示出非比寻常的应用前景。虽然,c-h键是一种非常常见的化学键,但是c-h键的键能非常高,碳元素与氢元素的电负性又很接近,因而c-h键的极性很小,这些因素使得其具有很强的惰性,该过程故此也被称为合成化学的“圣杯”。
3.其中惰性烷烃c-h键的直接活化并与缺电子杂环芳烃耦联产物是天然药物生产中最重要的中间体之一,如烷基取代的异喹啉及其衍生物在天然存在的化合物中的存在而且具有广泛的生物活性。喹啉化合物在抗癌药物开发中起重要作用,通过不同的作用机制显示出优异的结果,例如通过细胞周期停滞、细胞凋亡、抑制血管生成、破坏细胞迁移和调节的生长抑制剂。同时烷基取代的异喹啉也可在体外抑制药物敏感性和耐药性结核分枝杆菌,进一步遏制肺结核病毒的扩散,是当今治疗肺结核的重要药物中间体之一。
4.目前传统方法合成喹啉类药物的传统方式通常采用minisci反应的方式,这是一种采用亲核碳自由基对质子化的缺电子芳香杂环进行自由基加成生成取代杂环化合物的反应。但是在合成过程中通常要加入强氧化剂或者酸性催化剂并在高温条件下方能促进反应。且该反应速率较快,有机产物易发生分离。此外这种生产工艺还具有工艺复杂,反应过程产生的废弃物危害环境,不符合绿色化学的宗旨等诸多不足。
5.近些年来,金属有机框架化合物由于其具有较大的比表面积、多催化位点协同等优势,在非均相催化领域展示出良好的应用前景。基于此,我们设想将多组分催化单元组装到金属有机框架化合物中,在光驱动下,不仅可以实现惰性烷烃的功能化,同时可以促使其与缺电子杂环芳烃的耦联。该过程为实现惰性c-h键活化并制备天然药物中间体提供了一种绿色高效的策略。
技术实现要素:
6.为了克服现有技术中存在的不足,本发明目的是提供一种用于烷烃c-h键活化偶联反应的金属有机框架的制备方法及其应用。采用该种方法制备的基于金属有机框架化合物具有足够大的空腔,可包合底物促进催化位点与底物反应。同时其可通过光激发到达高能态,随后经由氢原子转移过程完成对惰性c-h键的活化,进而成功实现惰性c-h键与杂化芳烃的耦联。
7.为了实现上述发明目的,解决现有技术中所存在的问题,本发明采取的技术方案是:一种用于烷烃c-h键活化偶联反应的金属有机框架的制备方法,是以稀土金属铈盐中的
ce
3+
作为节点,以l作为配体通过溶剂热法制得金属有机框架化合物,其合成路线如下:
8.ce
3+
+l
→
ce-l;
9.所述配体l为h3btp;
10.所述稀土金属铈盐选自六水合硝酸铈或五水合醋酸铈中的一种;
11.所述配体h3btp具有如下(a)分子结构式,
[0012][0013]
所述制备方法,包括以下步骤:
[0014]
步骤1、将1,3,5-三(溴甲基)苯和烟酸按1∶2.9~3.0的摩尔比加入到5.0~8.0ml的n,n-二甲基甲酰胺溶液中,在70~80℃的条件下搅拌12~14h,冷却至室温,抽滤,滤饼用100~150ml乙腈洗涤,得到白色粉末,在真空烘箱中75~85℃的条件下烘干,制得配体h3btp;
[0015]
步骤2、将步骤1得到的配体h3btp与稀土金属铈盐按照1∶1~1.2的摩尔比加入到体积比为1∶2~3的乙醇与n,n-二甲基甲酰胺混合溶剂中,在鼓风干燥箱中加热至120~125℃,降至室温后析出黄色固体,制得目标化合物ce-btp。
[0016]
所述方法制备的金属有机框架化合物在催化环己烷制备1-环己基异喹啉方面中的应用。
[0017]
本发明有益效果是:一种用于烷烃c-h键活化偶联反应的金属有机框架的制备方法及其应用,其中制备方法,是以稀土金属铈盐中的ce
3+
作为节点,以l作为配体通过溶剂热法制得金属有机框架化合物,其合成路线如下:ce
3+
+l
→
ce-l,所述配体l为h3btp,所述稀土金属铈盐选自六水合硝酸铈或五水合醋酸铈中的一种;与已有技术相比,采用该方法制备金属有机框架化合物原料价格低廉,产率高,得到的化合物化学性质稳定,易于投入实际应用中。作为化合物ce-btp在催化环己烷制1-环己基异喹啉方面中的应用,其产率可达93%。
附图说明
[0018]
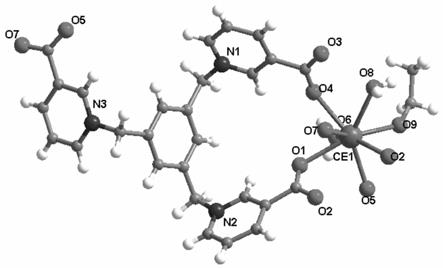
图1是实施例1化合物ce-btp的晶体结构图。
[0019]
图2是实施例1化合物ce-btp的xrd谱图。
[0020]
图3是实施例4化合物ce-btp光照条件下催化环己烷制备1-环己基异喹啉的反应产率随时间的变化图。
具体实施方式
[0021]
下面结合实施例对本发明作进一步说明。
[0022]
实施例1
[0023]
将1,3,5-三(溴甲基)苯(1.07g,3.0mmol)和烟酸(1.11g,9.0mmol)加入到5ml的n,n-二甲基甲酰胺溶液中。在80℃的条件下搅拌12h,冷却至室温后,抽滤,滤饼用120ml乙腈洗涤,得到白色粉末,在真空烘箱中80℃的条件下烘干,制得配体h3btp(1.00g,产率68.6%)。1h nmr(400mhz,dmso-d6,ppm):δ 9.68(d,j=12.7hz,3h),9.46-9.28(m,3h),9.09-8.95(m,3h),8.38-8.24(m,3h),7.73(s,3h),6.03(s,6h).
[0024]
称取配体h3btp(48.6mg,0.1mmol)和六水合硝酸铈(43.4mg,0.1mmol)加入到6ml体积比为1∶3的乙醇和n,n-二甲基甲酰胺混合溶剂中,在鼓风干燥箱中加热至120℃,降至室温后析出黄色固体,制得目标化合物ce-btp(46.0mg,产率50%),其晶体结构图,如图1所示,其xrd谱图,如图2所示。元素分析表明化合物c
29h30
br2cen3o
125
的计算值为:c,37.84;h,3.29;n,4.57%;实测值为:c,37.55;h,3.35;n,4.51%.
[0025]
实施例2
[0026]
称取实施例1中的配体h3btp(48.6mg,0.1mmol)和五水合醋酸铈(40.7mg,0.11mmol)加入到6ml体积比为1∶3的乙醇和n,n-二甲基甲酰胺混合溶剂中,在鼓风干燥箱中加热至120℃,降至室温后析出黄色固体,制得目标化合物ce-btp(43.2mg,产率47%)。
[0027]
实施例3
[0028]
称取实施例1中的配体h3btp(48.6mg,0.1mmol)和六水合硝酸铈(43.4mg,0.1mmol)加入到6ml体积比为1∶2的乙醇和n,n-二甲基甲酰胺混合溶剂中,在鼓风干燥箱中加热至120℃,降至室温后析出黄色固体,制得目标化合物ce-btp(47.8mg,产率52%)。
[0029]
实施例4利用ce-btp催化环己烷制备1-环己基异喹啉
[0030]
在20ml的光反应管中,加入5ml乙腈溶液,之后加入4.5mg的ce-btp,14μl的异喹啉以及112μl的环己烷,将反应器置于空气氛围中,利用395nm的led光源光照12h,有1-环己基异喹啉(19.5mg,产率93%)目标物生成,其反应产率随时间的变化图,如图3所示。
[0031][0032]
实施例5利用ce-btp催化环己烷制备6-环己基菲啶
[0033]
在20ml的光反应管中,加入5ml乙腈溶液,之后加入4.5mg的ce-btp,17.9mg的菲啶以及112μl的环己烷,将反应器置于空气氛围中,利用395nm的led光源光照12h,有6-环己基菲啶(24.0mg,产率92%)目标物生成。
[0034][0035]
实施例6利用ce-btp催化四氢呋喃制备1-四氢呋喃-异喹啉
[0036]
在20ml的光反应管中,加入5ml乙腈溶液,之后加入4.5mg的ce-btp,14μl的异喹啉以及120μl的四氢呋喃,将反应器置于空气氛围中,利用395nm的led光源光照12h,有1-四氢呋喃-异喹啉(18.1mg,产率91%)目标物生成。
[0037][0038]
实施例7利用ce-btp催化氧杂环丁烷制备氧杂环丁烷-异喹啉
[0039]
在20ml的光反应管中,加入5ml乙腈溶液,之后加入4.5mg的ce-btp,14μl的异喹啉以及100μl的氧杂环丁烷,将反应器置于空气氛围中,利用395nm的led光源光照12h,有氧杂环丁烷-异喹啉(9.4mg,产率51%)目标物生成。
[0040]
