1.本发明涉及水产养殖技术领域,具体涉及一种微生物水质调节剂及其制备方法和应用。
背景技术:
2.水产养殖生产全过程都离不开水体,水这个生存介质的优劣直接决定了养殖能否获利。良好的水体包括肥、活、嫩和爽四个关键字。“肥”是指水体内的浮游动植物的量足够多,可以为幼年养殖动物提供天然饵料;“活”是水体内生态系统完整,生产者与消费者及分解者三类角色正常发挥作用,水体内藻类等植物能正常进行光合作用,生态系统正常;“嫩”是指水体内的浮游动植物和菌类都处在增长期,细胞状态好,老化程度低;“爽”是指水质不混浊,悬浮物等其它杂质较少。良好的水体可以促进水产动物对饲料的充分吸收转化,提升水产品质量安全,增加水产养殖效益。因此水质调节具有重要的作用和意义。
3.水质调节剂主要包括化学制剂和微生物制剂。化学制剂多是以化学或无机原料为主,其去除水体内亚硝酸盐等污染物多依赖化学或是物理反应,使用效果都没有持续性,而且很难形成生态有机循环体系,并且在水体内添加多种化学品,可能从指标上能看到一时的效果,但剧烈的化学和物理反应,也必然会对水产动物产生不可预知的应激反应,不利于水产养殖的科学生产,相比之下微生物水质调节剂,可以更好地建立生态体系,高效预防和应对各种水质恶化的情况,实现稳产和高产。但是不同的微生物之间存在相互影响和制约,微生物也极易受到水温和ph的影响,市场上现有的微生物水质调节剂存在效果不佳等问题。
技术实现要素:
4.有鉴于此,有必要针对上述的问题,提供一种微生物水质调节剂及其制备方法和应用。本发明的微生物水质调剂包括三种益生菌剂,通过调整益生菌剂不同的种类,使其分别适用于水产养殖的肥水期、生长期以及养殖后期。在不同的水产养殖时期,投入相应的益生菌剂,分别保证不同养殖时期的水体需求。同时作用于相同水产养殖时期的不同种类的益生菌之间相互协同作用,调节养殖水体水质,提高水产动物成活率,增加水产养殖效益。
5.为实现上述目的,本发明采取以下的技术方案:
6.第一方面,本发明提供一种微生物水质调节剂,包括肥水期益生菌剂、生长期益生菌剂和养殖后期益生菌剂;所述肥水期益生菌剂按质量百分比计包括10~40%乳酸菌、10~50%小球藻和10~50%酵母菌;所述生长期益生菌剂按质量百分比计包括10~40%乳酸菌、10~40%沼泽红假单胞菌、10~40%酵母菌和10~40%枯草芽孢杆菌;所述养殖后期益生菌剂按质量百分比计包括10~40%乳酸菌、10~40%沼泽红假单胞菌、10~40%枯草芽孢杆菌和10~40%硝化细菌。
7.优选的,所述肥水期益生菌剂按质量百分比计包括30%乳酸菌、40%小球藻和30%酵母菌;所述生长期益生菌剂按质量百分比计包括20%乳酸菌、20%沼泽红假单胞菌、
30%酵母菌和30%枯草芽孢杆菌;所述养殖后期益生菌剂按质量百分比计包括20%乳酸菌、30%沼泽红假单胞菌、30%枯草芽孢杆菌和20%硝化细菌剂。
8.进一步的,所述乳酸菌包括发酵乳杆菌、植物乳杆菌、干酪乳杆菌和屎链球菌。
9.进一步的,所述酵母菌包括酿酒酵母和产朊假丝酵母。
10.进一步的,所述硝化细菌包括氨氧化细菌和亚硝酸氧化细菌。
11.进一步的,所述乳酸菌由按质量百分比计的50~70%乳酸菌发酵液、20~40%贝壳粉和10~30%冻干保护剂组成;所述沼泽红假单胞菌由按质量百分比计的50~70%沼泽红假单胞菌发酵液、20~40%贝壳粉和10~30%冻干保护剂组成;所述小球藻由按质量百分比计的50~70%小球藻发酵液、20~40%贝壳粉和10~30%冻干保护剂组成;所述酵母菌由按质量百分比计的50~70%酵母菌发酵液、20~40%贝壳粉和10~30%冻干保护剂组成;所述枯草芽孢杆菌由按质量百分比计的50~70%枯草芽孢杆菌发酵液、20~40%贝壳粉和10~30%冻干保护剂组成;所述硝化细菌由按质量百分比计的50~70%硝化细菌发酵液、20~40%贝壳粉和10~30%冻干保护剂组成。
12.进一步的,所述冻干保护剂由按质量百分比计的50%~80%脱脂奶粉、2%~20%乳糖和10%~30%甘油。
13.优选的,所述冻干保护剂由按质量百分比计的75%脱脂奶粉、5%乳糖和20%甘油组成。
14.进一步的,所述乳酸菌发酵液的制备方法为:
15.a1:将发酵乳杆菌、植物乳杆菌、干酪乳杆菌和屎链球菌,28~30℃下,先在斜面固体培养基中培养36小时得到一级纯培养物,然后接种到装有液体培养基的500ml三角瓶中进行24小时液体振荡培养得到二级纯培养物,最后接种到1.8l机械搅拌发酵罐培养24小时,得到乳酸菌发酵液,其菌数≥7logcfu/g;其中液体培养基为麦芽汁培养基,固体培养基为麦芽汁培养基加琼脂;
16.进一步的,所述沼泽红假单胞菌发酵液的培养方法为:
17.b1:配置培养基:称取乙酸钠3.5g,氯化氨1.0g,磷酸二氢钾1.2g,磷酸氢二钾0.4g,氯化镁0.1g,氯化钙0.1克,酵母提取物0.4g,蛋白胨0.8g,用蒸馏水定容至1升;调节ph=7.0,121℃高压灭菌20分钟;
18.b2:将沼泽红假单胞菌在装有制备好培养基的试管中光照28~30℃下培养96~144小时得到一级纯培养物,然后置于500ml三角瓶中恒温振荡培养60~72小时得到二级纯培养物,最后接种到1.8l塑料瓶中28~30℃下光照静止培养,得到沼泽红假单胞菌发酵液,其菌数≥7logcfu/g。
19.进一步的,所述小球藻发酵液的培养方法为:
20.c1:配置培养基:称取硝酸钠0.16g,磷酸二氢钾0.02g,硫酸镁0.05g,尿素0.04g,氯化钙0.02g,碳酸氢钠0.02g,氯化钠1.00g,柠檬酸三铁4.00mg,五水硫酸铜0.08mg,硼酸2.86mg,四水氯化锰1.81mg,二水钼酸钠0.21mg;用海水定容至1升;调节ph=7.0,121℃高压灭菌20分钟;
21.c2:将小球藻在装有培养基的试管中光照23~24℃培养96~144小时得到一级纯培养物,然后500ml三角瓶中恒温振荡培养60~72小时得到二级纯培养物,之后接种到1.8l塑料瓶,23~24℃光照静止培养,得到小球藻发酵液,其藻数≥7logcfu/g。
22.进一步的,所述酵母菌发酵液的培养方法为:
23.d1:配置液体培养基:称取酵母提取物5g,蛋白胨10g,葡萄糖20g,用蒸馏水定容1l,调节ph=6.4,118℃下高压灭菌20分钟;配制固体培养基:在液体培养基的基础上添加10g琼脂;
24.d2:将酿酒酵母和产朊假丝酵母在28~30℃下斜面固体培养得到一级纯培养物,然后接种到装有液体培养基的500ml三角瓶中恒温振荡培养得到二级纯培养物,最后接种到1.8l机械搅拌发酵罐培养24小时,得到酵母菌发酵液,其菌数≥8logcfu/g。
25.进一步的,所述枯草芽孢杆菌发酵液的培养方法为:
26.e1:配置培养基:称取蛋白胨10.0g、酵母提取物5.0g、氯化钠10.0g、葡萄糖10.0g,用蒸馏水定容至1升,调节ph=7.0,118℃湿热高压灭菌18分钟;配制固体培养基:在液体培养基的基础上添加10g琼脂;
27.e2:将枯草芽孢杆菌在28~30℃下斜面固体培养得到一级纯培养物,然后接种到装有液体培养基的500ml三角瓶中恒温振荡培养得到二级纯培养物,最后接种到1.8l机械搅拌发酵罐培养24小时,得到枯草芽孢杆菌发酵液,其菌数≥8logcfu/g。
28.进一步的,所述硝化细菌发酵液的培养方法为:
29.f1:配置氨氧化细菌培养基:称取硫酸铵0.5g,氯化钠0.3g,硫酸亚铁0.03g,磷酸氢二钾1.0g,硫酸镁0.05g,氯化钙7.5g,蒸馏水定容至1升;调节ph=7.0,121℃高压灭菌20分钟;
30.f2:配置亚硝酸氧化细菌培养基:称取亚硝酸钠1.0g,硫酸镁0.03g,硫酸锰0.01g,磷酸氢二钾0.75g,碳酸钠1.0g,磷酸氢二钠0.25g,蒸馏水定容至1升;调节ph=7.0,121℃高压灭菌20分钟;
31.f3:分别在28℃、160转/分钟的条件下恒温振荡培养144小时,分别得到氨氧化细菌发酵液和亚硝酸氧化细菌发酵液,将二者混合后得到硝化细菌发酵液总菌数≥8logcfu/g。
32.第二方面,本发明提供一种微生物水质调节剂的制备方法,按比例将乳酸菌、小球藻和酵母菌混合得到肥水期益生菌剂;按比例将乳酸菌、沼泽红假单胞菌、酵母菌和枯草芽孢杆菌混合得到生长期益生菌剂;按比例将乳酸菌、乳酸菌、枯草芽孢杆菌和硝化细菌混合得到养殖后期益生菌剂。
33.第三方面,本发明提供一种微生物水质调节剂的应用方法,在水产养殖过程中,养殖前期使用肥水期益生菌剂,养殖中期使用生长期益生菌剂,养殖后期使用养殖后期益生菌剂。
34.进一步的,肥水期益生菌剂、生长期益生菌剂以及养殖后期益生菌剂在使用前先加入含有质量百分比0.2%~2%食盐和2%~10%红糖的水中活化2~6小时。
35.优选的,肥水期益生菌剂、生长期益生菌剂以及养殖后期益生菌剂在使用前先加入含有质量百分比为1%食盐和4%红糖的水中活化4小时。
36.本发明的有益效果为:
37.(一)本发明微生物水质调剂综合使用多种益生菌(藻),并对乳酸菌、沼泽红假单胞菌、小球藻、酵母菌、枯草芽孢杆菌和硝化细菌的培养基和生长条件进行改进,制定了不同的培养增殖方案,可以使每类微生物都得较高浓度后投入使用,提高了效价,保证质量和
效益。
38.(二)本发明的微生物水质调剂包括三种益生菌剂,通过调整益生菌剂不同的种类,使其分别适用于水产养殖的前期、中期以及后期。在不同的水产养殖时期,投入相应的益生菌剂,分别保证不同养殖时期的水体需求,给予水产动物高质量生存环境,提升产品质量。同时作用于相同水产养殖时期的不同种类的益生菌之间相互协同作用,调节养殖水体水质,在养殖水体建立良好的生态体系,提高水产动物成活率,增加水产养殖效益。
具体实施方式
39.为使本发明的目的、技术方案和优点更加清楚,下面将结合本发明实施例,对本发明的技术方案作进一步清楚、完整地描述。需要说明的是,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
40.实施例1
41.一种微生物水质调节剂,包括肥水期益生菌剂、生长期益生菌剂和养殖后期益生菌剂;所述肥水期益生菌剂按质量百分比计包括30%乳酸菌、40%小球藻和30%酵母菌;所述生长期益生菌剂按质量百分比计包括20%乳酸菌、20%沼泽红假单胞菌、30%酵母菌和30%枯草芽孢杆菌;所述养殖后期益生菌剂按质量百分比计包括20%乳酸菌、30%沼泽红假单胞菌、30%枯草芽孢杆菌和20%硝化细菌。
42.所述乳酸菌由按质量百分比计的60%乳酸菌发酵液、20%贝壳粉和20%冻干保护剂组成;所述沼泽红假单胞菌由按质量百分比计的60%沼泽红假单胞菌发酵液、20%贝壳粉和20%冻干保护剂组成;所述小球藻由按质量百分比计的60%小球藻发酵液、20%贝壳粉和20%冻干保护剂组成;所述酵母菌由按质量百分比计的60%酵母菌发酵液、20%贝壳粉和20%冻干保护剂组成;所述枯草芽孢杆菌由按质量百分比计的60%枯草芽孢杆菌发酵液、20%贝壳粉和20%冻干保护剂组成;所述硝化细菌由按质量百分比计的60%硝化细菌发酵液、20%贝壳粉和20%冻干保护剂组成。
43.所述冻干保护剂由按质量百分比计的75%脱脂奶粉、5%乳糖和20%甘油。
44.其中,所述乳酸菌发酵液的制备方法为:
45.a1:将发酵乳杆菌、植物乳杆菌、干酪乳杆菌和屎链球菌,28~30℃下,先在斜面固体培养基中培养36小时得到一级纯培养物,然后接种到500ml三角瓶液体培养基中进行24小时液体振荡培养得到二级纯培养物,最后接种到1.8l机械搅拌发酵罐培养24小时,得到乳酸菌发酵液,其菌数≥7logcfu/g;其中液体培养基为麦芽汁培养基,固体培养基为麦芽汁培养基加琼脂。
46.其中,所述沼泽红假单胞菌发酵液的培养方法为:
47.b1:配置培养基:称取乙酸钠3.5g,氯化氨1.0g,磷酸二氢钾1.2g,磷酸氢二钾0.4g,氯化镁0.1g,氯化钙0.1克,酵母提取物0.4g,蛋白胨0.8g,用蒸馏水定容至1升;调节ph=7.0,121℃高压灭菌20分钟;
48.b2:将沼泽红假单胞菌在装有制备好培养基的试管中光照28~30℃下培养96~144小时得到一级纯培养物,然后置于500ml三角瓶中恒温振荡培养60~72小时得到二级纯培养物,最后接种到1.8l塑料瓶中28~30℃下光照静止培养,得到沼泽红假单胞菌发酵液,
其菌数≥7logcfu/g。
49.其中,所述小球藻发酵液的培养方法为:
50.c1:配置培养基:称取硝酸钠0.16g,磷酸二氢钾0.02g,硫酸镁0.05g,尿素0.04g,氯化钙0.02g,碳酸氢钠0.02g,氯化钠1.00g,柠檬酸三铁4.00mg,五水硫酸铜0.08mg,硼酸2.86mg,四水氯化锰1.81mg,二水钼酸钠0.21mg;用海水定容至1升;调节ph=7.0,121℃高压灭菌20分钟;
51.c2:将小球藻在装有培养基的试管中光照23~24℃培养96~144小时得到一级纯培养物,然后500ml三角瓶中恒温振荡培养60~72小时得到二级纯培养物,之后接种到1.8l塑料瓶,23~24℃光照静止培养,得到小球藻发酵液,其藻数≥7logcfu/g。
52.其中,所述酵母菌发酵液的培养方法为:
53.d1:配置液体培养基:称取酵母提取物5g,蛋白胨10g,葡萄糖20g,用蒸馏水定容1l,调节ph=6.4,118℃下高压灭菌20分钟;配制固体培养基:在液体培养基的基础上添加10g琼脂;
54.d2:将酿酒酵母和产朊假丝酵母在28~30℃下斜面固体培养得到一级纯培养物,然后接种到装有液体培养基的500ml三角瓶中恒温振荡培养得到二级纯培养物,最后接种到1.8l机械搅拌发酵罐培养24小时,得到酵母菌发酵液,其菌数≥8logcfu/g。
55.其中,所述枯草芽孢杆菌发酵液的培养方法为:
56.e1:配置培养基:称取蛋白胨10.0g、酵母提取物5.0g、氯化钠10.0g、葡萄糖10.0g,用蒸馏水定容至1升,调节ph=7.0,118℃湿热高压灭菌18分钟;配制固体培养基:在液体培养基的基础上添加10g琼脂;
57.e2:将枯草芽孢杆菌在28~30℃下斜面固体培养得到一级纯培养物,然后接种到装有液体培养基的500ml三角瓶中恒温振荡培养得到二级纯培养物,最后接种到1.8l机械搅拌发酵罐培养24小时,得到枯草芽孢杆菌发酵液,其菌数≥8logcfu/g。
58.其中,所述硝化细菌发酵液的培养方法为:
59.f1:配置氨氧化细菌培养基:称取硫酸铵0.5g,氯化钠0.3g,硫酸亚铁0.03g,磷酸氢二钾1.0g,硫酸镁0.05g,氯化钙7.5g,蒸馏水定容至1升;调节ph=7.0,121℃高压灭菌20分钟;
60.f2:配置亚硝酸氧化细菌培养基:称取亚硝酸钠1.0g,硫酸镁0.03g,硫酸锰0.01g,磷酸氢二钾0.75g,碳酸钠1.0g,磷酸氢二钠0.25g,,蒸馏水定容至1升;调节ph=7.0,121℃高压灭菌20分钟;
61.f3:分别在28℃、160转/分钟的条件下恒温振荡培养144小时,分别得到氨氧化细菌发酵液和亚硝酸氧化细菌发酵液,将二者混合后得到硝化细菌发酵液总菌数≥8logcfu/g。
62.实施例2
63.一种微生物水质调节剂,包括肥水期益生菌剂、生长期益生菌剂和养殖后期益生菌剂;所述肥水期益生菌剂按质量百分比计包括20%乳酸菌、40%小球藻和40%酵母菌;所述生长期益生菌剂按质量百分比计包括30%乳酸菌、10%沼泽红假单胞菌、25%酵母菌和35%枯草芽孢杆菌;所述养殖后期益生菌剂按质量百分比计包括20%乳酸菌、26%沼泽红假单胞菌、31%枯草芽孢杆菌和23%硝化细菌。
64.其中乳酸菌、小球藻、酵母菌、沼泽红假单胞菌、枯草芽孢杆菌、硝化细菌的制备方法同实施例1。
65.实施例3
66.一种微生物水质调节剂,包括肥水期益生菌剂、生长期益生菌剂和养殖后期益生菌剂;所述肥水期益生菌剂按质量百分比计包括18%乳酸菌、46%小球藻和36%酵母菌;所述生长期益生菌剂按质量百分比计包括28%乳酸菌、12%沼泽红假单胞菌、24%酵母菌和36%枯草芽孢杆菌;所述养殖后期益生菌剂按质量百分比计包括21%乳酸菌、25%沼泽红假单胞菌、32%枯草芽孢杆菌和22%硝化细菌。
67.其中乳酸菌、小球藻、酵母菌、沼泽红假单胞菌、枯草芽孢杆菌、硝化细菌的制备方法同实施例1。
68.对比例1
69.一种市购的水产养殖用微生态制剂(其成份主要为枯草芽孢杆菌、地衣芽孢杆菌)。
70.对比例2
71.一种微生物水质调节剂,包括肥水期益生菌剂、生长期益生菌剂和养殖后期益生菌剂;所述肥水期益生菌剂按质量百分比计包括35%乳酸菌和65%酵母菌;所述生长期益生菌剂按质量百分比计包括28%乳酸菌、12%沼泽红假单胞菌、24%酵母菌和36%枯草芽孢杆菌;所述养殖后期益生菌剂按质量百分比计包括30%乳酸菌、30%沼泽红假单胞菌和40%枯草芽孢杆菌。
72.其中乳酸菌、酵母菌、沼泽红假单胞菌、枯草芽孢杆菌的制备方法同实施例1。
73.对比例3
74.一种微生物水质调节剂,包括肥水期益生菌剂、生长期益生菌剂和养殖后期益生菌剂;所述肥水期益生菌剂按质量百分比计包括30%乳酸菌、10%沼泽红假单胞菌、25%酵母菌和35%枯草芽孢杆菌;所述生长期益生菌剂按质量百分比计包括20%乳酸菌、40%小球藻和40%酵母菌;所述养殖后期益生菌剂按质量百分比计包括20%乳酸菌、26%沼泽红假单胞菌、31%枯草芽孢杆菌和23%硝化细菌。
75.其中乳酸菌、酵母菌、沼泽红假单胞菌、枯草芽孢杆菌、小球藻、硝化细菌的制备方法同实施例1。
76.对比例4
77.一种微生物水质调节剂,包括肥水期益生菌剂、生长期益生菌剂和养殖后期益生菌剂;所述肥水期益生菌剂按质量百分比计包括21%乳酸菌、25%沼泽红假单胞菌、32%枯草芽孢杆菌和22%硝化细菌;所述生长期益生菌剂按质量百分比计包括18%乳酸菌、46%小球藻和36%酵母菌;所述养殖后期益生菌剂按质量百分比计包括28%乳酸菌、12%沼泽红假单胞菌、24%酵母菌和36%枯草芽孢杆菌。
78.其中乳酸菌、酵母菌、沼泽红假单胞菌、枯草芽孢杆菌、小球藻、硝化细菌的制备方法同实施例1。
79.检测数据
80.选择43个2亩池塘,分为7组养殖对比试验组,每组养殖试验设置6个平行试验,并设置一组空白对照组,空白对照组即全程不投入微生物水质调节剂。7组养殖对比试验组在
养殖过程中分别添加实施例1~3和对比例1~4的微生物水质调节剂,其中肥水期益生菌剂、生长期益生菌剂和养殖后期益生菌剂分别在养殖的前期、中期以及后期投入,对比例1为市购产品,其未对养殖时期进行区别,故在养殖全程投入相同的对比例1的微生物水质调节剂即可。
81.养殖方法:每个池塘使用相同的水源,池塘中水量相同,分别在4月养殖6万尾的虾苗,7月收虾。每天在9:30和18:00投放微生物水质调节剂,养殖前期每天投喂总量在6-8%,养殖中期和养殖后期每天投喂总量在3-4%。养殖过程中各个实施例和对比例的微生物水质调节剂的投入方式、投入时间以及投入量均相同。
82.本发明中养殖前期、养殖中期和养殖后期按照虾的个头量化进行划分。其中养殖前期为从虾苗育苗起至虾生长至1000头~1300头/每斤;养殖中期为养殖前期至虾生长至150头~180头每斤;养殖后期为养殖中期至养殖结束。对于其他水产种类的养殖过程,养殖前期、中期和后期可按照该领域常规的区分方法进行划分。
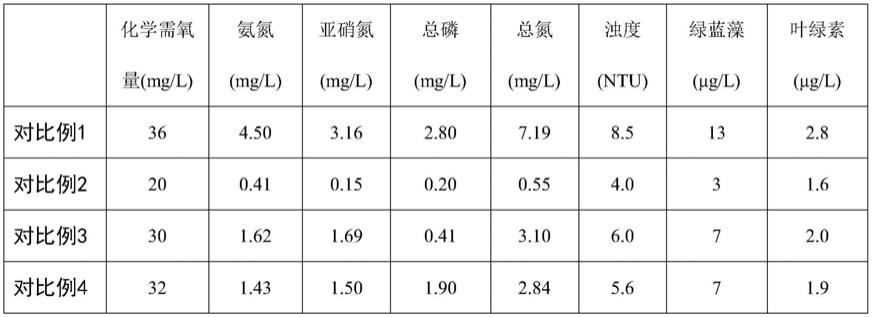
83.分别对池塘水质和透明度进行测试,测试结果如表1~表4所示。表1为在养殖中期时,相对于原水体水质指标变化的数据;表2为在养殖后期时,相对于原水体水质指标变化的数据;表3为养殖前期水体的透明度检测数据;表4为养殖后期养殖水体透明度检测数据。表1~表2中为每组养殖试验的6个平行试验的平均值。
84.表1
[0085][0086][0087]
表2
[0088][0089]
表3
[0090][0091]
表4
[0092][0093]
待7月收虾后,称重1斤有多少只虾,然后得到一只对虾的平均重量,再称重总虾重,总虾重除以对虾的平均重量计算出存活虾总尾数:
[0094]
成活率(%)=(存活虾总尾数/初始尾数)
×
100%。
[0095]
疾病发生率(%)=发病面积/测报面积。
[0096]
不同养殖试验组的存活率和疾病发生率如表5所示。
[0097]
表5
[0098][0099]
由表1和表2可知,无论是养殖中期水质变化还是养殖后期水质变化,相对于对比例,本发明实施例的微生物水质调节剂在不同养殖时期,投入不同的益生菌剂后,可以保持水质稳定,利于水产动物肠道微生态良好,抑制水体内病原微生物的繁殖。由表3和表4可知,养殖前期将肥水期益生菌剂加入水体后,水质肥嫩,对虾幼体生长快,在养殖前期,实施例1~3的透明度均比对比例要低,说明添加本发明实施例的微生物水质调节剂后,水体内的生物量较高,给水生动物食用的饵料多,利于对虾的生长。而在养殖后期,对比例的透明度显著偏低,化学指标也会相应偏高,这说明水体内病原菌及蓝绿藻在繁殖,极易影响水生
动物健康。而使用实施例1~3微生物水质调节剂后,养殖后期的水体透明较高。由此可见,本发明实施例提供的微生物水质调节剂,可以有效解决水产养殖的污染问题。由表5可知,使用本发明实施例1~3的微生物水质调节剂的对虾增重明显,饲料转化率高,比对比例对虾产量相对提高10%以上。
[0100]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
