一种n
1-硼代1,2,3-三氮唑化合物及其制备方法
技术领域
1.本发明涉及一种n
1-硼代1,2,3-三氮唑化合物及其制备方法,属于有机合成化学领域。
背景技术:
2.1,2,3-三氮唑化合物是一类重要的含氮杂环化合物
1.,并作为核心结构普遍存在于材料分子和药物分子中,例如抗生素他唑巴坦和头孢曲嗪,抗惊厥药卢非酰胺等
2.。而且,1,2,3-三氮唑化合物还被作为导向基
3.和重要的的合成前体
4.应用在有机合成中。
3.有机硼化物广泛的应用于有机合成、药物化学和材料科学中
[5-7]
。有机硼化物不仅做为合成前体用于各种官能团的转化
[8]
,有机化合物中引入硼原子还能够与生物体内的某些酶活性位点结合形成配位键,提供更强的亲和力从而改善生物活性
[9]
。然而关于n-硼代1,2,3-三氮唑化合物的合成方法只有一例报道
[10]
:运用氮杂环卡宾-硼烷nhc-bh3与碘反应生成nhc-bi,随后运用叠氮化钠进行亲核取代反应得到氮杂环卡宾硼叠氮化物nhc-bn3。所得到的nhc-bn3与炔烃在c6d6中,80℃反应,或者在甲苯中110℃反应,制得硼取代的1,2,3-三氮唑类化合物。然而这种方法存在一定的局限性:(1)需要多步反应来进行;(2)反应条件相对苛刻,有的底物需要在甲苯中加热到110℃反应;有些底物需要在三氟甲苯溶剂中,微波条件下,加热到180℃反应;(3)需要用到昂贵的试剂氘代苯,不利于大规模的反应。(4)反应需要的时间长,有一些底物反应时间长达七天。
[0004][0005]
参考文献:
[0006]
[1]p.thirumurugan,chem.rev.2013,113,4905-4979.
[0007]
[2]m.timmers,et al.j.psychopharmacol.2018,32,1341-1350.
[0008]
[3]x.ye,et al.chem.sci.,2013,4,3712-3716.
[0009]
[4]y.yang,et al.org.lett.2017,19,3982-3985.
[0010]
[5]r.smoum,chem.rev.2012,112,4156-4220.
[0011]
[6]g.f.s.fernandes,et al.eur.j.med.chem.2019,179,791-804.
[0012]
[7]z.huang,et al.angew.chem.,int.ed.2020,59,8800-8816.
[0013]
[8]l.xu,et al.chem.soc.rev.2015,44,8848-8858.
[0014]
[9]s.j.baker,et al.chem.soc.rev.2011,40,4279-4285.
[0015]
[10]e.merling,et al.org.lett.2012,14,2690-2693.
技术实现要素:
[0016]
本发明目的是提供一种n
1-硼代1,2,3-三氮唑化合物及其制备方法。该方法具有底物普适性好、原子经济性高、步骤简单、条件温和、反应时间短、原料易得等优点。由于1,2,3-三氮唑化合物是一类重要的生物活性分子,药物分子以及合成中间体,且将硼原子引进分子中,能够与生物体内的某些酶活性位点结合形成配位键,提供更强的亲和力从而改善生物活性,在药物合成领域有着非常广泛的应用。
[0017]
为了实现上述目的,本发明采用如下技术方案:
[0018]
一种n
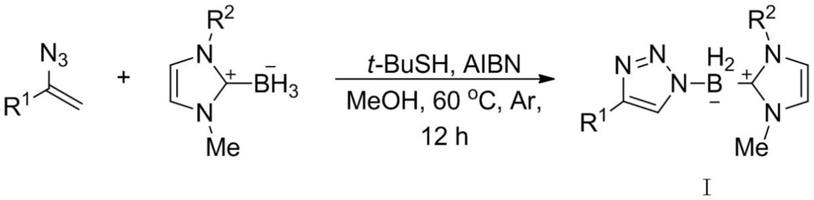
1-硼代1,2,3-三氮唑化合物,其结构式如式i所示:
[0019][0020]
式中,所述的烯基叠氮化合物选自r1为芳基:苯基、4-氟苯基、4-氯苯基、4-溴苯基、4-甲基苯基、4-甲氧基苯基、4-叔丁基苯基、联苯基、3-氯苯基、3-溴苯基、2-氯苯基;3-噻吩基、2-苯并呋喃基;r1为烷基:环己基、正己基、苯氧甲基、3-苯基丙基;所述的氮杂环卡宾-硼烷r2选自甲基、异丙基、正丁基、苄基。
[0021]
一种n
1-硼代1,2,3-三氮唑化合物的制备方法,包括如下步骤:
[0022]
(a)将上述烯基叠氮化合物、meoh、氮杂环卡宾-硼烷、aibn及t-bush依次加入到25ml的schlenk瓶中,对反应管抽真空并填充氩气重复三次操作。然后再加入溶剂并置于油浴中反应,反应温度控制在60℃,反应时间控制在12小时,所述的烯基叠氮化合物与氮杂环卡宾-硼烷的摩尔比为2:1、所述aibn与氮杂环卡宾-硼烷的摩尔比为1.2:1、所述的t-bush与氮杂环卡宾-硼烷的摩尔比为1:1、所述meoh加入量为氮杂环卡宾-硼烷的150倍;
[0023]
(b)反应结束后,真空下浓缩;
[0024]
(c)使用石油醚/乙酸乙酯洗脱,经硅胶柱分离制得系列n
1-硼代1,2,3-三氮唑化合物;反应式如下:
[0025][0026]
其中,反应式中的r1和r2和式i的r1和r2保持一致。
[0027]
采用上述技术方案的有益效果是:
[0028]
本发明是以烯基叠氮化合物和氮杂环卡宾-硼烷为原料,在aibn及t-bush的存在下,在meoh中加热反应,合成一系列n
1-硼代1,2,3-三氮唑化合物。因为目前仍然缺乏合成硼代1,2,3-三氮唑化合物的高效的方法,本发明主要提供了一种原子经济性好、步骤经济性高的n
1-硼代1,2,3-三氮唑化合物的合成方法,该方法具有底物普适性好、原子经济性
高、步骤简单、条件温和、原料易得、环境友好等优点。由于1,2,3-三氮唑化合物是一类重要的骨架结构,且将硼原子引入至有机分子中,在药物化学领域有着广泛的用途,具有较大的实用价值和社会经济效益。
附图说明
[0029]
图1为化合物1a的1h-nmr。
[0030]
图2为化合物1a的
13
c-nmr。
[0031]
图3为化合物1b的1h-nmr。
[0032]
图4为化合物1b的
13
c-nmr。
[0033]
图5为化合物1c的1h-nmr。
[0034]
图6为化合物1c的
13
c-nmr。
[0035]
图7为化合物1d的1h-nmr。
[0036]
图8为化合物1d的
13
c-nmr。
[0037]
图9为化合物1e的1h-nmr。
[0038]
图10为化合物1e的
13
c-nmr。
[0039]
图11为化合物1f的1h-nmr。
[0040]
图12为化合物1f的
13
c-nmr。
[0041]
图13为化合物1g的1h-nmr。
[0042]
图14为化合物1g的
13
c-nmr。
[0043]
图15为化合物1h的1h-nmr。
[0044]
图16为化合物1h的
13
c-nmr。
[0045]
图17为化合物1i的1h-nmr。
[0046]
图18为化合物1i的
13
c-nmr。
[0047]
图19为化合物1j的1h-nmr。
[0048]
图20为化合物1j的
13
c-nmr。
[0049]
图21为化合物1k的1h-nmr。
[0050]
图22为化合物1k的
13
c-nmr。
具体实施方式
[0051]
下面结合实施例对本发明作进一步说明:
[0052]
实施例1:(1,3-二甲基-1h-咪唑-2-基)(4-苯基-1h-1,2,3-三唑-1-基)二氢硼酸酯(1a)的合成
[0053][0054]
(1-叠氮乙烯基)苯(145.1mg,1.0mmol),(1,3-二甲基-1h-咪唑-2-基)三氢硼酸酯(55.0mg,0.5mmol),aibn(98.5mg,0.6mmol),t-bush(45.0mg,0.5mmol)和meoh(3ml)置于一
268.1730。
[0061]
实施例4:(4-(4-溴苯基)-1h-1,2,3-三唑-1-基)(1,3-二甲基-1h-咪唑-2-基)二氢硼酸酯(1d)的合成
[0062][0063]
1-(1-叠氮乙烯基)-4-溴苯(223.0mg,1.0mmol),(1,3-二甲基-1h-咪唑-2-基)三氢硼酸酯(55.0mg,0.5mmol),aibn(98.5mg,0.6mmol),t-bush(45.0mg,0.5mmol)和meoh(3ml)置于一个具有磁力搅拌子的schlenk管。对反应管抽真空并填充氩气重复三次操作。所得到的反应混合物在60℃下搅拌12小时。所得到的的混合物真空下浓缩。所得的粗产品经硅胶柱纯化,乙酸乙酯和石油醚作为洗脱液,得到(4-(4-溴苯基)-1h-1,2,3-三唑-1-基)(1,3-二甲基-1h-咪唑-2-基)二氢硼酸酯,白色固体(86.1mg,收率为52%)。1h nmr(400mhz,cdcl3)δ7.78(s,1h),7.70(d,j=8.6hz,2h),7.49(d,j=8.6hz,2h),6.91(s,2h),3.80(s,6h);
13
c nmr(101mhz,cdcl3)δ145.3,131.7,131.3,127.0,125.2,121.2,120.6,36.3.hrms(esi/[m+h]
+
)calcd for c
13h16
bbrn
5+
:332.0677,found 332.0679。
[0064]
实施例5:(1,3-二甲基-1h-咪唑-2-基)(4-(噻吩-3-基)-1h-1,2,3-三唑-1-基)二氢硼酸酯(1e)的合成
[0065][0066]
3-(1-叠氮乙烯基)噻吩(151.0mg,1.0mmol),(1,3-二甲基-1h-咪唑-2-基)三氢硼酸酯(55.0mg,0.5mmol),aibn(98.5mg,0.6mmol),t-bush(45.0mg,0.5mmol)和meoh(3ml)置于一个具有磁力搅拌子的schlenk管。对反应管抽真空并填充氩气重复三次操作。所得到的反应混合物在60℃下搅拌12小时。所得到的的混合物真空下浓缩。所得的粗产品经硅胶柱纯化,乙酸乙酯和石油醚作为洗脱液,得到(1,3-二甲基-1h-咪唑-2-基)(4-(噻吩-3-基)-1h-1,2,3-三唑-1-基)二氢硼酸酯,白色固体(73.8mg,收率为57%)。1h nmr(400mhz,cdcl3)δ7.68(s,1h),7.58(d,j=2.9hz,1h),7.45(d,j=5.0hz,1h),7.32(dd,j=5.0,3.0hz,1h),6.89(s,2h),3.77(s,6h);
13
c nmr(101mhz,cdcl3)δ142.5,133.5,126.1,125.6,125.0,121.2,119.3,36.2.hrms(esi/[m+h]
+
)calcd for c
11h15
bn5s
+
:260.1136,found 260.1140。
[0067]
实施例6:(4-(苯并呋喃-2-基)-1h-1,2,3-三唑-1-基)(1,3-二甲基-1h-咪唑-2-基)二氢硼酸酯(1f)的合成
[0068][0069]
2-(1-叠氮乙烯基)苯并呋喃(185.1mg,1.0mmol),(1,3-二甲基-1h-咪唑-2-基)三氢硼酸酯(55.0mg,0.5mmol),aibn(98.5mg,0.6mmol),t-bush(45.0mg,0.5mmol)和meoh(3ml)置于一个具有磁力搅拌子的schlenk管。对反应管抽真空并填充氩气重复三次操作。所得到的反应混合物在60℃下搅拌12小时。所得到的的混合物真空下浓缩。所得的粗产品经硅胶柱纯化,乙酸乙酯和石油醚作为洗脱液,得到(4-(苯并呋喃-2-基)-1h-1,2,3-三唑-1-基)(1,3-二甲基-1h-咪唑-2-基)二氢硼酸酯,无色液体(59.5mg,收率为41%)。1h nmr(400mhz,cdcl3)δ7.93(s,1h),7.57(d,j=6.9hz,1h),7.48(d,j=8.0hz,1h),7.58-7.19(m,2h),7.11(s,1h),6.93(s,2h),3.83(s,6h);
13
cnmr(101mhz,dmso)δ154.4,150.1,138.7,129.2,126.1,123.6,122.7,121.3,120.8,110.9,101.0,36.3.hrms(esi/[m+h]
+
)calcd for c
15h17
bn5o
+
:294.1521,found 294.1525。
[0070]
实施例7:(4-环己基-1h-1,2,3-三唑-1-基)(1,3-二甲基-1h-咪唑-2-基)二氢硼酸酯(1g)的合成
[0071][0072]
(1-叠氮乙烯基)环己烷(151.1mg,1.0mmol),(1,3-二甲基-1h-咪唑-2-基)三氢硼酸酯(55.0mg,0.5mmol),aibn(98.5mg,0.6mmol),t-bush(45.0mg,0.5mmol)和meoh(3ml)置于一个具有磁力搅拌子的schlenk管。对反应管抽真空并填充氩气重复三次操作。所得到的反应混合物在60℃下搅拌12小时。所得到的的混合物真空下浓缩。所得的粗产品经硅胶柱纯化,乙酸乙酯和石油醚作为洗脱液,得到(4-(苯并呋喃-2-基)-1h-1,2,3-三唑-1-基)(1,3-二甲基-1h-咪唑-2-基)二氢硼酸酯,无色液体(70.0mg,收率为54%)。1h nmr(500mhz,cdcl3)δ7.24(s,1h),6.88(s,2h),3.73(s,6h),2.71(ddt,j=11.2,7.1,3.6hz,1h),2.06
–
1.97(m,2h),1.76(dt,j=6.3,3.6hz,2h),1.71
–
1.64(m,1h),1.39-1.34(m,4h),1.30
–
1.15(m,1h);
13
cnmr(126mhz,cdcl3)δ152.3,124.6,121.2,36.2,35.3,33.5,26.4,26.3.hrms(esi/[m+h]
+
)calcd for c
13h23
bn
5+
:260.2041,found260.2050。
[0073]
实施例8:(1,3-二甲基-1h-咪唑-2-基)(4-(3-苯基丙基)-1h-1,2,3-三唑-1-基)二氢硼酸酯(1h)的合成
[0074]
[0075]
4-叠氮-4-烯-1-基)苯(187.1mg,1.0mmol),(1,3-二甲基-1h-咪唑-2-基)三氢硼酸酯(55.0mg,0.5mmol),aibn(98.5mg,0.6mmol),t-bush(45.0mg,0.5mmol)和meoh(3ml)置于一个具有磁力搅拌子的schlenk管。对反应管抽真空并填充氩气重复三次操作。所得到的反应混合物在60℃下搅拌12小时。所得到的的混合物真空下浓缩。所得的粗产品经硅胶柱纯化,乙酸乙酯和石油醚作为洗脱液,得到(1,3-二甲基-1h-咪唑-2-基)(4-(3-苯基丙基)-1h-1,2,3-三唑-1-基)二氢硼酸酯,无色液体(71.1mg,收率为51%)。1h nmr(400mhz,cdcl3)δ7.29-7.24(m,4h),7.20-7.14(m,3h),6.89(s,1h),3.75(s,6h),2.73(t,j=7.6hz,2h),2.67(d,j=7.6hz,2h),1.98(p,j=7.7hz,1h);
13
c nmr(101mhz,cdcl3)δ146.3,142.4,128.5,128.2,126.1,125.6,121.1,36.2,35.5,31.6,25.2.hrms(esi/[m+h]
+
)calcd for c
16h23
bn
5+
:296.2041,found 296.2044。
[0076]
实施例9:(1,3-二甲基-1h-咪唑-2-基)(4-(苯氧甲基)-1h-1,2,3-三唑-1-基)二氢硼酸酯(1i)的合成
[0077][0078]
((2-叠氮烯丙基)氧)苯(175.1mg,1.0mmol),(1,3-二甲基-1h-咪唑-2-基)三氢硼酸酯(55.0mg,0.5mmol),aibn(98.5mg,0.6mmol),t-bush(45.0mg,0.5mmol)和meoh(3ml)置于一个具有磁力搅拌子的schlenk管。对反应管抽真空并填充氩气重复三次操作。所得到的反应混合物在60℃下搅拌12小时。所得到的的混合物真空下浓缩。所得的粗产品经硅胶柱纯化,乙酸乙酯和石油醚作为洗脱液,得到(1,3-二甲基-1h-咪唑-2-基)(4-(苯氧甲基)-1h-1,2,3-三唑-1-基)二氢硼酸酯,无色液体(86.0mg,收率为61%)。1h nmr(400mhz,cdcl3)δ7.58(s,1h),7.24(t,j=7.8hz,2h),6.98(d,j=8.2hz,2h),6.90(t,j=7.4hz,2h),6.87(s,1h),5.17(s,2h),3.72(s,6h);
13
c nmr(101mhz,cdcl3)δ158.6,142.4,129.3,128.0,121.2,120.7,114.9,62.3,36.2.hrms(esi/[m+h]
+
)calcd for c
14h19
bn5o
+
:284.1677,found284.1683。
[0079]
实施例10:(3-异丙基-1-甲基-1h-咪唑-2-基)(4-苯基-1h-1,2,3-三唑-1-基)二氢硼酸酯(1j)的合成
[0080][0081]
(1-叠氮乙烯基)苯(145.1mg,1.0mmol),(1,3-二甲基-1h-咪唑-2-基)三氢硼酸酯(69.1mg,0.5mmol),aibn(98.5mg,0.6mmol),t-bush(45.0mg,0.5mmol)和meoh(3ml)置于一个具有磁力搅拌子的schlenk管。对反应管抽真空并填充氩气重复三次操作。所得到的反应混合物在60℃下搅拌12小时。所得到的的混合物真空下浓缩。所得的粗产品经硅胶柱纯化,乙酸乙酯和石油醚作为洗脱液,得到(3-异丙基-1-甲基-1h-咪唑-2-基)(4-苯基-1h-1,2,3-三唑-1-基)二氢硼酸酯,无色液体(89.9mg,收率为64%)。1h nmr(400mhz,cdcl3)δ7.84
–
7.80(m,2h),7.77(s,1h),7.35(t,j=7.7hz,2h),7.22(t,j=7.5hz,1h),7.00(d,j=2.0hz,1h),6.91(d,j=1.9hz,1h),5.16(p,j=6.8hz,1h),3.79(s,3h),1.36(d,j=6.7hz,6h);
13
c nmr(101mhz,cdcl3)δ146.3,132.4,128.5,126.8,125.4,124.9,121.8,115.7,50.4,36.1,23.1.hrms(esi/[m+h]
+
)calcd for c
15h21
bn
5+
:282.1885,found 282.1894。
[0082]
实施例11:(1-苄基-3-甲基-1h-咪唑-2-基)三氢硼酸酯(1k)的合成
[0083]
(1-叠氮乙烯基)苯(145.1mg,1.0mmol),(1,3-二甲基-1h-咪唑-2-基)三氢硼酸酯(93.1mg,0.5mmol),aibn(98.5mg,0.6mmol),t-bush(45.0mg,0.5mmol)和meoh(3ml)置于一个具有磁力搅拌子的schlenk管。对反应管抽真空并填充氩气重复三次操作。所得到的反应混合物在60℃下搅拌12小时。所得到的的混合物真空下浓缩。所得的粗产品经硅胶柱纯化,乙酸乙酯和石油醚作为洗脱液,得到(1-苄基-3-甲基-1h-咪唑-2-基)三氢硼酸酯,无色液体(67.0mg,收率为41%)。1h nmr(400mhz,cdcl3)δ7.84
–
7.79(m,2h),7.71(s,1h),7.40
–
7.29(m,5h),7.26
–
7.21(m,1h),7.18(ddt,j=6.9,1.6,0.6hz,2h),6.91(d,j=2.0hz,1h),6.80(d,j=2.0hz,1h),5.41(s,2h),3.84(s,3h);
13
c nmr(101mhz,cdcl3)δ146.2,135.0,132.3,129.0,128.5,128.4,128.0,126.8,125.4,125.1,121.8,119.9,52.5,36.3.hrms(esi/[m+h]
+
)calcd for c
19h21
bn
5+
:330.1885,found 330.1893。
