1.本发明属于药物合成技术领域,具体涉及一类具有抗肿瘤转移的小分子化合物及其制备方法。
技术背景
2.肿瘤是当今世界危及人类健康的一种最常见、最严重的疾病,其发病率仅次于心血管疾病。恶性肿瘤除在原发部位浸润生长、累及相邻器官外,还可通过淋巴管、血管等方式扩散到身体其他部位,这个过程称为肿瘤转移。近年来,恶性肿瘤的患病率和病死率呈逐年上升的趋势,由于恶性肿瘤易发生转移,给临床用药、手术治疗等都带来极大困难,以致超过90%的恶性肿瘤患者死于肿瘤转移,给人类社会和家庭带来了沉重的经济负担和健康压力。另一方面,肿瘤转移的发生可以在原发肿瘤还很小的“早期”状态,越来越多的证据显示,在原发肿瘤尚处于微小的状态,已经可以发生肿瘤细胞的远处播散,因此,阻止肿瘤转移成为了恶性肿瘤治疗的关键点。
3.纵观抗肿瘤药物,未来抗肿瘤药物的研发方向应该是既保证对肿瘤的杀伤性,又能通过特异性靶向而降低对正常细胞的影响。按照这样的策略来研发新型抗肿瘤药物,对恶性肿瘤治疗技术的发展具有重要意义。
4.目前,人类虽然已经研发出众多杀伤肿瘤细胞的药物,fda已了批准超过200余款抗癌药物,主要以药物的细胞毒性作为抗肿瘤作用的基础和主要途径,但临床仍缺少确能达到高效低毒目标的药物,缺乏靶向性,导致其在杀伤肿瘤细胞的同时,也杀伤了正常细胞,毒副作用很大,其中能抑制肿瘤转移的更少,且不能有效抑制肿瘤细胞转移,纵观抗肿瘤药物,临床上,如药物的细胞毒性在化疗中发挥了重要的作用,虽然常见肿瘤原发病灶有所减轻,但出现多处转移灶,最终致病情恶化。因此,对于现代肿瘤治疗来说,开发一种能够抑制肿瘤细胞转移的化合物对抗肿瘤药物的发展具有十分重要的意义。
技术实现要素:
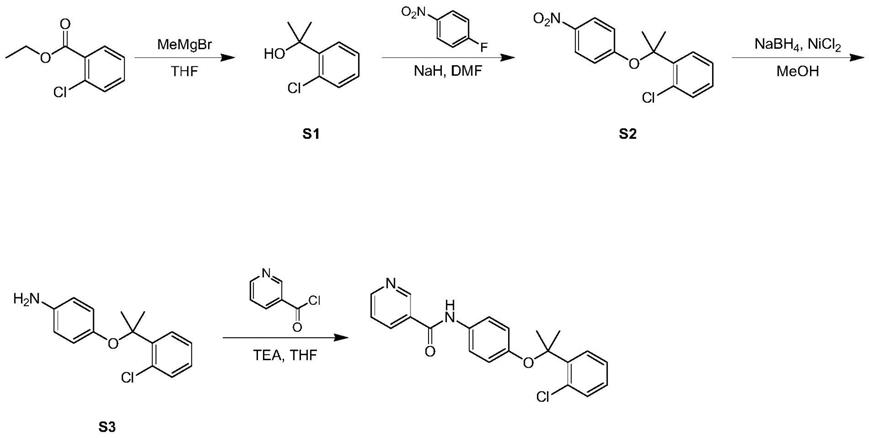
5.针对上述现有的技术问题,本发明提供了一类具有抗肿瘤转移的小分子化合物及其制备方法,该小分子化合物主要通过四步反应合成得到,首先采用2-氯苯甲酸乙酯与格式试剂发生亲核加成得到中间产物,然后与1-氟-4-硝基苯在碱性条件下反应,进一步发生还原胺反应,最后与烟酰氯盐酸盐缩合得到终产物;
6.所述具有抗肿瘤转移的小分子化合物的通式如式(i)所示;
[0007][0008]
式中r1为c
1~3
直链烷烃基、c
3~5
支链烷烃基、c
5~8
直链烷烃基、环丙基烷烃基、c
5~6
环烷基、1-萘基、苯基、联苯、苄基、甲氧基苯基、烯丙基、c
2~3
炔烃基或c
3~6
环烷烃基。
[0009]
所述的具有抗肿瘤转移的小分子化合物的制备方法,包括以下步骤:
[0010]
1)在-70℃下,将2-氯苯甲酸乙酯和格式试剂在干燥的有机溶剂进行混合,然后升至室温反应一段时间,用tlc薄层色谱监测反应终点,反应结束后,向反应体系中加入饱和氯化铵水溶液淬灭,经后处理得到化合物s1;
[0011]
2)在-10~0℃下,将化合物s1和nah溶解在干燥的有机溶剂中,将体系温度升至20~30℃反应一段时间,然后加入1-氟-4-硝基苯继续反应,用tlc薄层色谱监测反应终点,反应结束后,向反应体系中加入50ml 0.5m盐酸水溶液淬灭,经后处理得到化合物s2;
[0012]
3)将化合物s2和nicl溶解在干燥的有机溶剂中,在-10~0℃下将nabh4分批加入反应体系中,加完之后将反应体系升温至室温反应一段时间,用tlc薄层色谱监测反应终点,反应结束后,向反应体系中加入50ml 0.5m盐酸水溶液淬灭,经后处理得到化合物s3;
[0013]
4)将化合物s3和缚酸剂溶解在干燥的有机溶剂中,在0~5℃下将烟酰氯盐酸盐加入反应体系中,加完之后将反应体系升温至室温反应一段时间,用tlc薄层色谱监测反应终点,反应结束后,向反应体系中加入50ml 0.5m盐酸水溶液淬灭,经后处理得到化合物(i)。
[0014]
所述步骤1)中格式试剂为甲基溴化镁、乙基溴化镁、丙基溴化镁、异丙基溴化镁、环丙基溴化镁、环己基溴化镁、环戊基溴化镁、3-丁烯溴化镁、仲丁基溴化镁、戊基溴化镁、己基溴化镁、3-戊烷溴化镁、正庚基溴化镁、辛基溴化镁、1-萘基溴化镁、甲氧基苯基溴化镁、苯基溴化镁、联苯溴化镁、苄基溴化镁、烯丙基溴化镁、乙炔基溴化镁、1-丙炔溴化镁中的一种。
[0015]
所述步骤1)中2-氯苯甲酸乙酯与格式试剂的投料摩尔比为1:1~5;
[0016]
所述步骤2)中化合物s1、nah、1-氟-4-硝基苯的投料摩尔比为1:0.5~5:0.1~5;
[0017]
所述步骤3)中化合物s2、nicl、nabh4的投料摩尔比为1:0.5~3:2~6;
[0018]
所述步骤4)中缚酸剂选自二乙胺、三乙胺、n,n-二异丙基乙胺、吡啶、4-二甲氨基吡啶、碳酸钾、碳酸钠、氢氧化钾、氢氧化钠、乙醇钠中的一种;
[0019]
所述步骤1)~4)中有机溶剂选自甲醇、二氯甲烷、乙腈、丙酮、n,n-二甲基甲酰胺、乙醚、四氢呋喃、二甲基四氢呋喃中的一种;
[0020]
所述的后处理步骤为:向淬灭后的反应体系中加入乙酸乙酯,充分摇匀,静置分层,水相进一步用乙酸乙酯萃取,合并有机相,加入无水硫酸钠干燥,过滤后,减压浓缩,经正相硅胶柱层析纯化,浓缩、干燥。
[0021]
与现有技术相比,本发明的有益效果如下:
[0022]
(1)本发明制备的小分子化合物可抑制乳腺癌细胞mda-mb-231从足底至腘窝淋巴
结转移,相比空白组乳腺癌细胞mda-mb-231高达78%的转移率,本发明的小分子化合物使得小鼠的mda-mb-231乳腺癌细胞转移率下降至50%,具有显著的抑制肿瘤细胞转移的作用;
[0023]
(2)本发明的小分子化合物浓度为100μm时,对胃癌细胞mgc803产生的细胞毒性高于乳腺癌细胞mda-mb-231,对肺癌细胞h1299的ic
10
、ic
20
、ic
30
、ic
50
分别为9.521μm、23.413μm、42.579μm、101.2μm,具有很好的抑制癌细胞生长效果;
[0024]
(3)本发明的小分子化合物工作液浓度为50μm时,24h内对乳腺癌细胞mda-mb-231和肺癌细胞h1299和胃癌细胞mgc803的迁移有显著的抑制效果;
[0025]
(4)本发明的小分子化合物工作液浓度为5~10μm时,对乳腺癌细胞mda-mb-231和肺癌细胞h1299具有强侵袭能力,活性成分工作液浓度为50μm时,对胃癌细胞mgc803产生较高的侵袭能力;
[0026]
(5)本发明提供的该类小分子化合物可作为抗肿瘤转移药物用于治疗乳腺癌、肺癌、胃癌等。
附图说明
[0027]
图1为本发明小分子化合物通式,式中r1为c
1~3
直链烷烃基、c
3~5
支链烷烃基、c
5~8
直链烷烃基、环丙基烷烃基、c
5~6
环烷基、1-萘基、苯基、联苯、苄基、甲氧基苯基、烯丙基、c
2~3
炔烃基或c
3~6
环烷烃基。
[0028]
图2为本发明实施例1制备的小分子化合物的1h nmr。
[0029]
图3为本发明实施例1制备的小分子化合物的液质图。
[0030]
图4为本发明实施例1制备的小分子化合物的高效液相色谱图。
[0031]
图5为本发明实施例1制备的小分子化合物对不同肿瘤细胞的生长作用。
[0032]
图6为空白组与实验组对乳腺癌细胞mda-mb-231从小鼠足底至腘窝淋巴结转移的影响。
[0033]
图7为空白组与实验组中乳腺癌细胞mda-mb-231从小鼠足底至腘窝淋巴结转移中检测荧光素酶信号的局部放大图。
[0034]
图8为空白组和实验样本中乳腺癌细胞mda-mb-231转移的小鼠数量对比柱状图。
[0035]
图9为对照组与实施例1制备的小分子化合物对乳腺癌细胞mda-mb-231划痕实验测定。
[0036]
图10为对照组与实施例1制备的小分子化合物对肺癌细胞h1299划痕实验测定。
[0037]
图11为对照组与实施例1制备的小分子化合物对胃癌细胞mgc803划痕实验测定。
[0038]
图12为对照组与实施例1制备的小分子化合物对乳腺癌细胞mda-mb-231体外侵袭的抑制影响。
[0039]
图13为对照组与实施例1制备的小分子化合物对肺癌细胞h1299体外侵袭的抑制影响。
[0040]
图14为对照组与实施例1制备的小分子化合物对胃癌细胞mgc803体外侵袭的抑制影响。
[0041]
图中,inhibition rate为抑制率,concentration为浓度,invaded cell perfiled为侵袭细胞,control和negative为阴性对照,positive为阳性对照。
具体实施方式
[0042]
本发明下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。实施例中所用到的各种常用化学试剂,均为市售产品。
[0043]
除非另有定义,本发明所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不用于限制本发明。
[0044]
本发明的术语“包括”和“具有”以及它们任何变形,意图在于覆盖不排他的包含。例如包含了一系列步骤的过程、方法、装置、产品或设备没有限定于已列出的步骤或模块,而是可选地还包括没有列出的步骤,或可选地还包括对于这些过程、方法、产品或设备固有的其它步骤。
[0045]
为使本发明的目的、技术方案和优点更加清楚明了,下面结合具体实施方式,对本发明进一步详细说明。应该理解,这些描述只是示例性的,而并非要限制本发明的范围。此外,在以下说明中,省略了对公知结构和技术的描述,以避免不必要地混淆本发明的概念。
[0046]
以下实施例对本发明做进一步的描述,但该实施例并非用于限制本发明的保护范围。
[0047]
实施例1小分子化合物的制备
[0048]
小分子合成反应路线如下:
[0049][0050]
具体制备步骤如下:
[0051]
1)将0.054mol 2-氯苯甲酸乙酯溶解在200ml干燥的四氢呋喃中,在-70℃的反应温度下,将0.135mol甲基溴化镁(3m,45ml)采用恒压滴液漏斗滴加入反应体系中,滴毕,缓慢升至室温反应12小时,用tlc薄层色谱监测反应终点,反应结束后,向反应体系中加入饱和氯化铵水溶液淬灭,充分摇匀,静置分层,水相进一步用乙酸乙酯萃取,合并有机相,加入无水硫酸钠干燥,过滤后,减压浓缩,经正相硅胶柱层析纯化,得到化合物s1,收率为70.3%,纯度为95.3%;
[0052]
2)将0.023mol化合物s1溶解在40ml干燥的n,n-二甲基甲酰胺中,在0℃的反应温度下,将0.035molnah分批加入反应体系中,加完之后将反应体系升温至20℃反应0.5小时,然后将0.026mol1-氟-4-硝基苯一次性加入反应体系中,并在室温下继续反应2小时,用tlc
薄层色谱监测反应终点,反应结束后,2)向反应体系中加入50ml 0.5m盐酸水溶液淬灭,然后加入50ml乙酸乙酯,充分摇匀,静置分层,水相进一步用乙酸乙酯萃取,合并有机相,加入无水硫酸钠干燥,过滤后,减压浓缩,经正相硅胶柱层析纯化,得到化合物s2,收率为76.0%,纯度为95.1%;
[0053]
3)将0.017mol化合物s2和0.034molnicl溶解在50ml干燥的甲醇中,在0℃的反应温度下,将0.069molnabh4分批加入反应体系中,加完之后将反应体系升温至25℃反应1小时,用tlc薄层色谱监测反应终点,反应结束后,向反应体系中加入50ml 0.5m盐酸水溶液淬灭,3)然后加入50ml乙酸乙酯,充分摇匀,静置分层,水相进一步用乙酸乙酯萃取,合并有机相,加入无水硫酸钠干燥,过滤后,减压浓缩,经正相硅胶柱层析纯化,得到化合物s3,纯度为96.8%,收率为58.8%;
[0054]
4)将0.005mol化合物s3和0.016mol三乙胺溶解在13ml干燥的四氢呋喃中,在0℃的反应温度下,将0.006mol烟酰氯盐酸盐加入反应体系中,加完之后将反应体系升温至25℃反应12小时,用tlc薄层色谱监测反应终点,反应结束后,向反应体系中加入50ml 0.5m盐酸水溶液淬灭,然后加入50ml乙酸乙酯,充分摇匀,静置分层,水相进一步用乙酸乙酯萃取,合并有机相,加入无水硫酸钠干燥,过滤后,减压浓缩,经正相硅胶柱层析纯化,得到目标化合物,纯度为97.2%,收率为18.7%。
[0055]
实施例2
[0056]
对实施例1得到的小分子化合物进行核磁鉴定,结果如图1所示,1h nmr(dmso-d6):10.29(s,1h).9.04(d,j=2.0hz,1h),8.74-8.73(m,1h),8.23(d,j=7.6hz,1h),7.60-7.59(m,1h),7.50-7.49(m,1h),7.49-7.47(m,2h),7.43-7.36(m,3h),6.66(d,j=8.4hz,2h),1.79(s,6h)。
[0057]
实施例3
[0058]
对实施例1得到的小分子化合物进行液质分析,结果如图2所示,保留时间为0.944min,lc-ms(esi)m/z=367.2[m+1]
+
。
[0059]
实施例4
[0060]
对实施例1得到的小分子化合物进行纯度分析,检测波长为254nm,通过高效液相分析结果如图3所示。
[0061]
实施例5mtt测定药物对细胞生长影响
[0062]
实验对象:乳腺癌细胞mda-mb-231、肺癌细胞h1299、胃癌细胞mgc803;
[0063]
实验药物:小分子化合物,溶剂dmso;
[0064]
实验方法:1)铺板:收集对数期细胞,调整细胞悬液浓度,每孔加入90ul,细胞密度为5000每孔;2)加药:5%co2,37℃培养箱孵育,至细胞单层铺满孔底(96孔平底板),加入浓度梯度的药物,48h后倒置显微镜下观察,每孔加入20ul mtt溶液(5mg/ml,即0.5%mtt),继续培养4h,终止培养,小心吸去孔内培养液,每孔加入100ul二甲基亚砜,置摇床上低速振荡10min,使结晶物充分溶解;3)在酶联免疫检测仪od490 nm处测量各孔的吸光值,根据式(1)计算细胞相对存活率,具体结果见附图4;
[0065]
本实验设不含细胞的培养基作为空白对照组,每孔加入和样品相同稀释比的dmso溶液作为实验对照组,含小分子化合物的样品实验组;
[0066][0067]
从附图4结果可以看出,小分子化合物在浓度为100μm时对乳腺癌细胞mda-mb-231、胃癌细胞mgc803显示出一定的毒性,对肺癌细胞h1299的ic
10
、ic
20
、ic
30
、ic
50
分别为9.521μm、23.413μm、42.579μm、101.2μm,因此表明对肺癌细胞h1299的抑制活性更好。
[0068]
实施例6抑制乳腺癌细胞mda-mb-231足底至腘窝淋巴结转移
[0069]
(1)裸鼠样本:雌性,balb/c裸鼠,3-4周龄,于spf饲养室饲养5天,同时做隔离观察;
[0070]
(2)细胞接种:取生长状态良好的处于对数生长期的乳腺癌细胞mda-mb-231,消化,计数,用1
×
pbs稀释成1
×
107个/ml(75%酒精消毒小鼠足垫),将30μl细胞悬浮,即3
×
105个细胞注射至裸鼠的左后足底;
[0071]
(3)细胞注射后第7天,小鼠按照体重随机分组;
[0072]
(4)药物配制:空白组(n control)为10%dmso-40%peg 400-5%吐温80-45%生理盐水;实验组(sample)为含有实施例1制备的化合物(30mg
·
kg-1
·
d-1
)的10%dmso-40%peg400-5%吐温80-45%生理盐水。
[0073]
(5)给药:每只小鼠连续21日进行腹腔注射,给药100μl;
[0074]
(6)转移监测:接种裸鼠28天后,吸入异氟烷麻醉,腹腔注射d-荧光素(钾盐)浓度15mg/ml,5ul/g,之后使用ivscope8500小动物活体成像系统检测荧光素酶信号,检测荧光素酶信号后,摘取左后腘窝淋巴结,同时摘取右后腘窝淋巴结作为对照;
[0075]
(7)称量原发肿瘤重量:分别截取裸鼠的左、右后肢,以左后肢的重量减去右后肢的重量作为原发肿瘤的重量;
[0076]
(8)保留小鼠淋巴结,原位肿瘤用于石蜡包埋。
[0077]
按上述的实验方案,得到的实验结果见表1和附图5~7;
[0078]
表1:空白组和实验样本中乳腺癌细胞mda-mb-231转移的小鼠数量
[0079][0080]
由附图5看出,经过荧光标记的乳腺癌细胞mda-mb-231在空白组小鼠样本中产生的转移数量较多,而在实验组中乳腺癌细胞mda-mb-231的转移数量较少,进一步通过附图6荧光素酶信号可清楚显示和进行对比。
[0081]
由表1和附图7数据显示,经21天给药后,空白组27只小鼠中,乳腺癌细胞mda-mb-231转移的小鼠数量为21只,仅有6只未产生mda-mb-231癌细胞转移,相比之下,实验组24只小鼠中,乳腺癌细胞mda-mb-231转移的小鼠数量为12只,12只未产生mda-mb-231癌细胞转移,因此,相比空白组mda-mb-231癌细胞转移率高达78%,本发明的小分子化合物使小鼠的mda-mb-231癌细胞转移率下降至50%,表明本发明的小分子化合物可抑制乳腺癌细胞mda-mb-231足底原位至腘窝淋巴结转移,具有显著的抑制肿瘤细胞转移的作用。
[0082]
实施例7细胞划痕实验测定药物对细胞迁移能力的影响
[0083]
实验对象:乳腺癌细胞mda-mb-231,肺癌细胞h1299,胃癌细胞mgc803;
[0084]
实验药物:小分子化合物,阴性对照试剂0.1%dmso;
[0085]
实验方法:用marker笔细头在6孔板背后,用直尺比着,均匀地划线,大约每隔0.5-1cm一道,横穿过孔,一般划三道线,依次命名为a、b、c线,b线横穿正中央,其他两条等间距划在两侧,6孔板种板前每种细胞用10μm小分子化合物预处理19h左右。六孔板种板,每孔2ml,mda-mb-231和h1299每孔加入1
×
106个细胞,mgc803每孔加入1.5
×
106个细胞,各设置2个复孔,培养约24h。细胞数量以过夜贴壁能铺满90%以上为宜,适当调整。打开孔板盖子,吸掉旧培养基,直尺垂直b线架在孔板上,用200ul枪头紧贴直尺均匀移动制造细胞划痕线,同样,在线两侧等间距再划两条平行线,从左至右分别命名为线1,线2和线3,用无菌1
×
pbs冲洗细胞3次,去除划下的细胞后,加入血清培养基,再加入小分子化合物(mda-mb-231和h1299工作浓度为50μm,mgc803工作浓度为25μm),放入37℃5%co2培养箱,分别按加药0h,24h取样拍照。
[0086]
从附图8~10可以看出,24h后,本发明小分子化合物对乳腺癌细胞mda-mb-231,肺癌细胞h1299,胃癌细胞mgc803的迁移均有显著的抑制作用。
[0087]
实施例8invasion侵袭实验测定药物对细胞侵袭能力的影响
[0088]
实验对象:乳腺癌细胞mda-mb-231,肺癌细胞h1299,胃癌细胞mgc803;
[0089]
实验药物:小分子化合物,阴性对照试剂dmso。
[0090]
实验方法:包被基底膜(4℃操作)用4℃的无血清细胞培养基dmem稀释matrigel(10mg/ml to 250μg/ml),使用时,取50μl matrigel加入1950μl的dmem至ep管即可,取100μl稀释胶缓慢滴加到24-well transwell上室中,在培养箱中培养1小时,制备细胞悬液;消化细胞,终止消化后离心弃去培养液,用pbs洗1遍,无血清培养基重悬,调整细胞密度至合适浓度(乳腺癌细胞mda-mb-231,肺癌细胞h1299和胃癌细胞mgc803的种板密度依次为1.5
×
105个/ml,1.75
×
105个/ml,2
×
105个/ml)。接种细胞:每种细胞各设置阴性对照组(加入和小分子化合物相同稀释比的dmso),给药组即小分子化合物(mda-mb-231和h1299工作浓度分别为5μm和10μm,mgc803工作浓度为50μm),每组各2个复孔,根据细胞密度取细胞悬液适量,加入适量体积10%bsa使其最终百分比为0.1%,再加入上述药物,最后用dmem补齐,使得每孔总体积为200μl,混匀后轻柔均匀地加入transwell上室,立刻在24孔板下室一般加入800μl含20%fbs的培养基,给药24h后收板。细胞染色:取出transwell小室,弃去孔中培养液,用用棉签轻轻擦掉上室未迁移的细胞,并放入干净的24孔板内。用1
×
pbs洗1遍,甲醇固定30分钟,吸净甲醇,将小室放通风橱风干。0.1%结晶紫染色20min,吸掉回收结晶紫,用pbs洗1遍。吸净pbs,通风橱晾干。结果统计:5x镜下观察,10x显微镜下随机五个视野观察细胞,拍照,记数并统计作图,结果见附图5~7;
[0091]
从图11~13可以看出,本发明制备的小分子化合物可能通过影响乳腺癌细胞mda-mb-231、肺癌细胞h1299、胃癌细胞mgc803侵袭能力来影响上述癌细胞的发生与发展。
[0092]
需要说明的是,本说明书中描述的具体特征、结构、材料或者特点可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例以及不同实施例的特征进行结合和组合。
[0093]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来
说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
