重组人sema4c蛋白、表达载体、宿主细胞以及应用
技术领域
1.本技术涉及sema4c基因技术领域,尤其涉及重组人sema4c蛋白、表达载体、宿主细胞以及应用。
背景技术:
2.semaphorins家族是一种分泌型或跨膜蛋白,早期作为神经系统中一种发挥轴突导向功能的因子被发现,大部分蛋白通过其受体plexins和neuropilins家族发挥相应的生物学效应,包括:发育、调节细胞运动、血管生成、免疫调节、肿瘤形成和干细胞特性。一些semaphorin家族成员参与了上皮细胞屏障的分离,与肿瘤的epithelial-mesenchymal transition(emt)有关,例如,sema3e通过激活pi3k/erk/mapk使snail在细胞核内积聚来诱导emt。例如,sema4c在调控神经轴突的定向生长和肌管发育方面有重要作用,在人类宫颈癌、子宫内膜癌、乳腺癌和前列腺癌中均表达,并与淋巴转移等恶性行为相关。sema4c在乳腺癌细胞过表达上调了转录因子snail、slμg和sox-2,在肌细胞的分化过程中sema4c是p38mapk信号通路的重要激活因子。研究表明sema4c在宫颈癌组织的过表达与恶性生物学行为有关,emt与宫颈癌的进展密切相关,seam4c成为宫颈癌侵袭转移的预测标记和治疗靶点。
3.因此在体外研究或人seam4c结构和功能尤为重要。现有技术中,对人seam4c蛋白的重组表达一般以原核宿主为主,但原核表达容易产生包涵体和无生物活性的可溶性蛋白。因此,需要寻找新型重组表达人seam4c蛋白的宿主或表达形式,以利用获得体外获得大量的人seam4c蛋白,以利于对该蛋白进行研究,为其作为抗肿瘤药物或诊断试剂提供帮助。
技术实现要素:
4.有鉴于此,本技术的目的在于解决上述技术问题之一。
5.第一方面,本技术实施例公开了用于重组表达sema4c蛋白的dna分子,其核苷酸序列如seq id no.1所示,所述dna分子具有sema4c蛋白编码基因的21-663aa、1-497aa、30-497aa和556-644aa结构域序列中的至少一种。
6.第二方面,本技术实施例公开了一种sema4c蛋白重组表达载体,所述表达载体以质粒为骨架构建,其中插入有融合基因,所述融合基因如seq id no.1所示,所述融合基因包含sema4c蛋白编码基因的21-663aa、1-497aa、30-497aa和556-644aa结构域序列中的至少一种。
7.在本技术实施例中,所述融合基因还包含位于所述结构域5'端的第一序列和位于3'端的第二序列,所述第一序列如seq id no.2或3所示,,所述第二序列为c-6his、n-rabbit fc或c-human fc-6his标签。
8.第三方面,本技术实施例公开了用于pcr扩增sema4c蛋白重组表达载体融合基因的引物组,其中,所述结构域包括sema4c蛋白编码基因的21-663aa、1-497aa、30-497aa和556-644aa结构域序列中的一种;所述引物组包括六对引物,所述六对引物的核苷酸序列如
seq id no.4~15所示。
9.第四方面,本技术实施例公开了一种携带第二方面所述的重组表达载体的重组大肠杆菌。
10.第五方面,本技术实施例公开了一种用于表达sema4c蛋白的重组表达载体的重组表达细胞,所述重组表达细胞为携带第二方面所述重组表达载体的hek 293f细胞。
11.第六方面,本技术实施例公开了一种利用第五方面所述的重组表达细胞表达的重组蛋白。
12.第七方面,本技术实施例公开了第一方面所述的dna分子、或第六方面所述的重组蛋白在制备或筛选宫颈癌、子宫内膜癌、乳腺癌和前列腺癌之一肿瘤治疗或诊断制剂中的用途。
13.与现有技术相比,本技术至少具有以下有益效果:
14.本技术中选取人sema4c基因21-633aa区域中的若干结构域,进行体外重组表达,亦能够产生人sema4c蛋白的部分功能,也为其抗肿瘤研究提供帮助。以真核细胞hek 293f为宿主细胞,将上述构建的6种重组质粒通过瞬时转染的方式获得稳定表达如sema4c蛋白编码基因的21-663aa、1-497aa、30-497aa和556-644aa结构域的目的蛋白。该方法具有转染周期短和快速获得目的蛋白的效果,能够应用于研发阶段的摸索和大规模高通量筛选蛋白。
附图说明
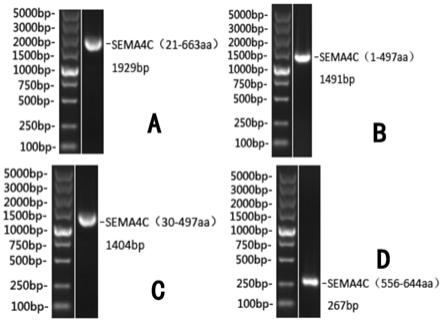
15.图1为本技术实施例提供的对四段目的片段pcr扩增的电泳检测结果图,a对应为21-663aa结构域的目的片段、b对应为1-497aa结构域的目的片段、c对应为30-497aa结构域的目的片段、d对应为556-644aa结构域的目的片段。
16.图2为本技术实施例提供的6种重组质粒转染细胞后的wb检测的蛋白电泳图(a-f);每一电泳图中的左方泳道为上清液样本,右方泳道为离心收集的具体细胞样本。
17.图3为本技术实施例提供的重组表达质粒5和重组表达质粒6转染细胞后的培养上清液纯化产物电泳结果图。
具体实施方式
18.为了使本技术的目的、技术方案及优点更加清楚明白,以下结合实施例对本技术进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本技术,并不用于限定本技术。
19.人sema4c蛋白是从人胎脑中克隆分离出的一个ⅳ型跨膜semaphorin家族新成员,其编码基因由13个外显子组成,染色体定位于2q11.2,该基因编码833个氨基酸,分子量约为92.6kd,为单次跨膜蛋白。人sema4c编码基因全长如seq id no.1所示,发明人发现,选取该基因21-633aa区域中的若干结构域,进行体外重组表达,亦能够产生人sema4c蛋白的部分功能,也为其抗肿瘤研究提供帮助。其具体实施过程如下:
20.一、重组质粒的构建
21.1、目的片段的扩增
22.分别以21-663aa、1-497aa、30-497aa和556-644aa结构域序列的dna片段为目的片
段,进行pcr扩增,扩增反应体系如表1所示,目的片段均由武汉金开瑞公司合成提供。
23.表1 50μl体系
24.gloria nova hs 2x hf master mix(abclonal,货号rk20715)25μlddh2o22μl模板1μl上/下游引物1+1μl
25.pcr反应程序为:98℃/5min
→
98℃/20s
→
60/30s
→
72℃/2kb/1min
→
72℃/10min
→
16℃/1h,其中,98℃/20s
→
60℃/30s
→
72℃/2kb/1min的步骤设置30个循环。结果如图1所示,其结果表明21-663aa、1-497aa、30-497aa和556-644aa结构域序列的dna片段扩增正确。
26.2、凝胶回收
27.pcr反应完成后,向pcr反应管中加入dna loading buffer,上样并进行琼脂糖凝胶电泳。在割胶仪的紫外灯下切取含有目的dna的凝胶,将胶切碎后置于2ml离心管中,凝胶回收目的dna片段。使用康为世纪琼脂糖凝胶dna回收试剂盒进行回收。
28.3、重组质粒的构建
29.本技术实施例选用了6种空载质粒,分别利用上述回收的目的片段与其对应的空载质粒进行同源重组,并且在其中插入了两种信号肽序列以及用于纯化的标签序列,以此构建了6种重组质粒。重组质粒的结果如表2所示。
30.表2 重组质粒的结构示意
[0031][0032]
表2中,采用上述pcr扩增得到的用于构建重组质粒的目的片段所使用的引物对分别与6个质粒相对应,对应为6对引物对,用于构建重组质粒1的目的片段扩增所用的引物对的核苷酸序列如seq id no.4~5所示,用于构建重组质粒2的目的片段扩增所用的引物对的核苷酸序列如seq id no.6~7所示,用于构建重组质粒3的目的片段扩增所用的引物对的核苷酸序列如seq id no.8~9所示,用于构建重组质粒4的目的片段扩增所用的引物对的核苷酸序列如seq id no.10~11所示,用于构建重组质粒5的目的片段扩增所用的引物对的核苷酸序列如seq id no.12~13所示,用于构建重组质粒6的目的片段扩增所用的引物对的核苷酸序列如seq id no.14~15所示。
[0033]
对于重组质粒1、2和5,其构建过程为:
[0034]
分别将含有目的片段的pcr产物分别与质粒1、质粒2和质粒5分别对应的酶切后的空载体质粒,用ecori/xhoi限制性内切酶进行双酶切空载体,37℃处理3h后用琼脂糖凝胶dna回收试剂盒进行回收,将纯化产物用1%琼脂糖凝胶电泳,回收目的片段和线性载体并测定浓度,并以如表4所示的反应体系进行同源重组,在pcr管中按上述体系配好并混合均匀后置于金属浴中50℃反应30min,即可得到重组的质粒。其中,双酶切反应体系如表3所示,同源重组反应体系如表4所示。
[0035]
对于重组质粒3的构建过程为:
[0036]
分别将含有目的片段的pcr产物和质粒3对应的酶切后的空载体质粒,用xhoi/xbai限制性内切酶进行双酶切空载体,37℃处理3h后用琼脂糖凝胶dna回收试剂盒进行回收,将纯化产物用1%琼脂糖凝胶电泳,回收目的片段和线性载体并测定浓度,并以如表4所示的反应体系进行同源重组,在pcr管中按上述体系配好并混合均匀后置于金属浴中50℃反应30min,即可得到重组的质粒。其中,双酶切反应体系如表3所示,同源重组反应体系如表4所示。
[0037]
对于重组质粒4和6的构建过程为:
[0038]
分别将含有目的片段的pcr产物和质粒4和质粒6,分别对应的酶切后的空载体质粒,用nhei限制性内切酶进行单酶切空载体,37℃3h),用琼脂糖凝胶dna回收试剂盒进行回收,将纯化产物用1%琼脂糖凝胶电泳,回收目的片段和线性载体并测定浓度,并以如表4所示的反应体系进行同源重组,在pcr管中按上述体系配好并混合均匀后置于金属浴中50℃反应30min,即可得到重组的质粒。其中,酶切反应体系如表3所示,同源重组反应体系如表4所示。
[0039]
表3 酶切反应体系
[0040][0041]
表4 同源重组反应体系
[0042][0043]
二、重组菌的构建
[0044]
对上述构建的重组质粒1~6进行测序检测,将测序正确的质粒分别转化dh5
ɑ
感受态细胞(货号btn12-11y,百奥莱博),得到重组质粒1~质粒6对应的重组菌。
[0045]
1、转化
[0046]
(1)取预冷的100μl dh5
ɑ
感受态细胞,加入10μl重组产物(重组质粒1~6分别设立不同的组别进行混合),冰浴处理30min后,42℃热水浴90s(严格控制时间),冰浴处理5min;
[0047]
(2)再于超净台上,向转化体系中加入加入500μl无抗lb/sob培养基,37℃,220rmp摇床中复苏45min;
[0048]
(3)6000rmp离心1min,收集菌体,留200μl菌液,用移液器吸打混匀后加入相应抗性的平板中,倒入4~6颗玻璃珠,轻晃平板将菌液涂布均匀,倒掉玻璃珠,将平板倒置放在37℃培养箱过夜培养。
[0049]
2、pcr鉴定阳性克隆菌体
[0050]
无无菌环境下,每个平板中挑取2~5个单菌落至含0.5ml相应抗性的液体lb培养基和10μlddh2o的溶液中,充分分散,取4μl菌液做菌液pcr鉴定。取6μl菌液密封,于37℃,220rmp摇床中培养4h,便送到测序公司(武汉金开瑞生物科技有限公司),及经过比对,测序100%匹配。
[0051]
表5 菌液pcr鉴定体系:20μl体系
[0052][0053]
pcr仪扩增反应程序:
[0054]
95℃/5min
→
(95℃/30s,60℃/30s,68℃/1kb/1min)30cycle
→
68℃/10min
→
16℃/1h。
[0055]
将摇好的菌液(菌液pcr鉴定有条带)送到测序公司(武汉金开瑞生物科技有限公司),及经过比对,测序100%匹配。
[0056]
三、重组表达细胞
[0057]
本技术实施例以真核细胞hek 293f为宿主细胞,将上述构建的6种重组质粒通过瞬时转染的方式获得稳定表达如sema4c蛋白编码基因的21-663aa、1-497aa、30-497aa和
556-644aa结构域的目的蛋白。该方法具有转染周期短和快速获得目的蛋白的效果,能够应用于研发阶段的摸索和大规模高通量筛选蛋白。
[0058]
1、瞬时转染
[0059]
经过上述实施例制得的6种重组质粒浓度(质粒1~6)分别为质粒浓度1260ng/μl、1190ng/μl、1220ng/μl、1187ng/μl、1310ng/μl和1250ng/μl。将这些质粒分别转入至hek 293f细胞,具体过程如下:
[0060]
(1)在培养基中转染前一天以1.3e6细胞/ml的hek 293f细胞(thermo fisher),体积27ml;
[0061]
(2)在转染之前,将所有试剂置于室温下;
[0062]
(3)转染前,将细胞密度调节到2.6e6/ml;
[0063]
(4)在无菌试管中用1.5ml opti-mem稀释总质粒dna(μg)30μg;
[0064]
(5)将90μl pei(1mg/ml,ph7.1)加入稀释的1.5ml opti-mem中,混匀静置5min;
[0065]
(6)将pei的混合溶液加入到dna的混合溶液中,翻转或移液混合(混匀的过程要求缓慢进行);
[0066]
(7)在室温下孵育20分钟(不要超过);
[0067]
(8)将dna/pei混合物加入细胞中,通过轻轻旋转将它们充分混合,混合后细胞总体积30ml;
[0068]
(9)转染后16~20小时第一次补料1.5ml,96小时后测活率及密度;
[0069]
(10)收获转染后的细胞,收集上清液添加10mm aebsf进行亲和纯化。
[0070]
如表6所示,分别对转染后的活细胞数和活率件统计分析,结果在6质粒质粒分别转染hek 293f细胞后得到的重组表达细胞的活细胞数,在转染第4天后,重组表达细胞的活细胞数仍然高达106个/ml。
[0071]
表6 重组表达细胞的活细胞数(106个/ml)
[0072]
重组表达细胞0天第1天第2天第3天第4天转染重组质粒12.63.93.32.81.9转染重组质粒22.63.63.22.41.65转染重组质粒32.63.332.82.21.55转染重组质粒42.63.453.012.451.6转染重组质粒52.63.643.112.51.87转染重组质粒62.63.983.222.552.01
[0073]
2、wb验证表达
[0074]
(1)样品制备:
[0075]
取转染后hek293f细胞100μl 3000r/min离心10min;离心后取上清20μl加20μl 3
×
loading buffer制样,97℃加热5min,命名为上清(supernatant);沉淀使用100μl pbs进行悬浮后,取20μl加入20μl3
×
loading buffer制样,97℃加热10min,命名为细胞(cell);
[0076]
(2)wb检测
[0077]
1)取上样5μl进行sds-page电泳:根据目的蛋白的分子量的大小选择合适的分离胶浓度。电泳采用恒压模式,5%浓缩胶80v,当marker开始分离大约25min,调至120v,溴酚蓝至分离胶底部终止电泳;
buffer洗柱,直到g250不变蓝,结束washing buffer预洗脱。
[0096]
b.加入1ml elution buffer 1洗柱,洗下与基质结合的蛋白。重力流,流出液用1.5ml无内毒素的ep管收集,收集管需放置在冰盒上保持低温,流完后用g250检测(取100μl g250于96孔板中,加入10μl正在滴出的洗脱液),如果g250变蓝,继续洗脱,直到g250不变蓝,结束elution buffer 1预洗脱。加入0.01m naoh用于调节蛋白溶液的ph。
[0097]
c.加入1ml elution buffer 2洗柱,洗下与基质结合的蛋白。重力流,流出液用1.5ml无内毒素的ep管收集,收集管需放置在冰盒上保持低温,流完后用g250检测(取100μl g250于96孔板中,加入10μl正在滴出的洗脱液),如果g250变蓝,继续洗脱,直到g250不变蓝,结束elution buffer洗脱。加入0.01m naoh用于调节蛋白溶液的ph。
[0098]
d.加入1ml elution buffer3洗柱,洗下与基质结合的蛋白。重力流,流出液用1.5ml无内毒素的ep管收集,收集管需放置在冰盒上保持低温。流完后用g250检测(取100μl g250于96孔板中,加入10μl正在滴出的洗脱液),如果g250变蓝,继续洗脱,直到g250不变蓝,结束elution buffer洗脱。加入0.01m naoh用于调节蛋白溶液的ph。
[0099]
e.将上面收集的流穿与洗脱液制样,一般为2
×
制样,即20μl蛋白+20μl 2
×
loading,进行sds-page电泳。
[0100]
关于质粒5和6中连接的fc-tag标签纯化用缓冲液如表7所示。
[0101]
表7 fc-tag标签纯化用缓冲液
[0102]
缓冲液名称成分binding bufferpbs,ph7.4washing bufferpbs,ph7.4elution buffer 10.05m醋酸钠,150mm nacl,ph4.0elution buffer 20.05m醋酸钠,150mm nacl,ph3.0elution buffer 30.05m醋酸钠,150mm nacl,ph2.2
[0103]
对纯化后蛋白进行电泳检测,结果如图3所示,质粒5转染的细胞上清液中未纯化到目的蛋白,可能由于其表达量较低所至。质粒6转染的细胞上清液中,能够纯化得到556-644aa结构域的目的蛋白,表达量约为8.53mg/1000ml cells。
[0104]
综上所述,本技术实施例通过第一序列和n-rabbit fc标签的共同存在的条件下实现了蛋白的分泌表达,经过wb验证及亲和纯化成功获取了sema4c蛋白sema4c的556-644aa的重组表达,表达量约为8.53mg/1000ml cells,后续可优化转染表达工艺从而实现更高的表达量。
[0105]
以上所述,仅为本技术较佳的具体实施方式,但本技术的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本技术揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本技术的保护范围之内。
