一种导致先天性白内障的maf基因突变体、多肽、试剂盒、构建体、重组细胞及应用
技术领域
1.本发明涉及生物基因工程技术领域,具体涉及一种导致先天性白内障疾病表型的maf基因突变体、多肽、试剂盒、构建体、重组细胞及应用。
背景技术:
2.目前,先天性白内障是一种严重的致盲性晶状体疾病,是由于胚胎期晶状体代谢紊乱、胚胎发育过程中的感染、基因缺陷和染色体异常而导致其自身透明度下降的疾病,主要表现为发生于婴幼儿期的白瞳症。临床上先天性白内障可表现为核性、前极、后极等形状各异的晶状体浑浊。白瞳症是新生儿中最常见的先天性白内障表现形式,不完全性白内障则常常以视力低下、斜视、眼球震颤等异常就诊。此病发病率约为0.01%~0.06%,占儿童致盲性眼病的10%~38%。遗传性白内障占全球儿童白内障的22.3%,最常见的遗传方式为常染色体显性遗传。
3.maf主要作为转录因子直接调控下游的晶状体蛋白编码基因的表达,若maf基因突变,会直接影响编码的maf多肽与多个晶状体蛋白编码基因启动子区的结合,进而使多个晶体蛋白的表达下降,最终导致白内障表现。maf作为先天性白内障的致病基因之一,其致病突变较为罕见,到目前为止,国内外共发现29个致病突变位点,以点突变导致的错义突变和无义突变为主,位于maf基因的一个外显子内,影响maf编码蛋白产物的转录调控功能。
4.明确先天性白内障表型相关的maf基因中的新发变异及其致病性,为明确患者的分子遗传学诊断、指导患者的精准治疗及其避免该家系的再生育风险有重要意义。但目前maf基因新发变异数据并不完善,阻碍了先天性白内障临床诊断的确立和相关家庭的再生育产前基因诊断的进行。
技术实现要素:
5.本发明的目的在于提供一种导致先天性白内障疾病表型的maf基因突变体、多肽、试剂盒、构建体、重组细胞及应用。本发明确定了maf基因的新突变体,新突变体与先天性白内障的发病密切相关,通过检测该新突变体在生物样品中是否存在,可以有效地检测生物样品是否因此患先天性白内障,明确患者的分子遗传学诊断、指导患者的精准治疗及其避免该家系的再生育风险。
6.本发明提供了一种maf基因突变体,所述maf基因突变体的核苷酸序列如seq id no.3所示。
7.本发明还提供了上述技术方案所述的maf基因突变体编码的多肽,所述多肽的氨基酸序列如seq id no.4所示。
8.本发明还提供了检测上述技术方案所述maf基因突变体或maf基因突变体编码的多肽的试剂在制备先天性白内障分子遗传学诊断试剂盒或产前基因诊断试剂盒或易患先天性白内障生物样品筛选试剂盒中的应用。
9.本发明还提供了一种试剂盒,所述试剂盒包括检测maf基因突变体或maf基因突变体编码的多肽的试剂;所述检测maf基因突变体的试剂含有检测maf基因第788位核苷酸突变a
→
g的试剂,突变后的maf基因突变体的核苷酸序列如seq id no.3所示。
10.优选的是,所述检测maf基因第788位核苷酸突变的试剂包括引物,所述引物的核苷酸序列如seq id no.5和seq id no.6所示。
11.本发明还提供了一种核酸构建体,所述核酸构建体含有maf基因突变体;所述maf基因突变体的核苷酸序列如seq id no.3所示。
12.优选的是,所述核酸构建体还含有flag标签序列或gfp标签序列;当所述核酸构建体含有flag标签序列时,所述核酸构建体的骨架载体包括pflag-cmv4,构建所述核酸构建体用引物的核苷酸序列如seq id no.7和seq id no.8所示;当所述核酸构建体含有gfp标签序列时,所述核酸构建体的骨架载体包括pacgfp1-c1,构建所述核酸构建体用引物的核苷酸序列如seq id no.9和seq id no.8所示。
13.本发明还提供了一种重组细胞,所述重组细胞由上述技术方案所述的核酸构建体转染受体细胞获得。
14.本发明还提供了上述技术方案所述的构建体或上述技术方案所述的重组细胞在制备研究maf基因突变体编码的多肽功能的试剂盒中的应用。
15.本发明还提供了上述技术方案所述的构建体或上述技术方案所述的重组细胞在制备明确先天性白内障患者的分子遗传学诊断、指导患者的精准治疗或避免患者家系的再生育风险的试剂盒中的应用。
16.本发明提供了一种导致先天性白内障疾病表型的maf基因突变体。目前国际上没有maf基因c.788a
→
g(p.d263g)突变导致先天性白内障的报道,缺乏maf基因该新发变异编码多肽的功能数据,影响新发变异的致病性评级,阻碍了该病临床诊断的确立和相关家庭的再生育产前基因诊断的进行。本发明确定了maf基因的新突变体,新突变体与先天性白内障的发病密切相关,通过检测该新突变体在生物样品中是否存在,可以有效地检测生物样品是否因此患先天性白内障。本发明所述技术方案明确了先天性白内障表型相关的maf基因中新发变异的致病性,为明确患者的分子遗传学诊断、指导患者的精准治疗及其避免该家系的再生育风险有重要意义。
17.本发明还提供了带有特定突变的maf多肽。本发明带有特定突变的maf基因的核酸构建体能够用于体外功能研究;带有特定突变构建体的重组细胞,能够用于明确判断maf突变多肽是否影响了下游晶状体蛋白编码基因的转录表达水平,为maf基因新发变异的致病性评级提供证据。
附图说明
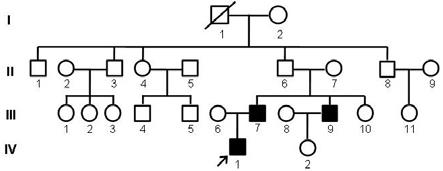
18.图1为本发明提供的先天性白内障家族的谱系图;图2为本发明提供的pcr法扩增白内障家系中患者与正常个体maf基因c.788位点上下游341 bp产物的琼脂糖凝胶电泳示意图;图3为本发明提供的maf野生型与突变体的c.788位点示意图;图4为本发明提供的maf第263位氨基酸位点在不同脊椎动物中的保守性分析示意图;
图5为本发明提供的带有flag标签序列的maf野生型与c.788a
→
g突变体的构建体示意图;图6为本发明提供的带有gfp标签序列的maf野生型与c.788a
→
g突变体的构建体示意图;图7为本发明提供的免疫印记法检测带有flag标签序列的maf野生型与c.788a
→
g突变构建体的重组hek293t细胞中,maf 野生型与p.d263g突变体多肽表达水平的示意图;其中,(a)重组hek293t细胞中flag-maf野生型(wt)和突变型(d263g)多肽;(b)重组hek293t细胞中flag-maf突变型(d263g)多肽和野生型(wt)多肽表达水平的柱状图,*:p《0.05;图8为本发明提供的免疫荧光法检测带有gfp标签序列的maf野生型与c.788a
→
g突变构建体的重组hek293t细胞中,maf野生型与p.d263g突变体多肽绿色荧光信号在细胞内定位的示意图。
具体实施方式
19.本发明提供了一种maf基因突变体,所述maf基因突变体的核苷酸序列如seq id no.3所示。maf基因定位于16q23.2,全长6900bp,由1个外显子构成,其全长cdna包含1122个核苷酸,编码产物是包含373个氨基酸的一种38.5kd的转录因子。maf主要作为转录因子直接调控下游的晶状体蛋白正常表达。本发明所述maf基因突变体是野生型maf基因的第1号外显子的第788位核苷酸存在a
→
g突变。野生型maf基因的核苷酸序列如seq id no.1所示。本发明以先天性白内障家系为研究对象,用全外显子组测序、sanger测序和限制性酶切片段长度多态性技术,鉴定了maf基因中的一个新的杂合致病突变,位于第1号外显子的788位编码核苷酸,存在a
→
g突变。目前国际上还没有关于maf基因c.788a
→
g(p.d263g)突变导致先天性白内障的报道。本发明通过目标区域捕获测序联合候选基因突变验证的方法确定了先天性白内障致病基因maf中新的c.788a
→
g突变。
20.本发明还提供了上述技术方案所述的maf基因突变体编码的多肽,所述多肽的氨基酸序列如seq id no.4所示。本发明所述多肽是野生型maf基因cdna编码的多肽第263位asp突变为gly,即所述多肽具有p.asp263gly(p.d263g)突变,所述突变是由于c.a788g的错义突变而引起的。本发明所述野生型maf基因cdna编码的多肽的氨基酸序列如seq id no.2所示。通过检测生物样品中是否表达该多肽,可以有效地检测生物样品是否易患先天性白内障,也可以通过检测这些多肽在生物体中是否存在,有效地检测生物样品是否因此患先天性白内障。
21.本发明还提供了检测上述技术方案所述maf基因突变体或maf基因突变体编码的多肽的试剂在制备先天性白内障分子遗传学诊断试剂盒或产前基因诊断试剂盒或易患先天性白内障生物样品筛选试剂盒中的应用。
22.本发明还提供了一种试剂盒,所述试剂盒包括检测maf基因突变体或maf基因突变体编码的多肽的试剂;所述检测maf基因突变体的试剂含有检测maf基因第788位核苷酸突变a
→
g的试剂,突变后的maf基因突变体的核苷酸序列如seq id no.3所示。本发明所述试剂盒能够实现易患先天性白内障的生物样品的筛选,也能够实现先天性白内障的分子遗传学诊断,还能实现先天性白内障产前基因诊断。基于本发明所述试剂盒的检测方法优选包括以下步骤:设计针对maf基因突变位点的上下游扩增引物,以待测样品的基因组dna为模
版,pcr方法扩增maf基因突变位点的上下游341bp序列,扩增产物进行琼脂糖凝胶电泳,pcr产物的分离纯化后,进行sanger测序分析核苷酸序列。maf基因突变体与先天性白内障的发病密切相关,通过检测该新突变体在生物样品中是否存在,可以有效地检测生物样品是否易患先天性白内障,或所述患者易患先天性白内障。
23.在本发明中,所述检测maf基因第788位核苷酸突变的试剂优选包括引物(针对maf基因突变位点的上下游扩增引物)或探针,所述引物的核苷酸序列如seq id no.5(正向5
’‑
ggcggcctgcacttc-3’)和seq id no.6(反向5
’‑
gggttgtcgctgctcg-3’)所示。本发明所述引物可以在pcr反应体系中显著有效地完成对maf外显子1的扩增,可以高效地筛选易患先天性白内障的生物样品。
24.在本发明中,pcr方法扩增的反应体系优选如表1所示:表1 反应体系在本发明中,所述pcr方法扩增的反应程序优选为:98℃变性3分钟;之后11个循环,98℃变性20秒、退火温度从70℃降至60℃(每循环降低1℃)20秒、72℃延伸30秒;之后40个循环,98℃变性20秒、59℃退火20秒、72℃延伸30秒。
25.本发明还提供了一种核酸构建体,所述核酸构建体含有maf基因突变体;所述maf基因突变体的核苷酸序列如seq id no.3所示。本发明所述的核酸是任何包含脱氧核糖核苷酸或者核糖核苷酸的聚合物,包括但不限于经过修饰的或者未经修饰的dna、rna,其长度不受任何特别限制。对于用于构建重组细胞的构建体,优选所述核酸为dna,因为dna相对于rna而言,其更稳定,并且易于操作。在本发明中所使用的术语“构建体”是指这样的一种遗传载体,其包含特定核酸序列,并且能够将目的核酸序列转入宿主细胞中,以获得重组细胞。根据本发明的实施例,构建体的形式不受特别限制。根据本发明的实施例,其为质粒、病毒的至少一种,优选质粒。质粒作为遗传载体,具有操作简单,可以携带较大片段的性质,便于操作和处理。质粒的形式也不受特别限制,既可以是环形质粒,也可以是线性质粒。本领域技术人员可以根据需要进行选择。
26.在本发明中,所述核酸构建体还含有flag标签序列或gfp标签序列;当所述核酸构建体含有flag标签序列时,所述核酸构建体的骨架载体包括pflag-cmv4,构建所述核酸构建体用引物的核苷酸序列如seq id no.7和seq id no.8所示;当所述核酸构建体含有gfp标签序列时,所述核酸构建体的骨架载体包括pacgfp1-c1,构建所述核酸构建体用引物的
核苷酸序列如seq id no.9和seq id no.8所示。
27.本发明还提供了所述核酸构建体的构建方法,优选包括以下步骤:根据maf基因的开放读码框设计带有特定酶切位点的扩增引物,对扩增产物进行双酶切后,根据研究需要连接到带有特定标签多肽序列的表达载体上,构建带有特定位点突变的核酸构建体。
28.具体的,带有flag标签序列的maf核酸构建体的构建:针对maf基因全长开放读码框设计带有特定酶切位点的核苷酸序列如seq id no.7和seq id no.8所示的引物,以含maf基因突变体的基因组dna为模板,扩增,将扩增产物与经相同酶切位点酶切的含flag标签的表达载体连接,得到带有flag标签序列的maf核酸构建体。在本发明中,所述含flag标签的表达载体优选包括pflag-cmv4。
29.带有gfp标签序列的maf核酸构建体的构建:针对maf基因全长开放读码框设计带有特定酶切位点的核苷酸序列如seq id no.9和seq id no.8所示的引物,以含maf基因突变体的基因组dna为模板,扩增,将扩增产物与经相同酶切位点酶切的含gfp标签的表达载体连接,得到带有gfp标签序列的maf核酸构建体。在本发明中,所述含gfp标签的表达载体优选包括pacgfp1-c1。
30.带有flag标签序列的maf核酸构建体,可用于研究比较maf野生型多肽和p.d263g突变型多肽在哺乳动物细胞中表达量的差异;带有gfp标签序列的maf核酸构建体,可用于研究比较maf野生型多肽和p.d263g突变型多肽在哺乳动物细胞中表达位置的差异。
31.本发明还提供了一种重组细胞,所述重组细胞由上述技术方案所述的核酸构建体转染受体细胞获得。所述重组细胞能够表达maf基因突变体编码的多肽。在本发明中,所述受体细胞的种类优选不受特别限制,例如可以为大肠杆菌细胞、哺乳动物细胞,优选该受体细胞来源于哺乳动物。在本发明中,所述受体细胞优选来源于大肠杆菌细胞(dh5α感受态细胞,购自天根生化科技有限公司)或哺乳动物细胞(hek293t细胞,购自国家生物医学实验细胞资源库)。利用本发明的核酸构建体转染受体细胞获得的重组细胞,能够评估突变体的蛋白表达水平;此外,后续可以结合带有特定晶状体蛋白编码基因启动子序列的萤火虫和海肾双荧光素酶报告系统,通过定量分析萤火虫荧光素酶基因表达的水平,进一步评估突变体影响晶状体蛋白编码基因转录的生物学有害性。
32.本发明还提供了上述技术方案所述的构建体或上述技术方案所述的重组细胞在制备研究maf基因突变体编码的多肽功能的试剂盒中的应用。
33.本发明还提供了上述技术方案所述的构建体或上述技术方案所述的重组细胞在制备明确先天性白内障患者的分子遗传学诊断、指导患者的精准治疗或避免患者家系的再生育风险的试剂盒中的应用。
34.下面结合具体实施例对本发明所述的一种导致先天性白内障疾病表型的maf基因突变体、多肽、试剂盒、构建体、重组细胞及应用做进一步详细的介绍,本发明的技术方案包括但不限于以下实施例。
35.实施例1设计针对maf基因突变位点的上下游扩增引物,以白内障患者的基因组dna为模版,pcr方法扩增maf基因突变位点的上下游341bp序列,扩增产物进行琼脂糖凝胶电泳,pcr产物的分离纯化后,进行sanger测序进行分析序列,检测白内障患者maf基因突变位点。
36.用于扩增maf基因外显子1中c.788a
→
g突变位点的引物:正向5
’‑
ggcggcctgcacttc-3’(seq id no.5);反向5
’‑
gggttgtcgctgctcg-3’(seq id no.6)pcr方法扩增带有maf基因突变位点序列的反应体系如表1所示。
37.pcr反应条件:98℃变性3分钟;之后11个循环,98℃变性20秒、退火温度从70℃降至60℃(每循环降低1℃)20秒、72℃延伸30秒;之后40个循环,98℃变性20秒、59℃退火20秒、72℃延伸30秒。
38.pcr产物的分离纯化:maf基因pcr扩增产物片段经2%的琼脂糖凝胶分离后,在紫外切胶仪中切下含有目的条带的凝胶条,装入1.5ml ep管,利用电子天平称凝胶块重量,向含有凝胶的离心管中按每100mg凝胶加入100μl binding buffer,放在金属浴中60℃加热至凝胶完全融化,离心30秒。将凝胶溶液转移到核酸硅胶纯化柱中,12000转/分离心1分钟,弃去废液。加700μl清洗液(含80%乙醇),12000转/分离心1分钟,弃去废液,再离心2分钟,去除离心管壁上残留的液体,将核酸硅胶纯化柱转移到一个无菌的1.5ml离心管中。将22
µ
l洗脱缓冲液均匀的滴加到吸附膜上,室温孵育5-6分钟,12000转/分离心1分钟将纯化的dna溶液收集到离心管中,用于sanger测序分析。
39.结果发现,新突变体与seq id no.1所示的野生型maf基因相比,具有c.a788g突变,即相对于野生型maf基因,本发明的maf基因突变体的第788位碱基从a突变为g。由此,其所编码的产物与野生型的maf相比,具有p.asp263gly突变:野生型maf的第263位氨基酸asp(d)突变为氨基酸gly(g)。
40.图1为先天性白内障家族的谱系图,其中,iv-1为先天性白内障患者先证者、iii-7先证者父亲、iii-9先证者叔叔他们均为白内障患者。因家系内多位患者均接受了晶体置换手术,因此不再有白内障表现,但是视力低下,双眼视力低于0.3。
41.采用实施例1的方法对先天性白内障患者家族进行检测,pcr法扩增白内障家系中患者与正常个体maf基因c.788位点上下游341 bp产物的琼脂糖凝胶电泳示意图如图2所示,iv-1为先天性白内障患者先证者、iii-7先证者父亲、iii-9先证者叔叔他们均为患者;iii-6先证者母亲、iii-10先证者姑姑、iv-2先证者堂妹均为正常人。
42.经测序,maf野生型与突变体的c.788位点示意图如图3所示。pcr扩增白内障患者及家系maf基因突变位点上下341bp片段后,sanger测序结果显示iv-1为先天性白内障患者先证者、iii-7先证者父亲、iii-9先证者叔叔该位点均为杂合患者;iii-6先证者母亲、iii-10先证者姑姑、iv-2先证者堂妹该位点均为正常无突变。证实突变与白内障基因型表型共分离。
43.后续将本发明核酸突变体编码的多肽氨基酸与野生型多肽进行对比分析,得到如图4所示的maf第263位氨基酸位点在不同脊椎动物中的保守性分析示意图;结果表明,这个位点在不同物种间(鸡、牛、猩猩等)具有高度保守性,说明它有重要的功能性。
44.实施例2(1)带有flag标签序列的maf构建体的构建(带有flag标签序列的maf野生型与c.788a
→
g突变体的构建体示意图如图5所示):设计针对maf基因全长开放读码框的上下游扩增引物,上游引物带hind iii酶切位点,下游引物带bamh i酶切位点,以maf基因存在c.788a
→
g杂合突变的白内障患者基因组dna为模版,由于该患者一个maf等位基因为野生
型正常序列,另一个maf等位基因包含c.788a
→
g突变序列,以该患者的基因组dna为模板,pcr方法扩增maf开放读码框序列,可同时得到包含野生型和c.788a
→
g突变型maf开放读码框序列,扩增产物进行hind iii和bamh i双酶切与纯化;商业化的pflag-cmv4表达载体经hind iii和bamh i双酶切并纯化后,与酶切纯化的maf开放读码框片段,经t4连接酶连接成环状双链dna后,取5μl连接产物转化30μl dh5α感受态细胞,接种于氨苄青霉素抗性的琼脂糖平板中,37℃过夜培养,挑取单克隆进行sanger测序,鉴定带有flag标签的野生型maf基因构建体(pflag-cmv4-maf-wt)和带有flag标签的突变型maf基因构建体(pflag-cmv4-maf-d263g)的序列;用于构建pflag-cmv4-maf-wt、pflag-cmv4-maf-d263g的引物:正向引物hind iii-maforf-f:5
’‑
aacgcgaagcttgcatcagaactggcaatgag-3’(seq id no.7);反向引物bamh i-maforf-r:5
’‑
aacgcgggatcctcacatgaaaaactcgggaga-3’(seq id no.8)。
45.pcr方法扩增带有hind iii和bamh i酶切位点的maf开放读码框序列的反应体系如表2所示。
46.表2 反应体系(2)带有gfp标签序列的maf构建体的构建(带有gfp标签序列的maf野生型与c.788a
→
g突变体的构建体示意图如图6所示):设计针对maf基因全长开放读码框的上下游扩增引物,上游引物带kpn i酶切位点,下游引物带bamh i酶切位点,以maf基因存在c.788a
→
g杂合突变的白内障患者基因组dna为模版,由于该患者一个maf等位基因为野生型正常序列,另一个maf等位基因包含c.788a
→
g突变序列,以该患者的基因组dna为模板,pcr方法扩增maf开放读码框序列,可同时得到包含野生型和c.788a
→
g突变型maf开放读码框序列,扩增产物进行kpn i和bamh i双酶切与纯化;商业化的pacgfp1-c1表达载体经kpn i和bamh i双酶切并纯化后,与酶切纯化的maf开放读码框片段,经t4连接酶连接成环状双链dna后,5μl连接产物转化30μl dh5α感受态细胞,接种于卡那霉素抗性的琼脂糖平板中,37℃过夜培养,挑取单克隆进行sanger测序,鉴定鉴定带有gfp标签的野生型maf基因构建体(pacgfp1-c1-maf-wt)和带有gfp标签的突变型maf基因构建体(pacgfp1-c1-maf-d263g)的序列;用于构建pacgfp1-c1-maf-wt、pacgfp1-c1-maf-d263g的引物:
正向引物kpni-maforf-f:5
’‑
aacgcgggtaccgcatcagaactggcaatgag-3’(seq id no.9),反向引物bamhi-maforf-r同seq id no.8。
47.扩增带有kpni和bamh i酶切位点的maf开放读码框序列的反应体系如表3所示。
48.表3 反应体系带有酶切位点的maf开放读码框序列pcr反应条件:98℃变性3分钟;之后11个循环,98℃变性15秒、退火温度从70℃降至60℃(每循环降低1℃)15秒、72℃延伸1分10秒;之后40个循环,98℃变性15秒、59℃退火15秒、72℃延伸1分10秒。
49.带有酶切位点的maf开放读码框序列pcr产物的分离纯化:pcr产物经1%的琼脂糖凝胶分离后,在紫外切胶仪中切下含有目的条带的凝胶条,装入1.5ml ep管,利用电子天平称凝胶块重量,向含有凝胶的离心管中按每100mg凝胶加入100μl binding buffer,放在金属浴中60℃加热至凝胶完全融化,离心30秒。将凝胶溶液转移到核酸硅胶纯化柱中,12000转/分离心1分钟,弃去废液。加700μl清洗液(含80%乙醇),12000转/分离心1分钟,弃去废液,再离心2分钟,去除离心管壁上残留的液体,将核酸硅胶纯化柱转移到一个无菌的1.5ml离心管中。将22
µ
l洗脱缓冲液均匀的滴加到吸附膜上,室温孵育5-6分钟,12000转/分离心1分钟将纯化的dna溶液收集到离心管中,用于双酶切反应。
50.带有hind iii和bamh i酶切位点的maf开放读码框序列pcr产物的双酶切体系如表4。
51.表4 双酶切体系pflag-cmv4载体hind iii和bamh i双酶切体系如表5。
52.表5双酶切体系
带有kpni和bamh i酶切位点的maf开放读码框序列pcr纯化产物的双酶切体系如表6。
53.表6 双酶切体系pacgfp1-c1载体kpn i和bamh i双酶切体系如表7。
54.表7 双酶切体系上述4种酶切体系的酶切反应条件:37℃孵育59分钟,80℃灭活15分钟,降至室温。
55.经hind iii和bamh i酶切的maf开放读码框序列pcr纯化产物,与hind iii和bamh i酶切后的flag标签载体回收产物的连接,连接反应体系如表8。
56.表8 连接反应体系经kpni和bamh i酶切的maf开放读码框序列pcr纯化产物,与kpni和bamh i酶切后的gfp标签载体回收产物的连接,连接反应体系如表9。
57.表9 连接反应体系
依据以上技术方法构建的pflag-cmv4-maf-wt、pflag-cmv4-maf-d263g,pacgfp1-c1-maf-wt、pacgfp1-c1-maf-d263g四种核酸构建体,sanger测序结果证实均构建成功。
58.实施例3使用实施例2构建得到的含有maf基因野生型和c.788a
→
g突变体的核酸构建体转染受体细胞,制备重组细胞。
59.受体细胞来源于大肠杆菌细胞(dh5α感受态细胞,购自天根生化科技有限公司)或哺乳动物细胞(hek293t细胞,购自国家生物医学实验细胞资源库)。
60.maf构建体转化dh5α感受态细胞的方法:5μl flag标签的连接产物转化30μl dh5α感受态细胞,置于冰上20分钟,42℃热激1分30秒,冰上孵育5分钟,接种于氨苄霉素抗性的琼脂糖平板中;5μl gfp标签的连接产物转化30μl dh5α感受态细胞,置于冰上20分钟,42℃热激1分30秒,冰上孵育5分钟,接种于卡那霉素抗性的琼脂糖平板中。平板置于37℃过夜培养,挑取单克隆进行扩增培养含有相应maf核酸构建体的重组细胞。
61.maf构建体转染hek293t哺乳动物细胞:hek293t细胞(编号:3111c0001ccc000091,购自国家生物医学实验细胞资源库)培养至60%-70%汇合度时转染,具体地,先制备opti-mem-构建体混悬液:在ep管中加入适量opti-mem(thermo fisher)培养基,再加入p3000试剂(2μl/1μg构建体,thermo fisher),然后依次添加野生型或突变型maf构建体,充分混匀;再制备opti-mem-脂质体混悬液:在ep管中加入适量opti-mem培养基,再加入lipofectamine 3000脂质体(thermofisher)试剂转染试剂(3μl/1μg构建体),轻轻吹打至完全混匀;然后将opti-mem-构建体混悬液加入到opti-mem-脂质体混悬液中(顺序不能颠倒),充分混匀,室温孵育5-10分钟,形成构建体-脂质体混合物。将上述构建体-脂质体混合物轻轻滴加到培养基中,放入培养箱中继续培养24小时后,通过免疫印记法和免疫荧光法检测flag标签或者gfp标签的maf多肽的表达和定位,评价重组细胞是否构建成功。
62.带有flag标签maf野生型和突变型多肽的免疫印记检测方法:含有flag-maf野生型和突变型多肽的细胞裂液制备和检测(以hek293t细胞为例):用细胞刮刀将含有pflag-cmv4-maf-wt和pflag-cmv4-maf-d263g构建体的hek293t细胞(含有共转染的pacgfp1-c1载体做为对照)收集到ep管中,离心收集细胞团块,加入细胞团块体积5倍的裂解液(含有ip lysis buffer,1x pic,2mm pmsf,8mm naf,2mm na3vo4),低温吹打至细胞完全裂解,冰上孵育10分钟后置于4℃离心机,12000转/分离心10分钟,上清液转移至新的ep管中,变性聚丙烯酰胺凝胶电泳可以检测该上清液中的flag-maf多肽。进一步的,用10% sds-page分离总蛋白,湿转法将page胶中的总蛋白转移到pvdf膜上,之后用1%tbs脱脂奶粉溶液室温封闭pvdf膜0.5小时,再加入能特异识别flag标签多肽序列的抗体α-flag(sigma,f1804)。同时,加入α-gfp(santa cruz,sc-9996)识别gfp多肽,作为对照,定量分析flag-maf多肽的表达水平。过夜孵育后,pvdf膜用封闭液稀释的辣根过氧化物酶
标记的二抗m-iggkbp-hrp(santa cruz,sc-516102)室温孵育,ecl显色,胶片曝光显影后显示40~50 kd之间的蛋白条带,证明含有pflag-cmv4-maf-wt和pflag-cmv4-maf-d263g构建体的重组细胞构建成功。用imagej软件分析条带光密度,进而定量分析flag-maf野生型和突变型多肽的表达水平。
63.带有gfp标签的maf野生型和突变型多肽的免疫荧光检测方法:pacgfp1-c1-maf-wt和pacgfp1-c1-maf-d263g构建体转染hek293t细胞(预先接种在0.1mg/ml多聚l-赖氨酸包被的盖玻片上),转染24小时后移除细胞培养基,室温条件下,用1% bsa/tbs润洗细胞两次,4%多聚甲醛1ml固定细胞15 min;1% bsa/tbs润洗两次后,盖玻片上滴加0.5ml triton-x100孵育10分钟,进行细胞打孔;1% bsa/tbs润洗细胞两次,滴加dapi荧光染料避光孵育1小时,1% bsa/tbs润洗两次;在载玻片上滴20 μl抗淬灭剂,轻轻将盖玻片带有细胞的一面覆盖于载玻片上,四周涂抹封片剂,在倒置荧光显微镜下观察到绿色信号,证明带有pacgfp1-c1-maf-wt和pacgfp1-c1-maf-d263g构建体的重组细胞构建成功。通过比较绿色荧光信号的强度和位置,明确gfp-maf野生型和突变型多肽在细胞内定位的差异。
64.上述检测结果证明:利用pflag-cmv4-maf-wt、pflag-cmv4-maf-d263g,pacgfp1-c1-maf-wt、pacgfp1-c1-maf-d263g四种构建体转染获得重组细胞建成功,可以用于分析和比较maf野生型多肽和p.d263g突变型多肽在哺乳动物细胞中表达水平和表达位置的差异。
65.图7是检测带有flag标签序列的maf野生型与c.788a
→
g突变构建体的重组hek293t细胞中,maf野生型与p.d263g突变体多肽表达水平的示意图。(a)重组hek293t细胞中flag-maf野生型(wt)和突变型(d263g)多肽;(b)柱状图显示重组hek293t细胞中flag-maf突变型(d263g)多肽的表达比野生型(wt)多肽显著增加,*:p《0.05。
66.图8是免疫荧光法检测带有gfp标签序列的maf野生型与c.788a
→
g突变构建体的重组hek293t细胞中,maf野生型与p.d263g突变体多肽绿色荧光信号在细胞内定位的示意图。在绝大多数重组细胞中,gfp-maf野生型多肽是均匀表达的,表现为绿色荧光信号在细胞中均匀分布,仅有个别细胞出现微弱的绿色荧光点状聚集,统计分析结果显示平均仅0.78个点/细胞;突变体多肽在重组细胞中的表达呈点状聚集,表现为明显的密集点状绿色荧光信号,平均高达30.2个点/细胞。免疫荧光检测显示maf突变体重组细胞中,maf p.d263g突变体多肽在细胞中的定位发生了改变,不再像maf野生型多肽均匀分布于细胞中,而是变为点状聚集状态。
67.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
