1.本发明属于生物领域,特别涉及一种大肠杆菌高密度发酵培养基及其发酵工艺。
背景技术:
2.基因工程是指在体外将目的基因插入病毒、质粒或其他载体分子中,构成遗传物质的新组合,并使之渗入到原先没有这些基因的寄主细胞内,且能稳定地遗传。随着技术的进步,目前已经能将目的蛋白在细菌、酵母、动物细胞、植物细胞等模式生物中实现表达。生物医药领域已经在广泛的使用基因工程技术,选择不同的蛋白表达系统来获得所需的目的产物。
3.在众多表达系统中,原核蛋白表达是最常见的表达系统,也是最经济实惠的表达系统。其中大肠杆菌表达系统以遗传背景清楚、成本低、表达量高和产物分离纯化相对简单等优点,被广泛应用于抗原、抗菌肽、酶制剂、核酸疫苗等的制备,据资料和报道,在动物疫苗行业,越来越多抗原的制备使用基因工程大肠杆菌表达,如鸡传染性法氏囊病毒(ibdv)、猪圆环病毒(pcv)、猪链球菌(ss)、副猪嗜血杆菌(hps)、禽腺病毒(fadv)、口蹄疫病毒(fmdv)、猪细小病毒(ppv)、犬细小病毒(cpv)、猪水泡病病毒(svdv)、塞内卡病毒(sva)等病。
4.虽然利用大肠杆菌表达系统培养的都是基因工程大肠杆菌,在摇瓶中使用普通的lb等一系列简单的培养基就能够实现表达,但由于表达产物的复杂多样性,放大到生产后,目的蛋白的表达量却很低。为了实现大规模生产,往往会用到不同的培养基和发酵工艺,甚至专门研发对应工程菌的高密度发酵培养基和发酵工艺。相关基因工程大肠杆菌高密度发酵的专利有:如申请公布号为cn 110819582 a的“大肠杆菌表达口蹄疫病毒样颗粒抗原的发酵培养基及培养方法”,申请公布号为cn 107937459 a的“一种规模化产trim72蛋白的高密度方法”等一系列的专利,都是针对某一特定的表达产物,且使用的培养基和培养工艺也相差较大,目前未见能够适用于不同基因工程大肠杆菌菌株高密度发酵的培养基和发酵工艺。生物医药方面的研发投入很大,且利用基因工程大肠杆菌生产的公司往往会有多个系列的基因工程大肠杆菌表达的产品,重复的研发也导致了资源的极大浪费。一些从科研院所或者其他公司转项目进行生产的公司,由于生产硬件设备的差异,要么放大不到生产,要么生产达不到预期效果,导致项目停滞,或者难以实现项目的转化预期。
技术实现要素:
5.为解决上述技术问题,本发明提出一种广谱的基因工程大肠杆菌高密度发酵培养基及其发酵工艺,该培养基和工艺能够适用于绝大多数基因工程大肠杆菌高密度发酵,针对不同条件的生产设备,也能实现目的蛋白的大量表达,实现现有设备的最大利用率。
6.本发明采用的技术方案之一为:一种基因工程大肠杆菌高密度发酵培养基,包括基础培养基、c源补料培养基、诱导补料培养基;
7.所述基础培养基组分:
[0008][0009][0010]
c源补料培养基组分:
[0011]
[0012]
诱导补料培养基组分:
[0013][0014]
所述基础培养基制备过程为:
[0015]
a1、根据基础培养基能够达到的最高发酵密度、能收获的最高细菌量与发酵罐硬件条件能达到的最高发酵密度、能收获的最高细菌量的比例,确定一份基础培养基的配置比例;
[0016]
a2、将步骤a1中配置好的基础培养基成分添加至三分之二体积的纯水中,搅拌至无固体颗粒后再定容,转入发酵罐;
[0017]
a3、对转入发酵罐的基础培养基溶液进行灭菌,从而得到基础培养基;采用的灭菌温度为116℃,灭菌时间为30min。
[0018]
所述c源补料培养基制备过程为:将一份c源补料培养基组分添加至三分之二体积的纯水中,搅拌至无固体颗粒后再定容,转入补料瓶;然后设置培养基溶液灭菌温度116℃,灭菌时间30min,得到c源补料培养基。
[0019]
所述诱导补料培养基制备过程为:将诱导补料培养基组分添加至三分之二体积的纯水中,搅拌至无固体颗粒后再定容,转入补料瓶;然后设置培养基溶液灭菌温度116℃,灭菌时间30min,得到诱导补料培养基。
[0020]
本发明采用的技术方案之二为:基因工程大肠杆菌高密度发酵工艺,包括如下步骤:
[0021]
步骤1:将灭菌好的c源补料培养基和诱导补料培养基分别通过硅胶管连接在发酵罐上,通过补料泵控制;将配置好的无菌naoh溶液通过碱补料泵与发酵罐相连调节基础培养基ph,一般10l以下小罐使用浓度2m,500l以上大罐使用浓度20m;
[0022]
步骤2:接种前,设置好发酵温度、通气量和转速。使用碱补料泵将ph控制在细菌最佳生长ph。当一切参数稳定后进行接种;
[0023]
步骤3:接种后,每小时记录发酵罐溶氧、ph、转速和通气量,每小时测量细菌生长od值、湿重和活菌数;
[0024]
步骤4:发酵时,发酵罐设置起始转速确保不产生气泛现象,一般在200rpm以上。通气量开至1个vvm(即每分钟通气量与发酵液体积比为1)。发酵过程中当溶氧低于30%时,先通过提高转速维持溶氧在30%,当转速达到最高时,再通过缓慢提高通气量维持溶氧在
30%;
[0025]
步骤5:发酵的0-4小时,设置补料泵流加c源补料培养基,每小时流加量(1~1.4)
×
发酵体积(发酵体积单位l),单位ml。发酵4小时以后,调整c源补料泵流速,每小时流加量(4.5~5)
×
发酵体积(发酵体积单位l),单位ml;
[0026]
步骤6:当细菌od值与基础培养基能生长的最高od值相差不到5个od值时,将温度、ph和溶氧调整为诱导最佳值,待参数稳定后,加入诱导剂进行诱导表达;
[0027]
步骤7:诱导时,设置诱导培养基补料泵进行补料,每小时流加量(10~15)
×
发酵体积(发酵体积单位l),单位ml;
[0028]
步骤8:达到最佳诱导时长,停止发酵,收获菌体。
[0029]
本发明的有益效果:采用本发明的培养基及培养工艺,能实现高密度发酵,也能根据不同发酵罐的硬件条件进行简单调整,实现更高密度发酵或低密度发酵,杜绝了资源的浪费,同时保证目的蛋白的高表达;并且本发明具有广谱性,能够用于绝大多数基因工程大肠杆菌高密度发酵,不论是表达抗原还是抗菌肽和酶等使用本发明均能取得满意的结果。
附图说明
[0030]
图1为高密度发酵3批次与批次式发酵3批次平均菌泥收获量对比图;
[0031]
图2为高密度发酵3批次与批次式发酵3批次单位菌泥目的蛋白表达量对比图;
[0032]
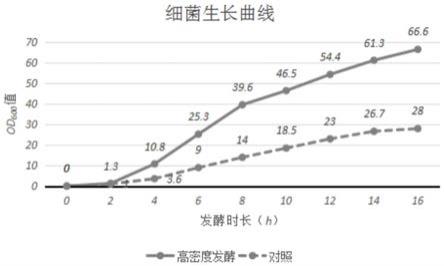
图3为高密度发酵与厂家原工艺发酵细菌生长情况对比图;
[0033]
图4为高密度发酵与厂家原工艺发酵单位菌泥目的蛋白酶活对比图;
[0034]
图5为高密度培养基与2
×
yt培养基发酵洗后菌泥收获量对比图;
[0035]
图6为高密度培养基与2
×
yt培养基发酵目的蛋白纯度对比图;
[0036]
图7为4批次发酵高密度发酵与批次式发酵发菌泥收获量对比图;
[0037]
图8为高密度发酵与批次式发酵目的蛋白纯度对比图;
[0038]
图9为湿重和目的蛋白收获量情况。
具体实施方式
[0039]
为便于本领域技术人员理解本发明的技术内容,下面结合附图对本发明内容进一步阐释。
[0040]
本发明的基因工程大肠杆菌高密度发酵培养基,培养基包括基础培养基,c源补料培养基,诱导补料培养基;
[0041]
基础培养基组分:
[0042][0043][0044]
其中丰富的氨基酸成分保证了细菌在接种后能够快速适应新培养环境,多种微量元素的添加满足不同工程菌高密度发酵的营养需求。
[0045]
基础培养基能够满足收获40个od值(80g/l菌泥)的营养,若发酵罐的硬件能够满足,则使用原比例,若发酵罐只能满足20个od值(40g/l菌泥)发酵,则将基础培养基成分都减半,以此类推确定使用基础培养基的比例。
[0046]
c源补料培养基组分:
[0047][0048]
碳元素是大肠杆菌的重要组成成分,大肠杆菌中碳元素占菌体干重10%一30%。糖类是大肠杆菌优先利用的碳源物质,糖代谢不仅为生物体的生命活动提供能量来源(60%-70%);还为其他化合物的合成提供碳骨架,可转变为生命所必需的其他物质,如脂质、蛋白质等;同时可作为细胞识别的信息分子,如细胞识别的功能都与糖蛋白的糖链有关。
[0049]
我们将多种碳源组合成c源培养基,其中包含单糖、多糖和甘油。通过匀速流加的方式添加,不仅能够避免将糖类加入底料灭菌时产生麦拉德反应,造成培养基营养的大量损失;同时控制好流加速度能够防止葡萄糖添加过多时大量代谢副产物,如乙酸等的产生,多糖和甘油的添加是便于流加速度更好的控制,在单糖短时间缺少的情况下暂时供能,防止细菌代谢氮源类物质供能,造成营养的损失。
[0050]
诱导补料培养基组分:
[0051][0052]
蛋白表达时对氮源的需求是必不可少的,有研究表明有机氮更有利于蛋白的高表达。磷酸盐既能够控制菌体的dna、rna和蛋白质的合成,也能控制糖的代谢作用、细胞的呼吸和胞内atp水平。磷酸盐的含量能够影响重组大肠杆菌表达质粒复制的速率,因而是菌体生长和目的蛋白表达量的决定性因素之一。磷酸盐浓度能够影响大肠杆菌比生长速率,而乙酸的生成又与比生长速率息息相关,有害代谢物对重组菌存在抑制作用是影响大肠杆菌高密度发酵的重要因素,因此控制适宜的磷酸盐浓度对提高外源蛋白产量具有重要意义。
[0053]
在大肠杆菌表达蛋白期间,正亮氨酸残基的引入会导致正常合成的蛋白结构或功能改变,引起可溶性蛋白表达量的降低,在发酵过程中,补入甲硫氨酸,可以确保细胞获得过量的甲硫氨酸,从而减少了甲硫氨酰trna不正确的加载正亮氨酸的概率,甲硫氨酸的加入可以抑制正亮氨酸残基的产生,从而维持菌体蛋白合成的正常结构和功能。亮氨酸可以
抑制酶参与正缬氨酸和正亮氨酸的合成,但是,亮氨酸同样影响细胞功能造成发酵结束时的细胞密度偏低。额外加入的异亮氨酸,则可以极大得增加重组蛋白产量。
[0054]
一些无机盐如mgso4和feso4等,与合成胞外产物的动态平衡有关,可以稳定目标产物。此外,加入k
+
,mn
2+
,zn
2+
等可以调节细胞代谢,有利于细菌的高密度和高表达。
[0055]
实施例一
[0056]
本实施例中给出一种基于大肠杆菌表达系统的96scfv抗体的发酵表达所基于的培养基及采用的发酵工艺,具体的:
[0057]
基础培养基组分:
[0058][0059]
在本实施例一中根据发酵的硬件条件,上述的一份基础培养基组分需要稀释2倍配制。
[0060]
然后将配置好的培养基先添加至三分之二体积的纯水中,搅拌至无固体颗粒后再定容,转入发酵罐。
[0061]
最后对基础培养基溶液进行灭菌,采用的灭菌温度为116℃,灭菌时间为30min。
[0062]
c源补料培养基组分:
[0063][0064]
本实施例的一份c源补料培养基组分先添加至三分之二体积的纯水中,搅拌至无固体颗粒后再定容,转入补料瓶。
[0065]
然后对c源补料培养基溶液进行灭菌,采用的灭菌温度为116℃,灭菌时间为30min。
[0066]
诱导补料培养基组分:
[0067][0068]
将本实施例的一份诱导补料培养基组分先添加至三分之二体积的纯水中,搅拌至无固体颗粒后再定容,转入补料瓶。
[0069]
然后对诱导补料培养基溶液进行灭菌,采用的灭菌温度为116℃,灭菌时间为30min。
[0070]
上述基因工程大肠杆菌高密度发酵培养基按照如下步骤进行发酵培养:
[0071]
步骤1:将灭菌好的c源补料培养基和诱导补料培养基分别通过补料泵与发酵罐相连,将配置好的无菌2mnaoh溶液通过碱泵与发酵罐相连调节基础培养基ph值;
[0072]
步骤2:设置发酵温度37℃、通气量5l/min、转速200rpm-800rpm,使用碱泵将ph调至6.8-7.4,当一切参数稳定后进行接种;本步骤中转速优选为450rpm,ph优选为7;
[0073]
步骤3:发酵时,使用碱补料泵关联ph在6.8-7.4。通过调节转速200-800rpm、通气量5-15l/min将溶氧维持在30%;本步骤中ph优选为7,转速优选为400rpm,通气量优选为10l/min;
[0074]
步骤4:每小时记录发酵罐溶氧、ph、转速和通气量,每小时测量细菌生长od值、湿重和活菌数;
[0075]
步骤5:发酵前4小时,设置补料泵流加c源补料培养基,流速5-7ml/h。发酵4小时以后,调整c源补料泵流速至22.5-25ml/h;本步骤中发酵前流速优选为6ml/h,发酵后流速优
选为25ml/h;
[0076]
步骤6:当细菌od
600
值达到10,将各参数整为诱导最佳值,温度调至12-37℃,ph调至6.8-7.4,待参数稳定后,加入诱导剂进行诱导表达4-20h;本步骤中温度优选调至18℃,ph优选调至7,待参数稳定后,加入诱导剂进行诱导表达优选为9h;
[0077]
步骤7:诱导时,设置诱导培养基补料泵进行补料,每小时流加量50~75ml/h;本步骤中每小时流加量优选为70ml/h;
[0078]
步骤8:达到最佳诱导时长,停止发酵,收获菌体。最佳诱导时长为4到16小时,本实施例中取值为4小时。
[0079]
按上述发酵工艺发酵3批次,同时用厂家原有批次式发酵工艺进行发酵3批次作为对照组,对比结果如图1、图2所示,可以看出,与批次发酵相比,本发明的高密度发酵平均菌泥收获量提高了5倍,同时单位菌泥目的蛋白表达量提高1.5倍,目的蛋白总收获量提高7.5倍。
[0080]
实施例二
[0081]
本实施例给出一种基于大肠杆菌表达系统的酶的发酵表达所基于的培养基及采用的发酵工艺,具体的:
[0082]
基础培养基组分:
[0083]
[0084][0085]
根据发酵的硬件条件,上述的一份基础培养基组分需要浓缩1.5倍配制。
[0086]
然后将配置好的基础培养基组分先添加至三分之二体积的纯水中,搅拌至无固体颗粒后再定容,转入发酵罐。
[0087]
最后对基础培养基溶液进行灭菌,采用的灭菌温度为116℃,灭菌时间为30min。
[0088]
c源补料培养基组分:
[0089][0090]
[0091]
将上述的一份c源补料培养基组分先添加至三分之二体积的纯水中,搅拌至无固体颗粒后再定容,转入补料瓶。
[0092]
然后对转入补料瓶的c源补料培养基溶液进行灭菌,采用的灭菌温度为116℃,灭菌时间为30min。
[0093]
诱导补料培养基组分:
[0094][0095]
将上述的一份诱导补料培养基组分先添加至三分之二体积的纯水中,搅拌至无固体颗粒后再定容,转入补料瓶。
[0096]
然后对转入补料瓶的诱导补料培养基溶液进行灭菌,采用的灭菌温度为116℃,灭菌时间为30min。
[0097]
上述基因工程大肠杆菌高密度发酵培养基按照如下步骤进行发酵培养:
[0098]
步骤1:将灭菌好的c源补料培养基和诱导补料培养基分别通过补料泵与发酵罐相连,将配置好的无菌10mnaoh溶液通过碱泵与发酵罐相连调节基础培养基ph;
[0099]
步骤2:设置发酵温度37℃、通气量60l/min、转速200rpm-800rpm,使用碱泵将ph调至6.8-7.4。当一切参数稳定后进行接种;本步骤中转速优选为300rpm,ph优选为6.8。
[0100]
步骤3:发酵时,使用碱补料泵关联ph在6.8-7.4。通过调节转速200-800rpm rpm、通气量60-180l/min将溶氧维持在30%;本步骤中ph优选为6.8,转速优选为500rpm,通气量优选为90l/min;
[0101]
步骤4:每小时记录发酵罐溶氧、ph、转速和通气量,每小时测量细菌生长od值、湿重和活菌数;
[0102]
步骤5:发酵前4小时,设置补料泵流加c源补料培养基,流速60-84ml/h。发酵4小时以后,调整c源补料泵流速至270-300ml/h;本步骤中发酵前流速优选为68ml/h,发酵后流速优选为275ml/h;
[0103]
步骤6:当细菌od
600
值达到35-50,将各参数整为诱导最佳值,温度调至12-37℃,ph调至6.8-7.4,待参数稳定后,加入诱导剂进行诱导表达4-20h;本步骤中优选当细菌od
600
值达到40时,将各参数整为诱导最佳值,温度优选调至20℃,ph调至7.1,待参数稳定后,加入诱导剂进行诱导表达优选为8h;
[0104]
步骤7:诱导时,设置诱导培养基补料泵进行补料,每小时流加量600~900ml/h;本
步骤中每小时流加量优选为700ml/h;
[0105]
步骤8:达到最佳诱导时长,停止发酵,收获菌体。最佳诱导时长为4到16小时,本实施例中取值为10小时。
[0106]
同时用厂家原有发酵工艺进行发酵作为对照组,对比结果如图3、图4所示,可以看出,与对照组相比,本发明的高密度发酵在保证酶活的情况下,将细菌收获量提高了2倍多,最终目的蛋白收获量提高2倍多。
[0107]
实施例三
[0108]
本实施例给出一种基于大肠杆菌表达系统的羊衣原体病基因工程亚单位疫苗的发酵表达所基于的培养基及采用的发酵工艺,具体的:
[0109]
基础培养基组分:
[0110]
[0111][0112]
根据发酵的硬件条件,本实施例中的一份基础培养基组分需要稀释1.25倍配制。
[0113]
然后将配置好的基础培养基组分先添加至三分之二体积的纯水中,搅拌至无固体颗粒后再定容,转入发酵罐。
[0114]
最后对转入发酵罐的基础培养基溶液进行灭菌,采用的灭菌温度为116℃,灭菌时间为30min。
[0115]
c源补料培养基组分:
[0116][0117]
将本实施例中的一份c源补料培养基组分先添加至三分之二体积的纯水中,搅拌至无固体颗粒后再定容,转入补料瓶。
[0118]
然后对转入补料瓶的c源补料培养基溶液进行灭菌,采用的灭菌温度为116℃,灭菌为时间30min。
[0119]
诱导补料培养基组分:
[0120][0121]
将本实施例中的一份诱导补料培养基组分先添加至三分之二体积的纯水中,搅拌至无固体颗粒后再定容,转入补料瓶。
[0122]
然后对转入补料瓶的诱导补料培养基溶液进行灭菌,采用的灭菌温度为116℃,灭菌时间为30min。
[0123]
上述基因工程大肠杆菌高密度发酵培养基按照如下步骤进行发酵培养:
[0124]
步骤1:将灭菌好的c源补料培养基和诱导补料培养基分别通过补料泵与发酵罐相连,将配置好的无菌2mnaoh溶液通过碱泵与发酵罐相连调节基础培养基ph;
[0125]
步骤2:设置发酵温度37℃、通气量16l/min、转速200rpm-800rpm,使用碱泵将ph调至6.8-7.4。当一切参数稳定后进行接种;本步骤中转速优选为300rpm,ph优选为6.8;
[0126]
步骤3:发酵时,使用碱补料泵关联ph在6.8-7.4。通过调节转速200-800rpm、通气量16-48l/min将溶氧维持在30%;本步骤中ph优选为6.8,转速优选为400rpm,通气量优选为30l/min;
[0127]
步骤4:每小时记录发酵罐溶氧、ph、转速和通气量,每小时测量细菌生长od值、湿重和活菌数;
[0128]
步骤5:发酵前4小时,设置补料泵流加c源补料培养基,流速16-22.4ml/h。发酵4小时以后,调整c源补料泵流速至72-80ml/h;本步骤中发酵前流速优选为16ml/h,发酵后流速优选为76ml/h;
[0129]
步骤6:当细菌od
600
值达到25-30,将各参数整为诱导最佳值,温度调至12-37℃,ph调至6.8-7.4,待参数稳定后,加入诱导剂进行诱导表达4-20h;本步骤中优选为当细菌od
600
值达到25时将各参数整为诱导最佳值,温度优选的调至20℃,ph优选调至7.2,待参数稳定后,加入诱导剂进行诱导表达优选为8h;
[0130]
步骤7:诱导时,设置诱导培养基补料泵进行补料,每小时流加量160~240ml/h;本步骤中每小时流加量优选为180ml/h;
[0131]
步骤8:达到最佳诱导时长,停止发酵,收获菌体。最佳诱导时长为4到16小时,本实施例中取值为10小时。
[0132]
同时用厂家原有的2
×
yt培养基和发酵工艺进行发酵作为对照组,对比结果如图
5、图6所示;可以看出,与2
×
yt培养基发酵相比,本发明的高密度发酵在保证目的蛋白纯度的情况下,将菌泥收获量提高8倍,最终目的蛋白收获量提高8倍。
[0133]
实施例四
[0134]
本实施例给出一种基于大肠杆菌表达系统的羊包虫病基因工程亚单位疫苗的发酵表达所基于的培养基及采用的发酵工艺,具体的:
[0135]
基础培养基组分:
[0136][0137]
[0138]
根据发酵的硬件条件,本实施例的一份基础培养基组分按照原浓度配制。
[0139]
将配置好的基础培养基先添加至三分之二体积的纯水中,搅拌至无固体颗粒后再定容,转入发酵罐。
[0140]
最后对转入发酵罐的基础培养基溶液进行灭菌,采用的灭菌温度为116℃,灭菌时间为30min。
[0141]
c源补料培养基组分:
[0142][0143]
将本实施例的一份c源补料培养基组分先添加至三分之二体积的纯水中,搅拌至无固体颗粒后再定容,转入补料瓶。
[0144]
然后对转入补料瓶的c源补料培养基溶液进行灭菌,采用的灭菌温度为116℃,灭菌时间为30min。
[0145]
诱导补料培养基组分:
[0146][0147]
将本实施例的一份诱导补料培养基组分先添加至三分之二体积的纯水中,搅拌至无固体颗粒后再定容,转入补料瓶。
[0148]
然后对转入补料瓶的诱导补料培养基溶液进行灭菌,采用的灭菌温度为116℃,灭菌时间为30min。
[0149]
上述基因工程大肠杆菌高密度发酵培养基按照如下步骤进行发酵培养:
[0150]
步骤1:将灭菌好的c源补料培养基和诱导补料培养基分别通过补料泵与发酵罐相连,将配置好的无菌2mnaoh溶液通过碱泵与发酵罐相连调节基础培养基ph;
[0151]
步骤2:设置发酵温度37℃、通气量2.5l/min、转速200rpm-800rpm,使用碱泵将ph调至6.8-7.4。当一切参数稳定后进行接种;本步骤中转速优先为600rpm,ph优选为6.9;
[0152]
步骤3:发酵时,使用碱补料泵关联ph在6.8-7.4。通过调节转速200-800rpm、通气
量2.5-7.5l/min将溶氧维持在30%;本步骤中ph优选为6.9,转速优选为500rpm,通气量优选为5l/min;
[0153]
步骤4:每小时记录发酵罐溶氧、ph、转速和通气量,每小时测量细菌生长od值、湿重和活菌数;
[0154]
步骤5:发酵前4小时,设置补料泵流加c源补料培养基,流速2.5-3.5ml/h。发酵4小时以后,调整c源补料泵流速至11.25-12.5ml/h;本步骤中发酵前流速优选为3ml/h,发酵后流速优选为12ml/h;
[0155]
步骤6:当细菌od
600
值达到30-40,将各参数整为诱导最佳值,温度调至12-37℃,ph调至6.8-7.4,待参数稳定后,加入诱导剂进行诱导表达4-20h;本步骤中优选当细菌od
600
值达到30时,将各参数整为诱导最佳值,温度优选调至25℃,ph调至7.4,待参数稳定后,加入诱导剂进行诱导表达优选10h;
[0156]
步骤7:诱导时,设置诱导培养基补料泵进行补料,每小时流加量25~37.5ml/h;本步骤中每小时流加量优选为30ml/h;
[0157]
步骤8:达到最佳诱导时长,停止发酵,收获菌体。最佳诱导时长为4到16小时,本实施例中取值为11小时。
[0158]
按上述发酵工艺发酵4批次,同时每批次用厂家原有批次式发酵工艺进行发酵作为对照,对比结果如图7、图8所示,可以看出,与批次发酵相比,本发明的高密度发酵在保证目的蛋白纯度的情况下,将菌泥收获量提高3-4倍,最终目的蛋白收获量提高3-4倍。
[0159]
实施例五
[0160]
本实施例给出一种基于大肠杆菌表达系统的pcv2病毒样颗粒的发酵表达所基于的培养基及采用的发酵工艺,具体的:
[0161]
基础培养基组分:
[0162]
[0163][0164]
根据发酵的硬件条件,本实施例的一份基础培养基组分按照原浓度配制。
[0165]
然后将配置好的基础培养基先添加至三分之二体积的纯水中,搅拌至无固体颗粒后再定容,转入发酵罐。
[0166]
最后对转入发酵罐的基础培养基溶液进行灭菌,采用的灭菌温度为116℃,灭菌时间为30min。
[0167]
c源补料培养基组分:
[0168][0169]
将本实施例的一份c源补料培养基组分先添加至三分之二体积的纯水中,搅拌至无固体颗粒后再定容,转入补料瓶。
[0170]
然后对转入补料瓶中的c源补料培养基溶液进行灭菌,采用的灭菌温度为116℃,灭菌时间为30min。
[0171]
诱导补料培养基组分:
[0172][0173]
将本实施例的一份诱导补料培养基组分先添加至三分之二体积的纯水中,搅拌至无固体颗粒后再定容,转入补料瓶。
[0174]
然后对转入补料瓶的诱导补料培养基溶液进行灭菌,采用的灭菌温度为116℃,灭菌时间为30min。
[0175]
上述基因工程大肠杆菌高密度发酵培养基按照如下步骤进行发酵培养:
[0176]
步骤1:将灭菌好的c源补料培养基和诱导补料培养基分别通过补料泵与发酵罐相连,将配置好的无菌2mnaoh溶液通过碱泵与发酵罐相连调节基础培养基ph;
[0177]
步骤2:设置发酵温度37℃、通气量15l/min、转速200rpm-800rpm,使用碱泵将ph调至6.8-7.4。当一切参数稳定后进行接种;本步骤中转速优选为700rpm,ph优选为7;
[0178]
步骤3:发酵时,使用碱补料泵关联ph在6.8-7.4。通过调节转速200-800rpm、通气量15-45l/min将溶氧维持在30%;本步骤中ph优选为7,转速优选为500rpm,通气量优选为25l/min;
[0179]
步骤4:每小时记录发酵罐溶氧、ph、转速和通气量,每小时测量细菌生长od值、湿重和活菌数;
[0180]
步骤5:发酵前4小时,设置补料泵流加c源补料培养基,流速15-21ml/h。发酵4小时以后,调整c源补料泵流速至67.5-75ml/h;本步骤中发酵前流速优选为20ml/h,发酵后流速优选为75ml/h;
[0181]
步骤6:当细菌od
600
值达到30-40,将各参数整为诱导最佳值,温度调至12-37℃,ph调至6.8-7.4,待参数稳定后,加入诱导剂进行诱导表达4-20h;本步骤中优选的当细菌od
600
值达到35时,将各参数整为诱导最佳值,温度优选调至25℃,ph优选调至7.4,待参数稳定后,加入诱导剂进行诱导表达优选为12h;
[0182]
步骤7:诱导时,设置诱导培养基补料泵进行补料,每小时流加量150~225ml/h;本步骤中每小时流加量170ml/h;
[0183]
步骤8:达到最佳诱导时长,停止发酵,收获菌体,最佳诱导时长为4到16小时,本实施例中取值为9小时。
[0184]
如图9所示为湿重和目的蛋白收获量情况,本发明的高密度发酵用于可溶性病毒样颗粒表达,也能有收获较高的湿重和较高的目的蛋白浓度。
[0185]
本领域的普通技术人员将会意识到,这里所述的实施例是为了帮助读者理解本发明的原理,应被理解为本发明的保护范围并不局限于这样的特别陈述和实施例。对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的权利要求范围之内。
