1.本发明涉及生殖生物学技术领域,特别涉及一种培养液及提高母源糖尿病卵子质量的方法。
背景技术:
2.随着社会经济发展,人类不孕不育问题也日益严重。目前,全球不孕不育夫妇约15%,部分国家和地区高达30%左右,其中40-50%的不孕不育是由母源因素引起的。在母源因素导致的不孕不育中,卵子质量降低是最主要的原因之一。卵子成熟过程中很多体内外因素都会导致卵子质量低下,如纺锤体异常、染色体不均等分离、线粒体功能下降等。低质量卵子受精率降低,胚胎发育潜能降低,也易导致新生儿甚至成年时较高的患病风险。在导致卵子质量降低的诸多因素中,母体代谢异常如糖尿病、肥胖等是最重要的原因之一。而且,糖尿病等代谢性疾病已经成为威胁人类健康的最重要的疾病。我国糖尿病发病人数已高达9千万以上,其中青少年患病率也居世界首位,而且快速增加。母源糖尿病会导致卵子成熟过程中减数分裂异常如纺锤体形态异常、染色体排列异常、染色体不均等分离率升高、受精率和胚胎发育潜能降低、流产率升高、卵子线粒体分布和功能异常等。
技术实现要素:
3.本发明的主要目的是提出一种培养液及提高母源糖尿病卵子质量的方法,旨在提高母源糖尿病卵子的质量。
4.为实现上述目的,本发明提出一种培养液,用于体外培养母源糖尿病卵丘-卵母细胞复合体,所述培养液包括茶多酚。
5.可选地,所述培养液中茶多酚的浓度为25~50μm。
6.可选地,所述培养液中茶多酚的浓度为50μm。
7.可选地,所述培养液还包括失活胎牛血清、丙酮酸钠、100
×
青链霉素、fsh和α-mem培养基。
8.可选地,所述培养液中失活胎牛血清的体积分数为4%~6%;和/或,
9.所述培养液中丙酮酸钠的浓度为0.20~0.30mm;和/或,
10.所述培养液中100
×
青链霉素的体积分数为0.7%~0.8%;和/或,
11.所述培养液中fsh的浓度为0.4~0.6u/ml。
12.本发明进一步提出一种提高母源糖尿病卵子质量的方法,包括以下步骤:
13.s10、构建母源糖尿病动物模型,并从所述母源糖尿病动物模型中分离卵丘-卵母细胞复合体;
14.s20、将所述卵丘-卵母细胞复合体置于培养液中培养,得mii期卵母细胞,其中,所述培养液为如上所述的培养液。
15.可选地,步骤s10中,所述母源糖尿病动物模型的血糖浓度大于等于17.0mm。
16.可选地,步骤s10中,从所述母源糖尿病动物模型中分离卵丘-卵母细胞复合体的
步骤包括:
17.向所述母源糖尿病动物模型的腹腔注射孕马血清促性腺激素,46~48h后取出卵巢,收集卵丘-卵母细胞复合体。
18.可选地,步骤s20中,培养条件为:二氧化碳体积浓度4%~6%,温度36~38℃,培养15~17h。
19.可选地,在步骤s20中,所述培养液的表面覆盖有石蜡油。
20.本发明提出的培养液,用于体外培养母源糖尿病卵丘-卵母细胞复合体,所述培养液包括茶多酚,在含有茶多酚的培养液中进行体外培养,有效的提高了卵子质量。培养中用到的茶多酚来自茶叶提取物,属于天然活性物质,对人体及动物等没有毒副作用,安全性好,且易得低廉。本发明提出的培养液,能提高母源糖尿病卵子的质量,改善母源糖尿病患者的生育问题。
附图说明
21.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅为本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
22.图1为本发明提出的提高母源糖尿病卵子质量的方法的一实施例的流程示意图;
23.图2为本发明实施例3得到的卵丘-卵母细胞复合体的示意图;
24.图3为本发明实施例3中培养cocs的培养皿及设备示意图;
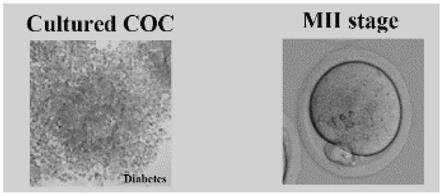
25.图4为本发明实施例3得到的培养16h后的卵丘-卵母细胞复合体及mii期卵母细胞示意图;
26.图5为本发明实施例3、实施例4、对比例1和对照组的mii期卵母细胞的纺锤体形态和染色体分布图;
27.图6为本发明实施例3、实施例4、对比例1和对照组的mii期卵母细胞的ros含量结果图;
28.图7为本发明实施例3、实施例4、对比例1和对照组的mii期卵母细胞的线粒体膜电位结果图。
具体实施方式
29.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
30.需要说明,若本发明实施例中有涉及方向性指示(诸如上、下、左、右、前、后、外、内
……
),则该方向性指示仅用于解释在某一特定姿态(如附图所示)下各部件之间的相对位置关系、运动情况等,如果该特定姿态发生改变时,则该方向性指示也相应地随之改变。
31.另外,若本发明实施例中有涉及“第一”、“第二”等的描述,则该“第一”、“第二”等的描述仅用于描述目的,而不能理解为指示或暗示其相对重要性或者隐含指明所指示的技
术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。另外,全文中出现的“和/或”的含义,包括三个并列的方案,以“a和/或b”为例,包括a方案、或b方案、或a和b同时满足的方案。另外,各个实施例之间的技术方案可以相互结合,但是必须是以本领域普通技术人员能够实现为基础,当技术方案的结合出现相互矛盾或无法实现时应当认为这种技术方案的结合不存在,也不在本发明要求的保护范围之内。
32.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
33.母源糖尿病会导致卵子成熟过程中减数分裂异常如纺锤体形态异常、染色体排列异常、染色体不均等分离率升高、受精率和胚胎发育潜能降低、流产率升高、卵子线粒体分布和功能异常等。
34.鉴于此,本发明提出一种培养液,旨在提高母源糖尿病卵子的质量。本发明附图中,图1为本发明提出的提高母源糖尿病卵子质量的方法的一实施例的流程示意图;图2为本发明实施例3得到的卵丘-卵母细胞复合体的示意图;
35.图3为本发明实施例3中培养cocs的培养皿及设备示意图;图4为本发明实施例3得到的培养16h后的卵丘-卵母细胞复合体及mii期卵母细胞示意图;图5为本发明实施例3、实施例4、对比例1和对照组的mii期卵母细胞的纺锤体形态和染色体分布图;图6为本发明实施例3、实施例4、对比例1和对照组的mii期卵母细胞的ros含量结果图;图7为本发明实施例3、实施例4、对比例1和对照组的mii期卵母细胞的线粒体膜电位结果图。
36.本发明提出一种培养液,用于体外培养母源糖尿病卵丘-卵母细胞复合体(cumulus-ocoyte complexes,cocs),所述培养液包括茶多酚。
37.本发明提出的培养液,用于体外培养母源糖尿病卵丘-卵母细胞复合体,所述培养液包括茶多酚,在含有茶多酚的培养液中进行体外培养,有效的提高了卵子质量。培养中用到的茶多酚来自茶叶提取物,属于天然活性物质,对人体及动物等没有毒副作用,安全性好,且易得低廉。本发明提出的培养液,能提高母源糖尿病卵子的质量。
38.对于培养液中茶多酚的浓度,本发明不做限制,优选地,所述培养液中茶多酚的浓度为25~50μm。浓度过低时,茶多酚对卵子质量提高效果不明显,浓度过高时,反而不利于卵子质量的提高,上述范围内,提高效果好。更优选地,所述培养液中茶多酚的浓度为50μm。研究表明,上述浓度下,卵子纺锤体结构异常、染色体排列异常显著降低,卵子ros(细胞内活性氧)水平显著降低,卵子线粒体功能得到恢复,与正常卵子无明显差异。
39.优选地,在本发明实施例中,所述培养液还包括失活胎牛血清、丙酮酸钠、青链霉素、fsh和α-mem培养基。其中,fsh为卵泡刺激素,具有促进卵泡发育成熟作用,与黄体生成素一起促进雌激素分泌。上述组分和茶多酚共同作用,提高母源糖尿病卵子的质量。
40.对于上述组分的浓度,本发明也不做限制,优选地,所述培养液中失活胎牛血清的体积分数为4%~6%,例如可以是4%、5%、6%等,失活胎牛血清为热失活胎牛血清;丙酮酸钠的浓度为0.20~0.30mm,例如0.20mm、0.22mm、0.25mm、0.28mm、0.30mm等;100
×
青链霉素为青霉素和链霉素的混合液,其中,青霉素的含量为10ku/ml,链霉素的含量为10mg/ml,100
×
青链霉素的体积分数为0.7%~0.8%,例如0.7%、0.75%、0.8%等,其体积分数为青
霉素和链霉素体积之和占混合液的体积分数;fsh的浓度为0.4~0.6u/ml,例如0.4u/ml、0.5u/ml、0.6u/ml等。研究表明,更优选地,所述培养液中失活胎牛血清的体积分数为5%;所述培养液中丙酮酸钠的浓度为0.25mm;所述培养液中100
×
青链霉素的体积分数为0.75%;所述培养液中fsh的浓度为0.5u/ml,上述浓度下,卵子纺锤体结构异常、染色体排列异常显著降低,卵子ros(细胞内活性氧)水平显著降低,卵子线粒体功能得到恢复,与正常卵子无明显差异。
41.请参阅图1,本发明进一步提出一种提高母源糖尿病卵子质量的方法,包括以下步骤:
42.s10、构建母源糖尿病动物模型,并从所述母源糖尿病动物模型中分离卵丘-卵母细胞复合体。
43.本步骤中,母源糖尿病动物模型通过以下方法建立:向动物的腹腔单次注射220mg/kg体重的stz(链脲佐菌素),4天后通过尾尖取血,用罗氏血糖仪测血糖浓度,如果血糖浓度大于等于17.0mm/l,则认为母源糖尿病动物模型构建成功。链脲佐菌素是一种诱导糖尿病动物模型的药物,给动物注射一定量的stz后,可得到糖尿病动物模型,用于糖尿病研究。因此,所述母源糖尿病动物模型的血糖浓度大于等于17.0mm。
44.进一步地,从所述母源糖尿病动物模型中分离卵丘-卵母细胞复合体的步骤包括:
45.向所述母源糖尿病动物模型的腹腔注射孕马血清促性腺激素(pmsg),46~48h后取出卵巢,收集卵丘-卵母细胞复合体。
46.具体地,在母源糖尿病动物模型构建成功后第10天,向动物的腹腔注射8iu的pmsg,46~48h后从腹腔取卵巢,至于含有米力农的m2培养液中,用1ml注射器针头刺穿卵泡,收集cocs,收集过程在含有米力农的m2培养液中进行,完成卵丘-卵母细胞复合体的分离。
47.s20、将所述卵丘-卵母细胞复合体置于培养液中培养,得mii期卵母细胞,其中,所述培养液为如上所述的培养液。
48.本步骤中,将分离出的卵丘-卵母细胞复合体置于含有茶多酚的培养液中培养,以得到mii期卵母细胞,具体地,用培养液清洗,去除米力农,然后将cocs转移到经过夜平衡的覆盖有石蜡油的培养滴,每个培养滴30~50微升。优选地,培养条件为:二氧化碳体积浓度4%~6%,温度36~38℃,培养15~17h。更优选地,培养条件为:二氧化碳体积浓度5%,温度37℃,培养16h。此外优选湿度为该温度下的饱和湿度,上述条件下,得到的mii期卵母细胞质量好。
49.此外,优选地,培养时,所述培养液的表面覆盖有石蜡油,能够防止培养过程中培养液蒸发和酸碱度改变,保证培养环境的稳定。
50.在本发明实施例中,步骤s10和s20均在直径3.5cm的塑料培养皿中进行,此外,步骤s20培养用多个培养液滴进行,所用培养滴大小为30~50微升每个。
51.本发明提出的提高母源糖尿病卵子质量的方法,简单易行,能提高母源糖尿病卵子的质量,改善母源糖尿病患者的生育问题。
52.以下结合具体实施例和附图对本发明的技术方案作进一步详细说明,应当理解,以下实施例仅用以解释本发明,并不用于限定本发明。
53.实施例1培养液
54.培养液包括以下成分:茶多酚(50μm)、热失活胎牛血清(体积分数5%)、丙酮酸钠(0.25mm)、100
×
青链霉素(体积分数0.75%)、fsh(0.5u/ml)和α-mem培养基。
55.实施例2培养液
56.除茶多酚浓度为25μm外,其余配方和浓度与实施例1相同。
57.实施例3提高母源糖尿病卵子质量的方法
58.(1)构建母源糖尿病动物模型,并从所述母源糖尿病动物模型中分离卵丘-卵母细胞复合体:母源糖尿病动物模型的建立通过腹腔注射220mg/kg体重的stz进行。首先选择7-8周龄小鼠体重,确定stz用量。用柠檬酸-柠檬酸钠缓冲液于冰上避光溶解stz,每只小鼠注射液体量不超过100微升。4天后通过尾尖取血,用血糖仪测量血糖浓度,其大于等于17.0mm/l者认为模型构建成功。模型构建成功后10天,腹腔注射pmsg 8iu,于46-48h后取卵巢,在解剖镜下用1ml注射器针头刺破卵泡,收集cocs,如图2所示的为高质量的cocs。整个收集过程在添加有米力农的m2培养液中进行,培养液至少提前预热2h。
59.(2)将所述卵丘-卵母细胞复合体置于培养液中培养:将(1)中的cocs转移到过夜平衡的覆盖有石蜡油的培养滴(实施例1的培养液)里,并清洗三次,去除米力农。如图3所示,清洗后的cocs至于培养箱中培养,培养条件为二氧化碳浓度5%,温度37℃,饱和湿度,所用培养液为实施例1的培养液,体外培养16h,即可得到mii期卵母细胞。
60.培养之后,得到的mii期卵母细胞如图4左图所示,可以看出,培养16h后cocs发育良好,去除颗粒细胞后的卵子排出了第一极体,发育成熟,之后,将成熟的cocs转移到含有1%透明质酸酶的m2培养液中,室温孵育5分钟,用移液枪吹打液体,使颗粒细胞和卵子分离;然后收集裸卵,如图4右图所示,用m2培养液清洗卵子,直到干净为止。
61.实施例4提高母源糖尿病卵子质量的方法
62.除采用实施例2的培养液以外,其余步骤和条件与实施例3相同。
63.对比例1
64.除培养液中不添加茶多酚以外,其余步骤和条件与实施例3相同。
65.以正常卵子为对照(control),对实施例3和4及对比例1得到的mii期卵母细胞进行如下测试:
66.以正常卵子为对照(control),将清洗后的卵子用4%的多聚甲醛室温固定40分钟,然后用含有0.1%的tween20和0.01%的tritonx-100的pbs清洗液清洗3次,每次5分钟;然后置于含有0.01%tritonx-100的pbs中室温20分钟,用清洗液清洗3次,每次5分钟;清洗后的卵子转移到含有1%bsa(牛血清)的清洗液中(封闭液),室温封闭1小时或4度过夜;然后转移到含有微管蛋白抗体(带有荧光标签的抗体,否则需要染二抗)的封闭液中,四度过夜;之后,用清洗液洗3次,每次5分钟;之后置于含有淬灭剂的pi中,并封片,用荧光倒置显微镜观察纺锤体形态和染色体分布,得图5。图5可以看出,相比于培养液中不添加茶多酚的对比例1,本发明实施例3和4得到的mii期卵母细胞纺锤体结构异常、染色体排列异常显著降低,与正常卵子(control)相似,实施例3的mii期卵母细胞更接近于正常卵子。
67.以正常卵子为对照(control),用ros检测试剂盒检测卵子ros含量,试剂盒购自碧云天生物技术有限公司,并按照说明书进行操作,得图6。图6可以看出,相比于培养液中不添加茶多酚的对比例1,本发明实施例3和4得到的mii期卵母细胞ros水平显著降低,与正常卵子无明显差异,实施例3的mii期卵母细胞更接近于正常卵子。
68.以正常卵子为对照(control),用膜电位检测试剂盒检测线粒体膜电位,试剂盒购买自碧云天生物科技有限公司,操作步骤按说明书进行,得图7。图7可以看出,相比于培养液中不添加茶多酚的对比例1,本发明实施例3和4得到的mii期卵母细胞线粒体功能得到恢复,与正常卵子相比没有差异,实施例3的mii期卵母细胞更接近于正常卵子。
69.综上所述,本发明提出的培养液,体外培养母源糖尿病卵丘-卵母细胞复合体后,可显著提高母源糖尿病卵子的质量,卵子纺锤体结构异常、染色体排列异常显著降低,卵子ros(细胞内活性氧)水平显著降低,卵子线粒体功能得到恢复,与正常卵子无明显差异。也即本发明提出的培养液,能提高母源糖尿病卵子的质量,改善母源糖尿病患者的生育问题。
70.以上仅为本发明的优选实施例,并非因此限制本发明的专利范围,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之类,所作的任何修改、等同替换、改进等,均应包括在本发明的专利保护范围内。
