一种与小麦穗发芽抗性相关的kasp分子标记与应用
技术领域
1.本发明涉及kasp分子标记的应用,特别涉及一种与小麦穗发芽抗性相关的kasp分子标记与应用。
背景技术:
2.穗发芽(pre-harvest sprouting,phs)是指小麦在收获前遇到阴雨或在潮湿环境下的穗上发芽。尤其小麦白粒品种为主,穗发芽抗性弱,一旦发生穗发芽造成的损失较大。发生穗发芽的麦田一般减产6-10%,并且发芽的麦粒中淀粉酶、蛋白酶和脂肪酶的活性大大增加,导致淀粉、蛋白质和脂肪发生降解,造成小麦加工品质下降,严重影响面包、面条和馒头的品质,用其加工出的面包体积变小,内部紧实不松软,使面条韧性和弹性均下降。由于穗发芽还导致面粉中天冬酰胺含量增加,在烘烤面包时天冬酰胺在高温下容易变成致癌的丙烯酰胺。因此,提高小麦品种穗发芽抗性是小麦育种的重要目标之一。
3.小麦穗发芽是受多基因控制的复杂性状,品种的形态特征及生理生化性状(如种子休眠特性、种皮颜色、α-淀粉酶活性、颖壳抑制物、穗部结构等)都会对小麦穗发芽产生不同程度的影响,其中籽粒休眠特性是影响穗发芽抗性的最主要因素。并且,小麦穗发芽受天气条件影响较大,同一小麦品种在不同年份、不同种植地点所表现出穗发芽抗性也会存在差异,因此田间进行鉴定的难度较大、准确度较低。
4.分子标记辅助选择(marker assisted selection mas)是基于基因型的选择,不受外界环境因素的影响,被越来越广泛地应用于育种实践中。常用的分子标记类型有rflp、aflp、ssr等,但这些标记类型不能与目标基因共分离。功能标记(functional marker)是一类基于基因特征序列开发的标记,与目标基因共分离,大大提高了选择的准确性,在mas中有着广泛应用前景。
5.并且,ssr标记或pcr标记检测速度较慢,不易对育种后代材料进行大规模筛选。kasp标记,即竞争性等位基因特异性pcr(kompetitive allele specific pcr)是近年前发展起来的标记类型,它根据等位基因中包含的特定snp(单碱基核苷酸多太性)或indels(插入/缺失)设计引物,利用在引物末端加入的荧光基团进行检测,可以快速准确的完成基因分型工作,并且能够实现高通量分析,极大的加快了分子标记辅助选择的进程,在作物育种中有着广阔的应用前景。因此,开发用于鉴定小麦穗发芽抗性的kasp标记,具有重要的理论意义和实用价值。
技术实现要素:
6.本发明所要解决的一个技术问题是如何高通量鉴定或辅助鉴定小麦穗发芽抗性。为了解决上述技术问题,本发明提供了下述a1-a3的任一种应用、a4的方法:
7.a1、检测小麦基因组中sdr2a-kasp位点的多态性或基因型(即等位基因)的组合物在鉴定或辅助鉴定小麦穗发芽抗性中的应用;所述sdr2a-kasp位点是小麦基因组中的一个snp位点,其核苷酸种类为g或a,为seq id no.1第643位核苷酸;所述组合物包含所述pcr引
物,所述pcr引物为p1或p2:
8.p1、所述pcr引物为由核苷酸序列是seq id no.2的单链dna、核苷酸序列是seq id no.3的第22-39位的单链dna和核苷酸序列是seq id no.4的第22-40位的单链dna组成的引物组;
9.p2、所述pcr引物为由核苷酸序列是seq id no.2的单链dna、核苷酸序列是seq id no.3的单链dna和核苷酸序列是seq id no.4的单链dna组成的引物组。
10.a2、检测小麦基因组中sdr2a-kasp位点的多态性或基因型(即等位基因)的组合物在制备鉴定或辅助鉴定小麦穗发芽抗性产品中的应用;所述sdr2a-kasp位点是小麦基因组中的一个snp位点,其核苷酸种类为g或a,为seq id no.1第643位核苷酸;所述组合物包含所述pcr引物,所述pcr引物为上述p1或上述p2。
11.a3、检测小麦基因组中所述sdr2a-kasp位点的多态性或基因型(即等位基因)的组合物在小麦育种中的应用或在制备小麦育种产品中的应用;所述sdr2a-kasp位点是小麦基因组中的一个snp位点,其核苷酸种类为g或a,为seq id no.1第643位核苷酸;所述组合物包含所述pcr引物,所述pcr引物为上述p1或上述p2。
12.所述育种的目的包括选育抗穗发芽小麦。
13.a4、鉴定或辅助鉴定小麦穗发芽抗性的方法,包括检测待测小麦的基因型,根据待测小麦的基因型鉴定或辅助鉴定小麦的穗发芽抗性;所述基因型为小麦基因组中所述sdr2a-kasp位点的基因型;所述sdr2a-kasp位点是小麦基因组中的一个snp位点,其核苷酸种类为g或a,为seq id no.1第643位核苷酸;所述检测利用pcr引物进行,所述pcr引物为上述p1或上述p2。
14.本发明所要解决的另一个技术问题是如何进行小麦育种。
15.为了解决上述技术问题,本发明提供了下述技术方案:
16.b1、a4所述的方法在小麦育种中的应用。
17.所述育种的目的包括选育抗穗发芽小麦。
18.b2、小麦育种的方法,包括:检测小麦基因组a1所述sdr2a-kasp的多态性,选择小麦基因组中所述sdr2a-kasp位点为g的纯合型的小麦作为亲本进行育种。
19.所述育种的目的包括选育抗穗发芽小麦。
20.下述含有检测小麦基因组中sdr2a-kasp位点的多态性或基因型(即等位基因)的组合物的1)-3)中任一种产品也属于本发明的保护范围:
21.1)检测与小麦抗穗发芽相关的单核苷酸多态性或基因型的产品;
22.2)鉴定或辅助鉴定小麦穗发芽抗性的产品;
23.3)用于小麦育种的产品。
24.上述应用、方法和产品中,所述sdr2a-kasp位点是小麦基因组中的一个snp位点,其核苷酸种类为g或a,为seq id no.1第643位核苷酸。所述检测小麦基因组中sdr2a-kasp位点的多态性或基因型(即等位基因)具体可为检测sdr2a-kasp位点的核苷酸种类。小麦基因组中sdr2a-kasp位点的基因型可为gg、aa或ag。所述gg是小麦基因组中所述sdr2a-kasp位点为g的纯合型,所述aa是小麦基因组中所述sdr2a-kasp位点为a的纯合型,所述ag是小麦基因组中所述sdr2a-kasp位点为a和g的杂纯合型。
25.a4所述方法中,所述根据待测小麦的基因型鉴定或辅助鉴定小麦的穗发芽抗性可
为基因型为gg的待测小麦穗发芽抗性高于或候选高于基因型为aa的待测小麦穗发芽的抗性。
26.上述应用、方法和产品中,所述小麦育种为培育抗穗发芽小麦或选育抗穗发芽小麦。
27.上述应用、方法和产品中,所述检测小麦基因组中sdr2a-kasp位点的多态性或基因型(即等位基因)的组合物可为通过下述至少一种方法确定sdr2a-kasp的多态性或基因型所需的试剂和/或仪器:dna测序、限制性酶切片段长度多态性、单链构象多态性、变性高效液相色谱和snp芯片。其中,snp芯片包括基于核酸杂交反应的芯片、基于单碱基延伸反应的芯片、基于等位基因特异性引物延伸反应的芯片、基于“一步法”反应的芯片、基于引物连接反应的芯片、基于限制性内切酶反应的芯片、基于蛋白dna结合反应的芯片,及基于荧光分子dna结合反应的芯片。
28.上述应用、方法和产品中,所述检测小麦基因组中sdr2a-kasp位点的多态性或基因型(即等位基因)的组合物如下1)、2)或3):
29.1)所述检测小麦基因组中sdr2a-kasp位点的多态性或基因型的组合物含有扩增包括所述sdr2a-kasp位点在内的小麦基因组dna片段的pcr引物;
30.2)所述检测小麦基因组中sdr2a-kasp位点的多态性或基因型的组合物为含有所述pcr引物的pcr试剂;
31.3)含有1)所述pcr引物或2)所述pcr试剂的试剂盒。
32.上述应用、方法和产品中,所述pcr引物可被标记物标记。所述标记物指可用于提供可检测的效果且可以连接至核酸的任何原子或分子。标记物包括但不限于染料;放射性标记,诸如
32
p;结合部分,诸如生物素(biotin);半抗原,诸如地高辛(dig);发光、发磷光或发荧光部分;和单独的荧光染料或与可以通过荧光共振能量转移(fret)抑制或移动发射光谱的部分组合的荧光染料。标记可以提供可通过荧光、放射性、比色、重量测定、x射线衍射或吸收、磁性、酶活性等检测的信号。标记可以是带电荷的部分(正电荷或负电荷)或可选地,可以是电荷中性的。标记可以包括核酸或蛋白序列或由其组合,只要包含标记的序列是可检测的。在一些实施方案中,核酸在没有标记的情况下直接检测(例如,直接读取序列)。如所述pcr引物可为由核苷酸序列是seq id no.2的单链dna、核苷酸序列是seq id no.3的单链dna和核苷酸序列是seq id no.4的单链dna组成的引物组,序列表中seq id no.3由39个核苷酸组成,第1-21位核苷酸为fam接头序列(作为标记物),第22-39位核苷酸为特异序列;序列表中seq id no.4由40个核苷酸组成,第1-21位核苷酸为hex接头序列(作为标记物),第22-40位核苷酸为特异序列。
33.上述应用、方法和产品中,所述产品可为试剂或试剂盒或系统,所述系统可包括试剂或试剂盒、仪器和分析软件的组合产品,如由pcr引物、parms master mix试剂、酶标仪和在线软件snp decoder(http://www.snpway.com/snpdecoder01/)组成的产品,由pcr引物、parms master mix试剂、在线软件snp decoder和荧光定量pcr仪组成的组合产品。所述产品可包括上述检测小麦基因组中sdr2a-kasp位点的多态性或基因型的组合物。
34.本发明公开了一种新的用于检测小麦穗发芽抗性的kasp标记。本发明提供的特异引物组,由seq id no.2所示的单链dna、seq id no.3所示的单链dna和seq id no.4所示的单链dna组成,其中seq id no.3所示的单链dna和seq id no.4所示的单链dna带有荧光标
记接头。本发明的一个实施例中,上述使用带有荧光标记接头的引物组扩增两组多个样品包括sdr2a-kasp位点在内的小麦基因组dna,利用高通量基因分型检测仪pherastar snp进行荧光信号处理,确定了sdr2a-kasp位点的核苷酸类型,并测定了每个待测样品的发芽指数。实验证明,在由83个小麦品种组成的第1组群体和由61个小麦品种组成的第2组群体中,sdr2a-kasp位点为g的纯合型小麦品种的发芽指数显著低于sdr2a-kasp位点为a的纯合型小麦品种的发芽指数,说明sdr2a-kasp为g的纯合型小麦品种的穗发芽抗性显著高于snp位点sdr2a-kasp为a的纯合型小麦品种。说明sdr2a-kasp是与小麦穗发芽抗性相关的snp分子标记,本发明提供的特异引物组可用于鉴定或辅助鉴定小麦穗发芽抗性,可用于小麦穗发芽抗性品种的筛选,可用于小麦分子标记辅助育种,可用于抗穗发芽小麦的选育和培育。sdr2a-kasp的多态性直接以dna的形式表现,在小麦的各个组织及各个发育阶段均可检测到,有利于方便快捷地预测小麦穗发芽抗性。在实际应用中,为了提高准确率,可将检测sdr2a-kasp位点多态性和基因型的组合物与其他物质(如检测其他与小麦抗穗发芽相关的单核苷酸多态性或基因型的物质)联合在一起制备鉴定小麦抗穗发芽品种的产品。将本发明中的特异性引物组运用于小麦抗穗发芽分子标记辅助选择,能快速筛选出具有较高穗发芽抗性的小麦品种(种质),从而加速抗穗发芽小麦新品种的培育进程。本发明对于利用分子标记辅助选择抗穗发芽的小麦品种具有重要的理论意义和经济价值。
附图说明
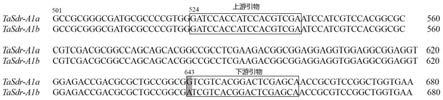
35.图1为本发明实施例1中sdr2a-kasp标记引物对与seq id no.1所示序列的特异性结合位点。
36.图2为本发明实施例1中利用sdr2a-kasp标记检测第1组小麦品种的基因分型结果图。
具体实施方式
37.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
38.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
39.本实施例中所有引物合成均由上海生工生物工程技术服务有限公司完成。
40.实施例1
41.前期,发明人克隆了位于小麦2a染色体上的tasdr-a1基因,开发了一个用于鉴定小麦穗发芽抗性的功能标记sdr2a,但此标记为caps(酶切扩增多态性序列),需要进行pcr和限制性核酸内切酶酶切,操作步骤繁琐,不易实现高通量检测。因此,本发明根据tasdr-a1基因含有的snp位点,开发了该基因的kasp标记sdr2a-kasp,极大的加快了小麦穗发芽抗性的检测速度。
42.1.应用kasp标记sdr2a-kasp检测普通小麦品种tasdr-a1等位基因类型
43.普通小麦品种tasdr-a1中存在一个snp位点,为seq id no.1第643位核苷酸,其核苷酸种类为g或a,以字母r代表。tasdr-a1的一个等位基因型为gg(即seq id no.1第643位核苷酸为g的纯合型),将该类型小麦作为tasdr-a1a(又称g碱基类型);tasdr-a1的另一个等位基因型为aa(即seq id no.1第643位核苷酸为a的纯合型),将该类型小麦作为tasdr-a1b(又称a碱基类型)。
44.利用kasp标记sdr2a-kasp批量检测每组中各普通小麦品种tasdr-a1等位基因类型,分为如下两个步骤:pcr扩增和基因分型。
45.(1)pcr扩增
46.以ctab法提取普通小麦基因组dna,加400μl te溶解。dna经1%琼脂糖凝胶电泳进行质量检测,所提dna要求无明显杂质、条带清晰、无降解。以此小麦基因组dna为模板,进行pcr扩增。
47.kasp标记引物工作液制备:根据小麦籽粒休眠tasdr-a1基因643位点处的snp设计kasp引物,该snp位点的多态性为a/g碱基差异,引物序列见表1,其与seq id no.1所示序列的特异性结合位点示意图见图1。
48.表1 用于鉴定普通小麦tasdr-a1基因等位变异的kasp标记引物序列
[0049][0050]
上述seq id no.2与seq id no.3所示的单链dna分子扩增seq id no.1第643位核苷酸为g的片段,用酶标仪或荧光定量pcr仪可读取到与fam序列结合的荧光基团的荧光信号;
[0051]
上述seq id no.2与seq id no.4所示的单链dna分子扩增seq id no.1第643位核苷酸为a的片段,用酶标仪或荧光定量pcr仪可读取到与hex序列结合的荧光基团的荧光信号。
[0052]
取上游引物(100μm)30μl、下游引物-1(100μm)12μl,下游引物-2(100μm)12μl,用无菌超纯水补充至100μl,作为kasp标记的引物工作液,-20℃保存备用。
[0053]
pcr扩增体系为:模板dna 2.2μl(浓度为20-50ng/μl),引物工作液0.056μl,50mm mgcl2(lgc公司,lot no.:10364672)0.08μl,kasp 2
×
master mix(lgc公司,lotno.10371613)2.5μl,用无菌超纯水补充反应体系至5μl。
[0054]
pcr反应程序为:95℃预变性15min;95℃变性20s、复性20s(第一次的复性温度为
65℃,每个循环降温1℃)共10个循环;95℃变性10s,57℃复性1min,共30个循环;10℃保存。
[0055]
(2)基因分型
[0056]
以96孔板或384孔板进行kasp snp检测,pcr反应完成后利用高通量基因分型检测仪pherastar snp扫描仪(lgc公司)对反应产物进行荧光数据读取。fam荧光激发波长为485nm,发射波长为520nm;hex荧光激发波长为535nm,发射波长为556nm。荧光扫描结果利用klustercaller软件进行图形化展示,gg基因型(tasdr-a1a)带有fam荧光,分布于x轴附近;aa基因型(tasdr-a1b)带有hex荧光,分布于y轴附近;杂合类型分布于对角线附近,无检出信号的样本分布于原点附近。
[0057]
2.应用kasp标记sdr2a-kasp检测普通小麦品种穗发芽抗性
[0058]
针对两组普通小麦品种进行实验,第一组普通小麦共83个中国冬小麦品种,第二组普通小麦共61个品种,所有品种均为公知品种,分别记载于非专利文献《the seed dormancy allele tasdr-a1a associated with pre-harvest sprouting tolerance is mainly present in chinese wheat landraces》、《cloning of seed dormancy genes(tasdr)associated with tolerance to pre-harvest sprouting in common wheat and development of a functional marker》、《isolation and characterization of viviparous-1 genes in wheat cultivars with distinct aba sensitivity and pre-harvest sprouting tolerance》、《distribution of vp-1 alleles in chinese white-grained landraces,historical and current wheat cultivars》和《cloning of tacyp707a1 gene that encodes aba 8
′‑
hydroxylase in common wheat(triticum aestivum l.)》中,在河北省农林科学院粮油作物研究所小麦研究中心有保存,公众可以从河北省农林科学院粮油作物研究所获得,以重复本技术实验,不可作为其它用途使用。
[0059]
(1)利用sdr2a-kasp标记检测第1组小麦品种。第1组小麦品种共83份,种植于北京,基因型检测结果见图2。
[0060]
小麦收获后检测籽粒的发芽指数(germination index)。发芽指数检测方法如下:在培养皿中放置两层滤纸,将滤纸用无菌水浸润,然后将籽粒腹沟向下放到滤纸上,室温培养,每天调查发芽籽粒数,连续调查7天,计算籽粒的发芽指数。通过籽粒发芽指数表征穗发芽抗性。
[0061][0062]
式中,n1、n2、
…
、n7依次表示种子在第1d、第2d、
…
、第7d,每日当天的发芽粒数。total grains表示调查的籽粒总数。进行三次重复实验,结果取平均值,结果见表2。83份中国冬小麦品种中:19份品种为tasdr-a1a(gg)基因型,发芽指数平均值为19.6;64个品种为tasdr-a1b(aa)基因型,发芽指数平均值为39.3;携带等位基因tasdr-a1a的小麦品种的发芽指数低于携带等位基因tasdr-a1b的小麦品种的发芽指数,两者具有显著差异(p《0.01),结果见表3。
[0063]
表2 第1组小麦品种sdr2a-kasp标记检测结果和发芽指数
[0064]
[0065]
[0066][0067]
表3 第2组普通小麦tasdr-a1基因等位变异类型与籽粒发芽指数关系的统计结果
[0068]
[0069][0070]
说明:发芽指数后面的不同字母代表差异达到极显著水平(p《0.01)。
[0071]
(2)利用sdr2a-kasp标记检测第2组小麦品种。第2组小麦品种共61份,种植于河南安阳。小麦收获后检测籽粒的发芽指数(germination index),发芽指数测定方法同上文(1)中的发芽指数测定方法。进行三次重复实验,结果取平均值,结果见表4。61份中国冬小麦品种中:10份品种为tasdr-a1a基因型,发芽指数平均值为16.4;51份品种为tasdr-a1b基因型,发芽指数平均值为41.2;携带等位基因tasdr-a1a的小麦品种的发芽指数低于携带等位基因tasdr-a1b的小麦品种的发芽指数,两者具有显著差异(p《0.01),结果见表5。
[0072]
表4 第2组小麦品种sdr2a-kasp标记检测结果和发芽指数
[0073]
[0074]
[0075][0076]
表5 第2组普通小麦tasdr-a1基因等位变异类型与籽粒发芽指数关系的统计分析结果
[0077][0078]
说明:发芽指数后面的不同字母代表差异达到极显著水平(p《0.01)。
[0079]
综上,sdr2a-kasp的基因型为gg(tasdr-a1a,又称g碱基类型)的小麦品种籽粒发芽指数显著低于sdr2a-kasp的基因型为aa(tasdr-a1b,又称a碱基类型),说明snp位点sdr2a-kasp为tasdr-a1a基因型小麦的穗发芽抗性显著高于snp位点sdr2a-kasp为tasdr-a1b基因型的小麦。
[0080]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
