一种直扩era偶联crispr/cas12a的核酸一步实时检测方法
技术领域
1.本发明属于分子生物学检测技术领域,具体涉及一种直扩era偶联crispr/cas12a的核酸一步实时检测方法。
背景技术:
2.近年来食用农产品中致病微生物的污染状况不容乐观。金黄色葡萄球菌成为仅次于沙门氏菌和副溶血杆菌的第三大微生物致病菌,导致食物中毒的事件时有发生。金黄色葡萄球菌(staphylococcus aureus),隶属于葡萄球菌属(staphylococcus),有“嗜肉菌”的别称,是革兰氏阳性菌的代表。金黄色葡萄球菌具有很强的致病性,动物被感染会后引起食源性疾病。金黄色葡萄球菌可以通过空气传播,在侵染人体后,会分泌出多种毒素,如肠毒素(staphylococcal enterotoxins,ses),ses可以促进金黄色葡萄球菌导致人体食物中毒。肠毒素的热稳定性非常高,在煮沸的条件下(100℃),30min还可保持生物学活性。目前已经发现的金黄色葡萄球菌肠毒素有20种,研究指出肠毒素sei、seg、she、see、sed、sec、seb以及sea能够诱发肠炎综合征。同时金黄色葡萄球菌在接触人体如眼睛、口腔或者伤口时,攻击人体的免疫细胞,可以导致人体化脓感染,甚至可引起肺炎甚至脑膜炎和脓血症等疾病,严重的会导致死亡。因此建立一种金黄色葡萄球菌病毒的快速实时核酸检测方法是十分必要的。
3.大麦是我国重要的经济农作物之一,除了供人食用外,也是作为牲畜铺草或用为粗饲料的重要原料。同时大麦芽也是啤酒酿造的主要原料之一,每年的产出量和质量是至关重要的。而大麦黄花病毒(barley yellow mosaic virus),是大麦黄花叶病毒属的代表种,侵染大麦使其染病,导致其产量和质量严重下降,且目前尚未出现抵抗该病毒的转基因作物。因此,开展对大麦黄花叶病毒的日常病毒检测也是十分有必要的。
4.目前传统的分子诊断方法主要有pcr,荧光定量pcr,基因芯片和环介导等温扩增方法(lamp)。然而,无论是pcr还是实时荧光定量pcr均需要经过预热-变性-退火-延伸等热循环过程,才能实现核酸的扩增。且必须依赖专门的实验设备及条件,这限制了pcr技术在非实验室条件下对核酸进行快速检测的要求。
5.基因芯片又称生物芯片,该技术将序列一致的靶序列的探针固定在支持物表面,再与待测样本中的源核酸杂交,最终通过测定荧光强度变化,对样品的序列信息进行解读和分析,高通量获取相关生物信息然而,相对来说基因芯片比较昂贵且操作较复杂,对操作人员的专业素质要求比较高,限制了它的广泛使用。
6.lamp技术是一种恒温扩增反应,比pcr反应速度更快,而且成本低,易推广。它只需一个简单的恒温器,不需要昂贵的pcr仪,缩短反应时间,且对操作人员的分子生物学技能要求不高。但是,lamp在引物设计上要设计至少两对引物,由于引物的增多可能会导致引物与引物互相作用,从而限制了反应。另外,lamp也可能会出现非特异性扩增。
7.crispr,全称规则成簇间隔短回文重复序列(clustered regularly interspaced short palindromic repeats),是细菌和某些古细菌在进化过程中形成的获得性免疫应答
0.55m的naoh和9.5-10mm的na2edta;
22.3)扩增反应
23.将步骤2)制备的模板加入era-cas 12a反应体系中,37℃保温50-60min,完成核酸的扩增反应;
24.4)荧光实时检测
25.在步骤3)的扩增反应过程中,每分钟收集1次荧光值,检测荧光值时,λex=493nm,λem=522nm,制作标准样品浓度-最大荧光值标准曲线,根据获得的标准曲线计算待测样品浓度。
26.优选地,步骤3)中,所述era-cas12a反应体系中各物质的终浓度为:上游引物era-f 0.1-0.3μm、下游引物era-r 0.1-0.3μm、crrna 15.6-62.5nm、ssdna-fq 25-100nm、cas12a 25-100nm和激活剂280mm mg(oac)2溶液。
27.本发明的era偶联crispr/cas12a技术主要涉及era扩增反应和crispr/cas12a反式切割作用。
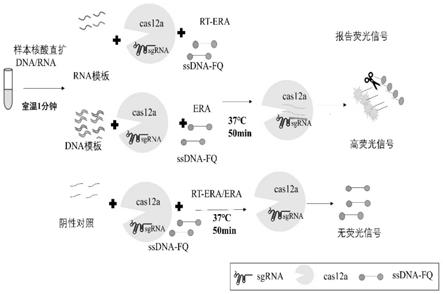
28.重组酶扩增技术(enzymatic recombinase amplification,era),是属于等温核酸扩增技术rpa(recombinase polymerase amplification)技术的又一分支,其原理与rpa类似,主要依靠三种酶:能结合单链核苷酸(寡核苷酸引物)的重组酶、单链dna结合蛋白ssb和具有链置换活性的dna聚合酶,在等温条件(37-42℃)下,重组酶与引物结合形成复合体,寻找双链dna上的同源序列,一旦序列匹配,就可以发生链置换反应并启动dna的合成,实现靶标dna的指数扩增,而被替换的dna链与ssb蛋白结合,阻止进一步替换。
29.crispr,全称规则成簇间隔短回文重复序列(clustered regularly interspaced short palindromic repeats),是细菌和某些古细菌在进化过程中形成的获得性免疫系统。cas12a蛋白的反式切割活性被发现,当crrna识别靶基因序列并配对后,引导刺激cas12a蛋白的反式切割作用,单链寡核苷酸(ssdna)被无差别切割,在ssdna两端的荧光发射基团和荧光猝灭基团分离,从而使得荧光监测系统接收到荧光信号,即每切割一条dna单链,就有一个荧光分子形成,实现荧光信号的累积与扩增产物的同步进行。本发明中,era扩增能有效地放大cas12a的反式切割作用,使得反应更加高效快速进行。
30.本发明中基于直扩era偶联crispr/cas12a基因编辑系统的核酸实时检测新方法,采用一步法,将crispr/cas12a基因编辑系统直接加入era反应体系,era与cas12a在在同一反应体系下,使epa扩增反应和crispr/cas12a反式切割作用进行偶联,利用cas12a蛋白的反式切割活性,37℃保温50-60min即可完成dna或rna扩增反应,实现靶标dna或者rna快速精准检测,反应结果通过荧光可视化,可实现实时定性、定量检测,降低了气溶胶污染,减少了劳动强度,节约时间。
31.本发明在细菌基因组dna抽提方法中,采用碱裂解法,选取的两种裂解试剂不仅可以裂解细菌,还将整个体系ph值调整至8.0以上,可有效地抑制核酸酶活性,防止细菌dna被降解,同时粗提时间只需1-3分钟,耗时短。
32.本发明中,在制备模板时采用模板直扩技术,加入含有终浓度为0.45-0.55m的naoh和9.5-10mm的na2edta的裂解液,无论是dna模板还是rna模板,一分钟室温裂解完成模板的制备。
33.本发明可用于食源性病原菌金黄色葡萄球菌和大麦黄花叶病毒的直扩era偶联
crispr/cas12a一步法核酸实时检测,在对金黄色葡萄球菌进行检测时,设置阴性对照(ddh2o)体系,以包含金黄色葡萄球菌目的序列的基因组为阳性,配制阳性反应体系,设置阴性对照以证明反应体系未被其他基因组污染,达到辨别阳性样品的目的,验证测定结果的正确性。为了防止实验出现假阳性结果,配制阳性反应体系和对照体系时,进行分区操作。
34.本发明提供一种金黄色葡萄球菌的直扩era偶联crispr/cas12a检测方法,包括以下步骤:
35.1)设计引物
36.选取金黄色葡萄球菌的靶基因,genbank id:cp049528.1,其扩增长度为174bp,具体核苷酸序列如seq id no.1所示,根据选取的靶基因设计相应的引物,获得上游引物era-sau-f、下游引物era-sau-r、sau-crrna和ssdna-fq;所述ssdna-fq的具体序列为:fam-5
’‑
tttttt-3
’‑
tamra;
37.2)制备模板
38.将待测金黄色葡萄球菌的dna样品加入裂解液,室温下,剧烈混匀5-10秒,静置1-3分钟,取上清液,即可完成模板的制备;
39.其中,所述裂解液中含有终浓度为0.45-0.55m的naoh和9.5-10mm的na2edta;
40.3)扩增反应
41.将步骤2)制备的模板加入era-cas 12a反应体系中,37℃保温50-60min,完成dna的扩增反应;
42.其中,所述era-cas12a反应体系中包括:上游引物era-sau-f0.1-0.3μm、下游引物era-sau-r 0.1-0.3μm、sau-crrna 15.6-62.5nm、ssdna-fq 25-100nm、cas12a 25-100nm和激活剂280mm mg(oac)2溶液;
43.4)荧光实时检测
44.在步骤3)的扩增反应过程中,每分钟收集1次检测荧光值时,λex=493nm,λem=522nm,荧光值,先制作标准样品浓度-最大荧光值标准曲线,再根据获得的标准曲线计算待测样品浓度。
45.优选地,步骤1)中设计的引物从5’到3’,具体核苷酸序列如下:
46.era-sau-f:5
’‑
cagctccacagagtacagatgcaagtaataaag-3’;
47.era-sau-r:5
’‑
ctccagagtcaataccaactgtcacattcgtca-3’;
48.sau-crrna5
’‑
uaauuucuacuaaguguagauguuuagcggcug uagcugca-3’。
49.优选地,所述era-cas 12a反应体系的总体积为20μl,各成分的终浓度为:era-sau-f和era-sau-r各0.1μm、reaction buffer 5μl、liquid basic 3μl、sau-crrna 31.25nm、ssdna-fq 75nm、cas12a 25nm、基因组1μl和激活剂2μl。
50.本发明提供一种大麦黄花叶病毒的直扩era偶联crispr/cas12a检测方法,包括以下步骤:
51.1)设计引物
52.从ncbi中找到大麦黄花叶病毒的靶基因,登录号:aj224622.1,其扩增长度为102bp,具体核苷酸序列如seq id no.2所示,根据选取的靶基因设计相应的引物,获得上游引物era-baymv-f、下游引物era-baymv-r、baymv-crrna和ssdna-fq;
53.2)制备模板
54.将待测大麦黄花叶的rna样品加入裂解液,室温下,剧烈混匀5-10秒,静置1-20分钟,取上清液,即可完成模板的制备;
55.其中,所述裂解液中含有:终浓度为2-5u/μl的rnase抑制剂、0.45-0.55m的naoh和9.5-10mm的na2edta;
56.5)扩增反应
57.将步骤2)制备的模板加入era-cas 12a反应体系中,37℃保温50-60min,完成rna的扩增反应;
58.其中,所述era-cas12a反应体系中包括:上游引物era-baymv-f0.1-0.3μm、下游引物era-baymv-r 0.1-0.3μm,baymv-crrna 15.6-62.5nm、ssdna-fq 25-100nm、cas12a 25-100nm和激活剂280mm的mg(oac)2溶液;
59.3)荧光实时检测
60.在步骤3)的扩增反应过程中,每分钟收集1次荧光值,检测荧光值时,λex=493nm,λem=522nm,先制作标准样品浓度-最大荧光值标准曲线,再根据获得的标准曲线计算待测样品浓度。
61.优选地,步骤1)中设计的引物从5’到3’,具体核苷酸序列如下:
62.era-baymv-f:gctttcgatttcttcgtcccacgatcatggat;
63.era-baymv-r:cggaagttaacatggtgttatacgttccagtt;
64.baymv-crrna:ggguaauuucuacuaaguguagauauugaccaaugugcaacuag。
65.本发明提供一种用于直扩era偶联crispr/cas12a检测中的试剂盒,其包括预分装的干粉试剂a和液体试剂b两部分,所述干粉试剂a为吹干或冻干试剂,封装在离心管管盖中;液体试剂b为液体试剂,储存在离心管管体中;其中,干粉试剂a为dna型或rna型;
66.dna型的干粉试剂a中各物质用量为:上游引物era-f 2-6pmol,下游引物era-r 2-6pmol,liquid basic 2-4μl,crrna 0.31-1.25pmol,lbcas12a 0.5-2pmol,rna酶抑制剂4-8u,ssdna-fq 0.5-2pmol,海藻糖4-8μm;
67.rna型的干粉试剂a中各物质用量为:上游引物era-f 2-6pmol,下游引物era-r 2-6pmol,liquid basic 2-4μl,crrna 0.31-1.25pmol,lbcas12a 0.5-2pmol,逆转录酶200-400u,rna酶抑制剂4-8u,ssdna-fq 0.5-2pmol,海藻糖4-8μl;
68.液体试剂b中各物质用量为:reaction buffer 3-7μl,depc-h2o 7.5-13μl,激活剂1-2.5μl,所述激活剂为280mm的mg(oac)2溶液。
69.进一步,所述试剂盒在使用时采用模板直扩方式,室温裂解1分钟即完成dna模板或rna模板的制备。
70.又,所述试剂盒在使用时,将制备的dna模板或rna模板加入液体试剂b后,将装有干粉试剂a的离心管管盖盖在装有的液体试剂b的管体上,倒置1min,与液体试剂b混合,上下颠倒混匀后,放入荧光恒温扩增仪检测,所述荧光恒温扩增仪集恒温扩增与荧光信号检测于一体,扩增过程中能实时检测并自动判读结果。
71.本发明的试剂盒中,将干粉试剂a和液体试剂b预分装,无需现场配制反应体系,将模板加入液体试剂b后,将装有干粉试剂a的离心管管盖盖在管体上,倒置1min,与液体试剂b混合,混匀后放入荧光检测仪检测,进行结果观察,扩增完成后,可实时判断结果,无需再
次开盖,无需电泳,既简化了现场操作步骤,又可有效防止污染,无需专业实验室和专业人员,高中生训练0.5-2小时即可掌握,完全是“傻瓜式”操作。
72.本发明的试剂盒可室温存放7个月,可常温运输,避免了冷链运输。应用时仅需在加入模板时开盖一次,扩增完成后,可直接得出判断结果,无需再次开盖,无需电泳,既简化了现场操作步骤,又可有效防止污染。
73.与现有技术相比,本发明具有如下有益效果:
74.本发明将crispr/cas12a基因编辑系统直接加入era反应体系,在同一反应体系下使epa扩增反应和crispr/cas12a反式切割作用进行偶联,一步式完成反应,利用cas12a蛋白的反式切割活性,实现靶标dna或者rna快速精准检测,并且反应结果通过荧光可视化,实现实时检测。
75.本发明首创了核酸检测“傻瓜式”操作步骤,只需三个步骤即完成检测:第一步:模板直扩,一分钟室温裂解完成dna或rna模板制备;第二步:模板加入试剂b,将干粉试剂a与液体试剂b混匀后放入荧光检测仪检测;第三步,扩增完成后,可实时判断结果,无需再次开盖,无需电泳,既简化了现场操作步骤,又可有效防止污染,无需专业实验室和专业人员。而传统的核酸检测需要在专业实验室和专业人员的操作,步骤繁琐,还增加了污染的风险和劳动强度,影响检测的重复性。
76.本发明的直扩era偶联crispr/cas12a检测方法特异性好,灵敏度高,其灵敏度检测和模拟样本实验结果一致,最低检测线为10copies/reaction,具有反应条件简单、操作简便快速、结果判定方便、准确等优点。
77.本发明中,分别以金黄色葡萄球菌(dna模板)和大麦黄花叶病毒(rna模板)为实验材料,建立能够用于dna或者rna模板的精准、实时、可视化、定性、定量的核酸检测试剂盒方法,并且对试剂盒工艺进一步改进,以满足更高的检测要求。
78.本发明提供的金黄色葡萄球菌era引物特异性强,与常见的其他7种病原微生物:变形杆菌、克雷伯杆菌、福氏志贺氏菌、铜绿假单胞菌、腊样芽孢杆菌、链球菌和沙门氏菌都无交叉反应。
79.本发明的检测方法重演性好,用于检测大麦黄花叶病毒时,检测特异性好,与其他7种病原微生物具体包括小麦土传花叶病毒(wsbmv)、大麦黄矮病毒(bydv)、小麦线条花叶病毒(wsmv)、大麦和性花叶病毒(bammv)、大麦条纹花叶病毒(bsmv)、大麦黄条点花叶病毒(bysmv)、北方禾谷花叶病毒(ncmv),均不产生交叉反应,灵敏度高,检测限约为0.001ng/μl,且在100-0.001ng/μl范围内符合线性关系。
附图说明
80.图1为本发明中直扩era偶联crispr/cas12a核酸检测原理示意图。
81.图2为本发明实施例1中era体系优化电泳结果示意图。
82.图3为本发明实施例1中金黄色葡萄球菌era偶联crispr/cas12a核酸检测方法中cas12a与crrna比例优化结果示意图。
83.图4-5为本发明实施例1中金黄色葡萄球菌era偶联crispr/cas12a核酸检测方法的灵敏度结果,其中,图4表示各浓度梯度的金黄色葡萄球菌样品的实时荧光扩增曲线,而图5为标准样品浓度-最大荧光值标准曲线。
84.图6-7为本发明实施例1中金黄色葡萄球菌era偶联crispr/cas12a核酸检测方法特异性结果示意图,图6为样品实时荧光扩增曲线,图7显示各样品最大荧光值。
85.图9-10为本发明实施例1中金黄色葡萄球菌era偶联crispr/cas12a核酸检测方法模拟样品检测结果示意图,其中,图8为样品实时扩增曲线,图9为样品的最大荧光值,图10位样品浓度-最大荧光值标准曲线。
86.图11为本发明实施例2中重演性分析大麦黄花叶病毒era偶联crispr/cas12a核酸检测方法中crrna与cas12a比例优化结果。
87.图12-13为本发明实施例2中重演性分析大麦黄花叶病毒era偶联crispr/cas12a核酸检测方法灵敏度结果示意图。图12为样品实时扩增曲线,图13为样品浓度-最大荧光值标准曲线。
88.图14-15为本发明实施例2中重演性分析大麦黄花叶病毒era偶联crispr/cas12a核酸检测特异性结果示意图,其中,图14为样品实时扩增曲线,图15为样品最大荧光值。
89.图16为本发明实施例3中干粉试剂a和液体试剂b预分装示意图。
90.图17为本发明试剂盒的操作流程示意图。
具体实施方式
91.以下结合具体实施例对本发明作进一步说明。
92.实施例1参见图1,一种用于检测金黄色葡萄球菌的直扩era偶联crispr/cas12a检测方法
93.1.era偶联crispr/cas12a核酸检测金黄色葡萄球菌
94.1)粗提细菌基因组dna
95.取20μl的金黄色葡萄球细菌菌液,加200μl的裂解液,剧烈混匀5s,室温放置1min,取1μl上清液并作为模板,其中,所述裂解液由0.5m naoh和10mm na2edta组成。
96.2)配制并优化era-cas 12a反应体系
97.以ddh2o为阴性对照,以包含金黄色葡萄球菌目的序列的基因组(靶基因174bp,genbank id:cp049528.1,具体核苷酸序列如seq id no.1所示)为阳性对照(103copies/reaction),配制era-cas 12a反应体系。
98.所述era-cas 12a反应体系中,总体积20μl,包括:浓度为10μm的上游引物era-sau-f和下游引物era-sau-r各0.2-0.6μl,liquid basic 2-4μl,reaction buffer 5-7μl,0.625μm的sau-crrna 0.5-2μl,1μm的lbcas12a 0.5-2μl,1μm ssdna-fq 0.5-2μl,基因组1μl,用无核酸酶的蒸馏水补足,反应最终由2μl激活剂启动反应,所述激活剂为280mm mg(oac)2溶液。
99.其中,涉及上游引物era-sau-f、下游引物era-sau-r、crrna、ssdna-fq序列,具体序列如下:
100.crrna:uaauuucuacuaaguguagauguuuagcggcuguagcugca;
101.era-sau-f:cagctccacagagtacagatgcaagtaataaag;
102.era-sau-r:ctccagagtcaataccaactgtcacattcgtca;
103.ssdna-fq:fam-5
’‑
tttttt-3
’‑
tamra。
104.3)进行反应
105.将步骤2)制备的模板加入era-cas 12a反应体系中,37℃保温50-60min,完成dna扩增反应;
106.4)鉴定扩增结果:
107.实时荧光检测仪反应的程序为:在进行dna扩增反应时,每分钟收集1次荧光值,λex 493nm,λem 522nm;
108.阳性样品出现明显的扩增曲线,而阴性样本无扩增曲线。
109.先制作标准样品浓度-最大荧光值标准曲线,再根据获得的标准曲线计算待测样品浓度,实现定性、定量检测。
110.2.era偶联crispr/cas12a核酸检测金黄色葡萄球菌体系优化
111.本发明对era反应体系中的引物、liquid basic和reaction buffer分别进行了优化筛选,不同的反应物浓度对应的扩增效率不同,根据正交实验对引物、liquid basic和reaction buffer三个因素的添加量进行优化,具体方案如表1所示,反应体系为50μl。
112.表1为本实施例中era体系优化反应液各试剂的比例
113.序号10μm primer(μl)liquid basic(μl)reaction buffer(μl)11.861520.691530.9121541.2121851.591861.562171.261580.961890.61221101.8921111.8918120.6618130.9921141.2921151.51215
114.era扩增反应结束后,产物经过3%的琼脂糖凝胶电泳,根据扩增产物的积累即目的条带的亮度筛选最优反应混合物最佳组合。
115.最终确定,50μl的era反应体系中,各物质的终浓度范围为:era-sau-f和era-sau-r各0.12-0.36μm,reaction buffer15-21μl,liquid basic 6-12μl和激活剂2μl,在该浓度范围内,都能获得良好的反应效率和产物产量,见图2。
116.本发明在确定era反应体系各物质浓度之后,对crispr/cas12a体系中的crrna和cas12a的比例进一步进行调整,反应体系优化方案设计如表2所示,反应体系为20μl。
117.表2 crrna、cas12a的比例优化反应液各试剂的比例
118.序号0.625μm crrna(μl)100pmol/μl cas12a(μl)10.50.5
210.531.50.5420.552161.5171180.5190.51.51011.5111.51.51221.51322141.521512160.52
119.实验步骤:
120.1)era偶联crispr/cas12a核酸检测反应体系中包括:era-sau-f和era-sau-r各0.1μm,reaction buffer 5μl,liquid basic 3μl,crrna见表2,ssdna-fq 75nm,cas12a见表2,余下由无核酸酶的蒸馏水补足,提取的基因组dna 1μl,总体积20μl。
121.2)分别加入阴性对照(ddh2o)和阳性模板(再分别在两组的管盖上加入激活剂2μl,将各体系的混合物涡旋混匀、瞬离。
122.3)鉴定扩增结果:
123.实时荧光检测仪反应的程序为:在进行dna扩增反应时,每一分钟收集1次荧光值,λex 493nm,λem 522nm。
124.结果如图3所示,可见,组2荧光值最大,反应效率最高,因此确定的最佳反应体系为:10μm era-sau f和era-sau-r各0.2μl,liquid basic 3μl,reaction buffer 5μl,0.625μm crrna 1μl,1μm lbcas12a 0.5μl,1μm ssdna-fq 1.5μl,基因组dna 1μl,反应由2μl激活剂启动,最后无核酸酶的蒸馏水补足20μl。
125.3.灵敏度检测
126.将金黄色葡萄球菌dna经nanodrop 1000uv-v分光光度计测定dna浓度并计算目的片段拷贝数(http://cels.uri.edu/gsc/cndna.html),进行稀释到10
7-100copies/μl进行反应。
127.反应体系:10μm era-sau-f和era-sau-r各0.2μl,liquid basic 3μl,reaction buffer 5μl,0.625μm crrna 1μl,1μm lbcas12a 0.5μl,1μm ssdna-fq 1.5μl,基因组dna 1μl,反应由2μl激活剂启动,最后由无核酸酶的蒸馏水补足20μl。
128.实时荧光检测仪反应的程序为:37℃50min每一分钟收集1次荧光值(λex 493nm,λem 522nm)。
129.如图4、5所示,阳性样品出现明显的扩增曲线,而阴性样本无扩增曲线(每梯度3个重复,根据方差分析进行显著性分析),建立的标准样品浓度-最大荧光值标准曲线,标准曲
线y=25240x
–
18970(r2=0.9912),计算样本浓度,可实现定性、定量检测。
130.结果表明,本发明涉及的检测方法最低检测限为10拷贝。
131.4.特异性
132.本实施例为验证筛选出来的金黄色葡萄球菌的引物特异性,模板分别为金黄色葡萄球菌阳性对照、金黄色葡萄球菌、变形杆菌、克雷伯杆菌、福氏志贺氏菌、铜绿假单胞菌、腊样芽孢杆菌、链球菌、沙门氏菌,ntc为阴性对照。
133.反应体系:10μm era-sau-f、era-sau-r各0.2μl,liquid basi c 3μl,reaction buffer 5μl,0.625μm crrna 1μl,1μm lbcas12a 0.5μl,1μm ssdna-fq 1.5μl,基因组dna 1μl,反应由2μl激活剂启动,最后由无核酸酶的蒸馏水补足20μl。。
134.结果判定方法参见实施例2,如图6、7所示,除金黄色葡萄球菌及其阳性对照以外显著的扩增曲线外,其余病毒样本和阴性对照均无扩增曲线。同时根据最大荧光值进行方差分析(每个样品3个重复),判定只有金黄色葡萄球菌样品与阴性对照有显著性差异,因此本发明涉及的金黄色葡萄球菌检测方法的特异性好,不与其他病原菌产生交叉感染。
135.5.模拟样品检测
136.在验证模拟现场检测实验中,通过验证人工污染猪肉的检出限来进行。
137.取经国家标准检测证实不含有本发明所涉及的食源性致病菌金黄色葡萄球菌的猪肉25克,切碎后加入225ml灭菌的生理盐水匀浆,制备猪肉匀浆液。将金黄色葡萄球菌分别接种于lb液体培养基中,在培养箱中37℃,220rpm振荡过夜培养,采用分光光度计进行测定,测出在波长为660时的od值,并换算成菌落数。
138.取致病菌菌液1ml加入到9ml猪肉匀浆液中,混合后作为污染食品样品原样,用匀浆液作为稀释液进行10倍倍比稀释,每个稀释度用粗提试剂提取基因组dna,进行modified detectr扩增确定金黄色葡萄球菌在猪肉中的检出限。
139.实验结果图8-10所示,模板浓度分别为10
4-100cfu/reaction浓度的金黄色葡萄球菌基因组dna,ntc为阴性对照。该实验表明在模拟样品实验中最低检测限为10cfu/reaction,与前述灵敏度结果一致。
140.同时,样本浓度在10
4-10copies/reaction范围内,荧光值与样本dna浓度呈线性关系,y=1944*x+2662(r2=0.9854)。
141.实施例2大麦黄花叶病毒的直扩era偶联crispr/cas12a检测方法
142.本实施例为验证该发明的实际应用性,将该发明中era偶联crispr/cas12a核酸检测金黄色葡萄球菌体系优化检测方法应用于rna病毒-大麦黄花叶病毒的检测中。
143.从ncbi中找到大麦黄花叶病毒(登录号:aj224622.1)的特异性序列,使用软件primer premier 5.0,根据era引物设计原则进行引物设计,并设计相应的crrna序列。
144.具体序列如下:
145.era-baymv-f:gctttcgatttcttcgtcccacgatcatggat;
146.era-baymv-r:cggaagttaacatggtgttatacgttccagtt;
147.baymv-crrna:ggguaauuucuacuaaguguagauauugaccaaugugcaacuag;
148.ssdna-fq:fam-5
’‑
tttttt-3
’‑
tamra。
149.参考实施例1的era优化体系,era-f和era-r各0.12-0.36μm,reaction buffer15-21μl,liquid basic 6-12μl和激活剂2μl,在该浓度范围内,都能获得良好的反应效率和产
物产量。
150.参考实施例1,20μl era偶联crispr/cas12a核酸检测大麦黄花叶病毒体系优化反应体系优化(具体方案如表2所示)中包括:era-baymv-f/r 0.1μm,reaction buffer 5μl,liquid basic 3μl,crrna 15.6-62.5nm,ssdna-fq 75nm,lbcas12a 25-100nm,余下由无核酸酶的蒸馏水补足,提取的基因组dna 1μl,反应有2μl激活剂激活,实验结果见图11。
151.在上述反应范围内,得出最佳的大麦黄花叶病毒的era-cas12a反应体系:era-baymv-f、era-baymv-r各0.1μm,reaction buffer 5μl,liquid basic 3μl,62.5nm crrna,100nm lbcas12a,75nm ssdna-fq,基因组1μl,反应有2μl激活剂激活。
152.实时荧光检测仪反应的程序为:37℃50min每一分钟收集1次荧光值(λex 493nm,λem 522nm)。
153.鉴定扩增结果:阳性样品出现明显的扩增曲线,而阴性样本无扩增曲线,实验结果可通过建立标准样品浓度-最大荧光值标准曲线,计算样本浓度,可实现定性、定量检测。
154.进一步,本实施例使用上述优化的体系和程序,对其进行特异性和灵敏度验证。
155.实验结果判定方法参见实施例1
156.1)在验证灵敏度实验中,含有大麦黄花叶病毒的rna模板浓度经100ng/μl-0.001ng/μl,10倍稀释,作为模板进行实验。
157.图12、13表明,大麦黄花叶病毒的检测限都是0.001ng/μl,rna模板在100ng/μl-0.001ng/μl内,符合线性关系,y=9592.6x+8596.1(r2=0.9913)。
158.2)在验证特异性实验中,与其他7种病原微生物具体包括小麦土传花叶病毒(wsbmv)、大麦黄矮病毒(bydv)、小麦线条花叶病毒(wsmv)、大麦和性花叶病毒(bammv)、大麦条纹花叶病毒(bsmv)、大麦黄条点花叶病毒(bysmv)、北方禾谷花叶病毒(ncmv)、ntc为阴性对照。如图14、15所示,大麦黄花叶病毒样本和阳性对照有明显的扩增曲线外,其余病毒样本和阴性对照均无扩增。说明该方法特异性好,与其他病毒无交叉。
159.实施例3一种用于直扩era偶联crispr/cas12a检测的试剂盒
160.本发明中的直扩era偶联crispr/cas12a反应体系,在技术方法、试剂盒工艺、操作方法、配套仪器方面进行了系统性创新,减少实验步骤、降低气溶胶风险、降低实验难度,确定直扩era偶联crispr/cas12a最佳反应体系后,对相应反应各组分预分装处理,将干粉试剂a封装至离心管管盖、液体试剂b封装至管体,见图16。
161.dna型的干粉试剂a(sau)中各物质用量为:上游引物era-sau-f 2-6pmol,下游引物era-sau-r 2-6pmol,liquid basic 2-4μl,crrna 0.31-1.25pmol,lbcas12a 0.5-2pmol,rna酶抑制剂4-8u,ssdna-fq 0.5-2pmol,海藻糖4-8μm;
162.rna型的干粉试剂a(baymv)中各物质用量为:上游引物era-baymv-f 2-6pmol,下游引物era-baymv-r 2-6pmol,liquid basic2-4μl,crrna 0.31-1.25pmol,lbcas12a 0.5-2pmol,逆转录酶200-400u,rna酶抑制剂4-8u,ssdna-fq 0.5-2pmol,海藻糖4-8μl;
163.液体试剂b中各物质用量为:reaction buffer 3-7μl,depc-h2o7.5-13μl,激活剂1-2.5μl,所述激活剂为280mm的mg(oac)2溶液。
164.如图16所示的离心管管盖和管体分别用铝箔袋真空封装,可室温存放7个月,可常温运输,避免了冷链运输。
165.该试剂盒检测时可配套荧光恒温扩增仪(由苏州先达基因科技有限公司提供):集
恒温扩增与荧光信号检测于一体,扩增过程中能实时检测并自动判读结果。
166.使用范围:适用于病原菌、病毒、组织、细胞等分子检测领域,需要配套核酸检测试剂盒一起使用
167.控温范围及精度:-65℃-室温;精度
±
0.5℃;
168.样品孔位:8孔;
169.温湿度范围:20%-80%,2℃-45℃;
170.显示屏及光源:lcd触控显示屏、led光源;
171.荧光通道:fam(470/520);
172.电压:外接dc12v、内置蓄电池供电;
173.尺寸与净重:185*158*110mm(长*宽*高);净重<2kg
174.连接方式:wifi、usb。
175.所述试剂盒在使用时,仅需要开盖一次,将制备的dna模板或rna模板加入液体试剂b后,将装有干粉试剂a的离心管管盖盖在装有的液体试剂b的管体上,倒置1min,与液体试剂b混合,上下颠倒混匀后,放入荧光恒温扩增仪检测,扩增完成后,可直接得出判断结果,无需开盖,无需电泳,既简化了现场操作步骤,又可有效防止污染,实现”傻瓜式”操作,参见图17。
