1.本发明涉及植物枯萎病防治领域,具体而言,涉及一种防治辣椒枯萎病的芽孢杆菌菌株ya-1及其应用。
背景技术:
2.枯萎病作为一种常见的植物病害已成为制约经济作物发展的一大主要病害,特别是对生姜、黄瓜、番茄、茄子、香蕉等作物造成了巨大经济损失,这些年随产业化集中,辣椒等蔬菜复种指数的提高,枯萎病的发生呈逐年增长趋势,严重影响了我国辣椒质量以及农户的收入。
3.辣椒枯萎病是由尖孢镰刀菌(fusarium oxysporum)侵染引起,其最为常见表现的是辣椒开花结果期叶片发黄,严重时伴随有大量脱落,部分临近地面的茎叶易受到田间积水的影响,长期处于腐烂状态,甚至影响到上部茎叶,使其凋萎。地下根系生长异常,存在软腐的问题,通过对茎基部的纵面剖析可以发现,其中的维管束普遍转变为褐色,若现场湿度较大,病部还伴随有霉状物,严重影响作物生长。辣椒枯萎病在世界上许多国家均有发生。我国自1955年首次报道(俞大绂,1955),随后,在陕西、甘肃、湖南、湖北、北京、广东、广西、海南等地相继发生(李静等,2014)。发病率一般为15%~30%,严重时为50%以上,个别地区严重时高达70%~80%,甚至绝产,造成了巨大经济损失。
4.为了解决辣椒枯萎病的问题,在实际生产中,培育和选用抗枯萎病品种从根本上解决辣椒枯萎病病害的重要措施,然而至今仍未有合适的抗枯萎病的优良品种,在大田种植过程中,枯萎病仍然普遍发生。由于辣椒枯萎病属典型的土传病害,病菌以厚垣孢子在土壤及病残体中越冬,可以在土壤中存活数年,并且很多宿主不会表现出症状,感病品种的重复种植能够导致厚垣孢子在土壤中大量积累,因而防治难度更大。
5.目前国内外关于枯萎病的防治方法主要是通过化学防治,例如选用恶霉灵、甲基托布津、代森锰锌、氟硅唑、吡唑醚菌酯和氰烯菌酯等化学杀菌剂进行灌根防治,然而不同化学杀菌剂对于不同种类、品种的农作物的防治效果不一致,且长期大量使用这些化学药剂,病菌易产生抗药性,防治效果逐年降低,甚至达到无法控制的程度,同时污染环境、破坏生态平衡和农药残留等问题也日益凸显。因此化学防治已经不能作为最合适的手段,需要更安全环保的生物防治剂代替这些化学药剂。
6.然而,由于单一菌株的局限性和致病菌的同步进化、现有生物菌株生防机制单一等原因,目前尚未发现能够有效拮抗枯萎病且抗菌谱广的生物菌株制剂。
技术实现要素:
7.基于上述现有技术中存在的问题,本发明提供一株能够从多种机制途径同时发挥作用、协同增效,有效防治多种植物枯萎病的芽孢杆菌(bacillus sp.)菌株ya-1。
8.本发明提供的芽孢杆菌bacillus sp.菌株ya-1,其特征在于,保藏号为cgmcc no.23360。
9.进一步地,本发明所提供的芽孢杆菌bacillus sp.菌株ya-1,其16s rdna序列如seq id 1所示。
10.本发明进一步提供上述芽孢杆菌bacillus sp.菌株ya-1在植物枯萎病防治中的应用。
11.进一步的,本发明提供芽孢杆菌bacillus sp.菌株ya-1的菌体在植物枯萎病防治中的应用。
12.优选地,所述菌体的制备方法为:从4℃冰箱中取出,接种于lb液体培养基(lb液体培养基配方为:10g氯化钠,10g蛋白胨,5g酵母粉,1000ml蒸馏水,充分溶解后分装于250ml三角瓶中,每瓶200ml液体lb,121℃灭菌30min,冷却,备用。)中,31℃,200rpm摇床中培养24h后,所得的菌悬体即为活菌体。
13.更优选地,所述制备方法为:从4℃冰箱中取出,接种于lb液体培养基(lb液体培养基配方为:10g氯化钠,10g蛋白胨,5g酵母粉,1000ml蒸馏水,充分溶解后分装于250ml三角瓶中,每瓶200ml液体lb,121℃灭菌30min,冷却,备用。)中,31℃,200rpm摇床中培养24h后,所得的菌悬体即为活菌体。
14.进一步的,本发明提供芽孢杆菌bacillus sp.菌株ya-1的发酵菌液在植物枯萎病防治中的应用。
15.优选地,所述发酵菌液的制备方法为:将菌种接种于lb液体培养基中,摇床培养后,收集菌悬体即制得菌体。
16.更优选地,所述发酵菌液的制备方法为:先取上述方法制备得到的菌体,接种于lb液体培养基(lb液体培养基配方为:10g氯化钠,10g蛋白胨,5g酵母粉,1000ml蒸馏水,充分溶解后分装于250ml三角瓶中,每瓶200ml液体lb,121℃灭菌30min,冷却,备用。)中,31℃,200rpm摇床中培养24h后,即得到活菌体菌悬液。然后将活菌体菌悬液用酶标仪或紫外分光光度计测量od600值,并用无菌lb液体培养基调节od600=0.6~0.8之间,即制得发酵菌液。
17.进一步的,本发明提供一种枯萎病防治方法,其特征在于,具体步骤为,采用上述芽孢杆菌bacillus sp.菌株ya-1的发酵菌液对植物进行灌根。
18.优选地,所述灌根时间持续10-20天,进一步优选为20天。
19.可选地,所述灌根时期可以为苗期、始花期、结果期和盛果期。
20.可选地,所述灌根的方法为:首次采用孢子浓度为度1
×
107孢子/g的发酵菌液100ml对每株植物进行灌根。
21.可选地,在20
±
5天内用相同浓度的发酵菌液再次进行灌根。
22.进一步地,本发明提供包含上述菌体或发酵液和药学上可接受的载体或赋形剂组成的生物制剂。
23.更进一步地,本发明提供上述生物制剂在植物枯萎病防治中的应用。
24.在本发明的一些方面,本发明提供一种用于制备辣椒枯萎病防治用生物制剂的菌株,其生物保藏号为cgmcc no.23360。
25.在本发明的一些方面,所述的植物枯萎病为生姜青枯病、辣椒枯萎病或瓜类枯萎病;优选地,所述的植物枯萎病为辣椒枯萎病。
26.本发明提供的芽孢杆菌(bacillus sp.)菌株ya-1已于2021年9月6日保藏于中国微生物菌种保藏管理委员会普通微生物中心(地址:中国北京市朝阳区北辰西路1号院3
号),其生物保藏号为cgmcc no.23360。
27.本发明与现有技术相比,具有以下优点和有益效果:
28.1、本发明筛选获得的芽孢杆菌(bacillus sp.)菌株ya-1,其菌体和发酵液对于生姜青枯病、辣椒枯萎病和瓜类枯萎病等植物病原菌的直接抑制具有显著作用,抑菌谱广。
29.2、本发明筛选获得的芽孢杆菌(bacillus sp.)菌株ya-1,其菌体和发酵液对辣椒枯萎病防治效果尤为显著,能够有效用于辣椒枯萎病防治,能产生良好的经济效益和应用价值。
30.3、本发明筛选获得的芽孢杆菌(bacillus sp.)菌株ya-1,能够提高植株防御酶pod、sod、pal活性,降低mda含量,通过诱导植株自身防御酶的活性使得植株产生枯萎病的诱导抗性。
31.4、本发明筛选获得的芽孢杆菌(bacillus sp.)菌株ya-1,能调节土壤微生物群落结构,促进辣椒植株生长。
32.5、本发明筛选获得的芽孢杆菌(bacillus sp.)菌株ya-1,对于不同生育期(苗期(4叶1芯期)、始花期、结果期和盛果期)枯萎病的防治均有较好的效果,防治时间长、范围广。
33.6、本发明筛选获得的芽孢杆菌(bacillus sp.)菌株ya-1及其应用,在上述直接抑制病原生长、诱导植株抗性、调节土壤微生物结构、多生育期防治四个方面同时发挥作用、协同增效,防治效果显著,且属于生物防治,安全有效,无环境污染风险,也无抗性耐药性问题。
附图说明
34.图1为实施例2中菌株对辣椒枯萎病的抑菌活性结果,其中a:ya-1对辣椒枯萎病菌的抑菌活性;b:待测菌株对辣椒枯萎病的抑制活性
35.图2为实施例2中ya-1对生姜青枯病的抑菌活性结果,a:ya-1对生姜青枯病菌的抑菌活性;b:空白对照
36.图3为实施例4中不同生育期ya-1对辣椒枯萎病的防治效果情况
37.图4为实施例5中芽孢杆菌ya-1对辣椒叶片sod活性的影响情况
38.图5为实施例5中芽孢杆菌ya-1对辣椒叶片pal活性的影响情况
39.图6为实施例5中芽孢杆菌ya-1对辣椒叶片pod活性的影响情况
40.图7为实施例5中芽孢杆菌ya-1对辣椒叶片mda活性的影响情况
41.图8为实施例6中ya-1 16s rdna基因系统发育分析结果
42.图9芽孢杆菌ya-1在不同分组中的丰度情况
43.图10实施例7中fusarium属在不同分组中的丰度情况,其中**:p《0.01;*:0.01《p《0.05;ns:p≥0.05。
具体实施方式
44.以下通过具体实施例进一步描述本发明,本发明的应用范围不限于下列实施例。由于已经根据以下优选实施例描述了本发明,某些修饰和等价变化对于本领域的普通技术人员是显而易见的且包括在本发明的范围内。
45.除非本文另有定义,连同本发明使用的科学和技术术语应具有本领域普通技术人员通常理解的含义。在本技术中,除非另有说明,“或”的使用意味着“和/或”。此外,术语“包含”及其他形式的使用是非限制性的。
46.本技术中采用的主要实验仪器为:生化培养箱(宁波江南仪器厂spx-288),光照培养箱(宁波江南仪器厂gxz智能型),冷冻离心机(德国ohaus-5515r),凝胶电泳仪(北京六一dyy-6c),紫外分析仪(bio-rad geldoc
tm
xr+),酶标仪(北京普朗dnm-9602),多层控温摇床(英国labtech ls1-5004ml),超低温冰箱(青岛海尔dw-86l338),紫外分析仪(上海天能uv-2000),小型台式离心机(德国eppendorf5418),pcr仪(伯乐bio-rad t100),高压灭菌锅(日本hve-50)。
47.本技术中采用的主要实验试剂为:氯化钠(西陇化工140808),细菌学蛋白胨(广东环凯3205016),酵母粉(英国dxoid 1213550-02),琼脂粉(北京奥博星01-023),琼脂糖(西班牙a6585),马铃薯葡萄糖琼脂(青岛海博生物hb0233),easy taq dna聚合酶(北京全式金ap111),trans 2k dna marker(北京全式金bm101),trans 15k dna marker(北京全式金bm161),土壤基因组dna快速提取试剂盒(北京百泰克dp4001),pcr mix(北京鼎国昌盛生物per007-1),λdna hind
ꢀⅲ
(东盛生物m1201),细菌基因组dna提取试剂盒(北京天根dp302-02),质粒小提试剂盒(北京天根dp103-03),琼脂糖凝胶dna回收试剂盒(北京天根dp209-03),通用型dna纯化回收试剂盒(北京天根dp214-03)。
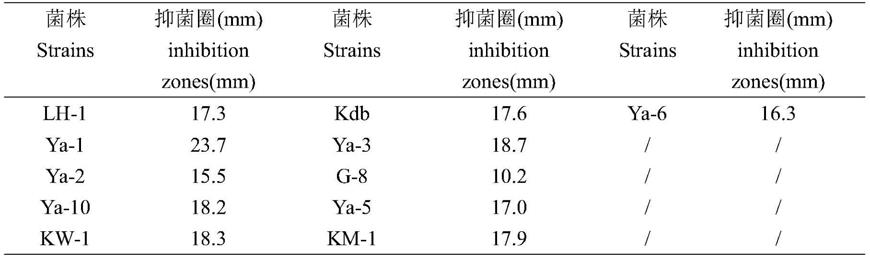
48.实施例1
49.材料来源:海南省五指山市热带雨林土壤样品。
50.分离方法:从五指山采集热带雨林土壤样品多份。经“高温浸泡+梯度稀释分离法”分离土壤中的芽孢杆菌,即首先称取1g土壤样品,置于装有100ml无菌水的250ml三角瓶中,30℃,200rpm,震荡培养30min,然后取出三角瓶,并置于80℃水浴锅中,浸泡10min,以尽可能多地杀死其它种类细菌;最后,取100ul高温处理的土壤悬液,加入900ul无菌水中,充分混匀,制成10-3稀释液。从10-3稀释液中100ul,加入900ul无菌水中,充分混匀,制成10-4稀释液,以此类推,获得10-3、10-4、10-5、10-6稀释液。
51.从10-4、10-5、10-6稀释液中,取100ul涂布于lb培养基平板上,每浓度梯度涂布3皿,31℃倒置培养2~3天,计算菌落数量,并挑取单菌落,保存培养。
52.其中lb培养基的配方为:nacl 10.0g,蛋白胨10.0g,酵母粉5.0g,琼脂粉20.0g,双蒸水1000ml,121℃,灭菌20min。
53.实施例2
54.将实施例2中获得的单菌落分别命名,并进行扩大培养后,分别对辣椒枯萎病菌和生姜青枯病菌进行拮抗试验,具体步骤如下:
55.2.1以辣椒枯萎病菌为靶标:
56.利用4mm打孔器,酒精灯火焰上高温消毒,冷却后,打出含各种芽孢杆菌单菌落的菌饼多个,并将菌饼接种到培养24h以上的辣椒枯萎病菌周围(离靶标菌约35mm,每皿对称的接3个菌饼)。28℃,温箱中培养72h后,测量抑菌圈直径,计算平均抑菌圈直径的大小(扣除对照4mm)。
57.2.2以生姜青枯病菌为靶标:
58.采用改进的双层琼脂法对芽孢杆菌菌株进行室内拮抗活性初筛。将待测细菌接种
于装有30ml液体lb培养基的100ml三角瓶中,30℃,200rpm,摇菌培养24h。4℃,5000rpm,离心5min,上清液保存备用。取出事先准备好的生姜青枯菌平板,每皿近似等边三角形放置3个牛津杯,往牛津杯中加满发酵菌液(约240μl),每种待测细菌发酵菌液重复3皿,保持各牛津杯之间的距离≥30mm,以加入lb液体培养基作对照。30℃温箱中培养48h后,测量抑菌圈直径,计算平均抑菌圈直径的大小。
59.2.3结果:
60.辣椒枯萎病菌的抑制活性试验结果如图1(,a:ya-1抑菌活性;b:全部菌株对辣椒枯萎病菌的抑菌活性)、表1所示,生姜青枯病菌的抑制活性试验结果如图2(a:ya-1抑菌平板;b:对照)、表2所示。
61.表1菌株对辣椒枯萎病菌的抑制活性
[0062][0063]
表2菌株对生姜青枯病菌的抑制活性
[0064][0065]
上述实验共筛选到11株有拮抗活性的细菌菌株,占测试菌株的2.26%。
[0066]
从表1中的抑制活性数据中可以看出,ya-1对于辣椒枯萎病的抑制效果最好,抑菌圈平均直径为23.7mm,从图1a中也可以看出,28℃恒温培养箱中,倒置培养72h后,ya-1菌落周围能产生明显的抑菌圈,而此时空白对照中,辣椒枯萎病菌菌丝几乎覆盖整个培养皿,从图1b中也明显可以看出,ya-1(上左2)对辣椒枯萎病菌菌丝生长的抑制效果明显优于其他细菌菌株。
[0067]
从表2中的抑制活性数据中可以看出,ya-1对于生姜青枯病的抑制效果最好,处理48h后,抑菌圈平均直径为23mm,从图2a中可以看出,发酵菌液周围明显有规则的透明圈,而空白对照(图2b)中,观察不到抑菌圈,生姜青枯病菌落长满整个培养皿。
[0068]
实施例3
[0069]
3.1ya-1菌体制备步骤:从4℃冰箱中取出,接种于lb液体培养基(lb液体培养基配方为:10g氯化钠,10g蛋白胨,5g酵母粉,1000ml蒸馏水,充分溶解后分装于250ml三角瓶中,每瓶200ml液体lb,121℃灭菌30min,冷却,备用。)中,31℃,200rpm摇床中培养24h后,所得的菌悬体即为活菌体。
[0070]
3.2ya-1发酵菌液制备步骤:先制备活菌体,即从4℃冰箱中取出,接种于lb液体培养基(lb液体培养基配方为:10g氯化钠,10g蛋白胨,5g酵母粉,1000ml蒸馏水,充分溶解后分装于250ml三角瓶中,每瓶200ml液体lb,121℃灭菌30min,冷却,备用。)中,31℃,200rpm摇床中培养24h后,即得到活菌体菌悬液。然后将活菌体菌悬液用酶标仪或紫外分光光度计测量od600值,并用无菌lb液体培养基调节od600=0.6~0.8之间,即为可以直接用于接种的发酵菌液。
[0071]
3.3抑制活性验证实验步骤:先按3.1和3.2方法制备足量的活菌体和发酵菌液。同时用打孔器打出多个直径为5mm滤纸片,并准备100ml去离子水,与滤纸片一起,121℃,,灭菌30min,冷却,备用。
[0072]
抑制活性实验开始前,从4℃冰箱中辣椒枯萎病菌株,用无菌枪头挑取菌丝,接种于事先准备好的pda平板上,28℃倒置培养5d,待菌丝长满培养皿后,加少量无菌水将孢子洗下,并用多余的无菌水调节孢子悬浮液浓度为1
×
106cfu/ml,备用。加热融解pda培养基,待其冷却到50℃左右,每99ml培养基中,加入1ml上述浓度的孢子悬浮液,摇匀,倒平板,冷却,备用。
[0073]
将无菌滤纸片分别在发酵菌液、活菌体和无菌水中浸泡10min,对称地置于上述含辣椒枯萎病菌孢子悬浮液的培养基平板上,并保证滤纸片之间的直线距离≥30mm。每处理重复3皿,每皿3个不同浸泡处理后的滤纸片。28℃恒温培养箱中培养48h后,测量抑菌圈直径,计算平均抑菌圈直径的大小。并做差异显著性分析。
[0074]
3.4结果
[0075]
活性验证实验结果如表3所示。
[0076]
表3拮抗菌ya-1对辣椒枯萎病菌的抑制作用
[0077][0078]
注:同列数据后标有不同字母表示在5%水平差异显著。
[0079]
上述实验结果表明,拮抗菌ya-1菌体及其发酵液对辣椒枯萎病菌均表现出抑制作用,但发酵液与活菌菌株ya-1对辣椒枯萎病菌的抑菌活性有一定的差异,菌体(83.1%)》发酵液(76.2%)》无菌水对照(/),且各处理间呈显著性差异(p《0.05)。
[0080]
实施例4
[0081]
按照实施例3中的方法制备得到ya-1发酵液。
[0082]
从辣椒地中取自然土,80目过筛后,与营养基质8:1比例,混匀后装盆。同时,“乾隆一号”(大辣椒)感病辣椒种子用1%次氯酸钠溶液表面消毒,无菌水冲洗3遍,在120mm无菌玻璃培养皿中保湿催芽5d,待80%以上的种子“露白”后,播种事先准备好的盆中,每盆2颗。
[0083]
分别在四个生育期,即苗期(4叶1芯期)、始花期、结果期和盛果期,进行接种,每生育期分成a、b、c、d四种处理,每处理5次重复,每次重复24盆(48株健康生长辣椒苗)。其中苗期处理方法,a:无菌水浸根10min+100ml无菌水浇灌(注:挖出浸根后,栽种于原营养盆中,然后用100ml无菌水浇灌);b:芽孢杆菌ya-1发酵液浸根10min+100ml ya-1发酵液(浓度1
×
107cfu/ml)浇灌;c:辣椒枯萎病菌(fusarium oxysporum)孢子悬浮液浸根10min+100ml f.oxysporum孢子悬浮液(孢子浓度1
×
107孢子/g)浇灌;d:先接种芽孢杆菌ya-1,24h后接种f.oxysporum孢子悬浮液(注:接种的方法、发酵液和孢子浓度与b、c处理一致);始花期、结果期和盛果期由于移栽会造成花、果脱落,故采用灌根法进行接种,处理方式除不用浸根外,其他与苗期一致。
[0084]
在各生育期实验猪处理后10d、20d观察辣椒生长及接种辣椒尖孢镰刀枯萎病菌的发病情况,统计辣椒枯萎病的发病率和防治效果。在dps软件中进行方差分析,在excel中绘制不同生育期各处理防效柱状图。其中统计方法为:
[0085][0086][0087]
统计结果见表4、图5。
[0088]
表4 ya-1对辣椒不同生育期枯萎病的防控效果
[0089]
[0090]
[0091][0092]
[0093]
如表4、图3所示,ya-1在始花期对辣椒枯萎病的防治效果最好,10d和20d后,其b(接芽孢杆菌ya-1)和d(先接ya-1,24h后接枯萎病菌)处理的平均防效最高,分别为64.17%、56.73%和56.94%、45.27%;其次为苗期,10d和20d后,其b和d处理的平均防效分别为56.43%、53.80%和51.43%、49.80%;再次为结果期和盛果期防效,10d后,b和d处理的平均防效亦在50%以上,分别为51.07%、50.91%和51.43%、50.63%,20d后防治效果有所下降。表明本发明中菌株能在始花期、结果期、盛果期、苗期均能够有效防治辣椒枯萎病,且随着时间的延长,补充浇灌ya-1发酵菌液1~2次效果更佳,补充灌注时间宜在20d前后。
[0094]
实施例5
[0095]
按照实施例3中的方法制备得到ya-1发酵液。
[0096]
试验分a、b、c、d共4种处理。a:空白对照。b:只接种芽孢杆菌ya-1。c:只接种辣椒枯萎病菌。d:先接种芽孢杆菌ya-1,24h后灌根接枯萎病菌。各处理分别于灌根接种后0、24、48、72、96h、120h和144h等不同时间段随机抽取3盆辣椒苗,取顶部叶片约4g,加入36ml 0.1mol/l磷酸盐缓冲液(ph6.8)于事先预冷的研钵中,迅速研磨成匀浆,4℃、3500r/min离心10min,收集上清液,用于过氧化物酶(pod)、超氧化物岐化酶(sod)、苯丙氨酸解氨酶(pal)的活性测定和丙二醛(mda)含量的测定。上述4个指标的测定分别采用南京建成科技有限公司生产的相应的试剂盒,并参照各试剂盒使用说明书进行。
[0097]
结果如图4所示,接种后,4种处理辣椒叶片sod活性均有不同程度上升,d处理上升最快,其次为b处理,a处理上升最慢。4种处理均在72h时出现sod活性峰值,此时sod活性差异最大。相较于空白对照,b处理sod活性提高了30.54%;相较于c处理,d处理sod活性提高了49.60%,;相较于b处理,d处理sod活性提高了20.45%。由此可见,先接种ya-1,24h后再接种辣椒枯萎病菌的组合比单独接种芽孢杆菌ya-1的处理更明显地提高了sod的活性(p<0.05)。
[0098]
如图5所示,接种24h后,辣椒叶片pal酶活性,b、c、d处理均显著高于空白对照a处理;b和c处理先缓慢上升,b处理在48h出现活性峰,比空白对照a处理高90.16%,而后又缓慢下降,直至120h时趋于平缓;c处理pal活性在96h后达到最高,比空白对照a处理高98.22%,而后急速下降;而d处理急速升高,48h后,出现第一个活性峰,比空白对照a处理高215.96%,而后急速下降,96h后下降到到最低,但依然比空白对照a和单独接种芽孢杆菌b处理要高;随后,快速升高,120h后,出现第二个活性峰,比空白对照a处理高176.66%,而后急速下降。除0h后,b、c、d处理的每个时间段均比对照显著升高,且既接芽孢杆菌ya-1又接枯萎病菌的d处理比单接芽孢杆菌ya-1的b处理和单接枯萎病菌的c处理更显著地提高了pal酶活性(p<0.05)。说明接种芽孢杆菌ya-1能显著地诱导pal酶活性升高,从而达到抵制病原菌侵染的目的。
[0099]
如图6所示,接种0h到48h,所有处理辣椒叶片pod酶活性缓慢上升;接种了枯萎病菌的处理c和d均是72h后达到活性峰值。此时,比对照分别提高了186.9%和144.59%。随后,单独接种枯萎病菌的c处理pod活性急速下降,到144h时,又开始缓慢升高。而既接芽孢杆菌ya-1,又接枯萎病菌的d处理72h达到活性峰值后,先缓慢下降,并逐渐趋于稳定。单独接种芽孢杆菌ya-1的b处理96h后急剧升高,120h时达到达到活性高峰。此时,比对照高182.02%,与空白对照a处理差异显著,而后缓慢下降,但仍显著高于a处理(p<0.05)。
[0100]
如图7所示,接种处理后0h到48h,所有处理辣椒叶片mda含量缓慢下降,且差异不
显著;48h到72h,所有处理辣椒叶片mda含量急剧上升,且72h后,均达到最高。此时,空白对照a处理变化最小,其次为接芽孢杆菌ya-1的b处理和既接芽孢杆菌ya-1又接枯萎病菌的d处理,变化最大的为单独接种枯萎病菌的c处理。相比于空白对照a处理,b、c、d处理mda含量明显提高。相比于c处理,d处理mda含量降低了27.42%(p<0.05)。b和d处理mda含量相当,说明芽孢杆菌ya-1诱导辣椒叶片mda含量明显下降。
[0101]
实施例6
[0102]
从4℃冰箱中取出,接种于lb液体培养基中,31℃,200rpm摇床中培养24h后,12000rpm离心5min,弃上清,收集菌体,然后用细菌基因组dna提取试剂盒(北京天根dp302-02)和通用型dna纯化回收试剂盒(北京天根dp214-03),按照其说明书提取和纯化ya-1基因组dna。同时,在上海生工生物科技有限公司合成细菌16s rrna基因通用引物1492r(5
′‑
tacggctaccttgttacgactt-3
′
)和27f(5
′‑
agagtttgatcctggctcag-3
′
)。以ya-1基因组dna为模板,利用该通用引物进行pcr扩增。扩增体系25μl,其中,10
×
easy taq buffer 2.5μl,2.5mm dntps 1.25μl,1492r 5pmol(1.25μl),27f 5pmol(1.25μl),模板0.5μl(50ng),ddh2o 18.0μl,easy taq dna聚合酶0.25μl。反应过程为:94℃预变性5min,94℃变性30sec,55℃退火60sec,72℃,延伸90sec,28个循环,72℃,延伸10min,4℃保存,并直接送北京华大基因有限公司测序分析。
[0103]
该基因序列全长为1514bp。在ncbi数据库中进行blast比对,发现其与芽孢杆菌bacillus sp.strain x5(登录号:mk736111)、bacillus sp.strain cl2(登录号:mk736118)、bacillus sp.ceb01(登录号:dq377150)、解淀粉芽孢杆菌bacillus amyloliquefaciens strain gf-3(登录号:mg264882)、bacillus amyloliquefaciens strain x17_liu(登录号:kt931622)、枯草芽孢杆菌bacillus subtilis strain rs51(登录号:ku551243)、bacillus subtilis strain ds52(登录号:ku551232)、bacillus subtilis strain csl2(登录号:kx281166)、bacillus subtilis strain mr7(登录号:mn514085)、维氏芽孢杆菌bacillus velezensis strain g341(登录号:mf167634)、bacillus velezensis strain nn04(登录号:mt114570)均在99.7%以上。说明菌株ya-1为芽孢杆菌中的一员。下载同源性较高的多条序列,与ya-1的16s rdna序列一起,以serratia liquefaciens strain bz65(登录号:hq588852)为外源参照序列,构建系统发育进化树,结果如图8所示。从图8上也能看到,菌株ya-1与芽孢杆菌的全部序列聚在同一进化分支上,遗传距离极其接近。进一步证明菌株ya-1属于芽孢杆菌(bacillus sp.)。
[0104]
实施例7
[0105]
种苗。从健康辣椒地中取土,80目过筛后,与营养基质8:1比例,混匀后装盆。“乾隆一号”(大辣椒)感病辣椒种子用1%次氯酸钠溶液表面消毒,无菌水冲洗3遍,在“120mm玻璃培养皿+无菌滤纸+没过滤纸片的无菌水”中,保湿催芽5d,待80%以上的种子“露白”后,播种到事先准备好的盆中,每盆三颗。
[0106]
接种。中途加1000倍液的腐殖酸浇灌3次,保证辣椒苗长势均匀、茁壮。待苗长到4叶1芯时开始处理。试验共设置4个处理。(1)无菌水浸根10min+100ml无菌水浇灌(注:挖出浸根后,栽种于原营养盆中,然后用100ml无菌水浇灌。编号为a;(2)芽孢杆菌ya-1发酵液浸根10min+100mlya-1发酵液(浓度1
×
107cfu/ml)浇灌,编号为b;(3)辣椒枯萎病菌(fusarium oxysporum)孢子悬浮液浸根10min+100ml f.oxysporum孢子悬浮液(孢子浓度1
×
107孢子/g)浇灌,编号为c;(4)先接种芽孢杆菌ya-1,24h接种f.oxysporum孢子悬浮液(注:接种的方法、发酵液和孢子浓度与b、c处理一致),编号为d。
[0107]
取样。分接采集接种前、接种后10天和接种后20天各处理根际根围土壤样本。接种前因各盆处理均一致,因而随机取5份样本,每个样本均是采用抖根法收集5株辣椒苗根际根围土壤10g;接种后10天、20天的取样方法类似于接种前。共采集到45个土壤样本。然后采用武汉天一辉远生物技术有限公司的高通量测序和分析平台,研究接种前和接种后10天、20天,a(空白对照)、b(接种芽孢杆菌ya-1)、c(接种辣椒枯萎病菌)、d(先接ya-1,24h后再接辣椒枯萎病菌)四种处理对辣椒根际根围土壤微生物群落结构的影响,以及芽孢杆菌ya-1与辣椒尖孢镰刀枯萎病菌(fusarium)的互作关系。
[0108]
采用细菌16s rdna的v3+v4区和真菌its2区高通量测序(在miseq平台进行pe250测序)和生物信息分析技术,研究了不同处理、不同时间段,微生物多样性变化,以及芽孢杆菌ya-1与辣椒尖孢镰刀枯萎病菌(fusarium)的互作关系。共得到10911099条原始序列,过滤质控后,得到10880705条有效序列。采用rdp classifier对有效序列进行分类,共得到192562个细菌16s otu和25124个真菌its out。
[0109]
从测序样本中核心细菌和真菌菌群(genus level)分析结果来看,样本体系中高丰度的核心细菌主要包括sphingomonas、gemmatimonas、candidatus_solibacter、mizugakiibacter、bryobacter等,而核心真菌主要包括trichobolus、neocosmospora、mortierella、humicola、fusarium等。
[0110]
从差异物种挖掘与趋势变化分析来看,芽孢杆菌ya-1对应的为属于芽孢菌属的otu567,枯萎病菌对应看fusarium属。可以看出,ya-1在添加组(b、d)中丰度远高于非添加组(bi、a、c)。其中,在ya-1和fusarium互作组(d)10day样本中丰度有一定程度的上升,但在20day样本中丰度又有所回落(图9)。fusarium在添加ya-1组(d)中的平均丰度要低于不添加ya-1组(c),在10day时有极显著的差异,但在20day时差异已不显著(图10)。这表明在10day的时候,ya-1对fusarium有显著的抑制作用,但在20day时,抑制作用已经不明显。同样说明20天前后可以增加1-2次灌根添加ya-1,提高ya-1作用后的土壤种群密度,改变群落结构,以达到对fusarium有持续的抑制作用。
