1.本发明涉及生物化工技术领域。具体是一种黄嘌呤氧化酶抑制肽的制备方法及应用。
背景技术:
2.痛风是一种以高尿酸血症为主要危险因素的慢性疾病,是由于尿酸生成过量或排泄紊乱,导致尿酸盐晶体在滑膜、滑囊、软骨等关节组织沉积而引起。据统计,痛风在世界范围内的发病率为0.06%-2.68%,在我国仅次于ii型糖尿病的发病率,是最普遍、最严重的代谢疾病之一,危害人们的健康。临床上应用的抗痛风药物有别嘌呤醇、非布司他、秋水仙碱等抑制尿酸生成或促进尿酸排泄的药物。然而,这些化学药物的肾毒性、皮炎、过敏反应等毒副反应给痛风患者带来健康隐患。目前迫切需要开发更多绿色健康和安全的抗痛风药物。从天然存在的蛋白质中提取的降尿酸肽,通过抑制黄嘌呤氧化酶(以下文中简写为xod)的活性减少尿酸的生成,或促进尿酸在肾脏的排泄达到治疗痛风或高尿酸血症的目的,具备天然低毒、易吸收和补充营养的优势,是更加绿色健康的治疗和预防方式。
3.目前制备多肽的方法有三种:化学合成法、蛋白酶水解法和非水相酶法。以固相合成法为代表的化学合成法历史悠久,通常作为验证新肽的标准方法,但是,保护碱基和脱保护步骤繁琐,而且多周期和复杂的纯化过程也阻碍了其大规模的工业应用。蛋白酶水解法是从蛋白质中制备功能性多肽应用最广泛的方法,但缺点是水解过程不可控、目标肽含量低、纯化成本高、蛋白提取率低等。近年来发展起来的非水相酶法合成多肽,通过抑制多肽水解反应并促进肽的合成、在提高反应特异性和易于溶剂工程调控等方面具有无可比拟的优势。目前为止,还未有关于在非水相介质中利用蛋白酶合成抗痛风肽或降尿酸肽的研究报道。
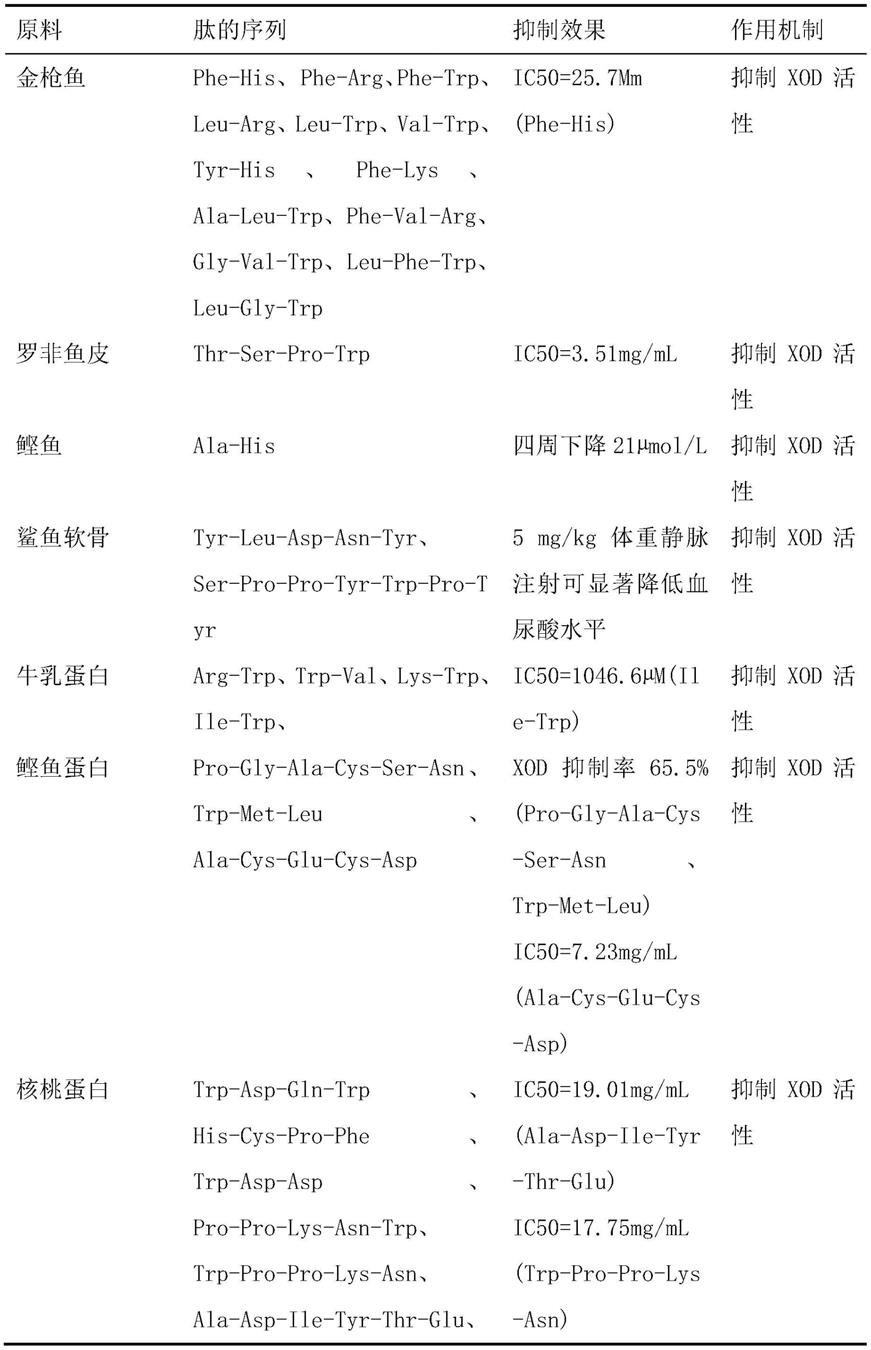
4.如表1所示,目前已报道的降尿酸肽共33种(共117个氨基酸),氨基酸残基从2个到9个不等,降尿酸肽通过抑制xod活性而减少尿酸的生成。从中可以看出降尿酸肽主要为芳香族氨基酸(aaas)和支链氨基酸(bcaas),其中色氨酸含量为17%、脯氨酸8.5%、丙氨酸9.4%、苯丙氨酸6.8%、亮氨酸6%、酪氨酸5.1%和组氨酸5.1%。研究表明,疏水肽比亲水性肽更容易进入xod活性部位,它们能够阻断xod与底物黄嘌呤的结合,疏水性氨基酸与xod活性位点氨基酸残基的相互作用更强。因此,以降尿酸肽中含量丰富的芳香族氨基酸、疏水氨基酸残基和亲水性氨基酸为原料,非水相酶催化合成多肽库,将是高效制备新型xod抑制肽的一个可行策略。
5.表1 降尿酸肽的序列组成,抑制效果和作用机制
6.7.
技术实现要素:
8.本发明的目的是提供一种黄嘌呤氧化酶抑制肽的制备方法及应用,选择芳香族氨基酸、支链氨基酸,以及l-脯氨酸和l-组氨酸作为原料,利用蛋白酶在非水相介质中制备黄嘌呤氧化酶抑制肽,获取的一种黄嘌呤氧化酶抑制肽序列为phe-trp-phe,单字母简写为fwf,能够持续稳定地抑制黄嘌呤氧化酶的活性。
9.本发明的目的通过下述技术方案实现:一种黄嘌呤氧化酶抑制肽的制备方法,包括以下步骤:
10.(1)选择l-色氨酸、l-苯丙氨酸、l-酪氨酸、l-亮氨酸、l-丙氨酸、l-脯氨酸和l-组氨酸作为原料,以蛋白酶为催化剂在非水相介质中合成黄嘌呤氧化酶抑制肽,筛选出合成抑制肽效果好的氨基酸组合是l-色氨酸和l-苯丙氨酸、l-色氨酸和l-组氨酸、l-酪氨酸和l-丙氨酸、l-酪氨酸和l-脯氨酸、l-组氨酸和l-组氨酸、l-组氨酸和l-脯氨酸、l-脯氨酸和l-酪氨酸;
11.(2)采用响应面法优化黄嘌呤氧化酶抑制肽合成的反应条件:三乙胺浓度为1~370mmol/l,ph为5.5~7.5,反应时间为1~3h,氨基酸浓度为0.001~100mmol/l,蛋白酶的添加量为0.1~8u/ml;
12.(3)黄嘌呤氧化酶抑制肽的分离纯化及其质谱鉴定;
13.(4)黄嘌呤氧化酶抑制肽的化学合成和抑制活性验证;
14.(5)采用分子对接的方法验证黄嘌呤氧化酶的抑制机理。
15.步骤(1)所述的筛选出合成抑制肽效果好的氨基酸组合还有l-色氨酸和l-苯丙氨酸、l-色氨酸和l-组氨酸、l-组氨酸和l-组氨酸、l-脯氨酸和l-酪氨酸。
16.步骤(1)中采用的氨基酸组合为l-色氨酸和l-苯丙氨酸。
17.步骤(2)中条件为:60mmol/l色氨酸,60mmol/l苯丙氨酸,8u/ml木瓜蛋白酶,90mmol/l三乙胺,ph 6.0,反应1.5h。
18.步骤(2)中所述的采用响应面法优化黄嘌呤氧化酶抑制肽合成的反应条件是90mmol/l三乙胺,ph 6.0,反应1.5h,氨基酸浓度为60mmol/l,蛋白酶的添加量为8u/ml。
19.所述制备的黄嘌呤氧化酶抑制肽为phe-trp-phe,单字母简写为fwf,抑制率为20.69%,能够持续稳定地抑制黄嘌呤氧化酶的活性。
20.所述黄嘌呤氧化酶抑制肽的分离纯化及其质谱鉴定是采用高效液相色谱法分离纯化,用lc-ms/ms对抑制肽进行序列鉴定。
21.所述的黄嘌呤氧化酶抑制肽的制备方法制备得到的黄嘌呤氧化酶抑制肽在制备预防和治疗痛风药物中的应用。
22.所述的黄嘌呤氧化酶抑制肽的制备方法制备得到的黄嘌呤氧化酶抑制肽在制备预防和治疗高尿酸血症药物的中的应用。
23.所述的黄嘌呤氧化酶抑制肽的制备方法制备得到的黄嘌呤氧化酶抑制肽在功能性食品添加剂中的应用。
24.所述的黄嘌呤氧化酶抑制肽的制备方法制备得到的黄嘌呤氧化酶抑制肽的应用,包括如下步骤:
25.(1)选择l-色氨酸、l-苯丙氨酸、l-酪氨酸、l-亮氨酸、l-丙氨酸、l-脯氨酸和l-组氨酸作为原料,两两配对组合,检测所有49种组合在非水相中合成肽对xod的抑制活性,筛选出抑制效果最优的氨基酸组合l-色氨酸和l-苯丙氨酸。
26.(2)利用步骤(1)中的氨基酸组合l-色氨酸和l-苯丙氨酸,通过5水平3因素(反应时间、三乙胺浓度和ph)试验,选择对酶促合成降尿酸肽最显著的影响因素。根据box-behnken模型中心组合实验设计原则,设计3因素3水平响应面试验,确定的最佳反应条件为:60mmol/l trp,60mmol/l phe,8u/ml木瓜蛋白酶,90mmol/l三乙胺、ph 6.0和反应时间1.5h。
27.(3)将步骤(2)优化反应条件下合成的肽混合物,用hplc进行分离纯化,用lc-ms/ms对纯化的多肽进行序列分析,获得的黄嘌呤氧化酶抑制肽有phe-trp-phe,phe-phe-trp,trp-phe-phe,对应的单字母简写分别为fwf,ffw和wff。
28.(4)采用固相合成方法对多肽进行鉴定并验证其抑制xod的活性,合成的fwf,ffw和wff具有与步骤(3)相同的色谱分离特征,在0.2mg/ml浓度条件下,对应的抑制率分别为18.47
±
0.35%、10.82%
±
0.25%和12.04%
±
0.06%,能够持续稳定地抑制黄嘌呤氧化酶的活性。
29.(5)通过moe分子对接模块研究表明,fwf与xod活性中心周围的关键氨基酸残基phe1009,val1011,ser876以及phe914存在相互作用。
30.与现有的技术相比,本发明的具有的优点和效果如下:
31.(1)提出以降尿酸肽的丰富氨基酸构建高质量xod抑制肽库的新策略,首次选用3种芳香族氨基酸trp,phe和tyr,3种疏水性氨基酸leu,pro和ala和1种亲水性氨基酸组氨酸,构建xod抑制肽库、获取新的xod抑制肽。而现有技术获取新抑制肽的方法是通过蛋白酶随机有限地切割蛋白生成多样性肽段结合抑制活性筛选,存在盲目性大、特异性差、多样性受天然蛋白氨基酸组成限制,带来效率低下的问题。现有技术也有采用化学合成法利用多种氨基酸随机合成多肽结合抑制活性筛选获取新的xod抑制肽的报道,但是氨基酸种类多、亲水性氨基酸比例大,合成的肽库中有效xod抑制肽占比低,成功率低下。
32.(2)首次采用非水相蛋白酶催化方法合成降xod抑制肽。现有技术有采用化学合成法利用多种氨基酸随机合成多肽结合抑制活性筛选获取新的xod抑制肽的报道,同时也采用化学法合成天然蛋白来源肽的xod抑制肽,进行功能验证,包括本文中表1所列的不同动植物来源的肽段,但是迄今尚未报道有在非水相介质中酶催化方法合成降xod抑制肽。
33.(3)制备出一种新的xod抑制剂三肽fwf,抑制率为20.69%,能够持续稳定地抑制黄嘌呤氧化酶的活性。
附图说明
34.图1为实施例1中基于不同氨基酸组合的木瓜蛋白酶催化合成肽混合物对xod抑制效果的比较图。(a)为色氨酸w分别与色氨酸w、苯丙氨酸f、酪氨酸y、组氨酸h、丙氨酸a、脯氨酸p和亮氨酸l的氨基酸组合的酶催合成肽对xod的抑制;(b)为f分别与w、f、y、h、a、p和l的组合产生的酶催合成肽对xod的抑制;(c)为y分别与w、f、y、h、a、p和l的组合产生的酶催合成肽对xod的抑制;(d)为h分别与w、f、y、h、a、p和l的组合产生的酶催合成肽对xod的抑制;(e)为h分别与w、f、y、h、a、p和l的组合产生的酶催合成肽对xod的抑制;(f)为a分别与w、f、y、h、a、p和l的组合产生的酶催合成肽对xod的抑制;(g)为p分别与w、f、y、h、a、p和l的组合产生的酶催合成肽对xod的抑制;(h)为y分别与w、f、y、h、a、p和l的组合产生的酶催合成肽对xod的抑制。
35.图2为实施例2中(a)三乙胺浓度、(b)反应时间和(c)ph对木瓜蛋白酶非水相催化合成肽混合物对xod抑制活性的影响图。
36.图3为实施例2中非水介质中木瓜蛋白酶催化合成降尿酸肽的xod抑制率随(a)时间和ph、(b)时间和三乙胺浓度以及(c)ph和三乙胺浓度的三维响应曲面图。
37.4.图4a为实施例3中利用制备型高效液相色谱纯化分离木瓜蛋白酶催化合成肽产物的色谱图,4b为纯化后的木瓜蛋白酶催化合成肽产物的hplc分析图;4c为hplc-ms/ms对纯化后的肽鉴定图;4d为化学法合成三种多肽(fwf,wff,ffw)的高效液相色谱图。
38.5.图5a为实施例4中抑制肽fwf与xod分子对接最佳模型图;5b为抑制肽fwf与xod相互作用力的可视化分析图。化学合成法合成三种多肽(fwf,wff,ffw)的高效液相色谱图。
具体实施方式
39.以下结合具体实施例对本发明的技术方案做进一步详细说明。
40.实施例1
41.非水相酶法合成黄嘌呤氧化酶抑制肽的氨基酸对及筛选
42.将20μl 0.06mol/l l-色氨酸、20μl 0.06mol/l l-苯丙氨酸、450μl乙酸乙酯和30μl 8u/ml木瓜蛋白酶分别加入96孔板,构建反应体系。放入恒温培养箱进行培养,40℃,220rpm,1.5h,反应完成后100℃水浴加热5min使酶失活,10000rpm离心5min,将上清液稀释10倍,将稀释后的样品溶液50μl置于96孔酶标板中,同时加入50μl 0.02u/ml xod溶液和150μl 0.48mm黄嘌呤溶液。用酶标仪在3min内测量295nm处的xod抑制率。
43.xod
44.抑制率=[(da/dt)
抑制剂-(da/dt)
空白
]/(da/dt)
空白
x100%,其中(da/dt)
抑制剂
和(da/dt)
空白
分别为有抑制剂(合成肽)和没有抑制剂(合成肽)时的反应速率。选取3个芳香族氨基酸trp、phe和tyr、3个疏水氨基酸残基leu、pro和ala、和1个亲水性氨基酸his组成的49种随机氨基酸组合进行反应,分别进行检测。
[0045]
黄嘌呤氧化酶抑制肽筛选结果如图1所示,由3个芳香族氨基酸(w,f,y),3个疏水性氨基酸残基(l,p,a)和1个亲水性氨基酸(h)随机配对的49种组合中,由(w,f)组合反应合成的肽混合物显示最高抑制率为20.69%,(w,h)约为15%,(y,a),(y,p),(h,h),(h,p),(a,y)和(p,y)6种氨基酸组合的合成产物显示的抑制率不足15%,而(h,a)和(p,w)没有抑制作用。含芳香族氨基酸的肽段对xod活性的抑制作用高于其他氨基酸,其中含苯丙氨酸的肽段
效果最好。
[0046]
实施例2
[0047]
黄嘌呤氧化酶抑制肽的优化合成
[0048]
选择phe和trp为底物,研究蛋白酶非水相催化合成黄嘌呤氧化酶抑制肽的优化条件。
[0049]
采用5水平3因素(反应时间、三乙胺浓度和ph)试验,确定影响酶促合成降尿酸多肽最显著的单因素。反应时间分别为:1、1.5、2、2.5、3h,ph为:5.5、6.0、6.5、7.0、7.5,三乙胺浓度为:0、90、180、280、370mmol/l。根据box-behnken模型的中心组合实验设计原则,设计3因素3水平响应面试验,以时间(a)、ph(b)、三乙胺浓度(c)为影响因素,以xod抑制率为响应值,如表2所示。研究酶促合成降尿酸肽的最佳反应条件。
[0050]
表2 响应面因子水平设计
[0051][0052]
单因素实验结果如图2所示,使用三乙胺作为溶剂可以提高合成肽的xod抑制率,三乙胺的最佳浓度为90mmol/l时,其抑制率为12%,比未添加三乙胺溶剂作为反应条件的酶促合成肽xod抑制率提高11倍。培养时间为1.5h时,合成肽的xod抑制后达到最大抑制效果38.35%,当反应时间超过1.5h后,xod抑制率开始下降。ph为6.0,xod的抑制效果最佳为20.22%。
[0053]
响应面法对酶法合成降尿酸肽的工艺优化结果如表3所示,最佳反应参数为:ph 6.0,三乙胺90mmol/l,反应时间1.5h。在此条件下,合成肽的xod抑制率为16.87%。
[0054]
表3 box-behnken设计及实验结果
[0055][0056][0057]
表4 二次多项式模型的方差分析
[0058][0059]
*显著性差异(p《0.05),**极显著性差异(p《0.01).
[0060]
如表4所示,时间(a)对酶促合成肽产物xod抑制率的影响极显著(p<0.01=;时间(a)和ph(b)的交互对酶促合成肽产物xod抑制率的影响显著(p<0.05=。响应面可以反映各种影响因素的相互作用。响应面越陡峭,该因素对响应值(xod抑制率)影响越大。如图3所示,响应面陡度级数为:ab》ac》bc,即时间和ph的相互作用对合成的降尿酸肽的xod抑制率影响最大。这与表4的方差分析一致。
[0061]
实施例3
[0062]
非水相酶法合成黄嘌呤氧化酶抑制肽的分离、纯化以及鉴定
[0063]
将优化条件下合成的肽产物离心分离,上清液蒸发干燥后所得到的固体用流动相(50%乙腈和50%水)溶解。经0.45μm有机滤膜过滤后,用制备型高效液相色谱分离出高抑制xod活性组分,再用分析型高效液相色谱对其进一步纯化分析。溶剂a为含有0.1%(v/v)tfa的超纯水,溶剂b为含有0.1%(v/v)tfa的乙腈,设置流速为1.0ml/min。采用线性梯度洗脱条件:0-20min:75-40%a;20-25min:40-0%a;25-30min:0%a。在220nm处检测吸光度。进样量为20μl,柱温为30℃。用hplc-ms/ms对纯化的多肽序列进行分析。通过固相化学合成方法对多肽进行序列鉴定并验证其抑制xod活性。
[0064]
结果如图4a所示,与底物氨基酸(trp和phe)相比,底物氨基酸保留时间为7.3min,
非水相体系酶法合成的肽产物在13-14min出现(保留时间为13.11min),显示出最高抑制活性(抑制率43%)。通过hplc分析(图4b),酶促合成肽在8.8min出峰,而trp和phe底物的峰值在4.5min。然后,收集8.8min峰组分,通过lc ms/ms(图4c)进一步分析,鉴定出该组分是由两种色氨酸和一种苯丙氨酸组成的三肽。为了明确三肽的结构,我们采用固相合成法合成wff、ffw和fwf三种三肽(图4d),并比较它们对xod的抑制活性和hplc的保留时间。在0.2mg/ml浓度下,wff、ffw和fwf的抑制率分别为12.04%
±
0.06%、10.82%
±
0.25%和18.47
±
0.35%。然而,只有fwf的出峰时间与非水相酶法合成的肽相似,均出现在8.8min。因此,利用非水介质木瓜蛋白酶催化合成的三肽推测为fwf。
[0065]
实施例4
[0066]
黄嘌呤氧化酶抑制肽fwf与xod的分子对接研究实验
[0067]
利用chemsketch10.0软件绘制小分子肽fwf的结构。优化后将结构保存为mol格式,并加载到moe分子模拟软件中。在调整其电荷和结构后,经过3d质子化和能量最小化,将其保存下来。从protein data bank(https://www.rcsb.org/)获得xod(pdb id:3nvy)的晶体结构,并根据其催化机理选择活性位点。利用moe中的site finder生成xod的活性位点,采用三角matcher法将配体放置在位点上,根据london dg评分函数进行排序,然后通过诱导拟合进行对接,使用affinity dg评分函数优化能量。从对接结果来看,得分越低,亲和度越高,xo晶体与配体的相互作用越强,对xo的抑制作用越强。
[0068]
xod和fwf分子对接结果如图5所示,fwf对接到一个包含xod活性中心的空腔中,空腔内排列着以下氨基酸残基:glu802,leu873,ser876,arg880,phe914,phe1009,thr1010,val1011,leu1014,ala1078,ala1079和glu1261,从而占据底物黄嘌呤在xod中的通道,阻断黄嘌呤的进入,降低xod的催化活性。fwf与xod的相互作用如下:phe1009和vall1011和fwf中的o29形成两个氢键,键长为和此外,xo中的ser876与fwf中的o37也形成一个氢键,键长phe914与fwf形成π-π叠加相互作用,键长黄嘌呤也与黄嘌呤氧化酶活性中心的关键氨基酸残基phe914、arg880、thr1010、glu1261存在相互作用。fwf可能与底物黄嘌呤竞争相同的结合位点,从而阻断底物进入,达到抑制xod活性的作用。
[0069]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化均应为等效的置换方式。都包含在本发明的保护范围之内。
