1.本发明涉及药物化学领域,特别涉及一类5-三氟甲基-4-吡唑衍生物的制备方法及其在抑制肿瘤细胞上的应用。
背景技术:
2.癌症是一个重大的健康问题,是人类主要的死因之一。美国国家癌症研究所报告的数据显示,过去十年全球每年都有1410万新病例和约800万与癌症相关的死亡人数。为了应对这一重大问题,各国科学家已经相继报道了多种治疗策略,其中化学疗法发挥着重要作用。然而,化疗药物产生的高耐药性和高副作用往往导致化疗失败。因此研发低毒、高效的新型抗癌药是目前药物研发的重要主题。
3.吡唑类衍生物具有广泛的药理活性,比如抗癌、抗炎、抗病毒和抗高血压等,并且目前已有多种吡唑类衍生物在临床应用多年的,比如塞来昔布(抗炎)、尼拉帕利(抗癌)和非唑拉明(治疗抑郁)等。这为吡唑类活性小分子开发提供参考。因此,近年来,人们设计合成了大量的针对不同靶点的抗肿瘤细胞抑制剂吡唑类衍生物,比如蛋白酪氨酸激酶抑制剂,表皮生长因子抑制剂、端粒酶抑制剂等,期望获得高效的肿瘤细胞抑制剂。
4.本课题组在cn 202111043014.8中合成了系列结构新颖1,5-二取代吡唑-4-甲酸乙酯中间体,其结构式如下:在该结构中,r1为异丙基、环己基、苯基、邻甲基苯基、邻乙基苯基、邻氟苯基、邻氯苯基或邻三氟甲基苯基, r2为三氟甲基、二氟甲基、一氯甲基、三氯甲基或甲基。
5.本专利中,基于课题组前期研究基础,将“1,5-二取代吡唑-4-甲酸乙酯”中间体进行衍生获得系列含“酰胺”、“脲”和“1,3,4-噁二唑”结构的5-三氟甲基
ꢀ‑
4-吡唑衍生物。通过抗肿瘤细胞活性筛选,该吡唑类衍生物在10μm的浓度下表现出了良好的抗肿瘤细胞活性。期望通过进一步的结构衍生,获得高抗癌活性的化合物,为抗癌药物的研发和创制奠定基础。
技术实现要素:
6.本发明要解决的技术问题是:提供一类5-三氟甲基-4-吡唑衍生物,用于抑制肿瘤细胞上的应用。
7.本发明的技术方案:一类5-三氟甲基-4-吡唑衍生物的制备方法及其在抑制肿瘤细胞上的应用,其结构式如下:其中,x为(酰胺)、 (酰胺)、
(脲)或(1,3,4-噁二唑);r1为环己基、苯基、取代苯基,其中取代为邻位单取代,取代基为甲基和卤素;r2为联苯基、取代联苯基、二苯醚基、取代二苯醚基、3-噻吩基、2-取代-3-噻吩基、4-吡啶基,其中取代基为卤素、支链烷烃。
8.优选的,x为(酰胺)、(酰胺)、(脲)或(1,3,4
‑ꢀ
噁二唑);r1为苯基、2-甲苯基或2-氟苯基;r2为4-吡啶基、3-噻吩基、2-(4
‑ꢀ
甲基-2-戊基)-3-噻吩基、3',4',5'-三氟-[1,1'-联苯]-2-基或2-(2,4-二氯苯氧)苯基。反应式如下:
[0009][0010]
所述的一类5-三氟甲基-4-吡唑衍生物在制备抑制肿瘤细胞药物上的应用。
[0011]
本发明的有益效果:本发明在“5-三氟甲基-4-吡唑酰胺”的结构基础上,用“1,3,4-噁二唑”和“脲”取代了传统的“酰胺”结构,制备了系列5-三氟甲基-4
‑ꢀ
吡唑衍生物,通过化合物的抗癌细胞活性测试发现,该类化合物在10μm的浓度下对多种癌细胞表现出良好的抑制活性,为该类化合物在抗癌药物的研发和创制提供重要的科学基础。
具体实施方式
[0012]
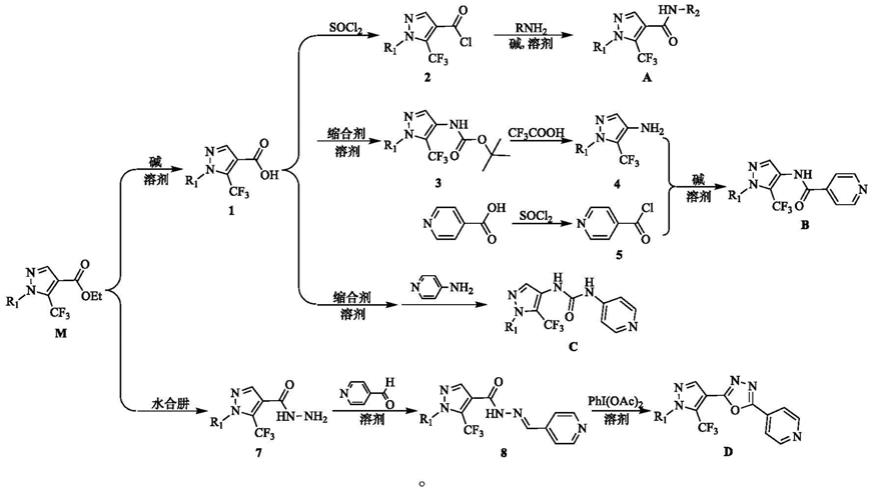
一类5-三氟甲基-4-吡唑衍生物的合成路线
[0013][0014]
以1-取代基-5-三氟甲基-1h-4-吡唑甲酸乙酯(m)为起始原料,通过水解反应获得中间体1,然后通过酰氯化得到中间体2,与相应的氨缩合反应获得目标化合物a。中间体1通过boc先保护氨基,然后通过curtis重排,水解和缩合反应获得目标化合物b。中间体1通过curtis重排反应获得目标化合物c。以1-取代基-5-三氟甲基-1h-4-吡唑甲酸乙酯(m)为起始原料,肼解获得中间体7,通过亲电加成消除反应和关环反应获得目标化合物d。
[0015]
目标化合物a的合成:
[0016][0017]
以n-(3-噻吩基)-1-苯基-5-三氟甲基-4-吡唑甲酰胺(a3)为例
[0018]
1-苯基-5-三氟甲基-1h-4-吡唑甲酸的合成(1)
[0019][0020]
在100ml的圆底烧瓶中分别加入m(20.0mmol),h2o(40ml),氢氧化钠(40.0mmol),加热回流5-7小时。调节ph至2.0-5.0,萃取,干燥,减压蒸馏除去溶剂获得1(18.0mmol),黄色固体,产率90%。
[0021]
1-苯基-5-三氟甲基-1h-4-吡唑甲酰氯的合成(2)
[0022][0023]
在50ml的圆底烧瓶中依次加入1(2.0mmol),socl2(25ml),加热回流 2-3小时,旋蒸,除去socl2获得粗品2。
[0024]
n-(3-噻吩基)-1-苯基-5-三氟甲基-4-吡唑甲酰胺(a3)的合成
[0025][0026]
在25ml的圆底烧瓶中,加入2(2.0mmol)、四氢呋喃(20-50ml),碳酸钾(4.0mmol),3-噻吩胺(2.0mmol)搅拌过夜,tlc检测反应,旋干溶剂,加二氯甲烷萃取,干燥,旋干溶剂,柱纯化获得a3(1.3mmol),黄色固体,产率 70%。
[0027]
目标化合物a的结构和理化数据:
[0028][0029]
a1:白色固体,产率51%,熔点149
–
150℃。1h nmr(400mhz,dmso-d6)δ10.14 (s,1h,nh),8.09(s,1h,pyrazole h),7.59(t,j=4.0hz,3h,benzene h),7.50-7.41(m, 10h,benzene h);
13
c nmr(101mhz,dmso-d6)δ159.48,139.56,138.73,137.95, 136.82,134.08,132.13,130.47,130.27,130.08,130.00,129.61,129.42,128.34,127.92, 127.13,125.99,121.13,119.24(q,j=270.4hz);
19
f nmr(367mhz,dmso-d6)δ
ꢀ‑
54.76.
[0030][0031]
a2:黄色油状物,产率70%。1h nmr(400mhz,dmso-d6)δ10.23(s,1h,nh),8.14 (s,1h,pyrazole h),7.82(t,j=4.0hz,1h,benzene h),7.74(d,j=4.0hz,1h, benzene h),7.59(t,j=4.0hz,3h,benzene h),7.53-7.50(m,2h,benzene h), 7.42-7.39(m,1h,benzene h),7.25-7.23(m,2h,benzene h),7.02(d,j=8.0hz,1h, benzene h),6.95-6.91(m,1h,benzene h);
13
c nmr(101mhz,dmso-d6)δ159.48, 151.27,148.72,139.78,138.76,130.06,129.89,129.89(q,j=39.0hz),129.42,128.63, 128.59,127.99,126.91,126.35,125.98,125.08,124.40,121.07,119.29(q,j=270.6hz), 118.55;
19
f nmr(367mhz,dmso-d6)δ-54.75.
[0032][0033]
a3:黄色固体,产率70%,熔点139
–
140℃。1h nmr(400mhz,dmso-d6)δ10.97 (s,1h,nh),8.31(s,1h,pyrazole h),7.72(s,1h,thiophen h),7.60(t,j=4.0hz,3h, benzene h),7.55-7.50(m,3h,benzene 2h,thiophen h),7.22(d,1h,j=8.0hz, thiophen h);
13
c nmr(101mhz,dmso-d6)δ158.00,139.79,138.81,136.43,130.14, 129.99(q,j=39.0hz),129.47,126.06,124.98,121.65,121.05,119.37(q,j=270.5hz), 109.84;
19
f nmr
(367mhz,dmso-d6)δ-54.71.
[0034][0035]
a4:黄色固体,产率78%,熔点124
–
125℃。1h nmr(400mhz,dmso-d6)δ10.15 (s,1h,nh),8.12(s,1h,pyrazole h),7.51-7.37(m,12h,benzene h),1.97(s,3h,ch3);
13
c nmr(101mhz,dmso-d6)δ159.53,139.61,137.98,137.77,136.92,135.23, 134.12,132.17,130.92,130.58,130.49,130.48(q,j=39.4hz),130.29,129.44,128.35, 128.08,127.40,127.17,126.78,120.25,119.18(q,j=270.5hz),16.36;
19
f nmr(367 mhz,dmso-d6)δ-56.17.
[0036][0037]
a5:白色固体,产率38%,熔点167
–
168℃。1h nmr(400mhz,dmso-d6)δ10.21 (s,1h,nh),8.18(s,1h,pyrazole h),7.52-7.37(m,10h,benzene h),1.96(s,3h,ch3);
13
c nmr(101mhz,dmso-d6)δ159.54,151.33(d,j=5.9hz),148.88(d,j=5.9hz), 139.66,137.75,135.99,135.23,134.19,130.92,130.60,130.51(q,j=39.4hz),130.31, 129.10,127.94,127.38,127.22,126.79,120.10,119.14(q,j=270.6hz),113.38(d,j= 21.3hz),16.27;
19
f nmr(367mhz,dmso-d6)δ:-56.37,-136.08
–‑
136.16(m,2f),
ꢀ‑
163.90
–‑
164.06(m 1f).
[0038][0039]
a6:黄色油状物,产率52%。1h nmr(400mhz,dmso-d6)δ10.20(s,1h,nh),8.18 (s,1h,pyrazole h),7.79(t,j=4.0hz,1h,benzene h),7.74(d,j=4.0hz,1h, benzene h),7.53-7.49(m,1h,benzene h),7.46-7.38(m,4h,benzene h),7.26-7.24(m, 2h,benzene h),7.05(d,j=8.0hz,1h,benzene h),6.95-6.92(m,1h,benzene h), 1.99(s,3h,ch3);
13
c nmr(101mhz,dmso-d6)δ159.39,151.24,149.00,139.88, 137.80,135.26,130.92,130.60(q,j=38.8hz),130.56,129.89,128.66,128.48,128.05, 127.40,127.01,126.76,126.66,125.13,124.38,121.22,120.09,119.20(q,j=270.7hz), 118.55,16.39;
19
f nmr(367mhz,dmso-d6)δ-56.13.
[0040][0041]
a7:黄色固体,产率72%,熔点124
–
125℃。1hnmr(400mhz,dmso-d6)δ10.95(s,1h,nh),8.33(s,1h,pyrazoleh),7.71(s,1h,thiophenh),7.52
–
7.50(m,2h,benzeneh),7.47(d,j=4.0hz,1h,benzeneh),7.41(d,j=4.0hz,2h,thiophenh),7.23(d,j=4.0hz,1h,benzeneh),2.00(s,3h,ch3);
13
cnmr(101mhz,dmso-d6)δ158.00,139.85,137.86,136.44,135.27,130.98,130.64,130.64(q,j=38.9hz),127.43,126.84,124.98,121.68,120.16,119.29(q,j=270.4hz),109.85,16.39;
19
fnmr(367mhz,dmso-d6)δ-56.12.
[0042][0043]
a8:淡黄色固体,产率51%,熔点87
–
88℃。1hnmr(400mhz,cdcl3)δ8.06(s,1h,pyrazoleh),7.45(t,j=8.0hz,1h,benzeneh),7.40(d,j=4.0hz,2h,thiophenh),7.37-7.28(m,3h,benzeneh),7.15(d,j=4.0hz,1h,nh),3.15-3.06(m,1h,ch(ch3)2),2.08(s,3h,ch
3-ph),1.59-1.45(m,3h,ch(ch3)ch2),1.30(d,j=8.0hz,3h,ch(ch3)ch2),0.89(t,j=4.0hz,6h,ch(ch3)2);
13
cnmr(101mhz,cdcl3)δ158.86,140.16,139.96,137.85,135.68,131.01,130.48,129.34,127.22,126.52,124.17,121.26,119.66,119.32(d,j=271.1hz),48.28,30.29,25.57,23.01,22.52(d,j=4.2hz),16.91;
19
fnmr(367mhz,cdcl3)δ-56.06.
[0044][0045]
a9:白色固体,产率62%,熔点161
–
162℃。1hnmr(400mhz,dmso-d6)δ10.18(s,1h,nh),8.18(s,1h,pyrazoleh),7.71-7.66(m,2h,benzeneh),7.66-7.40(m,10h,benzeneh);
13
cnmr(101mhz,dmso)δ159.14,157.72,155.23,140.36,137.93,136.89,134.00,132.90(d,j=8.0hz),132.12,131.21(q,j=39.3hz),130.43,130.26,129.32,128.31,128.01,127.18,126.32(d,j=12.6hz),125.31(d,j=3.8hz),120.85,119.01(q,j=270.7hz),116.53(d,j=19.0hz);
19
fnmr(367mhz,dmso-d6)δ-54.74(s,-cf3),-123.92(s,1f).
[0046][0047]
a10:白色固体,产率60%,熔点181
–
182℃;1h nmr(400mhz,dmso-d6)δ10.25 (s,1h,nh),8.24(s,1h,pyrazole h),7.68(t,j=8.0hz,2h,benzene h),7.57-7.36(m, 8h,benzene h);
13
c nmr(101mhz,dmso-d6)δ159.19,157.74,155.24,151.34, 148.93,140.43,135.17,134.08,132.96(d,j=8.0hz),131.21(q,j=39.3hz),130.33, 129.34,129.11,127.87,127.25,126.29(d,j=12.7hz),125.35(d,j=3.7hz),120.74, 119.00(q,j=270.6hz),116.56(d,j=19.1hz),113.36(d,j=21.3hz);
19
f nmr (367mhz,dmso-d6)δ-56.92(s,-cf3),-123.99(s,1f),-136.01
–‑
136.09(m,2f),
ꢀ‑
163.85
–‑
164.00(m,1f).
[0048][0049]
a11:黄色油状物,产率50%。1h nmr(400mhz,dmso-d6)δ10.26(s,1h,nh),8.22 (s,1h,pyrazole h),7.78-7.74(m,2h,benzene h),7.69-7.66(m,2h,benzene h),7.55 (t,j=8.0hz,1h,benzene h),7.45-7.40(m,2h,benzene h),7.26-7.23(m,2h, benzene h),7.01(d,j=8.0hz,1h,benzene h),6.93(t,j=4.0hz,1h,benzene h);
13
c nmr(101mhz,dmso-d6)δ159.09,157.75,155.25,151.24,148.97,140.61, 132.93(d,j=8.2hz),131.30(q,j=39.2hz),129.90,129.35,128.66,a1:128.41, 127.98,126.67,126.35(d,j=12.7hz),125.34(d,j=3.8hz),125.07,124.40,121.12, 120.75,119.06(q,j=270.7hz),118.58,116.57(d,j=19.0hz);
19
f nmr(367mhz, dmso-d6)δ-56.72(s,-cf3),-123.86(s,1f).
[0050][0051]
a12:白色固体,产率70%,熔点151
–
152℃。1h nmr(400mhz,dmso-d6)δ10.99 (s,1h,nh),8.40(s,1h,pyrazole h),7.73-7.69(m 3h,benzene h),7.57-7.50(m,2h, thiophen h),7.44(t,j=8.0hz,1h,benzene h),7.23(d,j=8.0hz,1h,thiophen h);
13
c nmr(101mhz,dmso-d6)δ157.68,155.31,140.62,136.37,132.98(d,j=8.0hz), 131.44(q,j=39.2hz),129.39,125.39(d,j=3.8hz),125.02,121.70,120.82,119.18(q, j=270.6hz),116.70,116.51,110.00;
19
f nmr(367mhz,dmso-d6)δ-56.71(s,
ꢀ‑
cf3),-123.97(m,1f).
[0052][0053]
a13:白色固体,产率48%,熔点125
–
126℃。1hnmr(400mhz,cdcl3)δ8.10(s,1h,pyrazoleh),7.57-7.52(m,1h,benzeneh),7.47(t,j=4.0hz,1h,benzeneh),7.40(d,j=8.0hz,1h,thiophenh),7.31(t,j=8.0hz,2h,benzeneh),7.16(d,j=8.0hz,1h,nh),3.15-3.06(m,1h,ch(ch3)2),1.60-1.45(m,3h,ch(ch3)ch2),1.29(d,j=8.0hz,3h,ch(ch3)ch2),0.88(t,j=4.0hz,6h,ch(ch3)2);
13
cnmr(101mhz,cdcl3)δ158.55,158.29,155.76,140.93,140.04,132.18(d,j=7.8hz),129.26,128.70,124.65(d,j=4.0hz),124.13,121.30,116.59(d,j=19.3hz),48.23,30.29,25.59,23.06,22.51;
19
fnmr(367mhz,cdcl3)δ-56.60(s,-cf3),-122.29(s,1f).
[0054][0055]
a14:淡黄色固体,产率26%,熔点136
–
137℃。1hnmr(400mhz,dmso-d6)δ10.17(s,1h,nh),8.18(s,1h,pyrazoleh),7.75(d,j=8.0hz,1h,benzeneh),7.69-7.64(m,2h,benzeneh),7.57(t,j=8.0hz,1h,benzeneh),7.48-7.40(m,8h,benzeneh);
13
cnmr(101mhz,dmso-d6)δ159.15,140.18,137.98,137.04,136.19,134.04,132.46,132.14,131.22(q,j=40.9hz),131.02,130.45,130.28,130.17,129.67,128.33,128.18,127.24,120.40,117.66;
19
fnmr(367mhz,dmso-d6)δ-56.46.
[0056][0057]
a15:白色固体,产率40%,熔点171
–
172℃。1hnmr(400mhz,dmso-d6)δ10.25(s,1h,nh),8.25(s,1h,pyrazoleh),7.75(d,j=8.0hz,1h,benzeneh),7.70-7.64(m,2h,benzeneh),7.57(t,j=8.0hz,1h,benzeneh),7.51-7.36(m,6h,benzeneh);
13
cnmr(101mhz,dmso-d6)δ159.21,151.36,148.95,140.23,139.36(t,j=15.6hz),136.89(t,j=15.4hz),136.18,135.34,134.13,132.49,131.30(q,j=39.1hz),131.05,130.32,130.18,129.65,129.12,128.35,128.06,127.30,120.27,118.99(q,j=270.6hz),113.36(d,j=21.1hz);
19
fnmr(367mhz,dmso-d6)δ-56.66(s,-cf3),-136.00
–‑
136.08(m,2f),-163.86
–‑
164.01(m,1f).
[0058][0059]
a16:黄色油状物,产率60%;1hnmr(400mhz,cdcl3)δ8.57(s,1h,benzeneh),8.32(s,1h,nh),8.09(s,1h,pyrazoleh),7.57(d,j=8.0hz,1h,benzeneh),7.52-7.48(m,2h,benzeneh),7.45-7.42(m,2h,benzeneh),7.26-7.23(m,1h,benzeneh),7.19(t,j=8.0hz,1h,benzeneh),7.07(t,j=8.0hz,1h,benzeneh),7.01(d,j=8.0hz,1h,benzeneh),6.78(d,j=8.0hz,1h,benzeneh);
13
cnmr(101mhz,cdcl3)δ158.44,150.14,145.30,140.44,136.57,132.28,131.95(q,j=39.7hz),131.69,130.65,130.29,130.18,128.94,128.61,128.30,127.47,126.51,124.69,124.47,121.47,121.38,120.19,119.01(q,j=271.4hz),116.25;
19
fnmr(367mhz,cdcl3)δ-56.60.
[0060][0061]
a17:棕色固体,产率70%,熔点113
–
114℃。1hnmr(400mhz,dmso-d6)δ10.97(s,1h,nh),8.40(s,1h,pyrazoleh),7.78-7.71(m,3h,benzeneh),7.67(t,j=8.0hz,1h,thiophenh),7.58(t,j=4.0hz,1h,thiophenh),7.51(t,j=4.0hz,1h,benzeneh),7.24(d,j=8.0hz,1h,thiophenh);
13
cnmr(101mhz,dmso-d6)δ157.67,140.41,136.39,136.31,132.52,131.46(q,j=39.1hz),131.09,130.22,129.70,128.40,124.98,121.75,120.36,119.16(q,j=270.7hz),110.00;
19
fnmr(367mhz,dmso-d6)δ-56.42.
[0062][0063]
a18:白色固体,产率50%,熔点108
–
109℃。1hnmr(400mhz,cdcl3)δ8.09(s,1h,pyrazoleh),7.57(d,j=8.0hz,1h,benzeneh),7.53-7.49(m,2h,benzeneh;thiophenh),7.45-7.42(m,2h,benzeneh),7.37(d,j=4.0hz,1h,thiophenh),7.14(d,j=4.0hz,1h,nh),3.15-3.06(m,1h,ch(ch3)2),1.57-1.44(m,3h,ch(ch3)ch2),1.28(d,j=8.0hz,3h,ch(ch3)ch2),0.87(t,j=4.0hz,6h,ch(ch3)2);
13
cnmr(101mhz,cdcl3)δ158.58,140.67,136.48,132.29,131.72,131.40(q,j=39.6hz),130.28,129.23,128.99,127.49,124.18,121.22,119.95,119.14(q,j=271.2hz),48.25,30.24,25.53,22.98,22.49(d,j=2.8hz);
19
fnmr(367mhz,cdcl3)δ:-56.35.
[0064][0065]
a19:白色固体,产率60%,熔点120
–
121℃。1hnmr(400mhz,cdcl3)δ8.36(s,1h,nh),7.56(s,1h,pyrazoleh),7.46-7.40(m,3h,benzeneh),7.37-7.32(m,3h,benzeneh),7.24-7.23(m,2h,benzeneh),4.72-4.19(m,1h,cyclohexylh),1.96-1.94(m,6h,cyclohexylh),1.74(d,j=12.0hz,1h,cyclohexylh),1.44-1.35(m,2h,cyclohexylh),1.30-1.21(m,1h,cyclohexylh);
13
cnmr(101mhz,cdcl3)δ159.54,137.79,136.28,134.28,131.53,130.55,130.06,129.32,128.88,125.03,121.97,119.68(q,j=270.6hz),119.09,61.25,33.10,25.42,24.94;
19
fnmr(367mhz,cdcl3)δ-56.83.
[0066][0067]
a20:白色固体,产率55%,熔点177
–
178℃。1hnmr(400mhz,cdcl3)δ8.25(s,1h,nh),7.64(s,1h,pyrazoleh),7.45(t,j=8.0hz,1h,benzeneh),7.27(s,1h,benzeneh),7.24(d,j=4.0hz,2h,benzeneh),7.02(t,j=8.0hz,2h,benzeneh),4.27-4.20(m,1h,cyclohexylh),1.98-1.90(m,6h,cyclohexylh),1.73(d,j=12.0hz,1h,cyclohexylh),1.42-1.37(m,2h,cyclohexylh),1.28(t,j=12.0hz,1h,cyclohexylh);
13
cnmr(101mhz,cdcl3)δ159.82,152.60,150.27,138.01,134.04,129.98,129.55,125.50,122.88,121.05,118.85,113.56(d,j=21.7hz),61.34,33.10,25.42,24.93;
19
fnmr(367mhz,cdcl3)δ-56.87(s,cf3),-132.62
–‑
132.70(m,2f),-160.43
–‑
160.52(m,1f).
[0068][0069]
a21:黄色固体,产率40%,熔点119
–
120℃。1hnmr(400mhz,cdcl3)δ8.53(s,1h,nh),8.11(s,1h,pyrazoleh),7.79(s,1h,benzeneh),7.48(s,1h,benzeneh),7.24-7.21(m,1h,benzeneh),7.17(t,j=8.0hz,1h,benzeneh),7.05(t,j=4.0hz,1h,benzeneh),6.97(d,j=8.0hz,1h,benzeneh),6.75(d,j=8.0hz,1h,benzeneh),4.31-4.24(m,1h,cyclohexylh),2.00-1.90(m,6h,cyclohexylh),1.73(d,j=12.0hz,cyclohexylh),1.43-1.40(m,2h,cyclohexylh),1.32-1.22(m,1h,cyclohexylh);
13
cnmr(101mhz,cdcl3)δ159.46,150.21,145.15,138.37,130.61,130.06,128.84,128.76(q,j=39.2hz),128.26,126.41,124.50,121.31,121.27,119.78(q,j=270.6hz),119.16,116.34,61.30,33.09,25.42,24.93;
19
fnmr(367mhz,cdcl3)δ-56.63.
[0070][0071]
a22:白色固体,产率50%,熔点183
–
184℃。1hnmr(400mhz,cdcl3)δ7.87(s,1h,nh),7.78(s,1h,pyrazoleh),7.76(d,j=4.0hz,1h,thiophenh),7.25(d,j=4.0hz,1h,thiophenh),7.04(d,1h,j=4.0hz,thiophenh),4.31-4.23(m,1h,cyclohexylh),1.99-1.91(m,6h,cyclohexylh),1.76,(d,j=12.0hz,1h,cyclohexylh),1.44-1.40(m,2h,cyclohexylh),1.28(q,j=12.0hz,1h,cyclohexylh);
13
cnmr(101mhz,cdcl3)δ159.15,138.41,135.27,128.74,124.98,121.42,121.15,118.95,111.27,61.47,33.35,25.69,25.19;
19
fnmr(367mhz,cdcl3)δ-56.7.
[0072]
目标化合物b的合成:
[0073][0074]
以n-(1-(2-甲苯基)-5-三氟甲基
–
4-吡唑基)-4-吡啶甲酰胺(b1)为例1-(2-甲苯基)-5-三氟甲基4-吡唑boc胺(3)的合成
[0075][0076]
在三口瓶中加入1(10.0mmol)和叔丁醇(25-50ml),在氩气保护下加入叠氮磷酸二苯酯(13.0mmol)和二异丙基乙胺(20.0mmol),常温搅拌3-4小时,加热回流2-3小时,旋蒸去除溶剂,萃取,干燥,柱纯化得到3(7.1mmol),产率71%,黄色油状液体。
[0077]
1-(2-甲苯基)-5-三氟甲基4-吡唑胺(4)的合成
[0078][0079]
在圆底烧瓶中依次加入3(10.0mmol),二氯甲烷(20ml)和三氟乙酸(10ml),常温下反应2-3小时,旋蒸除去溶剂,加入饱和碳酸钠,萃取,干燥,抽滤,旋蒸,柱层析得到4(9.0mmol),产率90%,黄色固体。
[0080]
4-吡啶甲酰氯(5)的合成
[0081][0082]
在圆底烧瓶中依次加入4-吡啶甲醛(5.0mmol),socl2(25ml),加热2-3小时,旋蒸,除去socl2获得粗品5。
[0083]
n-(1-(2-甲苯基)-5-三氟甲基4-吡唑基)-4-吡啶甲酰胺(b1)的合成
[0084][0085]
在圆底烧瓶中,加入5(2.0mmol)、四氢呋喃(30ml),碳酸钾(4.0mmol), 4(2.0mmol)搅拌3-6小时,旋干溶剂。萃取,干燥,旋干溶剂,柱纯化获得b1 (1.2mmol),白色固体,产率60%。
[0086]
目标化合物b的结构和理化数据:
[0087][0088]
b1:白色固体,产率60%,熔点82
–
83℃。1h nmr(500mhz,dmso-d6)δ:8.73(d, j=5.0hz,2h,pyridine h),8.48(s,1h,nh),8.43(s,1h,pyrazole h),7.67(d,j=5.0 hz,2h,pyridine h),7.38(t,j=5.0hz,1h,benzene h),7.28(d,j=7.2hz,1h, benzene h),7.23(t,j=10.0hz,2h,benzene h),1.99(s,3h,ch3);
13
c nmr(126 mhz,dmso-d6)δ:163.18,150.69,140.59,137.39,136.47,134.10,130.91,130.41, 127.66,126.34,121.49,120.90,120.17(q,j=269.2hz),16.75;
19
f nmr(471mhz, dmso-d6)δ:-57.08(s,cf3).
[0089][0090]
b2:黄色油状物,产率80%。1h nmr(500mhz,dmso-d6)δ9.10(s,1h,nh),7.94 (s,1h,pyrazole h),7.67-7.59(m,2h,benzene h),7.52-7.48(m,1h,benzene h),7.39 (t,j=8.0hz,1h,benzene h),1.45(s,9h,c(ch3)3);
13
c nmr(126mhz,dmso-d6) δ158.08,156.08,153.66,137.18,132.70(d,j=7.8hz),129.76,125.25(d,j=3.8hz), 123.27,119.66(q,j=269.3hz),116.70,116.55,79.82,28.01;
19
f nmr(471mhz, dmso-d6)δ-57.60(s,cf3),-123.50(s,1f).
[0091]
目标化合物c的合成:
[0092]
以1-(4-吡啶基)-3-(1-邻甲苯基-5-三氟甲基
–
4-吡唑基)脲(c1)为例
[0093][0094]
在三口瓶中,加入1(2.0mmol),1,4-二氧六环(30ml),在氩气保护下加入叠氮磷酸二苯酯(1.0mmol)和二异丙基乙胺(2.0mmol)。常温搅拌2-3小时后加入4-氨基吡啶(2.0mmol),加热回流4-5小时,旋蒸除去溶剂,萃取,干燥,柱纯化获得c1(1.2mmol),白色固体,产率62%。
[0095]
目标化合物c的结构和理化数据:
[0096][0097]
c1:白色固体,产率62%,熔点131
–
132℃。1hnmr(400mhz,dmso-d6)δ9.60(s,1h,nhco),8.55(s,1h,conh),8.38(d,j=4.0hz,2h,pyridineh),8.22(s,1h,pyrazoleh),7.50-7.42(m,4h,benzeneh),7.36(d,j=4.0hz,2h,pyridineh);
13
cnmr(101mhz,dmso-d6)δ172.61,152.45,150.64,146.72,138.17,136.47,134.31,131.29,130.81,128.25,127.04,123.39,120.55(q,j=268.9hz),120.20(q,j=37.1hz),112.76,16.74;
19
fnmr(376mhz,dmso-d6)δ-56.32.
[0098][0099]
c2:白色固体,产率68%,熔点204
–
205℃。1hnmr(400mhz,dmso-d6)δ9.58(s,1h,nhco),8.60(s,1h,conh),8.38(d,j=4.0hz,2h,pyridineh),8.28(s,1h,pyrazoleh),7.68-7.62(m,2h,benzeneh),7.51(t,j=8.0hz,1h),7.46(d,j=4.0hz,2h,pyridineh),7.40(t,j=8.0hz,1h,benzeneh);
13
cnmr(101mhz,dmso-d6)δ158.36,155.87,152.06,150.36,146.26,135.03,132.73(d,j=8.0hz),129.83,126.51(d,j=12.5hz),125.27(d,j=3.9hz),120.38(q,j=37.6hz),120.06(q,j=268.9hz),116.63(d,j=19.2hz),112.44;
19
fnmr(376mhz,dmso-d6)δ-56.90(d,j=3.8hz,cf3),-123.59.
[0100]
目标化合物d的合成:
[0101]
以2
–
(4
–
吡啶基)
–5–
(1
–
邻甲苯基
–5–
三氟甲基
–4–
吡唑基)
–
1,3,4
–
噁二唑(d1)为例
[0102]1–
邻甲苯基
–5–
三氟甲基
–4–
吡唑甲酰肼(7)的合成
[0103][0104]
在圆底烧瓶中,加入m(10.0mmol),水合肼(20ml),加热至80℃反应3-5小时。冷却至室温,抽滤,干燥,获得7(7.0mmol),无色晶体,产率70%。(e)
–
n'
–
(4-吡啶亚甲基)
–1–
邻甲苯基-5-三氟甲基4
–
吡唑甲酰肼(8)的合成
[0105][0106]
在圆底烧瓶中,加入7(3.5mmol),乙醇(12ml)和4
–
吡啶甲醛(3.8mmol),加热回流1-2小时,旋蒸除去溶剂,萃取,干燥,柱纯化获得8(2.1mmol),黄色固体,产率60%。
[0107]2–
(4-吡啶基)
–5–
(1
–
邻甲苯基
–5–
三氟甲基
–4–
吡唑基)
–
1,3,4
–
噁二唑(d1)的合成
[0108][0109]
在圆底烧瓶中,加入8(1.3mmol),二氯甲烷(10ml)和碘苯二乙酸(1.5mmol),在室温下反应2-3小时,旋蒸除去溶剂,萃取,干燥,柱纯化获得d1(0.8mmol),棕色固体,产率60%
[0110]
目标化合物d的结构和理化数据:
[0111][0112]
d1:棕色固体,产率60%,熔点178
–
179℃。1h nmr(400mhz,dmso-d6)δ8.88 (d,j=4.0hz,2h,pyridine h),8.69(s,1h,pyrazole h),8.01(d,j=4.0hz,2h, pyridine h),7.58-7.49(m,3h,benzene h),7.43(t,j=8.0hz,1h,benzene h),2.03(s, 3h,ch3);
13
c nmr(101mhz,dmso-d6)δ163.24,158.44,151.57,141.66,137.90, 135.63,131.49,131.39,130.59,127.90,127.36,120.73,16.75;
19
f nmr(376mhz, dmso-d6)δ-56.51.
[0113][0114]
d2:白色固体,产率58%,熔点132
–
133℃。1h nmr(400mhz,dmso-d6)δ8.88 (d,j=4.0hz,2h,pyridine h),8.75(s,1h,pyrazole h),8.00(d,j=4.0hz,2h, pyridine h),7.81(t,j=8.0hz,1h,benzene h),7.77-7.71(m,1h,benzene h),7.59(t, j=8.0hz,1h,benzene h),7.48(t,j=8.0hz,1h,benzene h);
13
c nmr(101mhz, dmso-d6)δ163.31,158.14,155.55,151.56,142.24,133.74(d,j=7.9hz),131.35(q, j=39.8hz),130.56,129.82,126.49(d,j=12.7hz),125.94(d,j=3.8hz),120.73, 117.96,117.06(d,j=18.9hz),108.59;
19
f nmr(376mhz,dmso-d6)δ-57.26(d,j =3.8hz,cf3),-124.28.
[0115]
目标化合物的抗癌活性测试方法
[0116]
试验材料
[0117]
癌细胞:肺癌细胞(a549),前列腺癌细胞(pc-3),白血病细胞(k562) 和肝癌细胞(hep-g2)。
[0118]
对照药剂:吉非替尼(gefitinib,98%原药,南京康满林生物医药科技有限公司)、5-氟尿嘧啶(5-fluorouracil,98%原药,天津希恩思生化科技有限公司)
[0119]
配制药液:称取待测化合物溶解到dmso中,配置浓度为10μm的溶液。以等量的dmso作为空白对照,以商品药吉非替尼和5-氟尿嘧啶为对照药。
[0120]
化合物抗癌活性测试
[0121]
细胞接种于96孔板,细胞密度为3-5
×
104cell/wel置于5%二氧化碳、37℃的细胞培养箱中培养,待细胞贴壁后,加入指定浓度的待测样品20μl,同一浓度药物设置三个平行。加药培养48h后,每孔加入20μl mtt(5mg/ml,10%mtt),继续培养4h,终止培养。采用吸液的方式,将培养板内的溶液吸出,每孔加入150 μl dmso溶解的甲臜颗粒,摇床震荡10min
(150转/分),混匀,使用酶标仪,在490nm测定od值,记录结果。使用prism 5.0软件计算抑制率,每个实验重复三次。
[0122]
计算公式如下:
[0123]
抑制率=1-(加药组od值-空白组od值)/(阴性组od值-空白组od值)
×
100%
[0124]
化合物对癌细胞ic
50
值的测定
[0125]
根据活性初步筛选数据,对高活性化合物和对照药进行了ic
50
值的测定。将待测药液分别配置成5个梯度浓度(10μm、5μm、2.5μm、1.25μm、0.625μm),以等量的dmso为空白对照,其余处理步骤同化合物的初筛一致,使用prism 5.0 软件计算ic
50
,每个实验重复三次。
[0126]
目标化合物的抗肿瘤细胞活性数据分析
[0127]
表1目标化合物在10μm的浓度下对癌细胞的抑制率
[0128]
[0129][0130]
a549:肺癌细胞;pc-3:前列腺癌细胞;k562:白血病细胞;hep-g2:肝癌细胞。
[0131]
通过对系列目标化合物a、b、c和d对四种肿瘤细胞的活性测试结果分析发现,酰胺类化合物(a)对肺癌细胞表现出明显的抑制活性,其中部分对前列腺癌细胞表现出较好的活性,如a8(ic
50
=12.5μm)和a17(ic
50
=23.8μm);而改变“酰胺”键位置后化合物b2(ic
50
=11.5μm)对前列腺癌细胞表现出较好的活性;而将“酰胺”替换成“1,3,4-噁二唑”和“脲”后,化合物c1、c2、d1和 d2对前列腺癌细胞(ic
50
=8.6,4.9,6.8和4.7μm)和白血病细胞(ic
50
=17.8,6.8, 15.5和13.3μm)均表现出良好的抑制活性。其中部分化合物的抗肿瘤细胞活性优于抗癌药物吉非替尼和5-氟尿嘧啶,具有继续研究的价值。为进一步的结构优化和成药性研究奠定基础。
[0132]
表2目标化合物对癌细胞的ic
50
值
[0133][0134]
