1.本发明涉及生物医用新材料技术领域,尤其涉及一种赖氨酸接枝聚乙烯亚胺阳离子基因载体及其制备方法和应用。
背景技术:
2.目前对于肿瘤治疗的方法很多,传统疗法放疗、化疗、手术切除存在着副作用大、易复发等缺点;而一些新兴疗法,如光疗、免疫治疗等也存在着响应率低、毒副作用大等缺点,基因治疗由于可以从基因水平校正病理缺陷,从而治愈癌症,目前已经被公认为癌症治疗的重要手段。基因在体外和体内的传递都离不开基因载体。当基因载体携带治疗基因在体内运输时,传递体系在体内会遇到很多障碍。在基因载体中,阳离子型基因载体日益受到人们的关注。在阳离子基因载体中,pei25k为阳离子基因载体的“黄金标准”。pei25k虽然具有较高的转染效率,但是其存在严重的细胞毒性,限制了其在临床上的应用。因此设计出高转染效率,低细胞毒性的阳离子基因载体逐渐成为研究的热点。
技术实现要素:
3.有鉴于此,本发明要解决的技术问题在于提供一种赖氨酸接枝聚乙烯亚胺阳离子基因载体及其制备方法和应用,制备的阳离子基因载体同时具有高转染效率和低细胞毒性。
4.本发明提供了一种赖氨酸接枝聚乙烯亚胺阳离子基因载体,包括超支化聚乙烯亚胺和接枝在所述超支化聚乙烯亚胺上的对甲苯磺酰基保护的赖氨酸。
5.优选的,所述超支化聚乙烯亚胺的重均分子量为600~25000da。
6.优选的,所述对甲苯磺酰基保护的赖氨酸的接枝量为5~300。
7.本发明提供了上述赖氨酸接枝聚乙烯亚胺阳离子基因载体的制备方法,包括以下步骤:
8.s1)将edc
·
hcl和hobt与对甲苯磺酰基和叔丁氧羰基双保护的赖氨酸在有机溶剂中混合,进行活化;
9.s2)将步骤s1)活化后的溶液与超支化聚乙烯亚胺的水溶液混合,进行反应,然后进行透析、冻干,得到中间产物;
10.s3)采用三氟乙酸对步骤s2)得到的中间产物进行脱保护,然后在无水乙醚中沉降,产物经真空抽干、透析、冻干,得到赖氨酸接枝聚乙烯亚胺阳离子基因载体。
11.优选的,所述有机溶剂为dmf、dmso、二氯甲烷或三氯甲烷。
12.优选的,所述活化的温度为20~40℃;时间为1~2h。
13.优选的,所述对甲苯磺酰基和叔丁氧羰基双保护的赖氨酸与超支化聚乙烯亚胺的摩尔比为1:1~800:1。
14.优选的,所述步骤s2)中反应的温度为20~40℃;反应的时间为24~72h。
15.优选的,所述步骤s2)中透析的分子量为1000~3500;
16.所述步骤s3)透析的分子量为1000~3500。
17.本发明提供了上述赖氨酸接枝聚乙烯亚胺阳离子基因载体作为转染细胞系的质粒dna的阳离子载体的应用。
18.与现有技术相比,本发明提供了一种赖氨酸接枝聚乙烯亚胺阳离子基因载体,包括超支化聚乙烯亚胺和接枝在所述超支化聚乙烯亚胺上的对甲苯磺酰基保护的赖氨酸。为了实现基因载体对基因的高效递送,本发明对小分子量聚乙烯亚胺进行了改性,在其上接枝了对甲苯磺酰基保护的赖氨酸。
19.本发明分别制备了3个不同接枝比例(1:5;1:10;1:15)的pei-lys(tos)载体。通过比较,筛选出了转染性能最好的接枝比例(1:10)用于后续的其他评价表征。通过对载体结构性能的表征,证明了对甲苯磺酰基保护的赖氨酸被成功接枝在了小分子量pei上。通过透射电镜、粒径和表面电位的评价,可以看到改性后的小分子量pei表面电位有所降低,因此毒性会有所改善。与基因形成复合物颗粒之后的粒径较改性前有所降低,更有利于肿瘤细胞的内吞和基因转染。实验结果表明,本发明通过改性设计,制备的pei-lys(tos)阳离子载体,具有更高的转染效率及更低的细胞毒性,在基因载体设计和抗肿瘤领域有巨大的应用前景。
附图说明
20.图1为本发明实施例1制备的pei
1.8k-lys(tos)-1:10的核磁氢谱图;
21.图2为本发明制备的pei
1.8k-lys基因载体与dna2.5/1复合后的sem图;
22.图3为本发明制备的pei
1.8k
、pei
1.8k-lys基因载体材料与dna复合后的粒径图;
23.图4为本发明制备的pei
1.8k
、pei
1.8k-lys基因载体材料与dna2.5/1复合时的表面电位。
具体实施方式
24.本发明提供了一种阳离子基因载体,包括超支化聚乙烯亚胺(pei)和接枝在所述超支化聚乙烯亚胺上的对甲苯磺酰基保护的赖氨酸(pei-lys(tos))。
25.本发明优选的,所述超支化聚乙烯亚胺的重均分子量为600~25000da,更优选为1000~2000da。在本发明的一些具体实施例中,采用pei1.8k为原料,即重均分子量为1800da。
26.本发明优选的,所述对甲苯磺酰基保护的赖氨酸的接枝量为5~300,更优选为10。具体的,可以是5、10、15。
27.上述接枝量指对甲苯磺酰基保护的赖氨酸接枝到超支化聚乙烯亚胺的结构中,对甲苯磺酰基保护的赖氨酸与超支化聚乙烯亚胺的摩尔比。
28.本发明提供了上述阳离子基因载体的制备方法,包括以下步骤:
29.s1)将edc
·
hcl和hobt与对甲苯磺酰基和叔丁氧羰基双保护的赖氨酸在有机溶剂中混合,进行活化;
30.s2)将步骤s1)活化后的溶液与超支化聚乙烯亚胺的水溶液混合,进行反应,然后进行透析、冻干,得到中间产物;
31.s3)采用三氟乙酸对步骤s2)得到的中间产物进行脱保护,然后在无水乙醚中沉降,产物经真空抽干、透析、冻干,得到阳离子基因载体pei-lys(tos)。
32.本发明优选的,所述有机溶剂为dmf、dmso、二氯甲烷或三氯甲烷。
33.本发明优选的,所述活化的温度为20~40℃,更优选为30℃。
34.本发明优选的,所述活化的时间为1~2h,更优选为2h。
35.所述edc
·
hcl的用量优选为对甲苯磺酰基赖氨酸的1~2倍摩尔当量,更优选为对甲苯磺酰基赖氨酸的1.5倍当量。
36.所述hobt的用量优选为对甲苯磺酰基赖氨酸的1~2倍摩尔当量,更优选为对甲苯磺酰基赖氨酸的1.5倍当量。
37.本发明优选的,所述对甲苯磺酰基和叔丁氧羰基双保护的赖氨酸与超支化聚乙烯亚胺的摩尔比为1:1~800:1,更优选为5:1~15:1,进一步优选为10:1。
38.本发明优选的,所述步骤s2)中反应的温度为20~40c,更优选为30c;反应的时间为24~72h,更优选为72h。
39.本发明优选的,所述步骤s2)中透析的分子量为1000~3500,更优选为2000;所述步骤s3)透析的分子量为1000~3500,更优选为2000。
40.上述分子量指透析袋的分子量。
41.所述冻干优选采用冷冻干燥机进行,所述冷阱的温度优选设定为-50~-80℃,更优选设定为-60~-70℃。
42.上述三氟乙酸脱保护的时间优选为4~8h,更优选为6h。
43.优选具体的,包括步骤如下:
44.将超支化聚乙烯亚胺溶解于去离子水中,将对甲苯磺酰基和叔丁氧羰基双保护的赖氨酸(boc-lys(tos)-oh溶解于有机溶剂中,将edc
·
hcl和hobt加入到boc-lys(tos)-oh溶液中室温下活化反应1h,然后将pei的水溶液缓慢加入到上述混合液中,室温反应,将反应的混合物透析、冻干,然后将冻干产物在三氟乙酸的条件下反应,真空浓缩,加无水乙醚沉降,真空抽干,透析,冻干得到白色固体产物pei-lys(tos)。
45.本发明的pei-lys(tos)可作为转染细胞系的质粒dna的阳离子载体。
46.基于此,本发明提供了上述阳离子基因载体作为转染细胞系的质粒dna的阳离子载体的应用。
47.所述转染的步骤和条件优选如下:
48.(1)细胞培养
49.将细胞培养在含10%体积分数的胎牛血清培养液中,细胞在设定温度为37℃、体积分数为5%的co2的恒温培养箱中培养;
50.(2)细胞转染
51.在转染前24h,取对数生长期细胞,胰酶消化后用含体积分数10%的胎牛血清培养液稀释,按照1
×
104细胞/孔的密度铺板于96孔细胞培养板中,置于培养温度为37℃、含体积分数5%的co2的恒温培养箱中培养直至细胞汇合度达80%~90%,转染时,将载体/pdna复合物复合20min后,按照0.2μg pdna/孔加入到96孔细胞板中,继续培养48小时。
52.根据本发明,所述细胞系包括但不限于hela、b16f10、293t、mcf-7、ct26、c26、cho、nih-3t3、4t1、a549、hepg2、lo2。
53.为了进一步说明本发明,下面结合实施例对本发明提供的阳离子基因载体及其制备方法和应用进行详细描述。
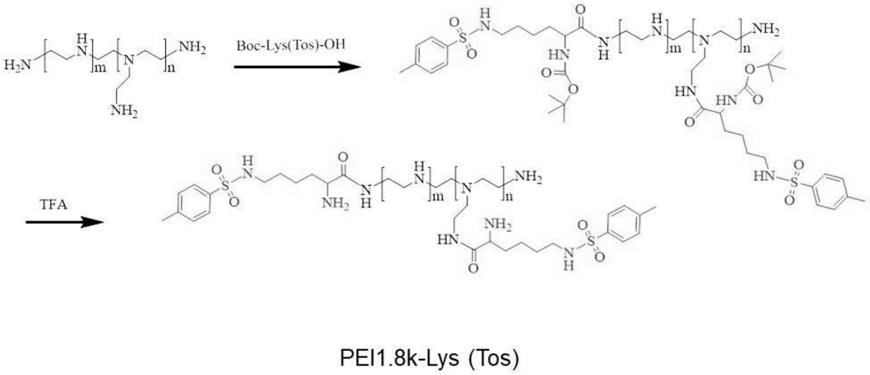
54.实施例1pei1.8k-lys(tos)的合成
[0055][0056]
将小分子量聚乙烯亚胺pei1.8k和boc-lys(tos)-oh溶于dmf,然后将hobt和edci加入其中,室温反应72h,然后将反应后的溶液用2000透析袋透析,冻干,将冻干样品溶解于三氟乙酸,室温条件下反应4小时,乙醚沉降,真空旋干,用去离子水溶解,然后2000透析袋透析,冻干,得到超支化聚乙烯亚胺(pei)接枝对甲苯磺酰基保护的赖氨酸(pei
1.8k-lys(tos))。
[0057]
根据上述方法,制备3个不同接枝比例的pei接枝甲苯磺酰基保护的赖氨酸(lys(tos)),接枝率列于表1。
[0058]
表1原料的摩尔比与产物分子量的对应关系
[0059][0060]
测试例1 pei
1.8k-lys基因载体的结构性能表征
[0061]
对载体结构性能进行表征,结果如图1所示,证明了聚赖氨酸被成功接枝在了小分子量pei上。
[0062]
测试例2 pei
1.8k-lys基因载体与dna2.5/1复合后的粒径表征
[0063]
配制0.05mg/ml的小牛胸腺dna水溶液,按照不同的聚合物/dna重量比配制同体积的聚合物溶液,混合,涡旋,室温下结合20min后,得到不同重量比的载体/dna复合物(质量比2.5:1)。
[0064]
采用透射电镜对pei
1.8k
、pei
1.8k-lys基因载体与dna2.5/1复合后的粒径进行表征,结果如图2、图3所示,图2为pei
1.8k-lys基因载体与dna2.5/1复合后的sem图,图3为pei
1.8k
、pei
1.8k-lys基因载体材料与dna复合后的粒径图。
[0065]
可以看到改性后的材料粒径大约在200nm左右。由图3可以看出,与未接枝相比,
pei接枝lys(tos)后的三个比例与dna形成的复合物颗粒,粒径均小于未接枝前。
[0066]
对pei
1.8k
、pei
1.8k-lys基因载体与dna2.5/1复合后的表面电位进行测试,结果如图4所示,可以看到改性后的材料电位有所下降。
[0067]
由图4可以看出,与未接枝相比,随着lys(tos)接枝量的增加,pei接枝lys(tos)后的三个比例与dna形成的复合物颗粒,电位有下降的趋势。
[0068]
载体/dna复合物的电位和粒径是在室温下测定(zeta potential/bi-90plus particle analyzer,brookhaven,usa)。
[0069]
测试例3 pei
1.8k-lys基因载体在细胞中的转染评价结果
[0070]
利用pei
1.8k-lys介导pgl3(荧光素酶质粒)、pegfpn1(绿色荧光蛋白质粒)对细胞进行体外转染。
[0071]
(1)细胞培养
[0072]
将细胞培养在含10%体积分数的胎牛血清培养液中,细胞在设定温度为37℃、体积分数为5%的co2的恒温培养箱中培养。
[0073]
(2)细胞转染
[0074]
在转染前24h,取对数生长期细胞,胰酶消化后用含体积分数10%的胎牛血清培养液稀释,按照1
×
104细胞/孔的密度铺板于96孔细胞培养板中,置于培养温度为37℃、含体积分数5%的co2的恒温培养箱中培养直至细胞汇合度达80%~90%。转染时,将载体pdna复合物复合20min后,按照0.2μg pdna/孔加入到96孔细胞板中,继续培养48小时。
[0075]
(3)细胞转染效率的测定
[0076]
a)荧光素酶活性检测
[0077]
从培养箱中取出细胞培养板,移除细胞培养液,用pbs洗涤2次,加入细胞裂解液放入-80℃中裂解20min,然后每孔加入一定量的荧光素酶底物,通过照度计定量测定细胞转染效率,结果如表2所示。
[0078]
b)绿色荧光蛋白(gfp)的表达
[0079]
在荧光显微镜下观察绿色荧光蛋白信号。能够转染的阳性细胞能够产生绿色荧光,而不转染的细胞就不会产生绿色荧光。可以用流式细胞仪(flow cytometry)检测转染阳性细胞的百分比,结果如表3所示。
[0080]
(4)细胞毒性的检测(mtt)
[0081]
采用四甲基偶氮唑盐(噻唑蓝)比色法进行阳离子载体/pdna复合物的细胞毒性评价。
[0082]
在转染前24h,取对数生长期细胞,胰酶消化后用含体积分数10%的胎牛血清培养液稀释,按照1
×
104细胞/孔的密度铺板于96孔细胞培养板中,置于培养温度为37℃、含体积分数5%的co2的恒温培养箱中培养直至细胞汇合度达80%~90%。将不同浓度的阳离子载体材料和细胞进行共培养24小时,然后在每孔中加入20μl噻唑蓝溶液(质量分数0.5%),在37℃下继续培养4小时,然后吸出培养液,往其中每孔加入200μl dmso,通过酶标仪检测培养板每孔的吸收,检测的波长选为490nm。细胞的存活率按如下公式:
[0083]
细胞存活率(%)=(a
sample
/a
control
)
×
100
[0084]asample
是转染后的细胞样品孔的吸收,a
control
是不加材料组样品孔的吸收,每组实验重复三次,结果如表4所示。
[0085]
按照上述方法,分别检测pei
1.8k-lys基因载体在hela细胞、b16f10细胞、293t细胞中的转染评价结果。
[0086]
表2 pei
1.8k-lys介导荧光素酶质粒的体外转染效率
[0087][0088]
表3 pei1.8k-lys介导绿色荧光蛋白质粒的体外转染效率
[0089][0090]
表4 pei
1.8k-lys阳离子载体/pdna复合物的细胞毒性
[0091][0092]
以上结果可以看出,本发明制备的pei1.8klys(tos)-1:10转染效率最高,pei1.8klys(tos)-1:10的毒性很低。
[0093]
以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
