一种
β-吲哚喹唑啉酮衍生物及其制备方法和应用
技术领域
1.本发明属于有机合成技术领域,尤其涉及一种β-吲哚喹唑啉酮衍生物及其制备方法和应用。
背景技术:
2.在芸香科植物(rutaceae)中发现的系列β-吲哚喹唑啉酮生物碱及其衍生物被报道具有多种药理活性,例如抗炎、抗菌和细胞毒活性,其结构为喹唑啉酮的2-位与吲哚的2-位相连构成,天然的β-吲哚喹唑啉酮骨架不容易进行多样化的衍生化修饰拓展,因此对于该骨架的衍生化研究比较单一。
3.例如中国专利cn104367575a公开了一种bouchardatine和bouchardatine衍生物及其制备方法和应用,其中公开的bouchardatine衍生物是在喹唑啉酮的羰基上进行取代基的修饰,提供了一系列衍生物,制备得到的衍生物具有降脂的效果,但是有些衍生物的降脂效果不明显,另外,该方案也只能提供喹唑啉酮的羰基上的取代基的修饰,而无法对该骨架的其他位点进行取代基修饰。
4.因此,有必要提供一系列新的β-吲哚喹唑啉酮衍生物且具有高的降脂效果和抗肿瘤效果。
技术实现要素:
5.本发明旨在至少解决现有技术中存在的上述技术问题之一。为此,本发明提供了一种β-吲哚喹唑啉酮衍生物。
6.本发明还提供了一种β-吲哚喹唑啉酮衍生物的制备方法。
7.本发明还提供了一种β-吲哚喹唑啉酮衍生物的应用。
8.本发明的第一方面提供了一种β-吲哚喹唑啉酮衍生物,所述β-吲哚喹唑啉酮衍生物的结构式如式(ⅰ)所示:
[0009][0010]
其中,所述r1和r2为一个或多个基团,所述r1和r2独立地选自h、c1~c6烷基或且r1和r2不同时为氢;
[0011]
r3和r4独立地选自氢、c2~c6烷基、环己基或且r3和r4不同时为氢;其中,所述r5为取代或未取代苯基、取代或未取代芳香杂环基、含有1-3个选自n、o和s的杂原子的
取代或未取代的c2~c12的饱和杂环基;n为0、1、2、3、4、5或6;
[0012]
或者r3和r4也可以通过c3~c10烷基链相连成环,所述烷基链上至少有一个杂原子。
[0013]
本发明关于β-吲哚喹唑啉酮衍生物的技术方案中的一个技术方案,至少具有以下有益效果:
[0014]
申请人在β-吲哚喹唑啉酮母核上实现芳香环上不同位置的c-n偶联胺化修饰方法,能够满足对含有该骨架的药物任意位置的后期快速c-n衍生化修饰;并且得到的衍生物进行了抗肿瘤活性研究和降脂活性评价,结果表明,本技术在芳香环上进行的取代基修饰能够提升抗肿瘤效果和降脂效果。
[0015]
取代基定义和一般术语:
[0016]
本发明中的“c1~c6烷基”表示碳原子总数为1~6的烷基,包括c1~c6的直链烷基和c1~c6的支链烷基。本发明中的“c2~c6烷基”也具有相同的定义,其区别在于碳原子总数不相同。
[0017]
本发明中的“取代或未取代苯基”表示苯基中有至少一个h被本文定义的相应基团所取代。本发明中的“取代或未取代苯基芳香杂环基”具有相似的定义。
[0018]“含有1-3个选自n、o和s的杂原子的取代或未取代的c2-12的饱和杂环基”表示碳原子总数为2-12的杂环基团,该杂环中的成环原子中含有杂原子,且杂原子数为1-3个,以及杂原子选自n、o和s中的至少一种,该杂环为饱和基团,并且任选该基团中有至少一个h被本文定义的相应基团所取代。
[0019]
本发明中的卤素是指氟、氯、溴、碘中的任意一个或两个以上。
[0020]
根据本发明的一些实施方式,所述选自选自x为溴或h。
[0021]
根据本发明的一些实施方式,所述β-吲哚喹唑啉酮衍生物为如下任意结构式中的一种:
[0022]
[0023][0024]
根据本发明的一些优选的实施方式,所述β-吲哚喹唑啉酮衍生物为如下任意结构式中的一种:
[0025][0026]
本发明的第二方面提供所述β-吲哚喹唑啉酮衍生物的制备方法,合成步骤如下:
[0027]
将化合物oac与含有基团的化合物溶解在有机溶剂中,在碱和双-(三甲基硅基)胺锂的条件下进行反应,即得β-吲哚喹唑啉酮衍生物;
[0028]
所述化合物oac选自如下结构式中的一种:
[0029][0030]
r3和r4独立地选自氢、c2~c6烷基、环己基或且r3和r4不同时为氢;其中,所述r5为取代或未取代苯基、取代或未取代芳香杂环、含有1-3个选自n、o和s的杂原子的取代或未取代的c2~c12的饱和杂环基;n为0、1、2、3、4、5或6;
[0031]
或者r3和r4通过c3~c10烷基链相连成环,所述烷基链上至少有一个杂原子。
[0032]
本发明关于β-吲哚喹唑啉酮衍生物的制备方法,至少具有以下有益效果:
[0033]
本发明在β-吲哚喹唑啉酮衍生物实现芳香环上不同位置的c-n偶联化修饰方法,该方法反应条件温和,原料来源廉价广泛,制备的β-吲哚喹唑啉酮pd氧化加成产物稳定可分离,能够满足对含有该骨架的药物任意位置的后期快速c-n衍生化修饰。
[0034]
根据本发明的一些实施方式,所述碱为碳酸钾、碳酸铯、叔丁醇钠、二水合磷酸二氢钠或乙酸钠中至少一种。
[0035]
根据本发明的一些实施方式,所述有机溶剂为四氢呋喃、甲苯或1,4-二氧六环中至少一种。
[0036]
根据本发明的一些实施方式,所述化合物oac、含有基团的化合物与碱的摩尔比为1:(1.0~3.0):(1.0~4.0)。
[0037]
根据本发明的一些实施方式,所述反应的时间为1~3h。
[0038]
根据本发明的一些实施方式,所述反应在氮气气氛下进行。
[0039]
根据本发明的一些实施方式,所述化合物2通过如下方法制备得到:
[0040]
将化合物iq、(1,5-环辛二烯)二氯化钯(ii)和2-二-叔丁膦基-2,4,6-三异丙基联苯加入到四氢呋喃中进行反应得到化合物2;
[0041]
所述化合物3选择如下结构中的一种:
[0042][0043]
其中,x为卤素原子。
[0044]
根据本发明的一些实施方式,所述化合物iq、(1,5-环辛二烯)二氯化钯(ii)和2-二-叔丁膦基-2,4,6-三异丙基联苯的摩尔比为1:1:(1.0~2.0)。
[0045]
根据本发明的一些实施方式,所述化合物iq可以通过购买得到,也可以通过如下方法制备得到。
[0046]
作为其中的一个实施方式,所述化合物iq-a通过如下方法制备得到,合成路线如下:
[0047][0048]
s1.将化合物4与二氯亚砜在氯仿中溶解进行反应得到中间体ⅰ;
[0049]
s2.将邻氨基苯甲酰胺、吡啶加入到氯仿中,随后将将中间体ⅰ滴加进去,反应得到化合物5;
[0050]
s3.将化合物5在乙醇和氢氧化钠的条件下进行反应得到化合物iq-a。
[0051]
作为其中的一个实施方式,所述化合物iq-d通过如下方法制备得到,合成路线如下:
[0052][0053]
s10.将化合物6与二氯亚砜在氯仿中溶解进行反应得到中间体ⅰ;
c16h10n3obr[m+h]+:340.0080,found:340.0075.
[0068]
加入化合物iq-11(3.0mmol,1.0equiv),(1,5-环辛二烯)二氯化钯(ii)(3.0mmol,1.0equvi)和2-二-叔丁膦基-2,4,6-三异丙基联苯(3.0mmol,1.0equiv)。反应瓶塞上橡胶塞,氮气置换瓶内气体,反复三次。随后,用注射器向反应瓶中加入无水四氢呋喃作为溶剂,室温下搅拌反应16h。反应结束后,减压旋去溶剂,向反应瓶中加入正戊烷,用刮铲充分研磨固体使其成为粉末状悬浮在正戊烷中,过滤,滤饼用正戊烷洗涤,随后真空干燥,得到化合物11-oac。
[0069]
加入化合物11-oac(0.2mmol,1.0equiv)、碳酸铯(0.4mmol,2.0equiv),氮气置换反应瓶中气体三次。随后用注射剂加入无水四氢呋喃(2ml),搅拌均匀。胺化试剂(0.3mmol,1.5equiv)溶于适量无水四氢呋喃中,用注射器加入到反应体系中,随后再加入双-(三甲基硅基)胺锂(0.4mmol,2.0equvi)。加毕,室温下反应2h,随后0.2m醋酸的二氯甲烷溶液(2ml)加入至反应瓶中搅拌0.5h以淬灭反应。反应结束后,反应液中加入dcm稀释,随后过硅藻土滤去固体残渣,收集滤液,减压旋去溶剂,通过快速的硅胶柱层析得到目标化合物11-9(41.0mg,47%yield)。1h nmr(500mhz,dmso-d6)δ12.50(s,1h),11.48(s,1h),8.45(s,1h),8.14(d,j=7.9hz,1h),7.82(t,j=7.7hz,1h),7.69(d,j=8.0hz,1h),7.60(s,1h),7.53(d,j=8.5hz,1h),7.47(t,j=7.5hz,1h),7.29(s,1h),7.22(d,j=8.6hz,2h),7.15(d,j=7.2hz,2h),6.88(d,j=8.7hz,1h).
13
c nmr(126mhz,dmso-d6)δ162.3,149.4,147.0,144.0,141.0,141.0,140.4,139.4,135.1,130.1,129.3,127.2,126.5,126.4,123.0,122.8,122.7,121.8,121.4,119.8,117.2,114.5,106.0,99.7.hrms(esi-tof):m/z calculated for c
23h15
n4o2f3[m+h]
+
:437.1220,found:437.1212.
[0070]
实施例2
[0071]
实施例2提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0072][0073]
化合物iq-2的合成,合成路线如下:
[0074]
[0075]
s10.将化合物6(10.0mmol,1.0equiv)与二氯亚砜(4.35ml,60mmol,6.0equiv)在氯仿(100ml,0.1m)中溶解;冰浴下,向反应瓶中滴加socl2(4.35ml,60mmol,6.0equiv);加毕,将反应瓶移至75℃下反应4h;反应结束后,减压旋去溶剂及多余的二氯亚砜,得到得到中间体ⅰ;
[0076]
s20.将氯代的邻氨基苯甲酰胺(10.0mmol,1.0equiv)和吡啶(0.83ml,10.0mmol,1.0equiv)溶解在氯仿(60ml)中,并将中间体ⅰ加入进去反应,室温下反应过夜,tcl监测反应是否完全。反应结束后,过滤,滤饼用氯仿洗涤,干燥得得到化合物7;
[0077]
s30.将化合物7在醋酸酐(20ml)中进行反应,120℃下反应2h,反应结束后冷却至室温,此时有固体析出;过滤,滤饼用无水乙醇清洗,随后真空干燥得到化合物8,并将化合物8在氨水(20.0ml)条件下进行反应,反应移至110℃下反应2h,反应结束后,冷却至室温,将反应液倒入冰水中,充分挥发掉多余的氨气,随后用4m稀盐酸调节ph至2左右,此时有大量固体析出。过滤,滤饼用水洗,真空干燥得到化合物iq-2。1h nmr(500mhz,dmso-d6)δ12.68(s,1h),11.94(s,1h),8.17(dd,j=7.9,1.5hz,1h),7.89
–
7.83(m,1h),7.76(d,j=8.1hz,1h),7.72(s,1h),7.70(d,j=2.0hz,1h),7.63(d,j=8.5hz,1h),7.53(t,j=6.9hz,1h),7.20(dd,j=8.5,1.8hz,1h).
13
c nmr(126mhz,dmso-d6)δ162.2,149.1,146.7,138.8,135.2,131.5,127.4,127.0,126.9,126.6,123.9,123.5,121.7,117.3,115.3,105.5.hrms(esi-tof):m/z calculated for c
16h10
n3ocl[m+h]
+
:296.0585,found:296.0586.
[0078]
加入化合物iq-2(3.0mmol,1.0equiv),(1,5-环辛二烯)二氯化钯(ii)(3.0mmol,1.0equvi)和2-二-叔丁膦基-2,4,6-三异丙基联苯(3.0mmol,1.0equiv)。反应瓶塞上橡胶塞,氮气置换瓶内气体,反复三次。随后,用注射器向反应瓶中加入无水四氢呋喃作为溶剂,室温下搅拌反应16h。反应结束后,减压旋去溶剂,向反应瓶中加入正戊烷,用刮铲充分研磨固体使其成为粉末状悬浮在正戊烷中,过滤,滤饼用正戊烷洗涤,随后真空干燥,得到化合物2-oac。
[0079]
加入化合物2-oac(0.2mmol,1.0equiv)、碳酸铯(0.4mmol,2.0equiv),氮气置换反应瓶中气体三次。随后用注射剂加入无水四氢呋喃(2ml),搅拌均匀。胺化试剂(0.3mmol,1.5equiv)溶于适量无水四氢呋喃中,用注射器加入到反应体系中,随后再加入双-(三甲基硅基)胺锂(0.4mmol,2.0equvi)。加毕,室温下反应2h,随后0.2m醋酸的二氯甲烷溶液(2ml)加入至反应瓶中搅拌0.5h以淬灭反应。反应结束后,反应液中加入二氯甲烷稀释,随后过硅藻土滤去固体残渣,收集滤液,减压旋去溶剂,通过快速的硅胶柱层析得到目标化合物2-5(40.9mg,62%yield)1h nmr(400mhz,dmso-d6)δ12.07(s,1h),11.69(s,1h),7.81(d,j=8.7hz,1h),7.61(d,j=9.5hz,2h),7.52(d,j=8.2hz,1h),7.20(t,j=7.6hz,1h),7.04(t,j=7.5hz,1h),6.88(t,j=5.4hz,1h),6.80(dd,j=8.8,2.3hz,1h),6.67(d,j=2.2hz,1h),3.03(t,j=6.0hz,2h),1.15
–
1.06(m,1h),0.51(q,j=5.5hz,2h),0.26(q,j=4.8hz,2h).
13
c nmr(101mhz,dmso-d6)δ161.2,154.0,150.9,146.4,137.4,130.5,127.5,126.9,123.8,121.4,119.8,113.9,112.3,109.7,104.2,104.0,46.9,10.2,3.6.hrms(esi-tof):m/z calculated for c
20h18
n4o[m+h]
+
:331.1553,found:331.1548.
[0080]
实施例3
[0081]
实施例3提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0082][0083]
实施例3的制备方法与实施例2相同,其区别在于,胺化试剂为
[0084]
制得的化合物2-2(43.0mg,60%yield),核磁数据为1h nmr(500mhz,dmso-d6)δ12.29(s,1h),11.79(s,1h),7.94(d,j=8.8hz,1h),7.62(d,j=7.7hz,2h),7.53(d,j=8.2hz,1h),7.21(t,j=7.7hz,1h),7.16(d,j=9.1hz,1h),7.05(t,j=7.5hz,1h),6.99(s,1h),3.43(s,4h),2.63(s,4h),2.33(s,3h).
13
c nmr(126mhz,dmso-d6)δ161.7,155.4,150.9,147.2,138.0,130.8,127.9,127.5,124.4,121.9,120.4,115.2,112.9,112.3,109.1,105.1,54.2,46.7,45.4.hrms(esi-tof):m/z calculated for c
21h21
n5o[m+h]
+
:360.1819,found:360.1816.
[0085]
实施例4
[0086]
实施例4提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0087][0088]
实施例4制备方法与实施例1相同,其区别在于,实施例1中化合物4的结构为胺化试剂为:制备得到的化合物iq-10(1.83g,6.2mmol)的结构式为:其核磁数据为1h nmr(400mhz,dmso-d6)δ12.68(s,1h),12.03(s,1h),8.16(dd,j=7.9,1.5hz,1h),7.88
–
7.82(m,1h),7.74(d,j=7.1hz,1h),7.71(d,j=2.0hz,1h),7.65(s,1h),7.57
–
7.48(m,2h),7.23(dd,j=8.8,2.1hz,1h).
13
c nmr(101mhz,dmso-d6)δ161.7,148.6,146.2,136.0,134.7,131.6,128.4,127.0,126.5,126.1,124.5,124.1,121.3,120.5,114.0,104.5.hrms(esi-tof):m/z calculated for c
16h10
n3ocl[m+h]
+
:296.0585,found:296.0583.
[0089]
制得的化合物10-1(20.7mg,30%yield)1h nmr(500mhz,dmso-d6)δ12.53(s,1h),11.56(s,1h),8.14(dd,j=7.9,1.5hz,1h),7.86
–
7.81(m,1h),7.72(d,j=8.1hz,1h),7.55(d,j=2.2hz,1h),7.49(t,j=7.5hz,1h),7.42(d,j=8.9hz,1h),7.07(dd,j=8.9,2.3hz,1h),7.04(s,1h),3.83
–
3.73(m,4h),3.15
–
3.01(m,4h).
13
c nmr(126mhz,dmso-d6)δ161.8,148.8,146.6,145.9,134.7,133.2,129.9,129.6,127.9,126.8,126.1,121.0,117.7,
112.8,106.1,104.7,66.4,50.8.hrms(esi-tof):m/z calculated for c
20h18
n4o2[m+h]
+
:347.1503,found:347.1519.
[0090]
实施例5
[0091]
实施例5提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0092][0093]
实施例5制备方法与实施例1相同,其区别在于,实施例1中化合物4的结构为胺化试剂为:制备得到的化合物iq-12(1.53g,52%yield)的结构式为:其核磁数据为1h nmr(400mhz,dmso-d6)δ12.64(s,1h),11.70(s,1h),8.16(d,j=7.7hz,1h),7.86(t,j=7.5hz,1h),7.78(d,j=8.1hz,1h),7.66(d,j=7.8hz,2h),7.52(t,j=7.4hz,1h),7.35(d,j=7.5hz,1h),7.11(t,j=7.8hz,1h).
13
c nmr(101mhz,dmso-d6)δ161.7,148.7,145.9,134.8,134.4,131.7,129.2,127.3,126.6,126.0,123.7,121.3,121.1,120.7,116.4,106.8.hrms(esi-tof):m/z calculated for c
16h10
n3ocl[m+h]
+
:296.0585,found:296.0598.
[0094]
制得的化合物12-1(35.2mg,51%yield),核磁数据为1h nmr(500mhz,dmso-d6)δ12.66(s,1h),11.03(s,1h),8.15(d,j=7.9hz,1h),7.83(t,j=7.5hz,1h),7.76(d,j=8.1hz,1h),7.58(d,j=2.3hz,1h),7.49(t,j=7.5hz,1h),7.35(d,j=7.8hz,1h),7.04(t,j=7.7hz,1h),6.86(d,j=7.3hz,1h),3.97
–
3.85(m,4h),3.07(t,j=4.4hz,4h).
13
c nmr(126mhz,dmso-d6)δ162.3,149.4,146.9,139.3,135.1,131.9,130.5,129.2,127.7,126.7,126.4,121.5,121.4,116.8,112.6,107.5,67.0,51.9.hrms(esi-tof):m/z calculated for c
20h18
n4o2[m+h]
+
:347.1503,found:347.1498.
[0095]
实施例6
[0096]
实施例6提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0097][0098]
实施例6的制备方法与实施例1相同,其区别在于,实施例1中化合物4的结构为
胺化试剂为:
[0099]
制备得到的化合物iq-9(2.21g,65%yield)的结构式为:其核磁数据为1h nmr(500mhz,dmso-d6)δ12.70(s,1h),12.17(s,1h),8.16(dd,j=8.0,1.5hz,1h),7.88
–
7.83(m,1h),7.75(d,j=8.0hz,2h),7.55(d,j=8.2hz,1h),7.54
–
7.50(m,1h),7.30(d,j=7.5hz,1h),7.16(t,j=7.9hz,1h).
13
c nmr(126mhz,dmso-d6)δ162.0,148.5,146.5,137.9,134.6,131.1,128.2,126.8,126.4,126.1,125.0,122.6,121.3,114.5,112.0,104.7.hrms(esi-tof):m/z calculated for c
16h10
n3obr[m+h]
+
:340.0080,found:340.0077.
[0100]
制得的化合物9-1(27.0mg,39%yield),核磁数据为1h nmr(500mhz,dmso-d6)δ12.51(s,1h),11.76(s,1h),8.15(d,j=7.9hz,1h),7.83(d,j=7.3hz,2h),7.72(d,j=8.2hz,1h),7.54
–
7.45(m,1h),7.18
–
7.06(m,2h),6.47(d,j=7.2hz,1h),3.92
–
3.82(m,4h),3.23
–
3.13(m,4h).
13
c nmr(126mhz,dmso-d6)δ162.3,149.3,147.0,146.6,139.6,135.2,128.7,127.3,126.6,126.5,125.4,121.5,121.2,107.0,106.2,105.0,67.0,51.7.hrms(esi-tof):m/z calculated for c
20h18
n4o2[m+h]
+
:347.1503,found:347.1491.
[0101]
实施例7
[0102]
实施例7提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0103][0104]
实施例7的制备方法与实施例2相同,其区别在于,实施例2中的被替代,胺化试剂为:
[0105]
制备得到的化合物iq-1(1.61g,65%yield)的结构式为其核磁数据为1h nmr(500mhz,dmso-d6)δ12.80(s,1h),11.54(s,1h),8.10(d,j=8.0hz,1h),7.98
(d,j=7.9hz,1h),7.71(s,1h),7.65(dd,j=16.0,8.2hz,2h),7.46(t,j=7.8hz,1h),7.26(t,j=7.8hz,1h),7.08(t,j=7.5hz,1h).
13
c nmr(126mhz,dmso-d6)δ161.9,147.6,145.8,138.3,135.2,131.0,130.2,127.9,126.9,125.6,124.8,123.3,122.1,120.6,113.2,106.3.hrms(esi-tof):m/z calculated for c
16h10
n3ocl[m+h]
+
:296.0585,found:296.0582.
[0106]
制备得到的化合物1-1(27.6mg,40%yield),其核磁数据为1h nmr(400mhz,dmso-d6)δ12.52(s,1h),11.21(s,1h),7.75(d,j=7.8hz,1h),7.65(d,j=8.0hz,1h),7.59(d,j=8.8hz,2h),7.39(t,j=7.8hz,1h),7.29(d,j=7.7hz,1h),7.25(t,j=7.6hz,1h),7.08(t,j=7.5hz,1h),3.94(t,j=4.5hz,4h),3.31(t,j=4.7hz,4h).
13
c nmr(101mhz,dmso-d6)δ162.1,148.0,144.0,141.6,137.5,130.5,127.5,126.6,124.0,122.4,121.6,121.5,120.1,118.4,112.6,105.1,66.2,51.8.hrms(esi-tof):m/z calculated for c
20h18
n4o2[m+h]
+
:347.1503,found:347.1493.
[0107]
实施例8
[0108]
实施例8提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0109][0110]
实施例8的制备方法与实施例2相同,其区别在于,胺化试剂不相同,胺化试剂为:
[0111]
制备得到的化合物2-1(40.1mg,58%yield),其核磁数据为1h nmr(500mhz,dmso-d6)δ12.44(s,1h),11.44(s,1h),8.12(d,j=7.9hz,1h),7.82(t,j=7.6hz,1h),7.70(d,j=8.2hz,1h),7.55(s,1h),7.51
–
7.44(m,2h),6.92(s,1h),6.89(dd,j=8.8,1.9hz,1h),3.85
–
3.71(m,4h),3.17
–
3.08(m,4h).
13
c nmr(101mhz,dmso-d6)δ161.3,155.4,150.4,146.8,137.5,130.3,127.5,127.0,123.9,121.5,119.9,114.5,112.4,112.1,108.4,104.6,65.9,47.1.hrms(esi-tof):m/z calculated for c
20h18
n4o2[m+h]
+
:347.1503,found:347.1491.
[0112]
实施例9
[0113]
实施例9提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0114]
[0115]
实施例9的制备方法与实施例2相同,其区别在于,实施例2中的被替代,胺化试剂为:
[0116]
制备得到的化合物iq-4(1.47g,50%yield)的结构式为其核磁数据为1h nmr(400mhz,dmso-d6)δ12.60(s,1h),11.79(s,1h),7.75(t,j=7.9hz,1h),7.69(d,j=1.4hz,1h),7.68
–
7.62(m,2h),7.53(dd,j=8.2,1.0hz,1h),7.49(dd,j=7.8,1.3hz,1h),7.24(ddd,j=8.2,6.9,1.2hz,1h),7.07(ddd,j=8.0,6.9,1.0hz,1h).
13
c nmr(101mhz,dmso-d6)δ160.0,151.3,147.2,137.7,134.4,132.7,129.4,128.6,127.4,126.5,124.3,121.6,120.0,118.0,112.4,105.5.hrms(esi-tof):m/z calculated for c
16h10
n3ocl[m+h]
+
:296.0585,found:296.0598.
[0117]
制备得到化合物4-1(27.7mg,40%yield),其核磁数据为:1h nmr(400mhz,dmso-d6)δ11.83(s,1h),7.75(d,j=8.1hz,1h),7.60(t,j=7.8hz,1h),7.54(d,j=8.2hz,1h),7.45(d,j=8.0hz,1h),7.24(t,j=7.3hz,1h),7.09(t,j=7.2hz,1h),7.03(d,j=7.4hz,1h),3.99(s,2h),3.76(s,4h),3.08(s,2h).
13
c nmr(126mhz,dmso-d6)δ164.2,151.9,148.4,144.7,137.1,134.1,129.5,129.4,128.1,125.0,124.2,120.8,120.1,119.0,113.4,113.4,66.6,52.7,51.7.
[0118]
实施例10
[0119]
实施例10提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0120][0121]
实施例10的制备方法与实施例1相同,其区别在于,实施例1中化合物4的结构为胺化试剂为:
[0122]
制得的化合物11-4(40.3mg,56%yield),其核磁数据为1h nmr(500mhz,dmso-d6)δ12.33(s,1h),11.16(s,1h),8.11(d,j=7.8hz,1h),7.80(t,j=7.7hz,1h),7.66(d,j=8.1hz,1h),7.49(s,1h),7.43(t,j=7.5hz,1h),7.30(d,j=8.7hz,1h),6.57(d,j=7.1hz,2h),5.69(t,j=5.8hz,1h),4.04(p,j=6.4hz,1h),3.81(q,j=7.2hz,1h),3.66(q,j=7.3hz,1h),3.10(t,j=5.9hz,2h),2.00(ddd,j=19.6,10.9,4.8hz,1h),1.86(qp,j=13.2,7.0hz,2h),1.63(dp,j=14.5,7.4,6.9hz,1h).
13
c nmr(126mhz,dmso-d6)δ162.3,
149.7,147.6,147.2,140.6,135.0,130.1,127.1,126.5,125.9,122.3,121.2,119.8,111.8,106.6,91.5,77.4,67.6,48.3,29.6,25.7.hrms(esi-tof):m/z calculated for c
21h20
n4o2[m+h]
+
:361.1659,found:361.1659.
[0123]
实施例11
[0124]
实施例11提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0125][0126]
实施例11的制备方法与实施例10相同,其区别在于,胺化试剂为:制备得到的化合物11-7(33.0mg,50%yield),其核磁数据为1h nmr(500mhz,dmso-d6)δ12.32(s,1h),11.15(s,1h),8.11(d,j=7.8hz,1h),7.80(t,j=7.7hz,1h),7.66(d,j=8.2hz,1h),7.49(s,1h),7.43(t,j=7.6hz,1h),7.30(d,j=8.5hz,1h),6.59
–
6.48(m,2h),5.77(t,j=6.2hz,1h),2.92(t,j=5.6hz,2h),1.27
–
1.22(m,1h),0.50(d,j=7.7hz,2h),0.26(d,j=4.9hz,2h).
13
c nmr(126mhz,dmso-d6)δ162.3,149.7,147.8,147.2,140.6,135.0,127.0,127.0,126.5,125.9,122.3,121.2,119.7,111.9,106.6,91.4,48.3,11.0,4.1.hrms(esi-tof):m/z calculated for c
20h18
n4o[m+h]
+
:331.1553,found:331.1549.
[0127]
实施例12
[0128]
实施例12提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0129][0130]
实施例12的制备方法与实施例10相同,其区别在于,胺化试剂为:
[0131]
制备得到的化合物11-8(22.9mg,30%yield),其核磁数据为1h nmr(500mhz,dmso-d6)δ12.47(s,1h),11.44(s,1h),8.27(s,1h),8.13(d,j=7.9hz,1h),7.82(t,j=7.6hz,1h),7.69(d,j=8.1hz,1h),7.58(s,1h),7.53
–
7.44(m,2h),7.32(s,1h),7.14(t,j=8.4hz,1h),6.85(d,j=8.6hz,1h),6.69(d,j=8.0hz,2h),6.40(d,j=7.9hz,1h),3.73(s,3h).
13
c nmr(126mhz,dmso-d6)δ162.3,160.7,149.5,147.0,145.6,140.9,139.5,135.1,130.3,129.0,127.2,126.5,126.3,122.6,122.5,121.4,114.6,109.5,106.0,105.3,102.3,98.8,55.3.hrms(esi-tof):m/z calculated for c
23h18
n4o2[m+h]
+
:383.1503,found:383.1489.
[0132]
实施例13
[0133]
实施例13提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0134][0135]
实施例13的制备方法与实施例10相同,其区别在于,胺化试剂为:
[0136]
制备得到的化合物11-10(30.0mg,42%yield),其核磁数据为1h nmr(500mhz,dmso-d6)δ12.29(s,1h),11.06(s,1h),8.10(dd,j=7.9,1.5hz,1h),7.82
–
7.76(m,1h),7.64(d,j=8.1hz,1h),7.47(d,j=2.1hz,1h),7.42(t,j=7.5hz,1h),7.28(d,j=8.6hz,1h),6.55(s,1h),6.51(dd,j=8.6,2.0hz,1h),5.49(d,j=7.8hz,1h),3.18(s,1h),2.03
–
1.96(m,2h),1.75(dt,j=12.2,3.0hz,2h),1.40
–
1.32(m,2h),1.22
–
1.12(m,4h).
13
c nmr(126mhz,dmso-d6)δ161.8,149.2,146.7,146.2,140.2,134.5,126.6,126.4,126.0,125.4,121.9,120.7,119.1,111.5,106.1,91.4,51.1,32.5,25.7,24.7.hrms(esi-tof):m/z calculated for c
22h22
n4o[m+h]
+
:359.1866,found:359.1855.
[0137]
实施例14
[0138]
实施例14提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0139][0140]
实施例14的制备方法与实施例10相同,其区别在于,胺化试剂为:
[0141]
制备得到的化合物11-13(40.4mg,54%yield),其核磁数据为1h nmr(500mhz,dmso-d6)δ12.32(s,1h),11.12(s,1h),8.10(d,j=7.9hz,1h),7.79(t,j=7.6hz,1h),7.65(d,j=8.1hz,1h),7.49(s,1h),7.42(t,j=7.5hz,1h),7.29(d,j=8.5hz,1h),6.53(d,j=10.4hz,2h),5.79(t,j=5.6hz,1h),3.88(dd,j=11.5,4.1hz,2h),3.29(t,j=11.8hz,2h),2.93(t,j=6.0hz,2h),1.91
–
1.79(m,1h),1.71(d,j=12.6hz,2h),1.28(dd,j=12.2,4.5hz,2h).
13
c nmr(126mhz,dmso-d6)δ161.9,149.2,147.4,146.7,140.2,134.6,126.6,126.5,126.0,125.4,121.9,120.7,119.2,111.3,106.1,90.9,66.9,49.5,34.1,30.9.hrms(esi-tof):m/z calculated for c
22h22
n4o2[m+h]
+
:375.1816,found:375.1806.
[0142]
实施例15
[0143]
实施例15提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0144][0145]
实施例15的制备方法与实施例10相同,其区别在于,胺化试剂为:
[0146]
制备得到的化合物11-14(38.1mg,60%yield),其核磁数据为1h nmr(500mhz,dmso-d6)δ12.32(s,1h),11.11(s,1h),8.10(d,j=7.9hz,1h),7.79(t,j=7.7hz,1h),7.65(d,j=8.2hz,1h),7.48(s,1h),7.42(t,j=7.5hz,1h),7.29(d,j=8.6hz,1h),6.53(s,1h),6.49(d,j=8.7hz,1h),5.48(s,1h),3.53(s,1h),1.17(d,j=6.3hz,6h).
13
c nmr(126mhz,dmso-d6)δ162.3,149.7,147.2,146.8,140.7,135.0,127.0,127.0,126.5,125.9,122.4,121.2,119.6,112.1,106.6,92.0,43.9,22.9.hrms(esi-tof):m/z calculated for c
19h18
n4o[m+h]
+
:319.1553,found:319.1553.
[0147]
实施例16
[0148]
实施例16提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0149][0150]
实施例16的制备方法与实施例2相同,其区别在于,胺化试剂为
[0151]
制得的化合物2-3(41.5mg,60%yield),核磁数据为1h nmr(500mhz,dmso-d6)δ12.08(s,1h),11.71(s,1h),7.80(d,j=8.7hz,1h),7.61(d,j=8.7hz,2h),7.52(d,j=8.3hz,1h),7.20(t,j=7.6hz,1h),7.04(t,j=7.5hz,1h),6.79(dd,j=9.8,7.5hz,2h),6.64(s,1h),3.13(q,j=6.7hz,2h),1.79
–
1.64(m,j=6.8hz,1h),1.51(q,j=7.2hz,2h),0.93(d,j=6.6hz,6h).
13
c nmr(126mhz,dmso-d6)δ161.7,154.5,151.4,146.9,137.9,131.0,128.0,127.4,124.2,121.8,120.3,114.3,112.8,110.0,104.8,104.3,41.1,37.7,25.9,22.9.hrms(esi-tof):m/z calculated for c
21h22
n4o[m+h]
+
:347.1866,found:347.1855.
[0152]
实施例17
[0153]
实施例17提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0154]
[0155]
实施例17的制备方法与实施例2相同,其区别在于,胺化试剂为
[0156]
制得的化合物2-9(49.6mg,65%yield),核磁数据为1h nmr(500mhz,dmso-d6)δ12.27(s,1h),11.73(s,1h),8.91(s,1h),7.99(d,j=8.7hz,1h),7.71
–
7.59(m,2h),7.52(d,j=8.2hz,1h),7.29(d,j=8.5hz,2h),7.21(t,j=7.7hz,1h),7.11(d,j=8.5hz,1h),7.05(t,j=7.5hz,1h),6.88(d,j=8.0hz,1h),6.81(s,1h),6.64(d,j=8.2hz,1h),3.77(s,3h).
13
c nmr(126mhz,dmso-d6)δ161.6,160.6,151.2,150.3,147.3,142.9,138.0,130.7,130.7,128.0,124.4,121.9,120.4,116.4,113.0,112.8,108.4,108.0,106.4,105.1,55.5.h rms(esi-tof):m/z calculated for c
23h18
n4o2[m+h]
+
:383.1503,found:383.1501.
[0157]
实施例18
[0158]
实施例18提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0159][0160]
实施例18的制备方法与实施例2相同,其区别在于,胺化试剂为
[0161]
制得的化合物2-17(44.6mg,60%yield),核磁数据为1h nmr(500mhz,dmso-d6)δ12.12(s,1h),11.66(s,1h),7.85(d,j=8.7hz,1h),7.64
–
7.58(m,2h),7.51(d,j=8.2hz,1h),7.40(d,j=5.0hz,1h),7.37(t,j=5.9hz,1h),7.20(t,j=7.4hz,1h),7.09(d,j=3.5hz,1h),7.04(t,j=7.5hz,1h),7.01(dd,j=5.0,3.5hz,1h),6.86(dd,j=8.7,2.3hz,1h),6.70(d,j=2.2hz,1h),4.61(d,j=5.8hz,2h).
13
c nmr(126mhz,dmso-d6)δ161.3,153.4,150.8,146.5,143.2,137.5,130.4,129.6,127.5,127.0,124.8,124.7,123.8,121.4,119.9,114.3,112.4,110.5,104.8,104.4,41.6.hrms(esi-tof):m/z calculated for c
21h16
n4os[m+h]
+
:373.1118,found:373.1126.
[0162]
实施例19
[0163]
实施例19提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0164][0165]
实施例19的制备方法与实施例6相同,其区别在于,胺化试剂为
[0166]
制得的化合物9-2(43.5mg,54%yield),核磁数据为1h nmr(500mhz,dmso-d6)δ12.45(s,1h),11.53(s,1h),8.13(d,j=7.9hz,1h),7.82(t,j=7.6hz,1h),7.69(d,j=
6.4hz,2h),7.47(t,j=7.6hz,1h),7.36(d,j=4.7hz,1h),7.08
–
6.96(m,3h),6.79(d,j=8.1hz,1h),6.16(d,j=7.5hz,1h),5.67(t,j=5.6hz,1h),3.48(q,j=6.7hz,2h),3.18(t,j=7.1hz,2h).
13
c nmr(126mhz,dmso-d6)δ161.8,149.1,146.7,142.2,142.1,138.7,134.6,127.3,127.0,126.7,126.0,126.0,125.8,125.2,124.0,120.9,117.3,103.8,101.0,98.3,44.8,29.0.
[0167]
实施例20
[0168]
实施例20提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0169][0170]
实施例19的制备方法与实施例5相同,其区别在于,胺化试剂为
[0171]
制得的化合物12-2(40.0mg,52%yield),核磁数据为1h nmr(500mhz,dmso-d6)δ12.56(s,1h),11.52(s,1h),8.16(d,j=7.9hz,1h),7.84(t,j=7.6hz,1h),7.77(d,j=8.2hz,1h),7.62(s,1h),7.49(t,j=7.5hz,1h),7.35(d,j=5.0hz,1h),6.98(d,j=5.5hz,2h),6.90(d,j=3.3hz,2h),6.41
–
6.31(m,2h),3.49(q,j=6.6hz,2h),3.21(t,j=7.0hz,2h).
13
c nmr(126mhz,dmso-d6)δ161.8,148.8,146.7,142.1,134.8,134.7,128.8,128.0,127.2,127.0,126.8,126.1,126.1,125.3,123.9,121.5,121.1,109.3,105.7,102.0,44.7,28.9.
[0172]
实施例21
[0173]
实施例21提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0174][0175]
实施例21的制备方法与实施例2相同,其区别在于,胺化试剂不相同,胺化试剂为:
[0176]
制备得到的化合物2-18(35.2mg,50%yield),其核磁数据为1h nmr(500mhz,dmso-d6)δ12.13(s,1h),11.68(s,1h),7.86(d,j=8.7hz,1h),7.65
–
7.59(m,3h),7.53(d,j=8.4hz,1h),7.20(q,j=6.9,6.0hz,2h),7.05(t,j=7.5hz,1h),6.87(d,j=8.8hz,1h),6.76(s,1h),6.42(s,1h),6.34(d,j=3.1hz,1h),4.41(d,j=5.8hz,2h).
13
c nmr(126mhz,dmso-d6)δ161.3,153.5,152.4,150.8,146.5,142.3,137.5,130.4,127.5,127.0,123.8,121.4,119.9,114.1,112.4,110.5,110.4,107.1,104.7,104.4,27.5.
[0177]
实施例22
[0178]
实施例22提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0179][0180]
实施例22的制备方法与实施例2相同,其区别在于,胺化试剂不相同,胺化试剂为:
[0181]
制备得到的化合物2-10(38.5mg,50%yield),其核磁数据为1h nmr(500mhz,dmso-d6)δ12.12(s,1h),11.69(s,1h),7.85(d,j=8.7hz,1h),7.62(d,j=8.0hz,2h),7.53(d,j=8.3hz,1h),7.36(d,j=4.5hz,1h),7.21(t,j=7.7hz,1h),7.05(t,j=7.5hz,1h),6.98(d,j=4.7hz,2h),6.88(t,j=5.8hz,1h),6.80(d,j=8.2hz,1h),6.71(s,1h),3.45(q,j=6.0hz,2h),3.18(d,j=3.5hz,1h),3.13(t,j=7.2hz,2h).
13
c nmr(126mhz,dmso-d6)δ161.7,154.0,151.4,147.0,142.0,137.9,130.9,130.1,128.0,127.6,127.5,125.8,124.5,124.3,121.9,120.3,112.8,110.5,104.8,104.6,104.6,44.5,29.1.
[0182]
实施例23
[0183]
实施例23提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0184][0185]
实施例23的制备方法与实施例10相同,其区别在于,胺化试剂为:
[0186]
制备得到的化合物11-11(38.1mg,55%yield),其核磁数据为1h nmr(500mhz,dmso-d6)δ12.33(s,1h),11.19(s,1h),8.10(d,j=7.8hz,1h),7.78(t,j=7.7hz,1h),7.65(d,j=8.2hz,1h),7.49(s,1h),7.42(t,j=7.5hz,1h),7.29(d,j=8.7hz,1h),6.52(d,j=7.7hz,2h),5.69(s,1h),3.03(t,j=7.5hz,2h),1.72(dp,j=13.5,6.7hz,1h),1.49(q,j=7.1hz,2h),0.93(d,j=6.6hz,6h).
13
c nmr(126mhz,dmso-d6)δ162.3,149.7,147.8,147.2,140.7,135.0,127.0,126.9,126.5,125.9,122.3,121.1,119.6,111.9,106.7,91.2,41.8,38.0,25.9,23.0.hrms(esi-tof):m/z calculated for c
21h22
n4o[m+h]
+
:347.1866,found:347.1862.
[0187]
实施例24
[0188]
实施例24提供一种β-吲哚喹唑啉酮衍生物,其结构式如下所示,制备方法如下:
[0189][0190]
实施例24的制备方法与实施例2相同,其区别在于,实施例2中的被替代,胺化试剂为:
[0191]
制备得到的化合物iq-3的结构式为核磁数据为1h nmr(500mhz,dmso-d6)δ12.77(s,1h),11.81(s,1h),8.08(d,j=2.4hz,1h),7.86(dd,j=8.7,2.6hz,1h),7.74(d,j=8.7hz,1h),7.68(d,j=2.1hz,1h),7.65(d,j=8.1hz,1h),7.54(d,j=8.3hz,1h),7.24(t,j=7.6hz,1h),7.07(t,j=7.5hz,1h).
13
c nmr(126mhz,dmso-d6)δ160.9,147.5,147.0,137.7,134.8,130.4,129.8,129.1,127.4,125.1,124.2,122.4,121.6,120.0,112.4,105.4.hrms(esi-tof):m/z calculated for c
16h10
n3ocl[m+h]
+
:296.0585,found:296.0592.
[0192]
制备得到的m3-1(24.5mg,34%yield)的核磁数据为1h nmr(500mhz,dmso-d6)δ12.43(s,1h),11.49(s,1h),7.62(d,j=8.0hz,1h),7.56(d,j=10.9hz,2h),7.47(s,1h),7.33(s,1h),7.22(t,j=7.8hz,1h),7.05(t,j=7.5hz,1h),3.78(d,j=4.6hz,4h),3.23(d,j=3.1hz,4h),2.69(s,3h).
13
c nmr(126mhz,dmso-d6)δ162.1,148.8,142.5,140.5,137.4,136.6,130.7,129.6,123.8,123.7,121.7,121.3,119.8,112.2,106.0,103.6,66.0,48.2,17.5.hrms(esi-tof):m/z calculated for c
21h20
n4o2[m+h]
+
:361.1659,found:361.1663.
[0193]
对比例1
[0194]
对比例1的结构式化合物为
[0195]
合成方法参考:2-吲哚甲酸(10mmol,1.61g,1.0equiv)加入至反应瓶中,加入50ml氯仿搅拌均匀;冰浴下,加入4.5ml二氯亚砜;加毕,移至75℃下反应4h。反应结束后,减压旋去溶剂和多余的二氯亚砜,得到酰氯固体。邻氨基苯甲酰胺(10mmol,1.36g,1.0equiv)加入至反应瓶中,加入50ml氯仿溶解,再加入0.8ml吡啶混合搅拌均匀,置于冰浴下冷却至0℃;酰氯固体用20ml氯仿溶解,缓慢滴加至混合体系中,室温下搅拌反应过夜。反应结束后,过滤,滤饼用氯仿洗涤,真空干燥。干燥的滤饼呈现白色,加入至反应瓶中,加入2m氢氧化钠溶
液25ml,再加入乙醇20ml,置于85℃下搅拌反应2h。反应结束后,冷却至室温,将反应液倒入冰水中,用4m盐酸调节ph至2左右,此时有大量固体析出。过滤,滤饼用大量清水清洗,真空干燥即得化合物iq。
[0196]
抗肿瘤和降脂活性检测
[0197]
抗肿瘤活性检测方法步骤如下:
[0198]
1、筛选:
[0199]
处于对数生长期的hct116,5000细胞/孔,均匀接种至96孔板,在细胞培养箱静置24h后给药(10μm和50μm)处理24h。随后加入-20℃预冷的70%乙醇固定细胞于-20℃冰箱过夜。加入10μg/ml碘化丙啶(propidium iodide,pi)室温染色4h,并采用全自动细胞组高内涵筛选分析系统进行检测,计算获得抑制率,数据见表1。
[0200]
抑制率=100%-(数值(化合物)/数值(ctrl))
×
100%
[0201]
2、ic
50
检测
[0202]
处于对数生长期的hct116,5000细胞/孔,均匀接种至96孔板,在细胞培养箱静置24h后,进行3gj、3gn和对比例1给药(0.1、1、5、10、25和50μm)处理24h。随后加入-20℃预冷的70%乙醇固定细胞于-20℃冰箱过夜。加入10μg/ml碘化丙啶(propidium iodide,pi)室温染色4h,并采用全自动细胞组高内涵筛选分析系统进行检测,最后,使用graphpad prism 8.0.1通过非线性回归拟合获得ic
50
。得到3gj的ic
50
值为1.7μm;3gn的ic
50
值为12.5μm;对比例1的ic
50
值为大于50μm。
[0203]
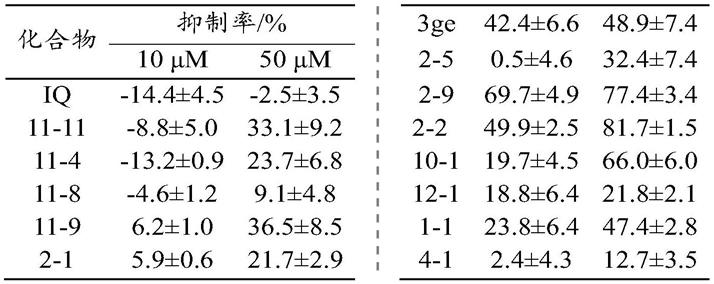
表1实施例和对比例1的抗肿瘤抑制率
[0204][0205]
降脂活性测试的步骤如下:
[0206]
对数生长期的3t3-l1前脂肪细胞,5.0*104细胞/孔,均匀接种至48孔板,细胞培养箱静置培养,每两天更换一次培养液。待细胞生长接近至80%融合,更换培养液,继续培养2天至细胞完全融合(day0),更换含有分化诱导液i的dmem完全培养基(含10%fbs及1%双抗的dmem培养基),37℃5%co2静置培养3天(day3)。3天后,更换含有分化诱导液ii的dmem完全培养基继续培养3天(day6)。对于药物干预组(实施例和对比例制备的化合物),以含有分化诱导液的dmem完全培养基为稀释液,稀释化合物至一定浓度,在day0与day3时,一同加入。空白对照组与分化对照组,分别加入等体积的dmso溶液。在day6时,进行油红o染色及定量分析。
[0207]
(1)分化诱导液配制
[0208]
分化诱导液i:含500μm m3-异丁基-1-甲基-黄嘌呤,1μm地塞米松、5μg/ml胰岛素的dmem完全培养基;分化诱导液ii:含5μg/ml胰岛素的dmem完全培养基。
[0209]
(2)油红o染色及定量
[0210]
细胞诱导分化至day6时,弃去培养基,4%多聚甲醛固定液室温固定60min。弃去固定液,并用异丙醇润洗细胞后,油红o染色工作液(0.5%油红o异丙醇储液:ddh2o=3:2)室温染色30min。弃去染色液,并用去离子水润洗2~3次后。随后,100μl60%异丙醇洗涤10min,并用100μl纯异丙醇萃取30min。取80μl萃取液于96孔板中并进行510nm吸光度检测及抑制率计算,结果如表2所示:
[0211]
抑制率=100%-(od
(化合物)-od
(und)
)/(od
(ctrl)-od
(und)
)
×
100%
[0212]
表2实施例的降脂抑制率的数据
[0213][0214]
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
