1.本发明涉及药物治疗技术领域,尤其涉及人脐带间充质干细胞外泌体在制备治疗硬皮病药物中的应用。
背景技术:
2.硬皮病,一种以纤维化、血管破坏和免疫异常为特点的自身免疫性疾病,该疾病会严重威胁到患者的生命,硬皮病的预后因此而受到广泛关注。目前尚无确切有效的治疗方法,临床上以糖皮质激素联合免疫抑制剂为主要治疗方案,但缓解率低、安全性和耐药性不肯定。此外,生物制剂也成为治疗硬皮病的新星,但是依旧不能逆转疾病的进展。
3.干细胞是具有自我更新和多向分化潜能的细胞,可以自主修复被损伤的组织。人脐带间充质干细胞(humscs)具有免疫原性更低、分化能力更强和更容易获得的特点。干细胞主要通过旁分泌发挥功能,而人脐带间充质干细胞外泌体(humscs-ex)正是一种旁分泌囊泡。通过无细胞移植,可以将外泌体的活性物质释放,达到治疗硬皮病的效果。
技术实现要素:
4.本发明的目的是针对现有技术中的不足,提供一种人脐带间充质干细胞外泌体在制备治疗硬皮病药物中的应用。
5.为实现上述目的,本发明采取的技术方案是:
6.提供人脐带间充质干细胞外泌体在制备治疗硬皮病药物中的应用。
7.优选地,所述人脐带间充质干细胞外泌体的制备方法包括:
8.s1、取冻存的人脐带间充质干细胞,35℃~40℃恒温水浴1min~5min并离心,加入新鲜培养基后,进行常规培养;
9.s2、取第3~5代人脐带间充质干细胞,当人脐带间充质干细胞融合至70%~80%时,更新新鲜无血清培养基,培养24h~72h后收集上清;
10.s3、高速离心以获取浓缩液,pbs重悬后-100℃~-60℃冷藏。
11.优选地,所述治疗硬皮病药物中所述人脐带间充质干细胞外泌体蛋白量为2-6mg/kg体重。
12.优选地,所述人脐带间充质干细胞外泌体使真皮层变薄。
13.优选地,所述人脐带间充质干细胞外泌体减轻细胞外基质沉积,抑制上皮-间质转化。
14.优选地,所述人脐带间充质干细胞外泌体抑制m2巨噬细胞极化,调节m1/m2巨噬细胞平衡。
15.本发明采用以上技术方案,与现有技术相比,具有如下技术效果:
16.本发明采用人脐带间充质干细胞外泌体干预,使得硬皮病小鼠的真皮层变薄,皮下脂肪层恢复到一定程度,细胞外基质沉积减轻,硬皮病小鼠的上皮-间质转化和m1/m2巨噬细胞平衡(两者均参与硬皮病的调控)得到调节。
附图说明
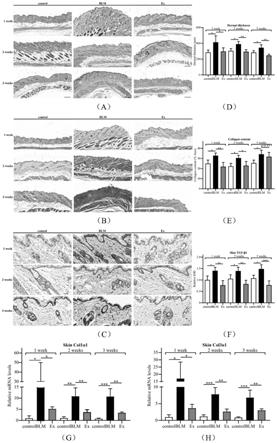
17.图1为人脐带间充质干细胞外泌体对硬皮病的治疗效果图。
具体实施方式
18.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
19.需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
20.下面结合附图和具体实施例对本发明作进一步说明,但不作为本发明的限定。
21.实施例
22.本实施例提供人脐带间充质干细胞外泌体在制备治疗硬皮病药物中的应用,其中,所述人脐带间充质干细胞外泌体的制备方法包括:
23.s1、从液氮罐中取出人脐带间充质干细胞的细胞冻存管,在37℃恒温水浴锅中水浴3min后,离心并加入新鲜培养基,进行常规培养;
24.s2、取状态好的第3~5代人脐带间充质干细胞,当人脐带间充质干细胞融合至75%时,更新新鲜无血清培养基,培养48h后收集上清;
25.s3、采用高速离心法获取人脐带间充质干细胞外泌体的浓缩液,pbs重悬后-80℃冷藏;
26.在成功构建硬皮病小鼠动物模型后,将经鉴定的人脐带间充质干细胞外泌体在皮损部位皮下注射,人脐带间充质干细胞外泌体总量为100μg。
27.硬皮病小鼠的表皮层、真皮层和皮下脂肪层分界紊乱,真皮层增厚,胶原纤维增加,细胞外基质沉积;人脐带间充质干细胞外泌体干预后,真皮层变薄,皮下脂肪层恢复到一定程度,细胞外基质沉积减轻,硬皮病小鼠的上皮-间质转化和m1/m2巨噬细胞平衡(两者均参与硬皮病的调控)得到调节。
28.检测实施例
29.本检测实施例以评判人脐带间充质干细胞外泌体对硬皮病的治疗效果:
30.①
小鼠皮肤组织经4%多聚甲醛固定后,进行常规脱水、石蜡包埋、切片;切片后用二甲苯脱蜡和梯度乙醇水化,接着苏木素和伊红进行先后染色,最后脱水封片;如图a所示,紊乱的皮肤结构得到明显纠正;
31.每张he染色的切片在
×
100的视野下随机选取3个视野,使用image j软件计算真皮厚度,并取平均值。如图d所示,增厚的真皮层变薄。
32.②
小鼠皮肤组织经4%多聚甲醛固定后,进行常规脱水、石蜡包埋、切片;切片后用二甲苯脱蜡和梯度乙醇水化,接着苏木素和苯胺蓝进行先后染色,最后脱水封片;如图b所示,人脐带间充质干细胞外泌体干预后,真皮层被胶原纤维的替代得到缓解;
33.每张masson染色的切片在
×
100的视野下随机选取3个视野,使用image j软件计算细胞外基质沉积面积占组织总面积的百分比,并取平均值;如图e所示,人脐带间充质干细胞外泌体使细胞外基质沉积的面积减少;
34.③
小鼠皮肤组织经4%多聚甲醛固定后,进行常规脱水、石蜡包埋、切片;滴加3%h2o2阻断内源性过氧化物酶,滴加山羊血清封闭;随后滴加一抗(tgf-β1),4℃过夜;pbs冲洗后滴加二抗,然后用二氨基联苯胺显色,苏木精复染,封片;
35.每张tgf-β免疫组化染色的切片在
×
400的视野下随机选取5个视野,使用image pro plus软件计算平均光密度值(iod);
36.如图c和图f所示,硬皮病关键通路分子tgf-β的表达水平得到纠正;
37.④
使用trizol法提取组织总rna后,进行cdna逆转录,将设计和合成的引物进行qpcr检测;每个样品重复三次,各个基因的相对表达水平以2
(ct内参基因-ct目的基因)
进行统计分析;如图g和图h所示,细胞外基质的标志物col1α1和col3α1也有如上的类似改变。
38.以上所述仅为本发明较佳的实施例,并非因此限制本发明的实施方式及保护范围,对于本领域技术人员而言,应当能够意识到凡运用本发明说明书及图示内容所作出的等同替换和显而易见的变化所得到的方案,均应当包含在本发明的保护范围内。
技术特征:
1.人脐带间充质干细胞外泌体在制备治疗硬皮病药物中的应用。2.根据权利要求1所述的应用,其特征在于,所述人脐带间充质干细胞外泌体的制备方法包括:s1、取冻存的人脐带间充质干细胞,35℃~40℃恒温水浴1min~5min并离心,加入新鲜培养基后,进行常规培养;s2、取第3~5代人脐带间充质干细胞,当人脐带间充质干细胞融合至70%~80%时,更新新鲜无血清培养基,培养24h~72h后收集上清;s3、高速离心以获取浓缩液,pbs重悬后-100℃~-60℃冷藏。3.根据权利要求1所述的应用,其特征在于,所述治疗硬皮病药物中所述人脐带间充质干细胞外泌体蛋白量为2-6mg/kg体重。4.根据权利要求1所述的应用,其特征在于,所述人脐带间充质干细胞外泌体使真皮层变薄。5.根据权利要求1所述的应用,其特征在于,所述人脐带间充质干细胞外泌体减轻细胞外基质沉积,抑制上皮-间质转化。6.根据权利要求1所述的应用,其特征在于,所述人脐带间充质干细胞外泌体抑制m2巨噬细胞极化,调节m1/m2巨噬细胞平衡。
技术总结
本发明涉及人脐带间充质干细胞外泌体在制备治疗硬皮病药物中的应用。本发明采用人脐带间充质干细胞外泌体干预,使得硬皮病小鼠的真皮层变薄,皮下脂肪层恢复到一定程度,细胞外基质沉积减轻,硬皮病小鼠的上皮-间质转化和M1/M2巨噬细胞平衡(两者均参与硬皮病的调控)得到调节。控)得到调节。控)得到调节。
技术研发人员:姜淼 俞悦 赵敬军
受保护的技术使用者:上海市同济医院
技术研发日:2021.09.30
技术公布日:2022/2/15
