1.本发明涉及生物医药技术领域,特别涉及一种硝唑尼特在制药中的应用。
背景技术:
2.前列腺(英文:prostate)是男性特有的性腺器官。前列腺疾病前列腺癌是男性泌尿系统最常见的恶性肿瘤,全球癌症病发率居第四位。据估计,在2020年就有1414259例患者病发于前列腺癌,有375304例癌症患者死于前列腺癌。相比欧美国家,虽然我国的前列腺癌发病率较低,但是随着近年来我国社会人口老龄化,经济水平提高及人们饮食习惯改变,我国前列腺癌发病率逐年升高的趋势,严重威胁着我国中老年男性的健康。根据2013年中国前列腺癌发病现状和流行趋势分析显示,1998年中国男性前列腺癌发病率仅为3.52/10万,但至2008年发病率达到11.00/10万,10年间的年均增长比例为12.07%。前列腺癌骨转移是前列腺癌常见的并发症之一,也是患者发病和死亡的主要原因。前列腺癌在初始阶段,生长在局部的肿瘤可通过外科手术或放射疗法成功治疗,但是大约20~30%的患者会复发。虽然复发的患者一开始会对雄激素剥夺疗法或雄激素受体拮抗剂敏感,但是最终都会不可避免地发展为去势抵抗性前列腺癌(castration-resistant prostate cancer,crpc)。这一阶段会同时或随后迅速出现继发性肿瘤,90%的转移性去势抵抗性前列腺癌(mcrpc)都会转移到骨骼部位。尽管对于患有骨转移的crpc患者建议使用denosumab或zoledronic acid预防或延迟骨骼相关事件(skeletal related events,sre),但在癌症特异性和总体生存方面未见明显疗效。目前,多西紫杉醇和卡巴他赛是唯一对mcrpc患者具有生存益处的化疗药物,但实际上所有mcrpc最终都会产生耐药性,多西紫杉醇治疗的骨转移患者预后仍然较差。
技术实现要素:
3.本发明的主要目的是提出一种硝唑尼特在制药中的应用,旨在提出一种硝唑尼特用于治疗前列腺疾病的新用途。
4.为实现上述目的,本发明提出一种硝唑尼特在制备治疗前列腺疾病的药物中的应用。
5.进一步地,本发明还提出一种硝唑尼特在制备治疗前列腺癌的药物中的应用。
6.此外,本发明还提出一种硝唑尼特在制备治疗前列腺癌骨转移的药物中的应用。
7.本发明提供的技术方案中,提出一种硝唑尼特在治疗前列腺疾病的应用,硝唑尼特是一种广谱抗寄生虫药和广谱抗病毒药物,在医学上用于治疗各种蠕虫、原生动物和病毒感染。本发明提出了硝唑尼特的新用途,能够治疗前列腺疾病,如前列腺癌骨转移,开拓了前列腺疾病治疗的新药,且硝唑尼特是fda批准的药物,其药物安全性已被验证;硝唑尼特可从植物和动物来源大量获得,获取成本低。
附图说明
8.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅为本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
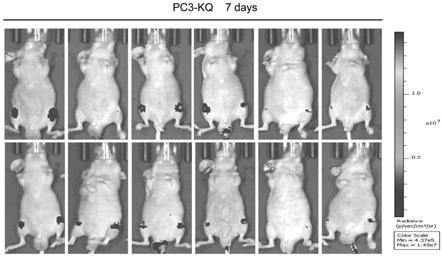
9.图1为本发明实施例pc3-kq细胞尾动脉注射入小鼠体内7天后的生物发光图;
10.图2为本发明实施例活体成像ntz(硝唑尼特)给药35后治疗前列腺癌骨转移效果图;
11.图3为本发明实施例对照组和ntz组小鼠下肢骨组织的生物发光对比图;
12.图4为本发明实施例统计分析给药前后对照组和ntz组的生物发光对比图;
13.图5为本发明实施例给药期间对照组和ntz组小鼠的体重变化曲线;
14.图6为本发明实施例micro-ct分析ntz对活体小鼠骨组织的保护作用图;
15.图7为本发明实施例micro-ct分析ntz对小鼠骨组织的保护作用图;
16.图8为本发明实施例micro-ct分析ntz对小鼠骨小梁的保护作用图;
17.图9为本发明实施例he染色检测pc3-kq细胞对骨组织的侵袭及ntz抗侵袭作用图;
18.图10为本发明实施例ntz减少骨组织癌细胞转移面积图;
19.图11为本发明实施例免疫组化检测ki67在对照组和ntz组中的表达结果图。
20.本发明目的的实现、功能特点及优点将结合实施例,参照附图做进一步说明。
具体实施方式
21.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
22.另外,全文中出现的“和/或”的含义,包括三个并列的方案,以“a和/或b”为例,包括a方案、或b方案、或a和b同时满足的方案。此外,各个实施例之间的技术方案可以相互结合,但是必须是以本领域普通技术人员能够实现为基础,当技术方案的结合出现相互矛盾或无法实现时应当认为这种技术方案的结合不存在,也不在本发明要求的保护范围之内。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
23.尽管对于患有骨转移的crpc患者建议使用denosumab或zoledronic acid预防或延迟骨骼相关事件(skeletal related events,sre),但在癌症特异性和总体生存方面未见明显疗效。目前,多西紫杉醇和卡巴他赛是唯一对mcrpc患者具有生存益处的化疗药物,但实际上所有mcrpc最终都会产生耐药性,多西紫杉醇治疗的骨转移患者预后仍然较差。
24.鉴于此,本发明提出一种硝唑尼特在制备治疗前列腺疾病的药物中的应用,旨在提出一种硝唑尼特用于治疗前列腺疾病的新用途。
25.硝唑尼特,是一种广谱抗寄生虫药和广谱抗病毒药物,在医学上用于治疗各种蠕虫、原生动物和病毒感染。它适用于治疗免疫正常个体的隐孢子虫和蓝氏贾第鞭毛虫的感染,并已重新用于治疗流感。在癌症研究中表明,硝唑尼特具有抗膀胱癌,胶质母细胞瘤,卵
巢癌及结直肠癌的潜力,但是在前列腺癌中从未见报道,尤其在骨转移方面。因此,本发明通过建立临床前模型,首次探索及发现了硝唑尼特的新医药用途,为治疗前列腺癌骨转移的药物发现提供了依据和基础。
26.进一步地,本发明还提出一种硝唑尼特在制备治疗前列腺癌的药物中的应用。在本发明实施例中,硝唑尼特用来制备治疗前列腺癌的药物,开发了硝唑尼特在药物领域的新用途。
27.进一步地,本发明还提出一种硝唑尼特在制备治疗前列腺癌骨转移的药物中的应用。在本发明实施例中,硝唑尼特用来制备治疗前列腺癌骨转移的药物,开发了硝唑尼特在药物领域的新用途。
28.以下结合具体实施例和附图对本发明的技术方案作进一步详细说明,应当理解,以下实施例仅仅用以解释本发明,并不用于限定本发明。
29.本发明实施例的细胞培养按照以下操作步骤进行:
30.1、细胞的增殖与传代
31.本发明所用的人前列腺癌细胞株pc3-kq在co2浓度为5%,湿度为95%的37℃恒温co2培养箱中进行培养,所使用的培养基为含有10%胎牛血清,1%青链霉素双抗的常规1640培养基。每日镜下观察培养瓶中培养基颜色变化,注意是否有浑浊,观察细胞状态,包括细胞的形态、密度以及伸展情况,待培养基颜色变淡后,进行换液。若细胞培养过程中发现细胞污染,立即丢弃所有细胞,并对细胞间进行彻底消毒,重新复苏细胞,待细胞状态良好,方可用于试验。
32.①
每日显微镜下观察细胞,直至生长至80~90%的饱和度,准备进行细胞传代;
33.②
对超净台和实验所用的物品进行30min的紫外线照射消毒;
34.③
移除培养液,加入pbs(2ml/皿),仔细冲洗残留于培养瓶中的培养液以及细胞;
35.④
移除pbs,每瓶加入1.5ml含有edta的0.25%胰蛋白酶,静置消化2~3min;
36.⑤
显微镜下观察细胞变化,直至细胞收缩变圆,细胞间隙增大,部分细胞脱落,则可认为消化完全,加入与胰酶等量的含有血清的细胞培养基进行终止消化,巴氏吸管反复吹打,直至贴于瓶壁的细胞完全脱落;
37.⑥
将吹打下来的细胞以及胰酶培养基混合液转移至15ml离心管,进行1200rpm离心,离心时间为3min;
38.⑦
丢弃离心管中上清液,注意保护离心管底白色沉淀物为离心下来的细胞,防止丢弃细胞,在离心管中加入2ml新鲜细胞培养液,巴氏吸管反复吹打40次,使细胞重悬,形成单细胞悬液;
39.⑧
将重悬为单细胞悬液的细胞,吸取1ml加入到新的10cm2细胞培养皿,并在培养瓶中加入9ml新鲜培养基;
40.⑨
分别吸取重悬细胞1ml,加入到上述准备好的培养瓶中,并将培养瓶放平后左右上下轻微晃动,使细胞均匀铺满培养皿;
41.⑩
镜下观察细胞,标记细胞名称及传代时间,再次置于培养箱中继续培养;将超净台整理整齐后再用75%的酒精擦拭超净台台面,熄灭酒精灯,紫外消毒。
42.2、细胞计数
43.①
将细胞计数板及盖玻片用75%酒精擦拭干净,在酒精灯火焰上左右晃动数次烘
干后,将盖玻片完全覆盖在计数板上,放平,勿使盖玻片滑动;
44.②
按照细胞传代方法加入胰蛋白酶消化细胞,将收集的细胞转移到15ml无菌离心管中并且进行单细胞悬液的制备;
45.③
移液枪吸取20μl单细胞悬液于1.5ml离心管中与20μl台盼蓝混匀;
46.④
细胞技术仪计数;
47.⑤
记录细胞计数结果,计算每皿细胞密度。
48.实施例1活体成像系统观察硝唑尼特对前列腺癌细胞骨转移的影响
49.一、前列腺癌高转移pc3-kq细胞的构建
50.1、转化
51.将大肠杆菌感受态于-80℃冰箱取出后,置于冰上融化;将实验室已构建的连接产物(k369q)加入大肠杆菌感受态,冰上孵育;42℃热激90s之后置于冰上2min;于超净台内向感受态中加入200μl的lb培养基、1μl抗生素,移液枪吹打均匀后涂含有抗生素的平板;涂板后37℃恒温培养箱培养过夜。
52.2、质粒扩增
53.用10μl枪头挑取平板上的单克隆菌落后放入ep管中,摇床中200rpm摇菌12h,根据质粒提取试剂盒提取质粒。
54.3、病毒包装
55.待293t细胞生长汇合度为80%左右,进行质粒转染,分别于48h和72h收取病毒,1500rpm离心5min;将制备好的病毒分装至1.5ml的ep管中,-80℃冰箱冻存备用。
56.4、病毒感染
57.将前列腺癌细胞pc3按照30%的汇合度铺到6孔板中,完全培养基培养,每孔2ml;
58.37℃的二氧化碳恒温培养箱培养;16~28h后,初次感染,吸去旧培养基,每孔加入500μl新鲜完全培养基和500μl病毒(k369q),最后加入1μl阳离子吸附剂(polybrene),摇晃均匀后放入37℃的二氧化碳恒温培养箱培养,6h后,每孔补入1ml新鲜完全培养基,mock代表不加入病毒,筛选稳定克隆的空白对照;16~24h后,二次感染,吸去旧的培养基和病毒,每孔加入500μl新鲜完全培养基和500μl病毒以及1μl阳离子吸附剂,37℃的二氧化碳恒温培养箱培养。6h后,每孔补入1ml新鲜完全培养基。16~24h后,感染完毕。
59.5、转基因多克隆细胞系筛选
60.将前列腺癌细胞pc3感染后16~24h,吸去旧的培养基和病毒,将细胞消化下来,转入10cm培养皿,每皿6ml完全培养基,继续培养;24h后,当细胞贴壁之后,吸去旧的培养基,选择压为pc3:800μg/ml的潮霉素b(hygromycin b);每隔两天更换一次含有选择压的培养基;两周之后,当mock皿中的细胞全部被选择压杀死之后,可认为处理中的阴性细胞也都被选择压杀死,而活下来的细胞则为筛选出来的阳性细胞;将筛选出来的细胞扩增培养,为前列腺癌高转移pc3-kq细胞,一部分用来收取rna和裂解蛋白,检测目的基因是否成功表达;一部分用来冻存保种;一部分用来继续培养,完成后续实验。
61.二、慢病毒感染构建荧光素酶细胞
62.1、探索puromycin(嘌呤霉素)的最适浓度
63.在筛选之前,需要摸索能够杀死空细胞的最低puromycin浓度:可将细胞铺板24孔板,每孔密度为5
×
104个细胞,24h后更换不同浓度puromycin的完全培养基,puromycin浓
度可设置为0、0.2、0.4、0.6、0.8、1.0、2.0、4.0、6.0、8.0、10.0mg/ml处理48h,选取能够杀死90%以上空细胞的最低浓度进行后续实验。
64.2、慢病毒感染细胞
65.day1:待细胞汇合度为80~90%,收集细胞铺于6孔板,每孔1.5
×
105个细胞;一般是保证第二天进行病毒感染时细胞汇合率介于30%~50%之间,铺板时不加抗生素;
66.day2:感染细胞之前,从-80℃冰箱取出病毒并在冰上慢慢融化,吸去细胞原有培养基,加入二分之一体积新鲜培养基(培养基可不含双抗和不含血清);
67.根据moi值(multiplicity of infection,感染复数),加入病毒进行感染;每孔加病毒体积(μl)=moi
×
细胞数/病毒滴度(tu/ml)
×
1000
68.需要加入polybrane(聚凝胺)的细胞,可同时加入polybrane(1:1000)
69.感染4h后用含血清培养基补足至完全培养体积;
70.day3:感染后第二天(约24h),吸去含有病毒的培养液,换上新鲜的完全培养液,继续培养24h;
71.day4:换上适当浓度puromycin的新鲜完全培养液,筛选稳定表达luc的细胞株;筛选时,需要设置未感染病毒的细胞对照实验组,并加入等量的puromycin;
72.day6:加药puromycin 48h,观察对照组未转染细胞的死亡情况,若对照组组细胞死亡率达90%以上,撤掉puromycin换新鲜的培养基培养,puromycin的浓度是2.0ug/ml。
73.puromycin筛选后,待细胞长满可适当比列传代培养,后面可用五分之一puromycin维持抗性。
74.三、硝唑尼特对前列腺癌骨转移的影响
75.细胞悬液制备:取汇合度为80~90%的pc3-kq细胞,胰酶消化,完全培养基终止消化,1200rpm离心3min,弃上清。加pbs制备成细胞悬液,混匀后细胞计数,按照1
×
106个/只小鼠准备细胞,稀释后制成细胞悬液,保存于冰上,待用。
76.尾动脉注射细胞:用2.5%的avertin(每10g注射120~150μl)对小鼠实行麻醉,待小鼠完全麻醉后,将小鼠腹部朝上放于无菌操作台上,用酒精棉球对其尾动脉进行消毒;从小鼠尾部三分之一处用胰岛素针迅速注射入100μl准备好的细胞悬液(1
×
106个),注射入动脉的时间要求小于3s,旋转出针,然后用干的棉球按压注射点约1min,防止出血。
77.尾动脉注射细胞后7天,开始给药硝唑尼特,给药方式灌胃给药,每天一次,每次100mg/kg每只鼠,溶剂为1%cmc,给药量每只鼠100ul。
78.小鼠体内活体成像:分别在注射细胞后7天,14天,21天,28天,35天进行活体成像。具体操作如下:在成像前10min,启动活体成像系统,打开氧气开关和气体麻醉开关,然后对每组小鼠腹腔注射实验前准备好的荧光素酶底物(d-luciferin,sodium salt),d-荧光素工作液浓度为15mg/ml,每只小鼠的注射量取决于小鼠的体重:150mg/kg;注射入小鼠体内10min后,麻醉小鼠,进行成像分析。
79.利用已构建的前列腺癌高转移pc3-kq细胞,通过转染荧光素luc,构建pc3-kq-luc细胞系,然后经尾动脉注射打入小鼠体内,结果如图1、图2、图3、图4及图5所示,其中,图1为本发明实施例pc3-kq细胞尾动脉注射入小鼠体内7天后的生物发光图,如图所示,在7天时pc3-kq-luc已转移到小鼠骨组织,根据生物发光值分为control组和ntz组;图2为本发明实施例活体成像ntz(硝唑尼特)给药35后治疗前列腺癌骨转移效果图,通过活体成像观察,对
照组生物发光明显强于ntz组;图3为本发明实施例对照组和ntz组小鼠下肢骨组织的生物发光对比图,在给药终点将小鼠解剖取骨组织进行活体成像;图4为本发明实施例统计分析给药前后对照组和ntz组的生物发光对比图,在第7天,对照组和给药组生物发光无差异,但在35天,ntz组生物发光值明显小于对照组,具有明显差异性(p《0.01)。
80.以上结果可以看出,在第7天活体成像观察到癌细胞已经转移至小鼠骨组织部位,根据生物发光值随机分组,在第7天灌胃给药硝唑尼特,每天给药,在35天活体成像发现,与对照组相比,给药组生物发光值明显降低,具有显著性差异。并且,如图5所示,对照组和给药组小鼠体重随着时间增长而增加。
81.实施例2microct检测硝唑尼特对小鼠骨组织的保护作用
82.待实施例1的实验结束,脱颈椎处死小鼠,解剖取出骨组织,用多聚甲醛固定48h后,将骨组织浸入含有pbs的离心管中,然后行小动物microct,观察pc3-kq细胞转移和骨组织破坏情况,并检测骨皮质破坏情况,并分析骨小梁密度(bv/tv)、骨小梁数量(tb.n)、骨小梁厚度(tb.th)和骨小梁分离度(tb.sp)等指标。
83.结果如图6,图7及图8所示,其中,图6为本发明实施例micro-ct分析ntz对活体小鼠骨组织的保护作用图,在给药终点,分别对pc3-kq对照组和pc3-kq ntz组行micro-ct。如图6所示,在pc3-kq对照组组可观察到裸鼠股骨远端和胫骨近端出现破骨行为,而硝唑尼特给药组没有观察到明显的破骨行为;图7为本发明实施例micro-ct分析ntz对小鼠骨组织的保护作用图,在给药终点解剖小鼠取骨组织行micro-ct,进行3d重构,从骨组织截面图可以看出,对照组的骨小梁面积减少及骨皮质受到破坏,而ntz组保持较为完整;图8为本发明实施例micro-ct分析ntz对小鼠骨小梁的保护作用图,通过micro-ct分析骨小梁密度(bv/tv)、骨小梁数量(tb.n)、骨小梁厚度(tb.th)和骨小梁分离度(tb.sp),发现与对照组相比,ntz可增加骨小梁密度,骨小梁数量及骨小梁厚度,降低骨小梁分离度。
84.对照组小鼠出现破骨表型,而硝唑尼特组骨组织完整性较为完好,且与对照组相比,硝唑尼特能增加骨小梁密度(bv/tv)、骨小梁数量(tb.n)、骨小梁厚度(tb.th)和降低骨小梁分离度(tb.sp),具有保护骨组织不受癌细胞破坏的效果。
85.实施例3he染色检测硝唑尼特对小鼠骨组织的治疗作用
86.一、he染色
87.(1)不同处理组小鼠颈椎脱臼处死后,分离股骨和胫骨,剪去周围多余的结缔组织和肌肉组织,固定于4%多聚甲醛中48h,之后用edta脱钙液脱钙14~21天;
88.(2)骨组织脱钙后,进行脱水,程序如下:
89.70%乙醇1h
90.80%乙醇1h
91.90%乙醇1h
92.95%乙醇1h
93.无水乙醇ⅰ1h
94.无水乙醇ⅱ1h
95.二甲苯ⅰ1h
96.二甲苯ⅱ1h
97.石蜡ⅰ1h
98.石蜡ⅱ1h
99.石蜡ⅲ1.5h
100.(3)包埋:提前2h打开包埋机,预热融化石蜡;将包埋盒浸泡在液体石蜡中备用,不锈钢包埋盒底模放于另外一边石蜡中,取一不锈钢底膜置于台上,挤入1/3的石蜡,然后将组织块放在中央;随后将载有组织的不锈钢底模具于冰冻台上,待其凝固变白,再次置于加热台上挤出石蜡至覆盖组织,取包埋盒地板于不锈钢模具上,再加入液体石蜡至超过底板高度,置于冷冻台上冷却,当石蜡块冷冻至可轻轻从模具中抠出蜡块时,抠出组织蜡块,然后通过包埋机加热台修去蜡块四周多去的石蜡。
101.(4)切片:预先将骨组织蜡块埋入冰里,然后在4℃冰箱内冷冻过夜以利于切片。从冰箱内取出蜡块,使用切片机对组织蜡块进行纵切,切片厚度为4μm。用42℃温水摊片,使切好的组织充分展开,随后固定于阳离子防脱玻片上。
102.(5)烤片:将组织切片放入62℃烤箱中烘片,时间为2~3h。
103.(6)脱蜡:程序如下:
104.二甲苯ⅰ10min
105.二甲苯ⅱ10min
106.二甲苯ⅲ10min
107.二甲苯ⅳ10min
108.无水乙醇ⅰ10min
109.无水乙醇ⅱ10min
110.95%乙醇10min
111.85%乙醇10min
112.75%乙醇10min
113.h2o 5min
114.(7)染色:苏木素染色1.5min,流水冲洗1min直至染色槽无色,pbs浸泡;5%醋酸分化3s,分化掉非特异性组织染色;流水冲洗一遍后,pbs浸泡,显微镜下观察染色效果,以核为天蓝色为宜;
115.(8)伊红染液染色2~3min;自来水快速洗2遍;
116.(9)梯度乙醇脱水:切片经75%乙醇20s,85%乙醇20s,95%乙醇20s,100%乙醇10min,然后镜下观察伊红染色结果;接着继续100%乙醇10min,二甲苯10min2次。
117.(10)封片:上述处理好的盖玻片,取中性树胶滴入载玻片的组织上,取盖玻片从一端逐步盖下去,避免发生气泡。
118.结果如图9和图10所示,其中,图9为本发明实施例he染色检测pc3-kq细胞对骨组织的侵袭及ntz抗侵袭作用图,对照组癌细胞侵袭骨组织明显多于ntz组;图10为本发明实施例分析对照组和ntz组骨组织癌细胞转移面积图,通过分析癌细胞在骨组织中所占比例,发现与对照组相比,ntz组癌细胞侵袭面积比例明显少于对照组。
119.在对照组中大量癌细胞侵入骨组织关节近端,而硝唑尼特组很少癌细胞侵入骨组织中,经过统计分析,给药组的癌细胞面积明显少于对照组。
120.实施例4免疫组化检测硝唑尼特抑制前列腺癌细胞在骨组织的生长
121.免疫组化
122.(1)石蜡切片脱蜡至水;
123.(2)pbs洗5min
×
3次;
124.(3)3%h2o2(80%甲醇)室温孵育10min,以消除内源性过氧化物酶的活性;
125.(4)pbs洗5min
×
3次;
126.(5)蛋白酶抗原修复方法进行抗原修复;
127.(6)pbs洗5min
×
3次;
128.(7)5~10%正常山羊血清(pbs稀释)封闭,室温孵育10~20min,甩去血清,勿洗;
129.(8)滴加ι抗50μl,室温静置1h或4℃过夜或37℃h;
130.(9)4℃过夜后需在37℃复温45min;
131.(10)pbs洗5min
×
3次;
132.(11)滴加ⅱ抗45~50μl,37℃1h(ⅱ抗中可加入0.05%的tween-20);
133.(12)pbs洗5min
×
3次;
134.(13)dab显色5~10min,在显微镜下掌握染色程度;
135.(14)pbs或自来水冲洗10min;
136.(15)苏木精复染2min,盐酸酒精分化;
137.(16)自来水冲洗10~15min;
138.(17)脱水、透明、封片、镜检。
139.图11为本发明实施例免疫组化检测ki67在对照组和ntz组中的表达结果图,如图11所示,ki67是癌细胞增殖的标志,通过免疫组化分析ki67在骨组织癌细胞中的表达,可以看到ki67在对照组明显表达,而在给药组中很少观察到其阳性表达。
140.综上所述,本发明提出的硝唑尼特在制药中的应用,能够治疗前列腺疾病,如前列腺癌骨转移,且治疗效果较好,开拓了前列腺疾病治疗的新药,且硝唑尼特是fda批准的药物,其药物安全性已被验证;硝唑尼特可从植物和动物来源大量获得,获取成本低,广泛应用于前列腺癌的治疗中。
141.以上仅为本发明的优选实施例,并非因此限制本发明的专利范围,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包括在本发明的专利保护范围内。
