1.本发明属于植物学技术领域,涉及植物转录因子互作影响的评估方法。
背景技术:
2.铬(cr)作为重要的工业原料,广泛用于石油精炼、皮革鞣制、纺织品制造、电镀、染料加工等工业。据统计,世界cr年均消耗量约1250万吨,而全球工业化时期所累积的cr产品约11054亿吨,导致环境中的cr污染加剧。国家环保部在2014年4月17日发布的《全国土壤污染物调查公报》显示,全国土壤污染总超标率为16.1%,其中cr的点位超标率为1.1%。植物是食物链中的生产者,也是生态系统中最重要的环节,其在污染胁迫下利用外源绿色调控剂调控植物的生长发育也是学者关注的热点问题。
3.脯氨酸(pro)是一种植物体内具有多种功能的氨基酸,其在缓解生物和非生物胁迫中起到重要作用。许多研究证明:植物在逆境条件下大量累积pro,通过维持细胞液的渗透平衡、清除羟基自由基、保护亚细胞结构、降低细胞膜过氧化程度、平衡细胞内氧化还原电势以及螯合重金属、保护蛋白质和增强各种酶活性等作用,缓解高温、干旱、高盐、强光、渗透胁迫、重金属胁迫、氧化胁迫以及各种生物胁迫等。
4.转录因子(tfs)是植物胁迫期间参与胁迫响应基因表达修饰的最重要的核心信号成分之一。它们可以与位于基因启动子中的短dna序列特异性结合,并与转录起始前复合物相互作用,从而激活或抑制rna聚合酶ii。参与植物胁迫反应的tfs及其相应家族主要包括myb、nac、wrky、bhlh和bzip,它们可构成调节网络,调节植物胁迫反应中各种相关基因的表达。这些tfs构成了植物适应环境变化过程的关键要素,是胁迫环境下调节植物各类性状的首选目标。然而,从tfs相关基因的网络互作及其互作复杂度的角度评价cr胁迫下外源pro对水稻生长的调控策略尚不明确。
技术实现要素:
5.为了达到上述目的,本发明实施例提供植物转录因子互作影响的评估方法,通过化学调控下重金属短期胁迫植物幼苗的基因互作概率模型,分析关键基因的互作概率,筛选出各试验组根组织和叶片组织的关键转录因子;根据各试验组根组织和叶片组织的关键转录因子,评估重金属胁迫下化学调控剂对植物转录因子的互作影响水平,解决了现有技术中存在的cr胁迫下外源pro对水稻生长的调控策略尚不明确的问题。
6.本发明所采用的技术方案是,植物转录因子互作影响的评估方法,包括以下步骤:
7.步骤1:选取化学调控剂,运用植物毒理学手段,对植物幼苗进行重金属短期胁迫;将植物幼苗分为试验组、对照组、空白组;
8.步骤2:计算各试验组根组织和叶片组织中参与胁迫反应的各类转录因子的基因表达变异系数;根据基因表达变异系数的阈值,筛选各试验组根组织和叶片组织中参与胁迫反应的各类转录因子中显著表达的基因;
9.步骤3:构建各试验组根组织和叶片组织中显著表达基因的网络互作图,并筛选出
各试验组根组织和叶片组织的网络互作图中存在高度关联的显著促进表达的关键基因以及显著抑制表达的关键基因;
10.步骤4:根据各试验组根组织和叶片组织中筛选出的显著促进表达的关键基因个数以及显著抑制表达的关键基因的个数分别与试验组中参与胁迫反应的各类转录因子基因总数的比值,得到各试验组根组织和叶片组织中显著促进表达的关键基因的发生概率以及显著抑制表达的关键基因的发生概率;
11.步骤5:根据每个试验组根组织和叶片组织中任两种或两种以上显著表达的关键基因的发生概率的乘积,计算得到每个试验组根组织和叶片组织中显著表达的关键基因的互作概率;全部试验组根组织和叶片组织中显著表达的关键基因的互作概率构成化学调控下重金属短期胁迫植物幼苗的基因互作概率模型;
12.步骤6:基于化学调控下重金属短期胁迫植物幼苗的基因互作概率模型,根据关键基因的互作概率的高低,筛选出各试验组根组织和叶片组织的关键转录因子;根据各试验组根组织和叶片组织的关键转录因子,评估重金属胁迫下化学调控剂对植物转录因子的互作影响水平。
13.进一步地,步骤1中,化学调控下经不同浓度重金属短期胁迫的植物幼苗为试验组,未经化学调控的重金属短期胁迫植物幼苗为对照组,未经重金属短期胁迫的植物幼苗为空白组。
14.进一步地,步骤1中,化学调控剂为脯氨酸;重金属为铬。
15.进一步地,步骤2中,各试验组根组织和叶片组织中参与胁迫反应的各类转录因子的基因表达变异系数的计算方法,包括以下步骤:
16.分别测定各试验组根组织和叶片组织中参与胁迫反应的各类转录因子基因的标准信号值;分别测定对照组根组织和叶片组织中参与胁迫反应的各类转录因子基因的标准信号值;测定空白组中相应各类转录因子基因的标准信号值;
17.分别计算各试验组根组织和叶片组织中参与胁迫反应的各类转录因子基因的标准信号值相对于空白组中相应各类转录因子基因的标准信号值的倍数变化fc1、fc1’
;分别计算对照组根组织和叶片组织中参与胁迫反应的各类转录因子基因的标准信号值相对于空白组中相应各类转录因子基因的标准信号值的倍数变化fc2、fc2’
;根据fc1相对于fc2变化的比例、fc1’
相对于fc2’
变化的比例分别计算得到各试验组根组织和叶片组织中参与胁迫反应的各类转录因子的基因表达变异系数gevcs、gevcs’。
18.进一步地,基因表达变异系数的计算,如下式所示:
[0019][0020][0021]
进一步地,步骤2中,显著促进表达的基因的基因表达变异系数的阈值为25%,所述显著抑制表达的基因的基因表达变异系数的阈值为-25%。
[0022]
进一步地,步骤2中,显著表达的基因由显著促进表达的基因和显著抑制表达的基因组成。
[0023]
进一步地,步骤3中,基于string网络在线数据库,对各试验组根组织和叶片组织中筛选出的显著表达的基因进行分析,构建各试验组根组织和叶片组织中显著表达基因的网络互作图。
[0024]
本发明的有益效果是:本发明实施例通过基因互作概率模型评估pro介导cr(vi)胁迫水稻幼苗中显著促进/抑制表达的关键基因的互作概率随污染物浓度影响的变化规律以及水稻幼苗中显著促进/抑制表达的关键基因互相作用的发生组织,为污染物胁迫下外源化学调控剂对水稻幼苗生长的调控策略提供数学模型,直观、高效展现调控水平,为科研人员对污染物胁迫下外源化学调控剂对水稻幼苗生长的调控策略提供了科学有效的评估方法,为后续关键转录因子功能的挖掘和验证指明了方向。
附图说明
[0025]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0026]
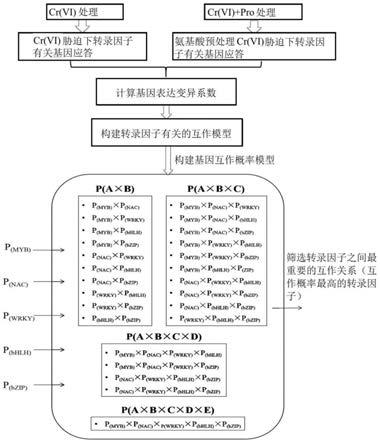
图1是本发明实施例的基因互作概率模型的构建过程。
[0027]
图2是本发明实施例cr(vi)对照组和cr(vi)+pro试验组水稻幼苗的tfs相关基因差异表达情况。
具体实施方式
[0028]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0029]
实施例
[0030]
植物幼苗的准备:
[0031]
水稻种子在水中浸泡12小时,然后浸泡后的水稻种子放入一次性纸杯中进行沙土培养,种植密度约水稻30~40颗/杯。培养在人工气候箱中进行,温度为25℃,湿度为65%,光照强度7000lux。每天浇灌改良后的iso8692营养液,成分如表1所示。水稻生长16天后,将水稻幼苗根部的沙土清洗干净,选取个体大小均匀一致的水稻幼苗备用。
[0032]
表1改良的iso8692营养液成分表
[0033]
序号试剂浓度序号试剂浓度1kno32823.9μmol/l8h3bo32992.1nmol/l2mgcl2·
6h2o59.0μmol/l9mncl2·
4h2o2097.0nmol/l3cacl2·
2h2o122.4μmol/l10na2moo4·
2h2o28.9nmol/l4mgso4·
7h2o60.9μmol/l11cuso4·
2h2o0.1nmol/l5kh2po4246.0μmol/l12znso422.0nmol/l6nahco31785.5μmol/l13cocl2·
6h2o6.3nmol/l7fe-edta10.0μmol/l
ꢀꢀꢀ
[0034]
实验设计:
[0035]
选定的水稻幼苗在以下处理溶液中培养:
[0036]
空白组:将水稻幼苗放置于50ml锥形瓶中,并加入50ml改良的iso8692营养液。锥形瓶都用锡箔纸包裹做避光处理,最大限度地减少水分流失并抑制藻类生长。每个处理有4个生物学重复,暴露时间为2天。
[0037]
cr(vi)对照组:将水稻幼苗放置于50ml锥形瓶中,并加入50ml改良的iso8692营养液,并向锥形瓶中添加不同质量的k2cro4,使得锥形瓶中形成不同浓度的cr(vi)溶液,cr(vi)溶液的浓度分别为0、2.0mg/l、8.0mg/l和16.0mg/l。锥形瓶都用锡箔纸包裹做避光处理,最大限度地减少水分流失并抑制藻类生长。每个处理有4个生物学重复,暴露时间为2天。
[0038]
cr(vi)+pro(脯氨酸)试验组:将水稻幼苗放置于50ml锥形瓶中,并加入50ml改良的iso8692营养液,并向锥形瓶中添加1mm的脯氨酸pro,再向锥形瓶中添加不同质量的k2cro4,使得锥形瓶中形成不同浓度的cr(vi)溶液,cr(vi)溶液的浓度分别为0、2.0mg/l、8.0mg/l和16.0mg/l。锥形瓶都用锡箔纸包裹做避光处理,最大限度地减少水分流失并抑制藻类生长。每个处理有4个生物学重复,暴露时间为2天。
[0039]
利用水稻基因芯片分析tfs有关基因的表达:各处理组的水稻幼苗暴露2d后,分别从空白组、cr(vi)对照组、cr(vi)+pro试验组收集水稻幼苗的根组织和叶片组织,分别分离纯化各处理组中根组织和叶片组织的rna。采用安捷伦4
×
44k水稻基因芯片测定各处理组的水稻基因表达谱,如图2所示。水稻基因表达谱中差异表达基因(degs)的阈值设定为各cr(vi)对照组或cr(vi)+pro试验组与空白组之间的对应基因表达的倍数变化(fc)为《0.5或》2.0,且p《0.05。
[0040]
通过下述4个水稻基因数据库,在水稻基因芯片中筛选出涉及五种tfs的基因,即myb(74个基因)、nac(89个基因)、wrky(56个基因)、bhlh(132个基因)、bzip(52个基因):
[0041]
rgap,http://rice.plantbiology.msu.edu/analyses_search_blast.shtml;
[0042]
crtc,http://www.ricedata.cn/gene/index.htm;
[0043]
rap-db,http://rapdb.dna.affrc.go.jp/;
[0044]
tair,http://www.arabidopsis.org/,v10.0。
[0045]
基因表达变异系数联合基因互作概率模型构建
[0046]
建立基因互作概率模型,研究cr(vi)胁迫水稻tfs相关基因在pro介导下的复杂性和功能多样性。如图1所示,基因互作概率模型的构建过程,包括以下步骤:
[0047]
(1),通过水稻基因芯片分别对于空白组、cr(vi)对照组和cr(vi)+pro试验组水稻幼苗各类tfs的基因数据进行分析和标准化处理(上海伯豪生物技术公司完成),得到空白组、cr(vi)对照组和cr(vi)+pro试验组水稻幼苗的各类tfs基因的标准信号值;
[0048]
(2),cr(vi)对照组和cr(vi)+pro试验组水稻幼苗的各类tfs基因的标准信号值与空白组对应的tfs基因标准信号值的比值即为该基因的差异表达倍数(fc),分别得到cr(vi)胁迫水稻幼苗的tfs相关基因差异表达的倍数变化fc
cr
,pro介导cr(vi)胁迫水稻幼苗的tfs相关基因差异表达的倍数变化fc
cr+pro
;通过fc
cr+pro
与fc
cr
计算得到cr(vi)+pro试验组相对于cr(vi)对照组的基因表达变异系数gevcs,用于评价pro介导cr(vi)胁迫水稻幼苗对tfs相关基因表达的影响,如式(1)所示:
[0049][0050]
设置基因表达变异系数gevcs的阈值为25%,gevcs大于25%表示显著促进表达;gevcs小于-25%表示显著抑制表达。
[0051]
筛选出cr(vi)+pro试验组水稻幼苗根组织和叶片组织中的各类tfs相关基因(总个数为n
total
)中显著促进表达(gevcs》25%)的基因个数和显著抑制表达(gevcs《-25%)的基因个数,结果如表2所示:
[0052]
表2基于gevcs计算得到cr(vi)+pro试验组水稻幼苗的各类tfs中显著促进表达以及显著抑制表达基因的数量
[0053][0054][0055]
(3),利用string网络在线数据库(https://version-10-5.string-db.org/),对筛选出的cr(vi)+pro试验组水稻幼苗的各类tfs相关基因中显著促进表达和显著抑制表达的基因进行分析,构建cr(vi)+pro试验组水稻幼苗的各类tfs相关基因的网络互作图。
[0056]
通过输入筛选基因的标识符(id),string根据其数据库收集的互作关系来匹配输
入基因,基因之间互作关系越复杂,关联系数分值越高,基因之间互作关系用cytoscape呈现出来即为网络互作图:
[0057]
统计cr(vi)+pro试验组水稻幼苗的各类tfs相关基因的网络互作图中存在高度关联的显著促进表达的关键基因个数,以及显著抑制表达的关键基因个数,如表3所示:
[0058]
表3网络互作图中各类tfs中存在的显著促进/抑制表达关键基因的个数
[0059][0060][0061]
(4),根据网络互作图中显著促进表达的关键基因个数n
promotion
、显著抑制表达的关键基因个数n
repression
分别与cr(vi)+pro试验组水稻幼苗的各类tfs相关基因总数n
total
的比值,分别得到网络互作图中各类tfs中显著促进表达的关键基因的发生概率p
(tfs-pro)
以及各类tfs中显著抑制表达的关键基因的发生概率p
(tfs-rep)
,具体计算如式(2)、式(3)所示:
[0062]
[0063][0064]
统计网络互作图中各类tfs中显著促进表达的关键基因的发生概率p
(tfs-pro)
和显著抑制表达的关键基因的发生概率p
(tfs-rep)
,如表4所示:
[0065]
表4各类tfs中显著促进/抑制表达的关键基因的发生概率
[0066][0067][0068]
由于网络互作图的各类tfs中显著促进/抑制表达的关键基因的发生是相互独立的,即一类tfs显著促进/抑制表达的关键基因的发生不会影响另一类tfs显著促进/抑制表达的关键基因的发生,说明p
(bhlh)
、p
(nac)
、p
(bzip)
、p
(myb)
和p
(wrky)
是独立发生事件。
[0069]
通过网络互作图中任两种或两种以上的各类tfs中显著促进或抑制表达的关键基因的发生概率的乘积,计算得到网络互作图各类tfs中显著促进或抑制表达的关键基因的互作概率,计算如式(4)所示。
[0070][0071][0072][0073]
p(a
×b×c×d×
e)=p
(myb)
×
p
(nac)
×
p
(wrky)
×
p
(bhlh)
×
p
(bzip)
ꢀꢀꢀꢀꢀꢀꢀꢀ
(7);
[0074]
其中,p
(a
×
b)
表示任意两类tfs中显著促进/抑制表达的关键基因的互作概率,p
(a
×b×
c)
、p
(a
×b×c×
d)
和p
(a
×b×c×d×
e)
分别表示任意三类、四类和五类tfs中显著促进/抑制表达的关键基因的互作概率。
[0075]
网络互作图各类tfs中显著促进或抑制表达的关键基因的全部互作概率构成pro介导cr(vi)胁迫水稻幼苗的基因互作概率模型,用于分析和发现重金属胁迫下化学调控剂对水稻生长调控策略。通过基因互作概率模型评估pro介导cr(vi)胁迫水稻幼苗中显著促进/抑制表达的关键基因的互作概率随污染物浓度影响的变化规律以及水稻幼苗中显著促进/抑制表达的关键基因互相作用的发生组织,为污染物胁迫下外源化学调控剂对水稻幼苗生长的调控策略提供数学模型,直观、高效展现调控水平,为科研人员对污染物胁迫下外源化学调控剂对水稻幼苗生长的调控策略提供了科学有效的评估方法。
[0076]
本实施例试验例根组织和叶片组织的基因互作概率模型图表5和表6所示。
[0077]
表5叶片的基因互作概率模型结果
[0078][0079]
[0080]
表6根部的基因互作概率模型结果
[0081][0082][0083]
表5和表6的基因互作概率模型的结果表明:在根部组织中,显著促进表达的关键
基因:myb&nac、nac&wrky、wrky&bhlh、bhlh&bzip、myb&wrky&bzip和显著抑制表达的关键基因myb&nac、nac&wrky、wrky&bhlh、bhlh&bzip、myb&nac&bzip的互作概率较高。而在叶片组织中,显著促进表达的关键基因myb&nac、nac&wrky、wrky&bhlh、bhlh&bzip和显著抑制表达的关键基因myb&nac、myb&wrky、nac&wrky、wrky&bhlh、bhlh&bzip、myb&nac&wrky、myb&wrky&bzip的互作概率更高一些。
[0084]
两种水稻组织中显著促进表达的关键基因的互作概率随cr浓度的增加而增加,显著抑制表达的关键基因的互作概率随cr浓度的增加而降低,说明随着cr浓度的增加,显著促进/抑制表达的关键基因的相互作用的复杂性增加。两种水稻组织中显著促进表达的关键基因的互作概率普遍高于显著抑制表达的关键基因的互作概率,且显著促进表达的关键基因和显著抑制表达的关键基因在根部中的互作概率普遍高于叶片中的互作概率,这些结果表明,pro介导的水稻tfs中显著促进/抑制表达的关键基因对cr(vi)胁迫调控主要发生在水稻根部中。
[0085]
需要说明的是,在本技术中,诸如第一、第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个
……”
限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
[0086]
本说明书中的各个实施例均采用相关的方式描述,各个实施例之间相同相似的部分互相参见即可,每个实施例重点说明的都是与其他实施例的不同之处。
[0087]
以上所述仅为本发明的较佳实施例而已,并非用于限定本发明的保护范围。凡在本发明的精神和原则之内所作的任何修改、等同替换、改进等,均包含在本发明的保护范围内。
