1.本发明涉及植物活性成分提取技术领域,尤其涉及一种杨树皮精制类脂的萃取方法及其应用。
背景技术:
2.杨树(poplars)即杨属(populus),属杨柳科(salicaceae),包括白杨(sect.populus),黑杨(sect.aigeiros duby),青杨(sect.tacamhaca spach),大叶杨(sect.leucoides spach),胡杨(sect.turanga bge)。杨树木材不仅可用作建筑用材,制浆造纸,合成中密度纤维板和胶合板,而且是家具和乐器的好材料。在杨树木材加工过程中树皮通常不被利用,常采用机械方式剥皮后将树皮焚烧或作为废弃物。这样不仅造成了资源的极大浪费,而且还会引起环境污染。
3.据记载,杨树皮在古代医学中有非常重要的药用价值。《唐本草》中记载,杨树以皮入药称白杨,功效为祛风活络、散瘀止痛,用于风痹、四肢不遂、龋齿、疼痛损伤、瘀血肿痛等症。据《全国中草药汇编》第三版记载,杨树皮可入药且具多种功效,已被载入中国药典。
4.杨树皮类脂(poplar bark lipid,pbl)是从杨树皮中提取的纯天然物质,具有高度的生物学活性,有较好的应用前景。pbl外观是无色或浅黄色油状液体,富含大量维生素e(ve)、胡萝卜素以及大量的不饱和脂肪酸等生物活性物质。已有研究表明,胡萝卜素可以抑制多种肿瘤的增殖,包括肝癌、乳腺癌、肺癌、结肠癌、白血病等。维生素e作为重要的抗氧化剂,最新研究表明,作为食物或维生素补充剂摄取,可能降低肝癌风险。不饱和脂肪酸一直在防治肿瘤疾病中发挥重要的作用,可以抑制癌细胞增殖,并促进癌细胞凋亡。
5.中国专利cn93110260.x公开了一种从杨树皮中提取杨树皮类脂的方法,其工艺工程为杨树皮锯切、干燥、破碎、石油醚萃取、过滤、蒸除石油醚,该发明简单可行。中国专利cn201810206778.6公开了一种从杨树皮类脂通过石油醚冷浸、渗漉、减压浓缩得到杨树皮活性总类脂的方法。但以上两种方法选用的萃取剂均为石油醚,极性较小,得到的萃取液含有较多非极性无活性物质,且直接应用存在较大困难。
6.中国专利cn200910075808.5公开了另外一种杨树皮类脂的制备方法,该发明萃取时选用的萃取剂为石油醚+乙酸乙酯+二氯乙烷=(75~80)+(10~15)+(5~15),该提取方法提高了杨树皮类脂的提取率,但其萃取液中包含了少量易溶于乙酸乙酯和二氯乙烷的极性略大的化学成分,类脂活性成分不够集中。
技术实现要素:
7.本发明的目的在于提供一种杨树皮精制类脂的萃取方法及其应用,本发明提取得到的杨树皮类脂活性成分含量高,且具有良好抗肿瘤活性。
8.为了实现上述发明目的,本发明提供以下技术方案:
9.本发明提供了一种杨树皮精制类脂的萃取方法,包括以下步骤:
10.将杨树皮粗提类脂和萃取剂混合,分层,得到含有杨树皮精制类脂的上层清液;所
述萃取剂选自乙酸乙酯、氯仿和二甲基亚砜中的一种或几种。
11.优选的,所述杨树皮粗提类脂的制备方法包括:将杨树皮经石油醚或环己烷提取,得到杨树皮粗提类脂。
12.本发明还提供了上述方案所述的萃取方法得到的杨树皮精制类脂在制备抗肿瘤的药物、抗肿瘤的增效剂或者减轻抗肿瘤毒副作用的制剂中的应用。
13.优选的,所述抗肿瘤的药物还包括其他的抗肿瘤活性成分。
14.优选的,所述其他的抗肿瘤活性成分包括以下成分中的一种或几种:白消安、噻替派、苯丁酸氮芥、环磷酰胺、雌二醇氮芥磷酸钠、异环磷酰胺、盐酸氮芥、美法仑、卡氮芥、罗氮芥、链脲霉素、卡铂、顺铂、氨甲喋呤钠、克拉屈滨、巯基嘌呤、硫鸟嘌呤、阿糖孢苷、羟基脲、柔红霉素、盐酸阿霉素、盐酸表柔比星、盐酸伊达比星、放线菌素d、硫酸博莱霉素、丝裂霉素、米托坦、盐酸米托蒽醌、依托泊苷、替尼泊苷、多西他赛、紫杉醇、硫酸长春花碱、硫酸长春新碱、硫酸长春地辛、酒石酸长春瑞宾、六甲蜜胺、安丫啶、i-门冬酰胺酶、达卡巴嗪、磷酸氟达拉滨、卟菲尔钠、盐酸丙卡巴肼、维a酸、苏拉明、tnp 470和沙利度胺。
15.优选的,所述增效剂包括化疗增效剂或放疗增效剂。
16.优选的,所述抗肿瘤包括抑制肿瘤细胞生长、促进肿瘤细胞凋亡、诱导肿瘤细胞分化或者降低肿瘤迁移率。
17.优选的,所述肿瘤包括肝癌、肺癌、卵巢癌、宫颈癌、结肠癌、乳腺癌或白血病。
18.优选的,所述药物、增效剂或者减轻抗肿瘤毒副作用的制剂的剂型包括口服制剂、注射剂、气雾剂或栓剂。
19.本发明提供了一种杨树皮精制类脂的萃取方法,具体是将杨树皮粗提类脂和萃取剂混合分层,得到含有杨树皮精制类脂的上层清液;所述萃取剂选自乙酸乙酯、氯仿和二甲基亚砜中的一种或几种。本发明对杨树皮粗提类脂进行进一步萃取精制,除掉部分非极性杂质,提高活性成分含量,可以得到质量更好的杨树皮类脂。经检测,本发明方法得到的杨树皮精制类脂中β胡萝卜素含量≥0.95mg/kg,α-生育酚≥13.50mg/100g,亚油酸的质量浓度≥70.00%,亚麻酸的质量浓度≥8.00%,油酸的质量浓度≥3.00%。
20.本发明得到的精制类脂比粗提类脂具有更好具有显著抗肿瘤活性,且能够作为抗肿瘤的增效剂和减轻抗肿瘤治疗的毒副作用,对制备抗肿瘤药物,尤其是抗肝癌、胃癌、乳腺癌、宫颈癌、结肠癌、白血病等抗肿瘤药物具有重要的意义。此外,本发明的提取方法提取分离的产品纯度高,质量易控,抗肿瘤药理作用更强、抗肿瘤治疗疗效高、毒副作用更低。
附图说明
21.图1是杨树皮精制类脂对肿瘤细胞周期分布的影响;
22.图2是杨树皮精制类脂对肿瘤细胞凋亡的影响。
具体实施方式
23.本发明提供了一种杨树皮精制类脂的萃取方法,包括以下步骤:
24.将杨树皮粗提类脂和萃取剂混合,分层,得到含有杨树皮精制类脂的上层清液;所述萃取剂选自乙酸乙酯、氯仿和二甲基亚砜中的一种或几种。
25.在本发明中,所述杨树皮优选的来源于新鲜杨树皮,所述新鲜杨树皮优选的经过
清洗、干燥和粉碎处理;本发明具体实施过程中,将新鲜杨树皮依次净选、淘洗、阴干、切块、烘干、粉粹,得到符合《中国药典》规定的粉末。
26.在本发明中,所述杨树皮来源的杨树的品种优选的包括小叶杨、毛白杨、小白杨和棉白杨中的一种或几种。在本发明中,所述杨树皮优选为新鲜的杨树皮;所述杨树皮不包括晒干或已霉烂的杨树皮。在本发明中,所述杨树皮来源的杨树的树龄优选为30~40年。
27.在本发明中,所述杨树皮粗提类脂的制备方法优选的包括:将杨树皮经石油醚或环己烷提取,得到杨树皮粗提类脂。本发明对所述杨树皮粗提类脂的提取方法没有特殊限制,采用本领域常规提取方法即可。在本发明中,所述杨树皮粗提类脂优选的采用中国专利cn 93110260.x或cn 201810206778.6所述的技术方法获得;或者,所述杨树皮粗提类脂采用以下方法制备得到:将杨树皮和粗提萃取剂混合进行萃取,得到萃取液;对所述萃取液进行减压浓缩至恒重,得到杨树皮粗提类脂。在本发明中,所述粗提萃取剂为石油醚或环己烷;所述杨树皮优选为符合《中国药典》规定的杨树皮粉末;所述杨树皮粉末优选的是由杨树皮依次经净选、淘洗、阴干、切块、烘干和粉粹得到。在本发明中,所述萃取的方式优选的包括:渗漉、加热回流、超声或微波辅助提取;所述萃取的温度不高于粗提萃取剂的沸点。
28.在本发明中,所述杨树皮粗提类脂和萃取剂混合的时间优选为10~30min,更优选为15~25min;本发明对所述混合的方式没有特殊限制,优选为水浴、超声或微波辅助混合。
29.在本发明中,所述分层的方式优选为静置分层或者离心分层;所述离心分层的转速优选为1500~4500rpm,更优选为2500~3500rpm所述离心分层的时间优选为15~30min,更优选为20~25min。
30.本发明在得到上层清液后,优选的还包括对所述上层清液进行浓缩;当所述萃取剂为乙酸乙酯或氯仿时,所述浓缩的方式优选为减压浓缩;当所述萃取剂为二甲基亚砜时,所述浓缩的方式优选为冷冻干燥浓缩。
31.本发明还提供了上述方案所述的萃取方法得到的杨树皮精制类脂,所述杨树皮精制类脂的β胡萝卜素含量≥0.95mg/kg、α-生育酚≥13.50mg/100g、亚油酸的质量浓度≥70.00%、亚麻酸的质量浓度≥8.00%、油酸的质量浓度≥3.00%。
32.本发明还提供了上述方案所述的萃取方法得到的杨树皮精制类脂在制备抗肿瘤的药物、抗肿瘤的增效剂或者减轻抗肿瘤毒副作用的制剂中的应用。
33.在本发明中,所述抗肿瘤的药物优选的还包括其他的抗肿瘤活性成分;所述其他的抗肿瘤活性成分包括以下成分中的一种或几种:白消安、噻替派、苯丁酸氮芥、环磷酰胺、雌二醇氮芥磷酸钠、异环磷酰胺、盐酸氮芥、美法仑、卡氮芥、罗氮芥、链脲霉素、卡铂、顺铂、氨甲喋呤钠、克拉屈滨、巯基嘌呤、硫鸟嘌呤、阿糖孢苷、羟基脲、柔红霉素、盐酸阿霉素、盐酸表柔比星、盐酸伊达比星、放线菌素d、硫酸博莱霉素、丝裂霉素、米托坦、盐酸米托蒽醌、依托泊苷、替尼泊苷、多西他赛、紫杉醇、硫酸长春花碱、硫酸长春新碱、硫酸长春地辛、酒石酸长春瑞宾、六甲蜜胺、安丫啶、i-门冬酰胺酶、达卡巴嗪、磷酸氟达拉滨、卟菲尔钠、盐酸丙卡巴肼、维a酸、苏拉明、tnp 470和沙利度胺。
34.在本发明中,所述增效剂优选的包括化疗增效剂或放疗增效剂。
35.在本发明中,所述抗肿瘤的药物的作用优选的包括抑制肿瘤细胞生长、促进肿瘤细胞凋亡、诱导肿瘤细胞分化或者降低肿瘤迁移率。
36.在本发明中,所述肿瘤优选的包括肝癌、肺癌、卵巢癌、宫颈癌、结肠癌、乳腺癌或
白血病。
37.在本发明中,所述抗肿瘤的药物、抗肿瘤的增效剂或者减轻抗肿瘤毒副作用的制剂的剂型优选的包括口服制剂或非肠道给药的剂型;所述或非肠道给药的剂型优选的包括注射剂、气雾剂或栓剂;所述口服制剂优选的包括片剂、丸剂、胶囊剂、颗粒剂或滴丸剂。在本发明中,所述抗肿瘤的药物、抗肿瘤的增效剂或者减轻抗肿瘤毒副作用的制剂的剂型包括液体剂型或固体剂型;所述液体剂型优选的包括真溶液类、胶体类、微粒剂型、乳剂剂型、混悬剂型;所述固体剂型优选的包括片剂、胶囊、气雾剂、丸剂、粉剂、颗粒剂、栓剂或冻干粉针剂。
38.在本发明中,所述抗肿瘤的药物、抗肿瘤的增效剂或者减轻抗肿瘤毒副作用的制剂的治疗对象包括人和动物。本发明制备得到的杨树皮精制类脂可用于畜禽(兽用)肿瘤治疗。
39.下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
40.实施例1
41.(1)杨树皮类脂的精制
42.a、选择新鲜的杨树皮,不得混有其他树种的树皮和杂质,允许用小叶杨、毛白杨、小白杨、棉白杨树皮进行单独或混合,不允许用晒干或已霉烂的杨树皮。将1kg杨树皮净选、清洗、阴干、切块、烘干、粉碎得到符合《中国药典》规定的粉末。将杨树皮粉末按照加入2.5l石油醚中,超声辅助萃取,温度30℃,萃取3次,每次萃取30min,过滤,得到总萃取液。将总萃取液用旋转蒸发仪进行浓缩,得到杨树皮粗提类脂167.35g。
43.b、将杨树皮粗提类脂加入200ml乙酸乙酯中,搅拌、混悬,超声辅助溶解30min,温度30℃。静置,分层,弃掉下层乳化层,取上清液,旋转蒸发仪进行浓缩,即得杨树皮精制类脂125.24g。
44.(2)杨树皮精制类脂的成分分析
45.参照gb/t 5009.83-2016《食品安全国家标准食品中胡萝卜素的测定》提供的方法对类脂中β胡萝卜素的含量进行检测,得到杨树皮精制类脂的β胡萝卜素含量为1.57mg/kg,参照gb 5009.82-2016《食品安全国家标准食品中维生素a、d、e的测定》提供的方法对类脂中α-生育酚的含量进行检测,得到杨树皮精制类脂的α-生育酚的含量为18.00mg/100g.参照gb/t 5009.168-2016《食品安全国家标准食品中脂肪酸的测定》提供的方法对类脂中脂肪酸的含量进行检测,得到杨树皮精制类脂的亚油酸含量为71.90%,亚麻酸含量为8.85%,油酸含量为3.17%。
46.实施例2
47.(1)杨树皮类脂的精制
48.a、选择新鲜的杨树皮,不得混有其他树种的树皮和杂质,允许用小叶杨、毛白杨、小白杨、棉白杨树皮进行单独或混合。将1kg杨树皮净选、清洗、阴干、切块、烘干、粉碎得到符合《中国药典》规定的粉末。将杨树皮粉末按照加入2.5l环己烷中,微波辅助提取,提取3次,每次提取2h,过滤,得到总提取液。将总萃取液用旋转蒸发仪进行浓缩,得到杨树皮粗提
29、人卵巢癌细胞skov3、人类髓性白血病细胞株k562、人b细胞淋巴瘤细胞株bjab均有抗肿瘤作用,并且呈剂量依赖关系。不同浓度的杨树皮精制类脂对各种肿瘤细胞的ic50值见表1。
68.表1杨树皮精制类脂对不同肿瘤细胞生长抑制作用
[0069][0070][0071]
试验例2杨树皮精制类脂对肝癌h22小鼠模型抗肿瘤作用研究实验
[0072]
1、实验材料
[0073]
1.1试剂、药品与设备
[0074]
阳性对照药:奥沙利铂(江苏恒瑞医药股份有限公司,批号10040821)。
[0075]
受试品:杨树皮精制类脂
[0076]
1.2动物及瘤的制备
[0077]
balb/c雄鼠30只,体重18~22g,购于北京维通利华。在spf级动物房饲养,温度为20~25℃,相对湿度40%~70%,每笼6只,照明时间12h,定时定量添加饲料,自由饮水,每日更换垫料。
[0078]
移植性肿瘤细胞:小鼠h22肝癌细胞购于北京北纳创联生物技术研究院,注射106个细胞至腹腔进行传代,7~10天后收集腹水中肝癌细胞行皮下接种术。
[0079]
2、实验方法
[0080]
2.1体内抑瘤效果评价
[0081]
肿瘤的传代保存:h22肝癌小鼠腹腔接种后取腹水传代保存。
[0082]
肿瘤接种:取腹水传代第10日的h22肝癌荷瘤小鼠,脱颈椎处死小鼠,消毒腹部皮肤,以无菌注射器吸取乳白色腹水,以注射用生理盐水调整肿瘤细胞浓度为1
×
106细胞/ml。以酒精棉球消毒balb/c小鼠右侧腋下皮肤,于皮下接种上述瘤细胞悬液0.2ml,常规饲养。
[0083]
分组和给药:荷瘤小鼠30只,按体重随机分为5组,每组6只,分别为模型对照组、奥沙利铂组、杨树皮精制类脂低剂量组(5mg/kg)、杨树皮精制类脂中剂量组(50mg/kg)、杨树皮精制类脂高剂量组(500mg/kg)。小鼠接瘤后第二日开始按表2所示给药剂量和方式给药,奥沙利铂组仅于接瘤后第二日给药一次,模型组每日灌胃给生理盐水一次,其余各组每日灌胃给药一次连续10天,给药体积为0.2ml/10g体重。末次给药24小时后,脱颈椎处死小鼠,剥取瘤组织称重。疗效采用瘤重抑制率(%)来评价,组间采用anova检验进行统计学比较。
个细胞至腹腔进行传代,7~10天后收集腹水中肝癌细胞行皮下接种术。
[0100]
2、实验方法
[0101]
2.1体内抑瘤效果评价
[0102]
肿瘤的传代保存:h22肝癌小鼠腹腔接种后取腹水传代保存。
[0103]
肿瘤接种:取腹水传代第10日的h22肝癌荷瘤小鼠,脱颈椎处死小鼠,消毒腹部皮肤,以无菌注射器吸取乳白色腹水,以注射用生理盐水调整肿瘤细胞浓度为1
×
106细胞/ml。以酒精棉球消毒balb/c小鼠右侧腋下皮肤,于皮下接种上述瘤细胞悬液0.2ml,常规饲养。
[0104]
分组和给药:荷瘤小鼠30只,按体重随机分为5组,每组6只,分别为模型组、奥沙利铂组、奥沙利铂+杨树皮精制类脂低剂量组(5mg/kg)、奥沙利铂+杨树皮精制类脂中剂量组(50mg/kg)、奥沙利铂+杨树皮精制类脂高剂量组(50mg/kg)。小鼠接瘤后第二日开始按表4所示给药剂量和方式给药,奥沙利铂组仅于接瘤后第二日给药一次,模型组每日灌胃给生理盐水一次,其余各组每日灌胃给药一次连续10天,给药体积为0.2ml/10g体重。末次给药24小时后,脱颈椎处死小鼠,剥取瘤组织称重。疗效采用瘤重抑制率(%)来评价,组间采用anova检验进行统计学比较。
[0105][0106]
表4杨树皮精制类脂联合奥沙利铂体内抑瘤效果评价实验给药剂量和方式
[0107][0108]
3、实验结果
[0109]
与模型组比较,各组肿瘤重量均有所减少,以肿瘤生长抑制率进行比较,杨树皮精制类脂与奥沙利铂联用,具有较强的抑制肿瘤效果,并且呈剂量依赖性。
[0110]
表5杨树皮精制类脂对肿瘤抑制效果比较
[0111]
组别体重(g)瘤重(g)抑瘤率(%)模型对照组21.5
±
1.62.32
±
0.23 奥沙利铂组22.3
±
1.10.91
±
0.1960.8奥沙利铂+杨树皮精制类脂低剂量组20.5
±
1.80.85
±
0.1463.4奥沙利铂+杨树皮精制类脂中剂量组21.7
±
2.10.66
±
0.1171.6
奥沙利铂+杨树皮精制类脂高剂量组20.9
±
2.60.54
±
0.1676.7
[0112]
试验例4杨树皮精制类脂对5种裸鼠移植瘤的抗肿瘤作用研究实验
[0113]
1、实验动物
[0114]
blab/c雌性裸鼠购自北京维通利华实验动物技术有限公司,共150只,6~7周龄,体重18~20g。裸鼠均饲养于spf级别动物房。
[0115]
小鼠皮下肿瘤细胞接种:分别取对数生长期的人肺癌细胞(a549)、人卵巢癌细胞(skov-3)、人宫颈癌上皮细胞(hela)、人结肠癌细胞(ht-29)、人乳腺癌细胞(mcf-7)用pbs制成细胞悬液(1
×
107个/ml),每只接种2
×
106个细胞,接种体积为200μl,接种在blab/c裸鼠腋部皮下。将选取的肿瘤组织放入玻璃匀浆器中,用无菌生理盐水研磨后,经滤网过滤成单个的细胞悬液,用台盼蓝染色法计数活细胞数,每只裸鼠腋下接种200μl(含1
×
106个细胞)。
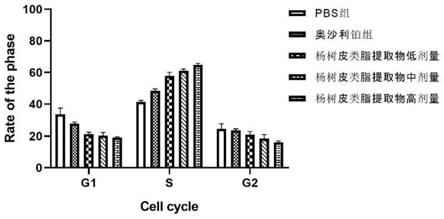
[0116]
2、实验分组及方法
[0117]
挑选肿瘤大小一致的裸鼠,将裸鼠称重随机分组,每种肿瘤细胞接种的裸鼠均有阴性对照组、阳性对照组、杨树皮精制类脂高剂量组、杨树皮精制类脂中剂量组、杨树皮精制类脂低剂量组各5只裸鼠。药物浓度及具体分组如下:(1)阴性对照组:灌胃200μl生理盐水,一次:(2)阳性药物对照组:奥沙利铂,30mg/kg进行灌胃一次;(3)杨树皮精制类脂高剂量组:30mg/kg进行灌胃;(4)杨树皮精制类脂中剂量组:30mg/kg进行灌胃;(5)杨树皮精制类脂低剂量组:30mg/kg进行灌胃。杨树皮精制类脂每天灌胃一次,连续注射5天,于未次给药24h后,取出瘤块,测定瘤重,计算肿瘤抑制率。
[0118]
3、实验结果
[0119]
3.1杨树皮精制类脂对a549裸鼠移植瘤的抑制作用。试验结果见表6。
[0120]
表6杨树皮精制类脂对a549裸鼠移植瘤的抑制作用试验结果(x
±
sd)
[0121]
组别剂量(mg/kg)体重(g)瘤重(g)抑制率(%)pbs组023.36
±
0.362.43
±
0.21 奥沙利铂组1019.26
±
0.150.96
±
0.1260.59杨树皮类脂提取物521.04
±
0.301.89
±
0.2322.01杨树皮类脂提取物5021.52
±
0.201.64
±
0.1532.56杨树皮类脂提取物50022.60
±
0.160.90
±
0.1963.07
[0122]
3.2杨树皮精制类脂对skov-3裸鼠移植瘤的抑制作用。试验结果见表7。
[0123]
表7杨树皮精制类脂对skov-3裸鼠移植瘤的抑制作用试验结果(x
±
sd)
[0124]
组别剂量(mg/kg)体重(g)瘤重(g)抑制率(%)pbs组021.40
±
0.453.23
±
0.06奥沙利铂组1018.69
±
0.141.87
±
0.2742.17杨树皮类脂提取物519.55
±
0.252.47
±
0.1523.59杨树皮类脂提取物5019.48
±
0.472.17
±
0.4032.88杨树皮类脂提取物50019.12
±
0.391.98
±
0.1938.76
[0125]
3.3杨树皮精制类脂对hela裸鼠移植瘤的抑制作用。试验结果见表8。
[0126]
表8杨树皮精制类脂对hela裸鼠移植瘤的抑制作用试验结果(x
±
sd)
[0127]
组别剂量(mg/kg)体重(g)瘤重(g)抑制率(%)pbs组021.95
±
0.253.51
±
0.25奥沙利铂组1017.84
±
0.201.77
±
0.1349.63杨树皮类脂提取物522.13
±
0.352.65
±
0.1524.39杨树皮类脂提取物5020.34
±
0.442.15
±
0.1738.63杨树皮类脂提取物50020.11
±
0.521.85
±
0.1347.18
[0128]
3.4杨树皮精制类脂对ht-29裸鼠移植瘤的抑制作用。试验结果见表9。
[0129]
表9杨树皮精制类脂对ht-29裸鼠移植瘤的抑制作用试验结果(x
±
sd)
[0130]
组别剂量(mg/kg)体重(g)瘤重(g)抑制率(%)pbs组021.96
±
0.202.51
±
0.15奥沙利铂组1017.93
±
0.350.88
±
0.1164.78杨树皮类脂提取物520.37
±
0.381.65
±
0.2334.42杨树皮类脂提取物5020.28
±
0.251.27
±
0.2349.48杨树皮类脂提取物50020.92
±
0.280.90
±
0.1364.22
[0131]
3.5杨树皮精制类脂对mcf-7裸鼠移植瘤的抑制作用。试验结果见表10。
[0132]
表10杨树皮精制类脂对mcf-7裸鼠移植瘤的抑制作用试验结果(x
±
sd)
[0133]
组别剂量(mg/kg)体重(g)瘤重(g)抑制率(%)pbs组022.50
±
0.733.97
±
0.27 奥沙利铂组1019.92
±
0.192.00
±
0.0849.67杨树皮类脂提取物521.15
±
0.483.09
±
0.1822.07杨树皮类脂提取物5021.85
±
0.452.56
±
0.1635.62杨树皮类脂提取物50022.09
±
0.471.96
±
0.1550.73
[0134]
试验例5杨树皮精制类脂对人类髓性白血病k562细胞周期的影响研究
[0135]
1、实验材料
[0136]
受试物:杨树皮精制类脂(提取方法见本发明实施例1)。
[0137]
实验细胞:人类髓性白血病细胞株k562,细胞来源于atcc细胞库。
[0138]
试剂耗材:rpmi 1640,hank
′
s液、胎牛血清(fbs)购于gibco公司,dmso购于sigma公司,dna含量检测试剂盒(细胞周期)购自索莱宝。rpmi 1640完全培养基:无血清rpmi 1640+10%fbs。
[0139]
2、实验方法
[0140]
细胞培养均在37℃5%co2条件下培养,当细胞贴壁达70%~80%融合后,收集对数期细胞,调节细胞悬液浓度为1
×
105个/ml,取2ml接种于6孔板,置于37℃5%co2培养过夜。
[0141]
实验组加入含有不同浓度受试样品及阴性对照,每个浓度设3个平行孔。于37℃5%co2处理24h后,收集各组细胞。pbs洗涤三次,并用100μlpbs重悬,按细胞周期试剂盒说明书对各组细胞4℃孵育30min,流式细胞术检测细胞周期,激光光波波长为488nm,每个样本收集50000个细胞。modifit软件进行细胞周期分析。
[0142]
3,实验结果
[0143]
杨树皮精制类脂对k562肿瘤细胞周期分布均有影响,并能引起k562细胞s周期的阻滞,抑制肿瘤细胞的增殖。不同浓度的杨树皮精制类脂对k562细胞周期分布的影响见图1。
[0144]
试验例6杨树皮精制类脂对人b细胞淋巴瘤bjab细胞凋亡的影响研究
[0145]
1、实验材料
[0146]
受试物:杨树皮精制类脂(提取方法见本发明实施例1)。
[0147]
实验细胞:人b细胞淋巴瘤细胞株bjab,细胞来源于atcc细胞库。
[0148]
试剂耗材:rpmi 1640,hank's液、胎牛血清(fbs)购于gibco公司,dmso购于sigma公司,annexin v fitc/pi凋亡检测试剂盒购自北京索莱宝。rpmi 1640完全培养基:无血清rpmi 1640+10%fbs。
[0149]
2、实验方法
[0150]
细胞培养均在37℃5%co2条件下培养,当细胞贴壁达70%~80%融合后,收集对数期细胞,调节细胞悬液浓度为1
×
105个/ml,取2ml接种于6孔板,置于37℃5%co2培养过夜。
[0151]
实验组加入含有不同浓度受试样品及阴性对照,每个浓度设3个平行孔。于37℃ 5%co2处理24h后,收集各组细胞。pbs洗涤三次,并用100μl pbs重悬,按照annexin-fitc/pi双标记流式细胞术检测细胞凋亡,fitc最大激发波长为488nm,最大发射波长525nm,fitc的绿色荧光在fl1通道检测;pi-dna复合物的最大激发波长为535nm,最大发射波长为615nm,pi的红色荧光在fl2通道检测。每个样本收集50000个细胞。flowjo软件进行细胞凋亡分析,绘制双色散点图,fitc为横坐标,pi为纵坐标。其中,左下象限(ll)为正常(活)细胞(annexin v-/pi-),右下象限(lr)为早期凋亡细胞(annexin v+/pi-),右上象限(ur)为晚期凋亡细胞(annexin v+/pi+),根据每个象限的数据计算出活细胞和凋亡细胞百分率。
[0152]
3、实验结果
[0153]
杨树皮精制类脂可引起bjab肿瘤细胞的细胞凋亡,并呈现药物浓度梯度剂量依赖性。不同浓度的杨树皮精制类脂对bjab细胞凋亡的影响见图2。
[0154]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
