d-ala
2-gip用于制备治疗焦虑症药物的应用
技术领域
1.本发明属于医药技术领域,具体为d-ala
2-gip用于制备治疗焦虑症药物的应用。
背景技术:
2.焦虑症是临床最普遍的精神障碍之一,大样本人群调查显示:高达30%的人在一生中的某段时间都曾遭到焦虑症困扰。焦虑症常表现为与所处环境不对等的担心和惊恐,常伴有躯体、认知和行为障碍,给患者生活和社会均带来极大负担。除部分心理干预有效外,大多焦虑症患者仍需长期药物治疗,目前推荐的一线药物为5-羟色胺再摄取抑制剂、5-羟色胺和去甲肾上腺素再摄取抑制剂,苯二氮类等药物可作为二线辅助应用。然而临床应用中发现,不少患者对现有药物治疗无效,部分治疗有效患者停药后出现症状反复发作的现象,甚至有些人症状的严重程度超过治疗前。此外,目前临床使用的药物长期应用会产生患者无法耐受的副作用。因此寻找焦虑症治疗新靶点是亟待解决的问题。
3.葡萄糖依赖性促胰岛素多肽(glucose-dependent insulinotropicpolypeptide,gip)又叫肠抑胃肽(gastric inhibitory polypeptide),是42个氨基酸组成的多肽,在体内主要由小肠粘膜k细胞产生。当血糖升高时,其能够促进胰岛素释放、抑制胃排空而降低血糖。然而内源性gip易被血浆中的二肽基肽酶-iv降解,其在人血浆中的半衰期仅为5min,啮齿类血浆半衰期短于2min。设计合成的耐酶长效类似物d-ala
2-gip血浆半衰期显著延长,d-ala
2-gip易穿透血脑屏障,有研究表明其可减少神经元凋亡,在神经退行性疾病中发挥保护作用,通过调节突触可塑性而改善学习记忆功能。
技术实现要素:
4.本发明的目的是提供d-ala
2-gip用于制备治疗焦虑症药物的应用,从而为焦虑症治疗提供一种新药物。
5.包括:
6.d-ala
2-gip用于制备治疗焦虑症药物的应用。
7.d-ala
2-gip用于制备治疗哺乳动物和/或人焦虑症药物的应用。
8.d-ala
2-gip用于制备治疗鼠焦虑症药物的应用。
9.d-ala
2-gip用于制备通过调节突触传递和抑制神经炎症来治疗疾病的药物的应用。
10.d-ala
2-gip用于制备通过调节突触传递和抑制神经炎症来治疗哺乳动物和/或人疾病的药物的应用。
11.一种治疗焦虑症的药物,其特征在于,所述药物的含有d-ala
2-gip。
12.可选的,所述的药物的剂型可以为片剂、颗粒剂、注射剂、丸剂、胶囊剂及常见药物剂型。
13.本发明的优点包括:
14.本发明的研究充分证明了在与情绪调节密切相关的前扣带回脑区焦虑小鼠gipr
表达显著高于正常小鼠,作为葡萄糖依赖性促胰岛素多肽(gip)的长效类似物,d-ala
2-gip腹腔注射或前扣带回脑区局部注射均能显著降低其焦虑水平,缓解焦虑症状,且不影响动物的运动功能,这些作用与d-ala
2-gip调节突触传递及抑制神经炎症反应有关。gip是小肠粘膜k细胞分泌的内源性多肽,在体内可降低升高的血糖,但其半衰期较短,作用维持时间短;d-ala
2-gip的半衰期显著延长,对正常血糖无降低作用,且易透过血脑屏障进入大脑发挥中枢效应,作为内源性多肽的类似物,其安全性良好,选择性强,特异性好,相较于其他在研治疗药物研究基础充分,研发周期可能更短。
附图说明
15.附图是用来提供对本公开的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本公开,但并不构成对本公开的限制。在附图中:
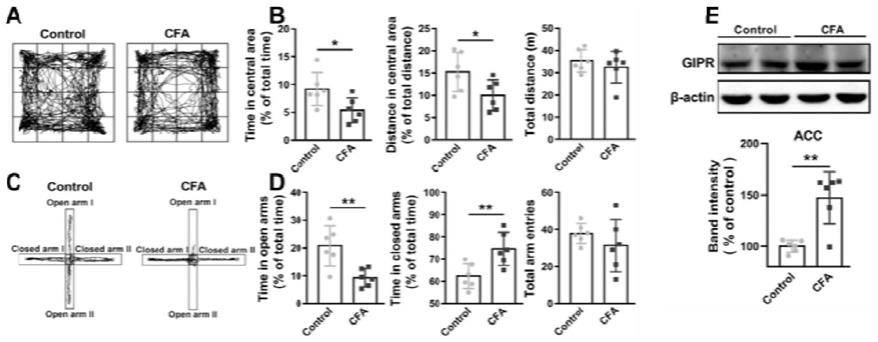
16.图1是小鼠足底注射完全弗氏佐剂(cfa)或生理盐水(control)两周后焦虑水平的检测及前扣带回脑区gipr的表达结果;其中a为旷肠实验轨迹图,b为小鼠在旷肠中央区域的活动时间(左)、中央区运动距离(中)和总的运动距离(右),c为高架十字迷宫轨迹图,d为小鼠在迷宫开臂中的停留时间(左)、闭臂中的停留时间(中)及进臂总次数(右),e为前扣带回脑区gipr蛋白表达情况;以上每组均为6只小鼠,*表示与control组相比统计学p《0.05,**表示与control组相比统计学p《0.01;
17.图2是葡萄糖依赖性促胰岛素多肽长效类似物d-ala
2-gip腹腔注射对小鼠焦虑水平的影响;a为各组小鼠旷肠实验轨迹图,其中d-ala
2-gip(图中简写d-ala2)和gipr抑制剂pro
3-gip(图中简写pro3)均在cfa足底注射的第7-14天给药;b、c和d分别为小鼠在旷肠中央区域的停留时间、中央区运动距离以及运动总距离;e为各组小鼠高架十字迷宫实验轨迹图,f、g和h分别为小鼠在十字迷宫开臂的停留时间、闭臂的停留时间以及进臂总次数;i为各组小鼠的血糖值。各实验每组均有8只小鼠,*表示横线下相关两组相比统计学p《0.05,**表示横线下相关两组统计学p《0.01,***表示横线下相关两组统计学p《0.001;
18.图3为前扣带回脑区局部注射d-ala
2-gip对小鼠焦虑水平的影响;a为实验的流程图,b为前扣带回局部注射位置示意图,c、d和e分别为小鼠在高架十字迷宫开臂中的停留时间、闭臂中的停留时间和进臂总次数。每组均7只小鼠,*表示横线下相关两组相比统计学p《0.05,**表示横线下相关两组统计学p《0.01,***表示横线下相关两组统计学p《0.001;
19.图4是评价d-ala
2-gip对前扣带回脑区突触传递关键分子表达的影响;a为各组小鼠前扣带回区谷氨酸ampa受体亚基glua1以及其831丝氨酸位点和845丝氨酸位点磷酸化(p-glua1-s831和p-glua1-s845)表达情况,b、c和d分别为glua1、p-glua1-s831和p-glua1-s845蛋白表达统计图。**表示横线下相关两组统计学p《0.01,***表示横线下相关两组统计学p《0.001,****表示横线下相关两组统计学p《0.0001;
20.图5评价d-ala
2-gip对前扣带回区域脑区突触传递的影响;a图为全细胞膜片钳记录的各组小鼠前扣带回区微小兴奋性突触后电流(mepscs),b图为各组mepscs频率累积曲线(左)和统计结果(右),c图为各组mepscs幅度累积曲线(左)和统计结果(右)。每组数据来自6只小鼠的12张脑片,*表示横线下相关两组相比统计学p《0.05,**表示横线下相关两组统计学p《0.01,****表示横线下相关两组统计学p《0.0001;
21.图6是评价d-ala
2-gip对前扣带回脑区趋化因子(受体)及炎性细胞因子表达的影
响;a为各组小鼠前扣带回趋化因子2(ccl2)及其受体(ccr2)mrna表达水平,b为趋化因子(cxc基序)配体1(cxcl1)及其受体(cxcr2)mrna表达水平,c、d和e分别为各组cxcl13/cxcr5、cx3cl1/cx3cr1及ccl4/ccr5的mrna的表达变化,f、g和h分别为各组小鼠前扣带回炎性因子tnf-α、il-1β及il-6的mrna的表达变化。每组均5只小鼠,*表示横线下相关两组相比统计学p《0.05,**表示横线下相关两组统计学p《0.01,***表示横线下相关两组统计学p《0.001,****表示横线下相关两组统计学p《0.0001;
22.图7是评价d-ala
2-gip对前扣带回脑区小胶质细胞活化的影响;a图为各组小鼠前扣带回区离子钙接头蛋白1(iba-1)的蛋白表达情况,b图为iba-1蛋白表达统计学结果,c图为前扣带回iba-1免疫荧光结果,d图为小胶质细胞胞体面积的统计结果,e图为小胶质细胞突起长度的统计结果。*表示横线下相关两组相比统计学p《0.05,**表示横线下相关两组统计学p《0.01,****表示横线下相关两组统计学p《0.0001。
具体实施方式
23.以下结合附图对本公开的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本公开,并不用于限制本公开。
24.d-ala
2-gip,葡萄糖依赖性促胰岛素多肽长效类似物,葡萄糖依赖性促胰岛素多肽(glucose-dependent insulinotropic polypeptide,gip)长效类似物d-ala
2-gip用于制备治疗焦虑症药物的应用。本发明的研究充分证明了焦虑小鼠前扣带回区域葡萄糖依赖性促胰岛素多肽受体(glucose-dependent insulinotropic polypeptide receptor,gipr)表达升高,作为gipr的长效激动剂,d-ala
2-gip腹腔注射及前扣带回脑区局部注射均能显著降低模型小鼠焦虑水平,缓解其焦虑症状,且不影响动物的运动功能,这些作用与其调节突触传递及抑制神经炎症反应有关。gip是小肠粘膜k细胞分泌的内源性多肽,在体内可降低升高的血糖,但其半衰期较短,作用维持时间短;d-ala
2-gip的半衰期显著延长,对正常血糖无降低作用,且易透过血脑屏障进入大脑发挥中枢效应,安全性良好,相较于其他在研治疗药物研究基础充分,研发周期可能更短。
25.发明人的研究显示,焦虑模型小鼠前扣带回gipr表达明显升高,葡萄糖依赖性促胰岛素多肽的长效类似物d-ala
2-gip能有效缓解小鼠的焦虑水平。据此,本发明首次将d-ala
2-gip用于制备治疗焦虑症药物的应用。经查阅文献,未见d-ala
2-gip对焦虑症患者或者模型动物的药理作用和治疗作用的报道。
26.本发明的研究充分证明了焦虑模型小鼠前扣带回脑区gipr表达显著高于正常小鼠,d-ala
2-gip腹腔注射或前扣带回局部注射均能有效降低动物的焦虑水平,且不影响动物的运动功能和血糖水平。d-ala
2-gip的抗焦虑作用与其调节前扣带回区的突触传递过程和抑制神经炎症有关。
27.为诱导小鼠焦虑模型,采用足底注射10μl 50%cfa的方法,在造模第15天采用旷场实验和高家十字迷宫实验检测其焦虑行为,发现模型小鼠较对照小鼠焦虑水平显著升高。
28.为评价d-ala
2-gip对模型小鼠焦虑水平的影响,在cfa注射后的第7-14天腹腔注射d-ala
2-gip(25nm/kg)或前扣带回局部注射d-ala
2-gip(1nm),每天一次,gipr抑制剂pro
3-gip在d-ala
2-gip给药前30分钟注射,在cfa注射后的第15天采用旷场实验和高家十字
迷宫实验检测各组小鼠焦虑行为,发现接受d-ala
2-gip药物注射的小鼠焦虑水平显著低于模型组。
29.为研究d-ala
2-gip发挥抗焦虑作用的原因,采用蛋白免疫印迹及全细胞膜片钳的方法,对各组小鼠前扣带回区域的突触传递及相关分子表达进行检测,发现d-ala
2-gip能够抑制前扣带回兴奋性突触传递。
30.为检测d-ala
2-gip对焦虑模型小鼠神经炎症的影响,采用荧光定量rt-pcr的方法检测各组小鼠前扣带回脑区相关趋化因子(受体)及炎性细胞因子的mrna水平变化,蛋白免疫印迹检测小胶质细胞标志物iba-1的表达变化,免疫荧光标记小胶质细胞探究其形态变化,发现d-ala
2-gip能有效抑制焦虑小鼠前扣带回区域的神经炎症。
31.下面通过具体实施例进一步解释本发明,但是本发明不仅限于实施例中。
32.1、本发明的研发思路及主要的创新点总结:
33.本发明首先确证焦虑模型小鼠前扣带回区域gipr的表达变化,然后考察d-ala
2-gip对模型小鼠焦虑行为的影响及药理作用机制。本发明发现腹腔注射或前扣带回局部给予d-ala
2-gip均能显著降低模型小鼠的焦虑水平,缓解焦虑症状,且不影响动物的运动功能和血糖水平。药理机制研究显示,d-ala
2-gip的抗焦虑作用是通过调节前扣带回脑区的突触传递及抑制神经炎症而实现的。
34.2、具体实施例:
35.小鼠右足底注射cfa建立焦虑模型,对照组给予等量生理盐水,需要接受d-ala
2-gip处理的小鼠在cfa注射后的第7-14天每天按照25nm/kg的量腹腔注射或者按1nm的量进行前扣带回局部注射,在第15天进行行为学实验,为减少动物的紧张感,每只小鼠在每天实验装置所在实验室接受实验操作员抚摸3min,连续三天。每个小鼠的检测结束后,用酒精清洗箱子内壁及地面,以免动物残留的气味对后续实验造成影响。研究内容如下:
36.实施例一:小鼠焦虑模型的建立及前扣带回脑区gipr的表达检测
37.大量证据表明,足底cfa注射可使小鼠表现出明显的焦虑样行为,可依此建立小鼠焦虑模型。本发明采用国际公认的经典旷场实验(open field test,oft)高架十字迷宫(elevated plus-maze test,epm)来检测小鼠焦虑样行为,主要利用小鼠对旷场中央区和高架十字迷宫开臂区的恐惧与新奇探索欲望之间的冲突紧张心理来评判小鼠的焦虑程度,小鼠越焦虑,在旷场中央区和高家十字迷宫开臂区的滞留时间越短。
38.旷场实验装置由旷场反应箱和数据采集分析系统组成,旷场反应箱是一个配有光照和换气装置的隔音箱,尺寸为30cm长,30cm宽,30cm高。四周和底部为透明的树脂玻璃的方形盒子,共四个,在箱子内部上方有一视野可覆盖整个旷场内部的数码摄像头,实验前,先设置好相关参数,实验时,小鼠被放于反应箱中央区,同时开启摄像头记录小鼠的活动情况,每个箱子每次放一只小鼠。让小鼠自由活15min,识别轨迹,记录小鼠在反应箱总活动路程和中央区活动时间。我们定义实验箱底部正中间的15
×
15cm2区域为中央区,占整个面积的四分之一。
39.高架十字迷宫装置由两个开臂(25cm
×
8cm
×
0.5cm)和两个闭臂(25cm
×
8cm
×
12cm)程十字交叉状组成,交叉区域形成中间平台,长宽均为8cm,整个装置离地面50cm,并用布帘包围以减少外界干扰。视频监视器置于装置正中上方约1.5m,并与计算机上小鼠十字迷宫检测软件相连。实验时,首先在软件上定义开臂、闭臂以及中央区域,设置各臂的参
数,调整摄像头位置。检测时,小鼠头朝开臂放于装置中间区域(此后每只动物均放到同一位置,),实验人员立即拉紧布帘,离开测试区,开始检测,计时5min,软件记录开、闭臂进入次数、滞留时间和进臂总次数,统计分析后对小鼠的焦虑水平作出评价。
40.结果见图1,图a和图b旷场实验结果显示,cfa足底注射15天后,与对照组小鼠相比模型小鼠在旷场中央区的活动时间及中央区运动距离显著减少,而总的运动距离变化不大。图c和图d高架十字迷宫检测显示,与对照组小鼠相比模型小鼠在高架十字迷宫的开臂停留时间显著降低,在闭臂中的停留时间明显增多,而进臂总次数变化不大。这些结果证明足底cfa注射确可诱导建立小鼠焦虑模型。图e蛋白免疫印迹结果显示,与情绪调节密切相关的前扣带回脑区,焦虑模型小鼠gipr表达明显高于对照组,说明该区域gipr参与了焦虑调控。
41.实施例二:d-ala
2-gip腹腔注射对小鼠焦虑行为的影响
42.本发明中动物共分为四组:control组、cfa组、cfa+d-ala
2-gip组及cfa+d-ala
2-gip+pro
3-gip组,每组8只小鼠,后三组小鼠右足底注射10μl cfa,对照组给予等量生理盐水,后两组小鼠在cfa注射后的第7-14天每天按照25nm/kg的量腹腔注射d-ala
2-gip一次,最后一组小鼠在d-ala
2-gip注射前的30min接受pro
3-gip腹腔注射(50nm/kg),第15天进行旷肠和高架十字迷宫实验,对各组小鼠的焦虑水平进行检测。
43.结果见图2,图a-d旷场实验结果显示,与对照组相比,焦虑模型小鼠在旷肠中央区域的停留时间和运动距离显著减少;而d-ala
2-gip能显著延长焦虑小鼠在中央区的停留时间,增加其在中央区的运动距离,gipr抑制剂pro
3-gip可阻断d-ala
2-gip的作用;对其活动能力的检测中发现,各组小鼠在旷肠中总的运动距离无显著差异;结果提示d-ala
2-gip具有抗焦虑作用且不影响运动功能。
44.图e-h高架十字迷宫检测显示,与对照组相比,模型小鼠在高架十字迷宫开臂停留时间显著降低,在闭臂中的停留时间明显延长;d-ala
2-gip连续七天给药可显著延长焦虑小鼠在开臂中的停留时间,减少其在闭臂中的时间,d-ala
2-gip的上述作用可被gipr抑制剂pro
3-gip所阻断;对其活动能力的检测中发现,各组小鼠开臂和闭臂进入的总次数无显著差异;结果进一步表明d-ala
2-gip具有抗焦虑作用且不影响动物的运动功能。
45.图i采用血糖试纸对各组小鼠的血糖水平进行检测,发现各组小鼠血糖平均水平无显著变化,说明d-ala
2-gip对正常血糖水平无影响。
46.实施例三:d-ala
2-gip前扣带回局部注射对小鼠焦虑行为的影响
47.前扣带回是与情绪调节密切相关的大脑边缘系统的核心组成部分,本发明采用前扣带回局部注射给药的方式进一步验证d-ala
2-gip的抗焦虑作用。采用脑立体定位仪对小鼠进行前扣带回立体定位手术,术后第7天小鼠右足底注射10μlcfa或者等量生理盐水,分为四组:control组、cfa组、cfa+d-ala
2-gip组及cfa+d-ala
2-gip+pro
3-gip组,后两组在cfa注射后的第7-14天前扣带回脑区局部给予1nm的d-ala
2-gip,每天一次,cfa+d-ala
2-gip+pro
3-gip组小鼠在d-ala
2-gip注射前30min给予1nm的pro
3-gip局部注射,control和cfa组则前扣带回局部给予等量的生理盐水。在cfa注射后的第15天进行行为学实验检测各组动物的焦虑水平。
48.结果见图3,图a为实验流程,图b为前扣带回局部注射位置示意图,图c-e高架十字迷宫检测显示,与对照组相比,模型小鼠在高架十字迷宫开臂停留时间显著降低,在闭臂中
的停留时间明显延长;前扣带回局部注射d-ala
2-gip可显著增加焦虑小鼠在开臂中的停留时间,减少其在闭臂中的时间,d-ala
2-gip的上述作用可被gipr抑制剂pro
3-gip所阻断;对其活动能力检测发现,各组小鼠开臂和闭臂进入的总次数无显著差异;结果表明d-ala
2-gip局部给药亦能发挥抗焦虑作用且不影响动物运动能力。
49.实施例四:d-ala
2-gip对前扣带回脑区突触传递关键分子表达的影响
50.有证据表明,前扣带回突触传递的异常在焦虑症发生进展中起关键作用。本发明采用蛋白免疫印迹法检测与兴奋性突触传递密切相关的谷氨酸受体亚型glua1及其磷酸化蛋白表达情况。
51.结果见图4,与对照组相比,焦虑模型小鼠前扣带回glua1及其丝氨酸831位点和845位点磷酸化(p-glua1-s831和p-glua1-s845)水平显著增加,d-ala
2-gip处理显著降低glua1及其磷酸化蛋白表达水平,其作用可被gipr抑制剂pro
3-gip阻断,提示d-ala2-gip可能能调控前扣带回脑区的突触传递。
52.实施例五:d-ala
2-gip对前扣带回脑区突触传递的影响
53.本发明采用全细胞膜片钳直接评价d-ala
2-gip对前扣带回脑区突触传递的影响。首先进行小鼠脑片的制备:行为学结束后迅速断头,小心取出全脑,置于混合气(95%o2+5%co2)饱和冰浴的切片用人工脑脊液中。振动切片机切取含前扣带回的300μm厚脑片,室温下置于混合气饱和的标准acsf中,恢复1h后进行全细胞记录:将孵育后的脑片移至记录槽内,混合气饱和的acsf循环灌流,流速为1.5ml/min.正置红外线显微镜下观察,选取不同脑区神经元记录。记录微小兴奋性突触后电流(mepscs),神经元钳制电位为-70mv,电极内液为兴奋性钾内液。所有记录在axopatch 200b膜片钳放大器、数模转换器digidata 1440a下进行,sampling为10000hz。mepscs数据采用mini analysis软件分析。在整个实验过程中监测串联电阻,仅那些串联电阻《30mω,波动小于20%的数据可用来分析。
54.结果见图5,由图5中的结果可知,与对照组相比,模型组小鼠前扣带回mepscs的发放频率和幅度都明显增加,说明焦虑小鼠该区域兴奋性突触传递增强,d-ala
2-gip处理组小鼠mepscs的发放频率和幅度都显著低于焦虑模型组,其作用可被gipr抑制剂所阻断,这些结果表明d-ala
2-gip的抗焦虑作用与其调控前扣带回区域的突触传递有关。
55.实施例六:d-ala
2-gip对前扣带回脑区趋化因子(受体)及炎性因子水平的影响
56.神经系统炎症是焦虑症发生进展的另一重要机制。本发明采用荧光定量rt-pcr的方法,检测各组小鼠前扣带回区域炎症相关趋化因子体系及细胞因子mrna水平的变化,以考察d-ala
2-gip对神经炎症的影响。
57.结果见图6,由图6中的结果可知,焦虑小鼠前扣带回脑区相关趋化因子及其受体如ccl2/ccr2、cxcl1/cxcr2、cxcl13/cxcr5、cx3cl1/cx3cr1及ccl4/ccr5,炎症细胞因子tnf-α、il-1β及il-6mrna的表达水平显著高于对照组,而d-ala
2-gip处理可阻断上述炎症体系mrna表达上调,结果表明d-ala
2-gip对前扣带回脑区的神经炎症有抑制作用。
58.实施例七:d-ala
2-gip对前扣带回脑区小胶质细胞活化的影响
59.小胶质细胞的异常活化是引起神经炎症的重要原因,在焦虑症的进展中起重要作用。本发明采用蛋白免疫印迹和免疫荧光的方法检测了各处理组小鼠前扣带回脑区小胶质细胞活化的情况,以考察d-ala
2-gip对小胶质细胞的影响。
60.结果见图7,由图a和b可知,与对照组相比,cfa焦虑模型组前扣带回脑区小胶质细
胞标志物iba-1蛋白表达显著升高,d-ala
2-gip处理可逆转上述变化趋势。由图c-e结果可知,焦虑模型组小鼠前扣带回小胶质细胞明显活化,表现为胞体膨大,突起缩短,而d-ala
2-gip处理可抑制小胶质细胞胞体的膨大,结果说明d-ala
2-gip对焦虑小鼠前扣带回脑区小胶质细胞的活化有抑制作用,这是其发挥抗焦虑效应的机制之一。
61.综上,葡萄糖依赖性促胰岛素多肽长效类似物d-ala
2-gip能显著降低模型小鼠的焦虑水平,且不影响动物的运动功能和血糖水平,其抗焦虑作用可能是通过调节前扣带回脑区的突触传递及抑制神经炎症而产生的,证明d-ala
2-gip可用于制备治疗焦虑症的药物。
62.以上结合附图详细描述了本公开的优选实施方式,但是,本公开并不限于上述实施方式中的具体细节,在本公开的技术构思范围内,可以对本公开的技术方案进行多种简单变型,这些简单变型均属于本公开的保护范围。
63.另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本公开对各种可能的组合方式不再另行说明。
64.此外,本公开的各种不同的实施方式之间也可以进行任意组合,只要其不违背本公开的思想,其同样应当视为本公开所公开的内容。
