eyp001与ifn用于治疗hbv感染的协同效应
技术领域
1.本发明涉及治疗乙型肝炎感染的方法。
背景技术:
2.乙型肝炎仍然是一个主要的全球公共卫生问题,尽管有广泛的疫苗接种计划,但仍有超过3.5亿的慢性感染者。慢性乙型肝炎可演变为危及生命的并发症,包括肝硬化和癌症。目前的治疗方案是长期治疗(例如,终生使用聚合酶抑制剂;使用聚乙二醇化干扰素长达一年),但因为它们不针对病毒储存库,导致仍不能治愈hbv。hbv功能性治愈仍然是未满足的主要医疗需求。
3.慢性乙型肝炎(chb)治疗的主要目标是永久抑制hbv复制,以及预防或改善肝脏疾病。目前有七种药物可用于治疗chb感染——常规干扰素(ifn)、聚乙二醇化干扰素和直接抗病毒药物。直接抗病毒药物(核苷/核苷酸类似物)分为三类:l-核苷(拉米夫定、替比夫定和恩曲他滨);直接干扰hbv的dna复制的脱氧鸟苷类似物(恩替卡韦)和核苷膦酸酯类(阿德福韦和替诺福韦),主要作为链终止剂。干扰素治疗的主要局限性在于严重副作用、hbv的dna抑制率低和alt正常化率低;直接抗病毒药物治疗的主要局限性在于:产生耐药性;停止治疗后hbv复制反弹,因此需要长期、终身的治疗;hbsag清除率极低,因此增加延长、终身治疗伴随的不良事件的风险。重要的是,目前的直接抗病毒药物抑制前基因组病毒rna向基因组dna的反转录。因此,它们作用于病毒进入肝细胞后形成的共价闭合环状dna(cccdna)的下游。cccdna作为附加的微染色体存在于细胞核中,转录成病毒mrna,并在肝细胞分裂时传递给子细胞。目前的直接抗病毒药物对hbv的cccdna储存库和病毒基因的表达没有或几乎没有影响。因此,目前可用的治疗是次优的且与严重的副作用有关。
4.wo 2015/036442公开了对fxr激动剂用于减少hbv复制的关注。eyp001是一种合成的非甾体、非胆汁酸fxr激动剂,其具有良好的耐受性特征。eyp001是一种口服生物可利用小分子,目前在慢性乙型肝炎患者中进行1b期评估。与主要针对病毒复制的终身护理标准相反,eyp001靶向cccdna(“病毒储存库”),因此旨在实现hbv的真正治愈。erken等人(2018,《肝脏病学杂志》,68,suppl 1,s488-s489)公开eyp001降低慢性乙型肝炎患者的hbv病毒载量。joly等人(2017,《肝脏病学杂志》,66,suppl 1,sat-158)公开eyp001和核苷类似物可安全用于健康个体,并对细胞培养中的hbv减少/消除具有相加效应。
5.已经研究了几种ifn和核苷类似物/核苷酸类似物的联合疗法:即ifn-α和选自拉米夫定、阿德福韦、替布韦、恩替卡韦和替诺福韦的药物的联合疗法(woo等人,2017年,ann transl med,5159)。几乎所有的组合都没有显示出任何益处。事实上,只有一种与替诺福韦的组合达到更高的hbsag(乙型肝炎表面抗原)丢失率,其百分比低于10%。然而,如此低的hbsag丢失率使得治愈仍然难以达到。
6.然而,仍需要更好的疗法来满足hbv感染的治疗目标,特别是chb感染的治疗目标。
技术实现要素:
7.发明人惊奇地发现eyp001与干扰素在治疗乙型肝炎方面具有协同效应,尤其是对前基因组病毒rna(病毒复制的标志物)和hbcrag(作为慢性乙型肝炎的血清标志物的核心相关抗原)具有协同效应。相应地,eyp001和ifn在减少cccdna转录方面具有协同效应。这些效应在治疗仅4周后观察到,这是一段非常短的时间,而单独使用eyp001和ifn在相同剂量和相同时间后均未显示出显著的效应。此外,令人惊讶的是,每天给药一次eyp001与每天给药两次相同日剂量的eyp001相比,协同效应至少要强两倍。
8.因此,本发明涉及eyp001和ifn的协同组合,用于治疗乙型肝炎感染,尤其是慢性乙型肝炎。
9.本发明涉及eyp001或包含eyp001的药物组合物,其与干扰素α(ifn-α)或其聚乙二醇化形式联合使用以治疗乙型肝炎病毒感染、尤其是慢性乙型肝炎,其中使用eyp001和ifn-α以获得减少hbv复制的协同效应。
10.本发明还涉及eyp001或包含eyp001的药物组合物与干扰素α(ifn-α)或其聚乙二醇化形式联合用于制造用来治疗乙型肝炎病毒感染、尤其是慢性乙型肝炎的药物的用途,其中使用eyp001和ifn-α以获得减少hbv复制的协同效应。本发明还涉及一种在有需要的对象中治疗乙型肝炎病毒感染、尤其是慢性乙型肝炎的方法,所述方法包括给药治疗有效量或亚治疗量的eyp001和给药治疗有效量或亚治疗量的干扰素α(ifn-α)或其聚乙二醇化形式,其中给药eyp001和ifn-α以获得减少hbv复制的协同效应。
11.在一个方面,以每天50mg至800mg范围内的剂量给药eyp001。更具体地说,以每天100mg至600mg、优选每天200mg至400mg范围的剂量给药eyp001。任选地,以亚治疗量给药eyp001。
12.一方面,eyp001每天给药一次。在另一方面,eyp001每天给药两次。
13.在一个方面中,ifn-α为ifn-α2a、ifn-α2b或其聚乙二醇化形式。优选地,ifn-α或其聚乙二醇化形式通过皮下途径每周给药一次。任选地,可以亚治疗量给药ifn-α或其聚乙二醇化形式。
14.在一个特定方面,以亚治疗量给药eyp001和ifn-α或其聚乙二醇化形式。
15.在一个方面中,eyp001和ifn-α或其聚乙二醇化形式在5周、6周、7周或8周至52周的时间段内给药。
16.在一个方面中,eyp001和ifn-α或其聚乙二醇化形式与至少一种附加活性成分联合使用。更具体地说,至少一种附加活性成分是选自l-核苷、脱氧鸟苷类似物和核苷膦酸酯类的聚合酶抑制剂。在非常具体的方面,至少一种附加活性成分选自拉米夫定、替比夫定、恩曲他滨、恩替卡韦、阿德福韦和替诺福韦。
附图说明
17.图1:fxr激动剂eyp001a或安慰剂与干扰素联合使用的抗hbv疗程4周后,先前未经治疗的慢性感染hbv患者的hbv pgrna(log10拷贝/ml)与基线相比发生变化。pbo:安慰剂。peg-ifn:聚乙二醇化干扰素α2a。150bid:150mg,每日两次。300qd:300mg,每日一次。pgrna:前基因组核糖核酸。黑色柱表示第29天治疗结束时的变化。灰色柱表示第35天治疗结束后一周的变化。*p=0.04。
18.图2:fxr激动剂eyp001a或安慰剂与干扰素联合使用的抗hbv疗程4周后,先前未经治疗的慢性感染的hbv患者的hbcrag(log10iu/ml)与基线相比发生变化。pbo:安慰剂。peg-ifn:聚乙二醇化干扰素α2a。hbcrag:乙型肝炎核心相关抗原。黑色柱表示第29天治疗结束时的变化。灰色柱表示第35天治疗结束后一周的变化。
具体实施方式
19.eyp001是cas号1192171-69-9中公开的fxr激动剂,由下式表示:
[0020][0021]
eyp001旨在表示该化合物及其任何药学上可接受的盐。
[0022]
发明人观察到,eyp001与ifn-α联合治疗在治疗仅4周后(非常短的一段时间内)令人惊讶地对慢性乙型肝炎产生协同效应,而eyp001或ifn-α单独治疗均未显示任何显著效应。已观察到对前基因组rna(hbv pgrna)和乙型肝炎核心相关抗原(hbcrag)的该效应。因此,通过使用eyp001与ifn-α的协同组合,患者可以获得治疗益处。
[0023]
定义
[0024]
如本文所用,术语“治疗”是指旨在改善患者健康状况的任何行为,例如治疗、防止、预防和延缓疾病。在特定实施方式中,这些术语指疾病或与其相关的症状的改善或根除。在其它实施方式中,该术语指将由于向患有此类疾病的对象给药一种或多种治疗剂以使得疾病的传播或恶化最小化。更具体地说,术语“治疗”是指通过给药该组合物减轻hbv感染、阻止疾病发展和/或去除hbv。
[0025]
减少hbv复制,优选地是指与没有hbv复制相比hbv复制减少至少10或100倍。
[0026]
更具体地说,治疗乙型肝炎感染,特别是慢性乙型肝炎,表现为hbv复制减少。hbv复制可通过测定对象的以下水平的至少一种来评估:hbeag水平、hbsag水平、hbcrag水平、前基因组rna(hbv pgrna)水平、前核心rna水平、松弛环状dna(hbv rcdna)水平、hbv cccdna水平或hbv dna水平。hbsag丢失和血清转化通常是临床治愈的目标。减少hbv复制,是指与未治疗相比,hbeag水平、hbsag水平、hbcrag水平、前基因组rna(hbv pgrna)水平、前核心rna水平、松弛环状dna(hbv rcdna)水平、hbv cccdna水平和hbv dna水平中的至少一种水平降低。
[0027]
减少hbv复制,优选是指与未经治疗时的hbv复制相比,hbv复制减少至少10或100倍。例如,可以通过测定hbv dna水平来评估hbv复制,与无eyp001时的hbv复制相比,该水平至少降低10或100倍。或者,与未治疗相比,hbv cccdna水平降低了至少10、15、20、25、30、35、40、45或50%。
[0028]
如本文所用,术语“对象”、“个体”或“患者”是可互换的并均指人,包括成人、儿童、新生儿和处于产前阶段的人。在特定方面,对象或患者患有乙型肝炎感染,尤其是慢性乙型
肝炎。
[0029]
术语“量”和“剂量”在本文中互换使用,并可指分子的绝对定量。
[0030]
如本文所用,术语“治疗效果”是指由根据本发明所述的活性成分或药物组合物引发的效果,能够预防或延迟疾病或病症的出现和发展,或治愈或减弱疾病或病症的影响。
[0031]
如本文所用,术语“治疗有效量”是指活性成分或药物组合物的量,其用于预防、去除或减轻疾病,特别是传染病的有害影响。显然,本领域技术人员可以根据待治疗的对象、疾病的性质等调整给药量。特别是,给药的剂量和方案可以根据待治疗疾病的性质、阶段和严重程度以及对象的体重、年龄和整体健康状况以及医生的判断变化。
[0032]
如本文所用,术语“亚治疗量”或“亚治疗剂量”是指在没有其它药剂的情况下,剂量小于在对象中产生治疗效果的剂量。例如,“亚治疗量”或“亚治疗剂量”可指与治疗有效量相比减少了25%、50%、70%、80%或90%的剂量,所述治疗有效量尤其是单独使用时对于相同适应症和相同给药途径的常规治疗剂量。常规治疗剂量为药品批准机构(如fda或emea)认可的剂量。
[0033]
如本文所用,术语“赋形剂或药学上可接受的载体”指除活性成分之外存在于药物组合物中的任何成分。其添加可能旨在赋予最终产品特定的稠度或其它物理或味觉特性。赋形剂或药学上可接受的载体必须和活性成分没有任何相互作用,特别是化学相互作用。
[0034]
如本文所用,术语“聚乙二醇化形式”指聚乙二醇化干扰素。
[0035]“协同效应”指的是减少hbv复制的效应,该效应大于每种分子单独的效应的总和。hbv复制可通过测定表面hbv抗原(hbsag)、hbeag、hbv核心相关抗原(hbcrag)、hbv dna、hbv前基因组rna、hbv前核心rna和/或hbv cccdna来评估。更具体地说,在前基因组rna(hbv pgrna)和/或乙型肝炎核心相关抗原(hbcrag)上观察到这种效应。
[0036]
联合治疗
[0037]
本发明涉及eyp001和ifn的组合用于治疗乙型肝炎病毒感染、尤其是慢性乙型肝炎的用途。事实上,该组合导致对抗hbv的协同效应。
[0038]
因此,本发明涉及以下方面:
[0039]-一种药物组合物,其包含eyp001和ifn-α或其聚乙二醇化形式,以及任选的药学上可接受的载体和/或附加活性成分,所述药物组合物特别用于治疗乙型肝炎病毒感染、尤其是慢性乙型肝炎,其中使用eyp001和ifn-α以获得减少hbv复制的协同效应;
[0040]-一种含有eyp001或包含eyp001和ifn-α或其聚乙二醇化形式的药物组合物的产品或药剂盒,作为同时、单独或顺序使用的组合制剂,特别用于治疗乙型肝炎病毒感染、尤其是慢性乙型肝炎,其中使用eyp001和ifn-α以获得减少hbv复制的协同效应;任选地,该产品或药剂盒可包含至少一种附加活性成分;
[0041]-一种组合制剂,其包含eyp001或包含eyp001和ifn-α或其聚乙二醇化形式的药物组合物,所述组合制剂用于同时、单独或顺序使用,特别用于治疗乙型肝炎病毒感染、尤其是慢性乙型肝炎,其中使用eyp001和ifn-α以获得减少hbv复制的协同效应;任选地,所述组合制剂可包含至少一种附加活性成分;
[0042]-一种包含eyp001的药物组合物,其用于治疗乙型肝炎病毒感染、尤其是慢性乙型肝炎,该治疗与使用ifn-α或其聚乙二醇化形式的治疗联合,其中使用eyp001和ifn-α以获得减少hbv复制的协同效应;任选地,所述药物组合物可包含至少一种附加活性成分;
[0043]-一种包含ifn-α或其聚乙二醇化形式的药物组合物,其用于治疗乙型肝炎病毒感染、尤其是慢性乙型肝炎,该治疗与使用eyp001的治疗联合,其中使用eyp001和ifn-α以获得减少hbv复制的协同效应;任选地,所述药物组合物可包含至少一种附加活性成分;
[0044]-包含eyp001的药物组合物用于制造用来治疗乙型肝炎病毒感染、尤其是慢性乙型肝炎的药物的用途,该治疗与使用ifn-α或其聚乙二醇化形式的治疗联合,其中使用eyp001和ifn-α以获得减少hbv复制的协同效应;任选地,所述药物组合物可包含至少一种附加活性成分;
[0045]-包含ifn-α或其聚乙二醇化形式的药物组合物用于制造用来治疗乙型肝炎病毒感染、尤其是慢性乙型肝炎的药物的用途,该治疗与使用eyp001的治疗联合,其中使用eyp001和ifn-α以获得减少hbv复制的协同效应;任选地,所述药物组合物可包含至少一种附加活性成分;
[0046]-包含eyp001和ifn-α或其聚乙二醇化形式以及任选的药学上可接受的载体的药物组合物用于制造用来治疗乙型肝炎病毒感染、尤其是慢性乙型肝炎的药物的用途,其中使用eyp001和ifn-α以获得减少hbv复制的协同效应;任选地,所述药物组合物可包含至少一种附加活性成分;
[0047]-一种在有需要的对象中治疗乙型肝炎病毒感染、尤其是慢性乙型肝炎的方法,所述方法包括给药有效量的药物组合物,所述药物组合物包含a)eyp001,b)ifn-α或其聚乙二醇化形式,以及药学上可接受的载体,其中使用eyp001和ifn-α以获得减少hbv复制的协同效应;任选地,所述药物组合物可包含至少一种附加活性成分,或者所述方法可进一步包括给药至少一种附加活性成分;
[0048]-一种在有需要的对象中治疗乙型肝炎病毒感染、尤其是慢性乙型肝炎的方法,所述方法包括给药有效量的包含eyp001的药物组合物和有效量的包含ifn-α或其聚乙二醇化形式的药物组合物,其中使用eyp001和ifn-α以获得减少hbv复制的协同效应;任选地,所述药物组合物之一可包含至少一种附加活性成分,或者所述方法可进一步包括给药至少一种附加活性成分。
[0049]
ifn-α可以是例如ifn-α1或ifn-α2,例如ifn-α1a、ifn-α1b、ifn-α2a、ifn-α2b、ifn-α2c或复合ifn-α。在非常特定的方面中,ifn是ifn-α2a、ifn-α2b或其聚乙二醇化形式。
[0050]
任选地,从以下非穷举列表中选择ifn-α:复合ifn-α(例如,)、ifn-α1b(例如,)、ifn-α2a(mor-22、inter 2a、inmutag、inferon)、聚乙二醇化ifn-α2a(例如,ypeg-ifnα-2a、pegaferon)、ifn-α2b(例如,infronalfarona、bioferon、inter 2b、citpheron、zavinex、ganapar等)、聚乙二醇化ifn-α2b(例如,albuferon、aop2014/p1101、algeron、pai ge bin)和ifn-α2c(例如,berofor alpha)。在特定方面,ifn是聚乙二醇化ifn-α2a(例如,)或聚乙二醇化ifn-α2b
[0051]
在一个方面中,通过皮下途径每周给药一次ifnα或其聚乙二醇化形式;例如,以1μg至500μg、优选10μg至500μg、更优选100μg至250μg的剂量下,例如100μg、110μg、120μg、130μg、140μg、150μg、160μg、170μg、180μg、190μg或200μg的剂量给药。
[0052]
任选地,可以亚治疗量给药ifnα或其聚乙二醇化形式。
[0053]
eyp001可以每天一次或两次有效的治疗量给药;更具体地说,日剂量为50至800mg/成人/天,优选地100至600mg/成人/天;更优选地150至400mg/成人/天或每天200mg至400mg,例如,约300mg/成人/天;优选地口服给药。
[0054]
优选地,包含eyp001和ifn-α的联合疗法对于减少hbv复制有效。
[0055]
在使用eyp001和ifn-α(即ifn-α2a、ifn-α2b或其聚乙二醇化形式)进行联合治疗的情况下,发明人惊奇地观察到,每天给药一次eyp001时,与每天给药两次相同日剂量相比,协同效应至少强两倍。此外发明人还观察到,令人惊讶地,当eyp001每天给药一次而不是每天给药两次时,瘙痒发生的次数更少。因此,在特定方面,每天给药一次eyp001。
[0056]
在特定方面,在晚上(例如,下午6点和10点)给药eyp001。在另一个方面,在早晨(例如,在上午6点到10点之间)给药eyp001。
[0057]
任选地,eyp001与食物或不与食物一起给药。然后,在第一方面,在进餐期间、例如在临进餐前、进餐时或刚进餐后给药eyp001。在第二方面中,在餐前或餐后至少一小时或两小时给药eyp001。
[0058]
优选地,该组合物、剂量单位或剂型含有5mg、10mg、15mg、25mg、50mg、75mg、100mg、200mg、300mg、400mg和500mg eyp001,用于对待治疗患者的剂量进行对症调整。药物通常含有约5mg至约500mg的eyp001,优选50mg至约500mg的eyp001,50mg至约450mg的eyp001,100mg至约400mg的eyp001,或150mg至约300mg的eyp001。
[0059]
在一个方面,该剂型可以是刻痕剂型。或者,可以通过给药几种剂型来提供日剂量。
[0060]
eyp001可与药学上可接受的赋形剂和任选的缓释基质(例如可生物降解聚合物)组合以形成药物组合物。
[0061]“药学上”或“药学上可接受的”是指当适当地给药哺乳动物,尤其是人类时,不会产生不良、过敏或其它不良反应的分子实体和组合物。药学上可接受的载体或赋形剂是指无毒固体、半固体或液体填料、稀释剂、封装材料或任何类型的制剂助剂。
[0062]
包含eyp001的药物组合物可适于口服、舌下、皮下、肌肉内、静脉内、经皮、局部或直肠给药,优选用于口服给药。
[0063]
eyp001单独或与另一种活性要素组合,可作为与传统药物载体的混合物以单位给药形式给药。合适的单位给药形式包括口服途径形式,例如片剂、凝胶胶囊、粉末、颗粒和口服悬浮液或溶液、舌下和口腔给药形式、气雾剂、植入物、皮下、经皮、局部、腹腔内、肌肉内、静脉内、真皮下、经皮,鞘内和鼻内给药形式以及直肠给药形式。
[0064]
在优选实施方式中,口服剂型为胶囊或片剂。任选地,口服剂型为刻痕剂型。任选地,剂型可刻痕为四部分、三部分或两部分。
[0065]
任选地,治疗持续2-4个月至24个月,例如2至24个月或2至12个月,例如2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或24个月。在非常特定的方面,治疗持续12至52周,优选45至52周,例如48周。
[0066]
eyp001和ifn-α或其聚乙二醇化形式可与至少一种附加活性成分联合使用。优选地,附加活性成分是抗病毒药物,更具体地说是具有抗hbv活性的抗病毒药物。在优选方面中,至少一种附加活性成分是选自l-核苷、脱氧鸟苷类似物和核苷膦酸酯类的聚合酶抑制
剂。在非常具体的方面,至少一种附加活性成分选自拉米夫定、替比夫定、恩曲他滨、恩替卡韦、阿德福韦和替诺福韦。
[0067]
本发明的其它方面和优点将在以下实施例中描述,这些实施例应被视为说明性的而非限制性的。
[0068]
实施例
[0069]
hbv慢性感染患者(男性(n=39)和女性(n=34))接受了为期4周的疗程,在研究的a部分(n=48)作为单独疗法每日口服fxr激动剂eyp001a或安慰剂或恩替卡韦(etv),或在b部分与干扰素联合使用(n=23,每周皮下注射聚乙二醇化ifnα2a,peg-ifn)。患者特征为:平均年龄39.7岁(范围:19岁至63岁);73人中有6人hbeag阳性;70%未经治疗;hbv dna平均基线为4.2(
±
1.5sd)log10 iu/ml、hbsag 3.5(
±
0.8sd)log10 iu/ml,并且基因型a(25)、b(8)、c(10)、d(7)和e(4)。表2和表3总结了详细的病毒学特征。fxr与所有eyp001剂量的整合导致c4减少,fgf19增加(数据未显示)。
[0070]
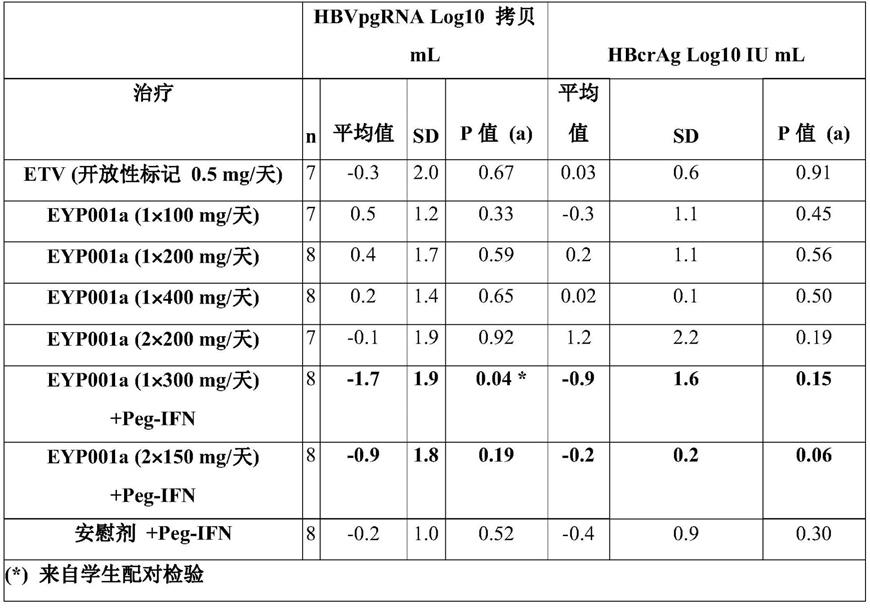
在第29天治疗结束时,400mg qd eyp001使平均hbsag降低-0.1log10 iu/ml(p《0.05)。令人惊讶的是,当eyp001与peg-ifn联合使用时,hbv复制的早期标记物pgrna和hbcrag显示出协同性降低,而peg-ifn或eyp001单独疗法没有这种效应(表1)。hbv pgrna的平均值降低-1.7log10拷贝/ml(p《0.05),hbcrag的平均值降低-0.9log10 iu/ml(p=0.15),而安慰剂+peg-ifn组没有显著降低(-0.2log10拷贝/ml pgrna,-0.4log10 iu/ml hbcrag)。这种效应持续到第35天,即治疗结束后7天(eot,图1和图2)。与bid相比,qd具有更强的协同效应。
[0071]
表1
[0072][0073]
表2:a部分基线处hbv感染参数汇总
[0074][0075]
表3:b部分基线处hbv感染参数汇总
[0076]
