ph响应性t1-t2双激活纳米探针及其制备方法和应用
技术领域
1.本发明属于纳米材料和分子影像技术领域,具体涉及ph响应性t1-t2双激活纳米探针及其制备方法和应用。
背景技术:
2.磁共振成像(magnetic resonance imaging,mri)具备高分辨率、无电离辐射损伤及多参数、多序列成像等优点,已成为当代临床诊断中最有力的检测手段之一。
3.为了凸显组织间的差异,尤其是正常组织与病患部位间的差别,常使用造影剂提高成像对比度。按照作用原理,mri造影剂可以分为纵向弛豫造影剂(t1造影剂)和横向弛豫造影剂(t2造影剂),t1造影剂主要加速t1弛豫并在t1加权图像中产生“明亮”对比度,t2造影剂主要增加t2弛豫速率并产生“黑暗”对比效果。然而t1加权成像和t2加权成像造影剂都有它们各自的优点和缺点。例如基于钆的t1加权mri造影剂具有优秀的造影效果,但同时也具有生物毒性威胁;基于t2加权成像的超顺磁性氧化铁纳米颗粒具有低毒性,但因为磁敏感伪影和它的负造影效果,与周围具有低mr信号的骨、脉管系统等邻近组织不能很好的区别,限制了其应用。
4.单一模式的t1和t2越发不能满足医疗检测的要求,将t1和t2造影剂结合的双模态造影剂带来新的突破。有研究公开了一种双向调控的(tmret)gsh敏感的纳米探针,并通过调控t1阳性对比剂(卟啉螯合锰)及t2阴性对比剂(spio)的比例(40:1),首次发现在肿瘤高还原状态微环境下t1-t2信号双淬灭和激活(off-on)效应。尽管该探针能进一步增强成像部位的mri信号激活放大倍数,但该探针所用的t1对比剂比例高,制作工艺较复杂,不利于向临床转化应用;且该探针采用的是gsh响应模式,相较于ph响应模式,存在灵敏性和特异性不足的问题。
5.综合上述,提供一种能有效增强mri信号且具备高灵敏性和特异性的mri造影剂,对于mri领域具有重要意义。
技术实现要素:
6.为解决现有技术中双模态造影剂灵敏性和特异性不足、且制备工艺复杂的问题,本发明公开了一种ph响应性t1-t2双激活纳米探针及其制备方法和应用,所述的纳米探针具备ph响应性,在肿瘤微环境酸性条件下进行t1和t2信号同时激活,最终提高成像的性能和准确度;同时,所述的纳米探针具有良好的生物相容性和生物可降解性,且制备方法简单,有利于向临床转化应用。
7.为解决上述问题,本发明首先提供了一种ph响应性t1-t2双激活纳米探针的制备方法,包括以下步骤:
8.s1,以硝酸钆、转铁蛋白为原料,加入naoh溶液,37℃进行反应,反应液离心取上清,经超滤、复溶后得到转铁蛋白螯合钆,4℃保存备用;
9.s2,以转铁蛋白螯合钆、氨基化spio为原料,加入双醛基聚乙二醇溶液,室温条件
下反应,得到所述的ph响应性t1-t2双激活纳米探针;
10.其中,步骤s1中,所述的naoh溶液的浓度为1mol/l,所述的硝酸钆、转铁蛋白和naoh溶液的用量比为5-6mg:15-25mg:0.1-0.2ml;
11.步骤s2中,所述转铁蛋白螯合钆和氨基化spio中钆离子与铁离子的质量比为15:1。
12.优选地,所述的氨基化spio中的铁离子浓度为0.01-1.0mg/ml。
13.优选地,所述的双醛基聚乙二醇的分子量为4000。
14.优选地,所述步骤s1中的离心为冷冻离心,10000rpm,离心30min。
15.优选地,所述步骤s1中超滤的具体步骤为:将上清装入截留分子量为30kda的超滤管中,5000rpm,超滤30min。
16.本发明另一方面还提供了一种根据前面任一所述的制备方法制备的ph响应性t1-t2双激活纳米探针。
17.本发明另一方面还提供了一种造影用组合物,包括:权利要求6所述的ph响应性t1-t2双激活纳米探针;以及药学上可接受的辅剂。
18.本发明另一方面还提供了一种药用组合物,包括:权利要求6所述的ph响应性t1-t2双激活纳米探针,药物以及药学上可接受的载体。
19.本发明另一方面还提供了所述的ph响应性t1-t2双激活纳米探针、所述的造影用组合物在制备磁共振成像剂中的应用。
20.相对于现有技术,本发明的有益效果是:
21.1、本发明的t1-t2双激活纳米探针在体内肿瘤周围正常组织中处于t1和t2信号双淬灭状态,而在肿瘤部位能够实现t1和t2信号同时激活,使肿瘤部位与周围正常组织呈现显著的mri信号差,从而实现对肿瘤部位的高质量成像。
22.2、本发明的t1-t2双激活纳米探针具有ph响应机制,在酸性条件下能够同时实现t1和t2造影剂信号激活,随着酸性的增加,激活效果也随之增强;同时具有时间依赖性,随着时间的推移,激活效果也随之增强。
23.3、本发明制备的t1-t2双激活纳米探针中,采用的t1对比剂相较于传统的钆基对比剂(如gd-dtpa、gd-dota等),弛豫率提高了近三倍,有效降低了t1与t2对比剂的比例,不仅提高了生物相容性,且工艺简单,易于制备,有利于向临床转化应用。
附图说明
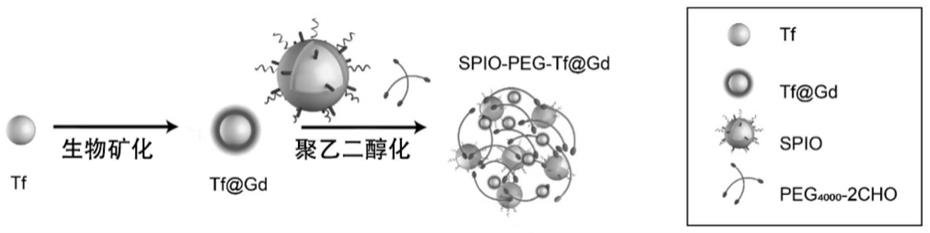
24.图1为本发明制备tf@gd-peg-spio纳米探针的流程图;
25.图2为实施例1制备的tf@gd在不同浓度、不同ph条件下的t1、t2弛豫率;
26.图3为实施例1制备的tf@gd-peg-spio纳米探针的tem图;
27.a为ph7.4条件下tf@gd-peg-spio纳米探针的tem图;
28.b为ph5.0条件下tf@gd-peg-spio纳米探针的tem图;
29.图4表示实施例1制备的tf@gd-peg-spio纳米探针在不同ph条件下的t1和t2信号强度图及t1map和t2map彩色编码图;
30.a为不同ph条件下tf@gd-peg-spio纳米探针的t1加权成像图及t1map彩色编码图;
31.b为不同ph条件下tf@gd-peg-spio纳米探针的t2加权成像图及t2map彩色编码图;
32.c为不同ph条件下tf@gd-peg-spio纳米探针的t1弛豫率;
33.d为不同ph条件下tf@gd-peg-spio纳米探针的t2弛豫率;
34.图5表示实施例1制备的tf@gd-peg-spio纳米探针的t1和t2信号强度随时间的变化;
35.a为不同时间下tf@gd-peg-spio纳米探针的t1加权成像图及t1map彩色编码图;
36.b为不同时间下tf@gd-peg-spio纳米探针的t2加权成像图及t2map彩色编码图;
37.c为不同时间下tf@gd-peg-spio纳米探针的t1弛豫率;
38.d为不同时间下tf@gd-peg-spio纳米探针的t2弛豫率;
39.图6表示肝脏微转移瘤小鼠经tf@gd-peg-spio注射后的mri成像图;
40.a为小鼠注射tf@gd-peg-spio后0h和5h的t1map彩色编码图;
41.b为小鼠注射tf@gd-peg-spio后0h和5h的t2map彩色编码图;
42.c为小鼠注射tf@gd-peg-spio后0h和5h时,正常肝脏组织和肿瘤组织之间的t1弛豫率对比;
43.d为小鼠注射tf@gd-peg-spio后0h和5h时,正常肝脏组织和肿瘤组织之间的t2弛豫率对比;
44.图7表示肌肉内炎症小鼠经tf@gd-peg-spio注射后的mri成像图;
45.a为小鼠注射tf@gd-peg-spio后0h、3h和6h的t1map彩色编码图;
46.b为小鼠注射tf@gd-peg-spio后0h、3h和6h的t2map彩色编码图;
47.c为小鼠注射tf@gd-peg-spio后0h、3h和6h的t1弛豫率;
48.d为小鼠注射tf@gd-peg-spio后0h、3h和6h的t2弛豫率。
具体实施方式
49.以下将结合附图和实施例对本发明的技术方案做进一步的说明。
50.如前所述,鉴于现有技术的不足,本发明申请人经长期研究和大量实践,提出本发明的技术方案,制备流程如图1所示:首先利用生物矿化法将硝酸钆吸附到转铁蛋白上得到t1阳性对比剂(tf@gd),然后与表面氨基化修饰的t2阴性对比剂超顺磁性氧化铁(superparamagnetic iron oxide,spio)按照钆离子与铁离子的质量比为15:1的比例共同孵育在双醛基聚乙二醇溶液中,利用t1和t2对比剂表面的氨基与醛基反应形成席夫碱,实现t1、t2对比剂的共组装,得到具有ph响应性的t1-t2双激活纳米探针tf@gd-peg-spio(tgps)。
51.术语
52.本发明所述“转铁蛋白螯合钆”“tf@gd”可以互换使用;“氨基化spio”“spio-nh
2”可以互换使用;“双醛基聚乙二醇”“cho-peg4000-cho”可以互换使用。
53.如本发明所用,“药学上可接受的”的成分是适用于人和/或哺乳动物而无过度不良副反应(如毒性)的,即具有合理的效益/风险比的物质。术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。该术语指这样一些药剂载体:它们本身并不是必要的活性成分,且施用后没有过分的毒性。
54.本发明的ph响应性t1-t2双激活纳米探针的制备方法,包括以下步骤:
55.s1,以硝酸钆、转铁蛋白为原料,加入naoh溶液,37℃进行反应,反应液冷冻离心取
上清,经超滤、复溶后得到转铁蛋白螯合钆,4℃保存备用;
56.s2,以转铁蛋白螯合钆、氨基化spio为原料,加入双醛基聚乙二醇溶液,室温条件下反应,得到所述的ph响应性t1-t2双激活纳米探针;
57.其中,步骤s1中,所述的naoh溶液的浓度为1mol/l,所述的硝酸钆、转铁蛋白和naoh溶液的用量比为5-6mg:15-25mg:0.1-0.2ml;
58.超滤的具体步骤为:将上清装入截留分子量为30kda的超滤管中,5000rpm,超滤30min;
59.步骤s2中,所述转铁蛋白螯合钆和氨基化spio中钆离子与铁离子的质量比为15:1。
60.优选地,所述的氨基化spio中的铁离子浓度为0.01-1.0mg/ml。
61.优选地,所述的双醛基聚乙二醇的分子量为4000。
62.本发明还提供了前面任一所述的制备方法制备的ph响应性t1-t2双激活纳米探针及其用途,例如在制备造影用组合物中的用途,所述造影用组合物包括:所述的ph响应性t1-t2双激活纳米探针;以及药学上可接受的辅剂。
63.本发明还提供了所述的ph响应性t1-t2双激活纳米探针和造影用组合物在制备磁共振成像剂中的应用。
64.本发明还提供了一种药用组合物,包括:所述的ph响应性t1-t2双激活纳米探针,药物以及药学上可接受的载体。所述药物包括治疗性药物、示踪性分子等药物组分,可实现诊疗一体化。
65.本发明探针在肿瘤微环境的酸性条件下,连接tf@gd与spio的席夫碱键响应性解离,tf@gd与spio之间的距离增加致使t1、t2信号双激活,肿瘤诊断中具有良好的信号激活能力和高空间分辨率,从而实现对早期微小转移瘤诊断以及对炎症病灶的检出效能。
66.下面对本发明的实验过程及实验结果进行详细说明。
67.实施例1、tgps纳米探针的制备
68.(1)转铁蛋白螯合钆(tf@gd)的制备
69.称取硝酸钆gd(no3)
3 5.4mg、转铁蛋白tf 20mg溶解于1.2ml纯水中(环境温度保持37℃),搅拌5分钟,待溶解完全,加入配好的0.12ml 1mnaoh溶液,继续在37℃下搅拌反应12h(匀速缓慢搅拌即可,不宜剧烈搅拌)。反应结束后,将反应物用冷冻离心机10000rpm转速离心30min,提取上清液,装入超滤管(30kda)中,在5000rpm转速下超滤30min,除去多余的gd
3+
离子,然后将超滤管中上层的产物复溶在1ml纯水中,即可得到转铁蛋白螯合钆(tf@gd),用icp对gd含量进行定量后,制备成gd浓度为1mg/ml的探针溶液,置于4℃冰箱内保存。
70.取出部分tf@gd用3.0t的磁共振扫描仪进行测试,结果如图2所示,本发明制备的t1阳性对比剂(tf@gd)的弛豫率在ph 7.4条件下为14.25mm-1
s-1
,在ph 5.5条件下为15.5mm-1
s-1
,而目前临床常用的钆造影剂弛豫率仅在5mm-1
s-1
左右,即本发明制备的tf@gd弛豫率为常规t1造影剂的三倍左右,为后续制备双激活探针时降低t1对比剂的使用量提供基础。
71.(2)双醛基聚乙二醇水溶液的制备
72.称取10.5mg的cho-peg4000-cho溶于0.375ml纯水中,配制双醛基聚乙二醇水溶液。
73.(3)tf@gd-peg-spio(tgps)的制备
74.称取tf@gd 1ml和铁浓度为0.05mg/ml的spio-nh
2 1.33ml,将二者共混于10ml圆底烧瓶中,然后加入双醛基聚乙二醇水溶液,分多次加入,密切观察有无沉淀产生;如果有沉淀产生,则涡旋搅拌至没有沉淀,再继续加入剩余的双醛基聚乙二醇水溶液。在室温下搅拌48h,即可得到tf@gd-peg-spio(tgps),然后通过离心浓缩,纯水定容至1ml。置于4℃冰箱内保存。
75.(4)透射电镜表征
76.为了考察本发明双激活纳米探针能通过控制ph值实现tf@gd(t1对比剂)和spio(t2对比剂)之间距离的调节,最终控制t1和t2信号的激活,我们对其进行了电镜考察:分别在ph 7.4和5.0条件下测试tem,观察纳米颗粒在两种酸性条件下的分散、解离情况。
77.结果图3所示,在ph 7.4条件下,tgps均匀而紧密的排列成球形(图3中的a);当在酸性溶液的作用下,ph值从7.4将至5.0时,纳米胶束由纳米球解离为纳米颗粒(图3中的b)。说明本发明方法制备的纳米探针可在酸性微环境中成功实现t1对比剂和t2对比剂的解离,最终实现酸性微环境中t1和t2信号的激活。
78.实施例2、tgps纳米探针的制备
79.(1)转铁蛋白螯合钆(tf@gd)的制备
80.称取硝酸钆gd(no3)
3 5mg、转铁蛋白tf 15mg溶解于1.2ml纯水中(环境温度保持37℃),搅拌5分钟,待溶解完全,加入配好的0.1 2ml 1m naoh溶液,继续在37℃下搅拌反应12h(匀速缓慢搅拌即可,不宜剧烈搅拌)。反应结束后,将反应物用冷冻离心机10000rpm转速离心30min,提取上清液,装入超滤管(30kda)中,在5000rpm转速下超滤30min,除去多余的gd
3+
离子,然后将超滤管中上层的产物复溶在1ml纯水中,即可得到转铁蛋白螯合钆(tf@gd),用icp对gd含量进行定量后,制备成gd浓度为1mg/ml的探针溶液,置于4℃冰箱内保存。
81.(2)双醛基聚乙二醇水溶液的制备
82.称取10.5mg的cho-peg4000-cho溶于0.375ml纯水中,配制双醛基聚乙二醇水溶液。
83.(3)tf@gd-peg-spio(tgps)的制备
84.称取tf@gd 1ml和铁浓度为0.05mg/ml的spio-nh
2 1.33ml,将二者共混于10ml圆底烧瓶中,然后加入双醛基聚乙二醇水溶液,分多次加入,密切观察有无沉淀产生;如果有沉淀产生,则涡旋搅拌至没有沉淀,再继续加入剩余的双醛基聚乙二醇水溶液。在室温下搅拌48h,即可得到tf@gd-peg-spio(tgps),然后通过离心浓缩,纯水定容至1ml。置于4℃冰箱内保存。
85.实施例3、tgps纳米探针的制备
86.(1)转铁蛋白螯合钆(tf@gd)的制备
87.称取硝酸钆gd(no3)
3 6mg、转铁蛋白tf 25mg溶解于1.2ml纯水中(环境温度保持37℃),搅拌5分钟,待溶解完全,加入配好的0.12ml 1m naoh溶液,继续在37℃下搅拌反应12h(匀速缓慢搅拌即可,不宜剧烈搅拌)。反应结束后,将反应物用冷冻离心机10000rpm转速离心30min,提取上清液,装入超滤管(30kda)中,在5000rpm转速下超滤30min,除去多余的gd
3+
离子,然后将超滤管中上层的产物复溶在1ml纯水中,即可得到转铁蛋白螯合钆(tf@gd),用icp对gd含量进行定量后,制备成gd浓度为1mg/ml的探针溶液,置于4℃冰箱内保存。
88.(2)双醛基聚乙二醇水溶液的制备
89.称取10.5mg的cho-peg4000-cho溶于0.375ml纯水中,配制双醛基聚乙二醇水溶液。
90.(3)tf@gd-peg-spio(tgps)的制备
91.称取tf@gd1 ml和铁浓度为0.05mg/ml的spio-nh
2 1.33ml,将二者共混于10ml圆底烧瓶中,然后加入双醛基聚乙二醇水溶液,分多次加入,密切观察有无沉淀产生;如果有沉淀产生,则涡旋搅拌至没有沉淀,再继续加入剩余的双醛基聚乙二醇水溶液。在室温下搅拌48h,即可得到tf@gd-peg-spio(tgps),然后通过离心浓缩,纯水定容至1ml。置于4℃冰箱内保存。
92.实施例4、tgps纳米探针的ph响应分析
93.以实施例1制备的t1-t2双激活纳米探针为例,对本发明的t1-t2双激活纳米探针的ph响应进行分析。
94.将100μl实施例1制备的t1-t2双激活纳米探针分别加入900μl预先配置好的ph值为5.0、5.5、6.8、7.4的pbs溶液中,摇晃均匀,用3.0t的磁共振扫描仪进行测试,测试得到不同ph值下的t1加权成像t1wi和t2加权成像t2wi。重复三次扫描并测量弛豫时间,计算r1和r2。
95.结果如图4中的a-d所示,本发明制备的t1-t2双激活纳米探针具有良好的ph响应性,在中性环境下处于t1和t2信号双淬灭状态,而在酸性条件下能够同时实现t1和t2信号的激活,且随着酸性的增加,其激活效果也随之增强。
96.实施例5、酸性环境下tgps纳米探针的时间响应分析
97.以实施例1制备的t1-t2双激活纳米探针为例,对本发明的t1-t2双激活纳米探针在酸性环境下的时间响应进行分析。
98.将100μl实施例1制备的t1-t2双激活纳米探针加入900μl预先配置好的ph值为5.0的pbs溶液中,摇晃均匀后分别于2h、6h、12h和24h用3.0t的磁共振扫描仪进行测试,测试得到不同时间下的t1加权成像t1wi和t2加权成像t2wi。重复三次扫描并测量弛豫时间,计算r1和r2。
99.结果如图5中的a-d所示,本发明制备的t1-t2双激活纳米探针在生理ph值下稳定,mri信号变化不显著;在酸性ph条件下,试剂孵育时间越长,t1和t2信号的双激活效果也随之增强。表明本发明制备的纳米探针在酸性条件下,具有时间依赖性,随着时间的推移,信号激活越显著,为后面的细胞实验及体内实验打下基础。
100.实施例6、mri监测tgps纳米探针在小鼠肝脏微转移瘤内的释放
101.选用4t1乳腺癌细胞构建balb/c鼠脾脏注射肝转移模型,观察肝脏转移瘤生长情况,待长至肿瘤大小约1-3mm时,尾静脉注射200μl tgps纳米探针,注射前和注射后5h分别进行t1wi、t2wi、t1 map、t2 map序列扫描,选择信号相对均匀的区域作为roi区域,测量三次,取平均值。以上实验重复三次并测量弛豫时间,计算r1和r2。
102.结果如图6中的a-d所示,肝脏中的微小转移瘤在尾静脉注射200μltgps纳米探针后呈现激活状态,给药后5h肿瘤区域的r1和r2值明显升高,并且正常组织和肿瘤组织之间mr强度的对比度差异明显增大。结果表明,本发明制备的纳米探针可敏感性检出微小肿瘤病灶。
103.实施例7、mri监测tgps纳米探针在小鼠病灶内炎症的释放
104.构建裸大鼠肌肉内炎症模型:将100μl松节油缓慢注入裸大鼠肌肉间,spf级别饲养,注射后每两天观察裸大腿肌肉有无红肿、水肿以及裸大鼠精神状态,大约3-4天左右,发现裸大鼠大腿肌肉水肿后,尾静脉注射200μltgps纳米探针,在注射前和注射后3h、6h分别进行t1wi、t2wi、t1 map、t2 map序列扫描,选择信号相对均匀的区域作为roi区域,测量三次,取平均值。以上实验重复三次并测量弛豫时间,计算r1和r2。
105.结果如图7中的a-d所示,肌肉间的炎症病灶在给药后呈现更高的tgps积累,并且这种效应随着时间的推移而增加。结果表明,在炎症酸性环境下,本发明纳米探针发生t1-t2双激活效应,且随着时间的推移,激活效果越显著,本发明制备的探针对对体内炎症病灶也有良好的检出效能。
106.综上所述,本发明的ph响应性t1-t2双激活纳米探针具有ph响应性,在肿瘤微环境酸性条件下能够同时实现t1和t2信号的双激活,且随着酸性、时间的增加,激活效果也随之增强,能显著提高成像的性能和准确度;同时,所述的纳米探针具有良好的生物相容性和生物可降解性,且制备方法简单,有利于向临床转化应用。
107.尽管本发明的内容已经通过上述优选实施例作了详细介绍,但应当认识到上述的描述不应被认为是对本发明的限制。在本领域技术人员阅读了上述内容后,对于本发明的多种修改和替代都将是显而易见的。因此,本发明的保护范围应由所附的权利要求来限定。
