1.本发明涉及生物医药技术领域,具体而言,涉及一种鹰嘴豆有效部位及其制备方法和应用。
背景技术:
2.随着人民生活水平得到明显的提升,饮食结构发生改变,使得糖尿病的发病率呈现一个爆炸式的上升,俨然成为一种严重影响人们生活质量和生命健康的慢性代谢性疾病。2型糖尿病(diabetes mellitus type 2,t2dm)是一种以高血糖、胰岛素抵抗等为特征的代谢综合征疾病,t2dm患者占糖尿病患病人群的绝大多数。
3.t2dm的治疗不依赖胰岛素注射,临床上一些常用的治疗药物包括磺脲类、双胍类和非磺脲类等,t2dm是慢性代谢性疾病,需要长期治疗,但是长期服用西药可能给机体带来不可逆的伤害;如磺脲类药物远期使用不良反应发生率比较高,如恶心呕吐;双胍类药物在使用过程中可能出现乳酸性中毒现象等等。
4.因此,如何提供一种对于人体的毒副作用较小且具有降糖作用或糖尿病治疗作用的药物成为如今亟待解决的技术问题之一。
5.鉴于此,特提出本发明。
技术实现要素:
6.本发明的目的在于提供一种鹰嘴豆有效部位及其制备方法和应用。
7.本发明是这样实现的:
8.第一方面,本发明实施例提供了一种鹰嘴豆有效部位的制备方法,其包括以下步骤:采用第一萃取剂对鹰嘴豆醇提物的水溶液进行第一步萃取;其中,所述第一萃取剂选自乙酸乙酯和正丁醇中的至少一种。
9.第二方面,本发明实施例提供了一种鹰嘴豆有效部位,其包括由前述实施例所述的鹰嘴豆有效部位的制备方法制备获得。
10.第三方面,本发明实施例提供了如前述实施例所述的鹰嘴豆有效部位在制备用于改善糖尿病的药物或食品中的应用。
11.第四方面,本发明实施例提供了如前述实施例所述的鹰嘴豆有效部位在制备用于抑制α-葡萄糖苷酶活性的药物或食品中的应用。
12.第五方面,本发明实施例提供了如前述实施例所述的鹰嘴豆有效部位在制备用于增加细胞的葡萄糖消耗量的药物或食品中的应用。
13.第六方面,本发明实施例提供了如前述实施例所述的鹰嘴豆有效部位在制备用于促进细胞糖原合成的药物或食品中的应用。
14.本发明具有以下有益效果:
15.经过本发明的制备方法获得的鹰嘴豆有效部位具有显著改善ir hepg2细胞葡萄糖消耗量和糖原合成和α-糖苷酶抑制作用,可以作为原料或者辅助剂用于防治糖尿病的治
疗药物和保健品中。
附图说明
16.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
17.图1为鹰嘴豆乙酸乙酯部位细胞毒性;与0μg/ml组相比,*p<0.05,**p<0.01,***p<0.001;
18.图2为鹰嘴豆正丁醇部位细胞毒性;与0μg/ml组相比,*p<0.05,**p<0.01,***p<0.001;
19.图3为鹰嘴豆水层细胞毒性;与0μg/ml组相比,*p<0.05,**p<0.01,***p<0.001;
20.图4为鹰嘴豆不同部位对ir hepg2细胞细胞毒性影响;与control组相比,***p<0.001;与model组相比,#p<0.05,##p<0.01,###p<0.001;
21.图5为鹰嘴豆不同部位对ir hepg2细胞葡萄糖消耗量影响;注:与control组相比,***p<0.001;与model组相比,#p<0.05,##p<0.01,###p<0.001;与乙酸乙酯10μg/ml组相比,
▲
p<0.05,
▲▲
p<0.01,
▲▲▲
p<0.001;
22.图6为鹰嘴豆不同部位对α-葡萄糖苷酶抑制率;
23.图7为鹰嘴豆乙酸乙酯部位对ir hepg2细胞糖原合成影响;与model组相比,糖原合成量*p<0.05,**p<0.01,***p<0.001;
24.图8为鹰嘴豆乙酸乙酯部位的lc-ms图;
25.图9为鹰嘴豆乙酸乙酯部位的主成分结构图。
具体实施方式
26.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
27.本发明实施例提供了一种鹰嘴豆有效部位的制备方法,其包括以下步骤:采用第一萃取剂对鹰嘴豆醇提物的水溶液进行第一步萃取;其中,所述第一萃取剂选自乙酸乙酯和正丁醇中的至少一种。第一步萃取时获得的萃取产物可以作为鹰嘴豆有效部位,具有改善ir hepg2细胞葡萄糖消耗量、糖原合成和α-糖苷酶抑制作用,可以作为原料或者辅助剂用于防治糖尿病的治疗药物和保健品中。
28.本文中的“有效部位”可以理解为有效成分。
29.本文中的“醇提物”指采用醇类溶剂对鹰嘴豆进行提取所获得的提取物,醇类溶剂可以为乙醇,优选为体积浓度为60%~80%的乙醇溶液,乙醇对鹰嘴豆的提取步骤可基于现有技术获得。在一些实施例中,可以如下:鹰嘴豆粉中加入8~12倍体积的70%浓度的乙醇,采用超声提取提取1~3次,每次提取时间为28~32min,过滤,合并提取液,58~62℃左
右减压浓缩至无醇味,得到醇提物。
30.优选地,所述方法还包括对第一萃取剂的萃取产物进行分层收集,获取萃取产物的有机相和水相。有机相和水相可以分别作为鹰嘴豆的有效部位,比不分层收集时的有效部位具有更好的降糖效果。当萃取次数包括多次时,分别将每次萃取分离获得的有机相合并作为萃取剂对应的有效部位,水相则用于后一次萃取或作为区别于有机相的有效部位。
31.优选地,所述正丁醇为水饱和正丁醇。
32.相对于正丁醇和水饱和正丁醇而言,乙酸乙酯萃取获得的有效部位具有更好的降糖效果,可以更好的提高ir hepg2细胞细胞活性、ir hepg2细胞葡萄糖消耗量以及ir hepg2细胞糖原合成量,对α-葡萄糖苷酶具有更明显的抑制作用。优选地,所述第一步萃取的次数为1~5次,优选为3~5次,3~5次可进行更为充分的萃取。优选地,所述第一萃取剂每次萃取时与待萃取物的体积比为(0.5~1.5):(0.5~1.5),优选为1:1。
33.优选地,所述第一萃取剂为乙酸乙酯,由乙酸乙醇萃取获得的有机相的集合记为乙酸乙酯部位,其主要成分包含三叶豆紫檀苷、鹰嘴豆芽素a、芒柄花素和刺芒柄花苷。
34.优选地,当所述第一萃取剂为乙酸乙酯时,所述制备方法还包括:采用第二萃取剂对乙酸乙酯萃取产物中的水相进行第二步萃取,分层获取对应的有机相和水相;其中,所述第二萃取剂为极性大于乙酸乙酯的有机溶剂。需要说明的是,第一步萃取、第二步萃取以及后续的第三步萃取不是对萃取顺序的限定,萃取的顺序按照陈述的流程进行。
35.优选地,所述第二步萃取的次数为1~5次,优选为3~5次,3~5次可进行更为充分的萃取。优选地,所述第二萃取剂每次萃取时与待萃取物的体积比为(0.5~1.5):(0.5~1.5)。优选地,所述第二萃取剂为正丁醇,更优选为水饱和正丁醇。
36.优选地,所述制备方法还包括:所述制备方法还包括:先采用第三萃取剂对鹰嘴豆醇提物的水溶液进行第三步萃取,然后将萃取产物中的水相作为所述第一萃取剂的待萃取物;其中,所述第三萃取剂为极性小于所述第一萃取剂的有机溶剂。提前采用极性小于乙酸乙酯的萃取剂对鹰嘴豆醇提物的水溶液进行萃取能够过滤掉一些对于有效部位功能(如降糖功能)无明显助益的物质,使得后续在乙酸乙酯部位的成分纯度更高,具备的降糖功能也更加具有针对性。
37.优选地,所述第三步萃取的次数为1~5次;优选为3~5次,3~5次可进行更为充分的萃取。优选地,所述第三萃取剂每次萃取时与待萃取物的体积比为(0.5~1.5):(0.5~1.5)。优选地,所述第三萃取剂选自石油醚和环己烷中的至少一种。
38.可以理解的是,在没有进行明确的限定下,第一~三步萃取的条件为常温常压。
39.本发明实施例还提供了一种鹰嘴豆有效部位,其包括由前述任意实施例所述的鹰嘴豆有效部位的制备方法制备获得。
40.本发明实施例还提供了如前述实施例所述的鹰嘴豆有效部位在制备用于改善糖尿病的药物或食品中的应用。
41.优选地,所述糖尿病包括ii型糖尿病。
42.优选地,所述改善糖尿病包括改善糖尿病并发症,并发症可以为糖尿病肾病和糖尿病脑病中的至少一种。
43.本发明实施例还提供了如前述任意实施例所述的鹰嘴豆有效部位在制备用于抑制α-葡萄糖苷酶活性的药物或食品中的应用。
44.本发明实施例还提供了如前述任意实施例所述的鹰嘴豆有效部位在制备用于增加细胞的葡萄糖消耗量的药物或食品中的应用。
45.优选地,所述细胞包括ir hepg2细胞。
46.此外,本发明实施例还提供了如前述任意实施例所述的鹰嘴豆有效部位在制备用于促进细胞糖原合成的药物或食品中的应用。
47.优选地,所述细胞包括ir hepg2细胞。
48.以下结合实施例对本发明的特征和性能作进一步的详细描述。
49.实施例1
50.一种鹰嘴豆改善糖尿病并发症有效部位的制备方法,包括以下步骤。
51.a、提取:鹰嘴豆粉中加入10倍体积的70%浓度的乙醇,采用超声提取提取1-3次,每次提取时间为30min,过滤,合并提取液,60℃左右减压浓缩至无醇味,得到醇提物;
52.b、萃取:将步骤a中醇提物用水复溶,在室温条件下依次用石油醚、乙酸乙酯、水饱和正丁醇进行萃取,具体包括:
53.采用石油醚(第三萃取剂)对醇提物的水溶液进行萃取,石油醚和水溶液的体积比为1:1,充分振荡后,静置30min分层,移出上层的有机相,重复此操作3-5次(上层有机相无明显颜色为止),将获得的水相用于后续萃取;
54.采用乙酸乙酯(第一萃取剂)对经石油醚萃取后获得的水相进行萃取,乙酸乙酯和水相的体积比为1:1,充分振荡后,静置30min分层,移出上层的有机相,重复此操作3-5次(上层有机相无明显颜色为止),合并有机相萃取液减压浓缩,即得到鹰嘴豆乙酸乙酯部位,将萃取产物中的水相用于后续正丁醇的萃取;
55.采用水饱和正丁醇(第二萃取剂)对经乙酸乙酯萃取后获得的水相进行萃取,乙酸乙酯和水相的体积比为1:1,充分振荡后,静置30min分层,移出上层的有机相,重复此操作3-5次(上层有机相无明显颜色为止),合并有机相萃取液减压浓缩,即得到鹰嘴豆正丁醇部位,将水相作为另外的有效部位(水层)。
56.实施例2
57.鹰嘴豆不同有效部位干预浓度的确定。
58.1、取对数生长期hepg2细胞,制成细胞悬液,调整细胞浓度为1
×
105个/ml接种于96孔板,细胞悬液为100μl/孔然后将细胞培养板置于37℃,5%二氧化碳培养箱中培养24小时,使细胞贴壁。
59.2、给药:用鹰嘴豆不同极性部位的不同浓度处理细胞24h。
60.3、cck-8检测细胞毒性:采用cck-8进行显色,10μl/孔。1小时反应完成后,取出细胞培养板混匀,放入酶标仪,450nm处进行结果测定并记录。按照下列公式计算样品对hepg2细胞活力的影响。
61.细胞活力(%)=[(实验组a-对照组a)/(正常组a-对照组a)]
×
100%。
[0062]
鹰嘴豆乙酸乙酯部位细胞毒性结果见图1,鹰嘴豆水饱和正丁醇部位细胞毒性结果见图2,鹰嘴豆水层细胞毒性结果见图3。
[0063]
结果显示:鹰嘴豆水饱和正丁醇部位和水层在1~10ug/ml浓度对hepg2细胞没有细胞毒性;乙酸乙酯部位在1~50ug/ml浓度范围对hepg2细胞没有细胞毒性,且10ug/ml和50ug/ml组可显著提高hepg2细胞活性。
[0064]
实施例3
[0065]
鹰嘴豆不同有效部位对ir hepg2细胞毒性考察。
[0066]
1、hepg2细胞胰岛素抵抗模型(ir hepg2)的建立:利用葡萄糖胺(glucosamin)制成4mol/l(溶解在5mm dmem,不含血清),加入到细胞培养板中18个小时使hepg2细胞产生胰岛素抵抗。
[0067]
2、细胞铺板:取对数生长期hepg2细胞,制成细胞悬液,调整细胞浓度为1
×
105个/ml接种于96孔板,细胞悬液为100μl/孔然后将细胞培养板置于37℃,5%二氧化碳培养箱中培养24小时,使细胞贴壁。
[0068]
3、给药:各部位给药的低中高浓度为1μg/ml、5μg/ml、10μg/ml。分组:对照组、模型组(胰岛素抵抗模型)、不同部位(1μg/ml、5μg/ml、10μg/ml)、二甲双胍组(met),不同组别及同个组别的不同浓度均重复实验6次。
[0069]
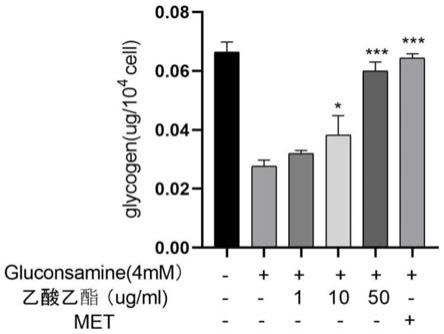
4、cck-8检测细胞毒性:采用cck-8进行显色,10μl/孔。1小时反应完成后,取出细胞培养板混匀,放入酶标仪,450nm处进行结果测定并记录。按照下列公式计算样品对hepg2细胞活力的影响。
[0070]
细胞活力(%)=[(实验组a-对照组a)/(正常组a-对照组a)]
×
100%。
[0071]
结果见图4和表1。
[0072]
表1 不同部位对ir hepg2细胞活力的影响
[0073][0074]
注:与模型组比较,*p<0.05,**p<0.01,***p<0.001。
[0075]
结果显示:鹰嘴豆不同部位给药后都可以有效的提升细胞活力,但乙酸乙酯组最为明显,且与阳性药二甲双胍组无统计学差异。
[0076]
实施例4
[0077]
鹰嘴豆不同极性部位对ir hepg2细胞葡萄糖消耗量的影响。
[0078]
hepg2细胞胰岛素抵抗模型建立见实施例3,用葡萄糖测试试剂盒进行葡萄糖含量测定,并按照下列公式计算各组细胞的葡萄糖消耗量。
[0079]
葡萄糖消耗量(mm)=葡萄糖浓度
空白组-葡萄糖浓度
对照/处理组
。
[0080]
结果见图5和表2。
[0081]
表2 不同部位对ir hepg2葡萄糖消耗量的影响
[0082][0083][0084]
注:与模型组比较,*p<0.05,**p<0.01,***p<0.001。与乙酸乙酯组5μg/ml相比,ap<0.05,
aa
p<0.01,
aaa
p<0.001;与乙酸乙酯组10μg/ml组相比,bp<0.05,
bb
p<0.01,
bbb
p<0.001。
[0085]
结果显示鹰嘴豆的不同部位都可以一定程度上增加hepg2细胞的葡萄糖消耗量,且乙酸乙酯部位能够最为显著的增加细胞的葡萄糖消耗量,并呈现浓度依赖趋势。
[0086]
实施例5
[0087]
鹰嘴豆不同部位对α-糖苷酶抑制活性的影响。
[0088]
预先配制一系列不同部位不同浓度供试样品溶液,阿卡波糖为阳性对照,并以不加样品溶液作空白对照,该实验所用到的试剂均用微孔滤膜过滤。取200μl样品溶液与200μl 0.04u/mlα-葡萄糖苷酶(0.01mm磷酸缓冲液配制)混合,37℃水浴5min,加入100μl 0.5mm pnpg溶液(0.01mm磷酸缓冲液配制),37℃水浴30min,加入500μl 0.1m na2co3溶液终止反应,反应结束,在酶标仪405nm处测定od值,通过检测pnp生成量确定α-葡萄糖苷酶活性。实验重复3次。按照下列公式计算各组样品对α-葡萄糖苷酶活性的抑制率:抑制率=(1-od
实验组
/od
空白组
)
×
100%。
[0089]
结果见表3和图6。
[0090]
表3 鹰嘴豆不同部位对α-糖苷酶抑制活性的影响
[0091][0092]
结果显示:在相同浓度下,鹰嘴豆不同极性部位对α-葡萄糖苷酶有不同程度的抑制作用,乙酸乙酯部位的抑制作用最强。
[0093]
实施例6
[0094]
鹰嘴豆有效部位对ir hepg2细胞糖原合成的影响。
[0095]
分组:对照组、模型组、有效部位(乙酸乙酯部位)组根据实施例1筛选结果确定低中高给药浓度为1μg/ml、10μg/ml、50μg/ml,1mm二甲双胍为阳性对照组。hepg2细胞胰岛素抵抗模型建立见实施例2。4mm葡萄糖胺造模18h,接着给药24h后,收集细胞,根据说明书处理细胞,通过试剂盒所示公式计算各组细胞的糖原合成量。
[0096]
糖原(mg/104cell)=(c
标准
×v1
)
×
(a
3-a1)
÷
(a
2-a1)
÷
(细胞数量
×v1
÷v2
)
÷
1.11;
[0097]
说明:1.11为此法葡萄糖含量换算为糖原含量的常数;c标准:标准管浓度0.1mg/ml;v1:待测样本加入反映体系中的体积;v2:样本总体积;细胞数量:以104为单位,万个。
[0098]
结果表4和图7。
[0099]
表4 乙酸乙酯部位对ir hepg2糖原合成的影响
[0100][0101]
注:与模型组比较,*p<0.05,**p<0.01,***p<0.001。
[0102]
结果表明:与模型组相比,有效部位组1μg/ml组无统计学差异,有效部位10μg/ml和50μg/ml组的糖原含量明显增加且有统计学差异;与met组相比,有效部位50μg/ml糖原合成量无显著性差异。
[0103]
实施例7
[0104]
对鹰嘴豆改善糖尿病最佳活性部位(实施例1的乙酸乙酯部位)采用lc-ms技术进行成分分析,结果见图8。
[0105]
由图8可知,乙酸乙酯部位的主要成分包含三叶豆紫檀苷、鹰嘴豆芽素a、芒柄花素和刺芒柄花苷,具体结构式参照图9。
[0106]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
