一种预防新型冠状病毒肺炎covid-19的疫苗及其制备方法
技术领域
1.本发明涉及免疫学技术、生物技术及生物医药领域,具体涉及一种预防新型冠状病毒肺炎covid-19的疫苗及其制备方法。
背景技术:
2.冠状病毒是一种带有rna的正向包膜病毒,其基因组大小约为26~32kb,是已知基因组最大的rna病毒。基因组rna和磷酸化核衣壳(n)蛋白被埋在磷脂双层中并被刺突糖蛋白三聚体(s)覆盖,膜(m)蛋白(iii型跨膜糖蛋白)和包膜(e)蛋白位于病毒包膜的s蛋白之间。冠状病毒具有多种宿主,包括禽类和哺乳动物,特别是蝙蝠。冠状病毒是在自然界中广泛存在的一类病毒,可引起包括呼吸道、消化道及神经系统在内的多系统疾病,高致病性冠状病毒感染已成为近10年来广受关注的公共卫生问题。2002年11月,首例严重急性呼吸系统综合症(sars)发生在中国佛山。2012年,中东呼吸综合征冠状病毒(mers-cov)是21世纪发现的第二种高致病性冠状病毒。mers-cov的死亡率很高,多达40%的患者死亡。2019新型冠状病毒(sars-cov-2)于2019年12月首次发现,其感染导致的新型冠状病毒肺炎(covid-19)正在影响全球上百万的患者。
3.covid-19患者会出现不同程度的症状,从发烧或轻度咳嗽到肺炎,更严重者甚至死亡。目前covid-19的致死率约为2%至4%,尽管死亡率低于sars和mers,但新型冠状病毒(sars-cov-2)具有潜伏期长、传染性强和重症率较高的特点,与引发非典型肺炎的sars病毒不同,部分病例潜伏期具有传染性,另有一些病毒携带者没有表现出任何明显症状,这增加了疫情的防控难度。因此,快速研制出能够提升群体免疫水平并阻断病毒传播的预防疫苗已成为全球当前最为迫切的重大需求。
4.sars-cov-2的核衣壳由核衣壳蛋白(nucleocapsid protein,n)包裹单股正链rna形成;外有包膜,嵌有三种糖蛋白:刺突蛋白(spikeprotein,s)、包膜蛋白(envelope protein,e)和膜蛋白(membrane protein,m)。s蛋白位于病毒最外层,在膜上规则排列成冠状结构,参与病毒与宿主细胞表面的病毒受体结合并介导病毒通过膜融合进入细胞的过程,在诱导宿主产生中和抗体过程中起重要作用。目前国内外covid-19疫苗的研发均是以s蛋白作为首要目标抗原,但有报道称同属冠状病毒的sars-cov的s蛋白也可能诱发抗体依赖性免疫增强反应(ade),因此筛选s蛋白中特异性片段(即多肽)作为抗原,可以有效的预防covid-19同时避免潜在ade的发生。
5.自18世纪末期人类首次应用生物制品牛痘疫苗以来,疫苗已在消除多种传染病中发挥了不可替代的作用。在covid-19被确认后,国内外多家机构开展了covid-19疫苗的研究,目前有至少5条技术路线在同步开展,包括核酸疫苗、病毒载体疫苗、灭活疫苗、重组蛋白疫苗、减毒流感病毒载体疫苗等,但鉴于疫苗的自身特点,疫苗要严格按照国家规定的研发生产流程进行,在动物实验通过后,还必须完成中试研究、临床申报及i~iii期的临床试验研究,获得批准后才有可能正式进入生产阶段。sars疫苗被搁置至今,正是因为ii期临床试验后,疫情已完全控制,无法再进行ⅲ期试验。目前对covid-19疫苗的后期临床实试验设
no.5所示多肽与crm197的偶联物、氨基酸序列是seq id no.6所示多肽与tt的偶联物和氨基酸序列是seq id no.7所示多肽与tt的偶联物组成。
21.(3)氨基酸序列是seq id no.4所示多肽与crm197的偶联物、氨基酸序列是seq id no.5所示多肽与crm197的偶联物、氨基酸序列是seq id no.6所示多肽与crm197的偶联物、氨基酸序列是seq id no.7所示多肽与crm197的偶联物和氨基酸序列是seq id no.2所示多肽与crm197的偶联物组成。
22.(4)氨基酸序列是seq id no.4所示多肽与crm197的偶联物、氨基酸序列是seq id no.5所示多肽与crm197的偶联物、氨基酸序列是seq id no.6所示多肽与crm197的偶联物、氨基酸序列是seq id no.7所示多肽与crm197的偶联物和氨基酸序列是seq id no.2所示多肽与tt的偶联物组成。
23.(5)氨基酸序列是seq id no.4所示多肽与crm197的偶联物、氨基酸序列是seq id no.5所示多肽与crm197的偶联物、氨基酸序列是seq id no.6所示多肽与crm197的偶联物、氨基酸序列是seq id no.7所示多肽与crm197的偶联物、氨基酸序列是seq id no.2所示多肽与crm197的偶联物和氨基酸序列是seq id no.1所示多肽与crm197的偶联物组成。
24.(6)氨基酸序列是seq id no.4所示多肽与crm197的偶联物、氨基酸序列是seq id no.5所示多肽与crm197的偶联物、氨基酸序列是seq id no.6所示多肽与crm197的偶联物、氨基酸序列是seq id no.7所示多肽与crm197的偶联物、氨基酸序列是seq id no.2所示多肽与crm197的偶联物和氨基酸序列是seq id no.1所示多肽与m-omp的偶联物组成。
25.(7)氨基酸序列是seq id no.4所示多肽与crm197的偶联物、氨基酸序列是seq id no.5所示多肽与crm197的偶联物、氨基酸序列是seq id no.6所示多肽与crm197的偶联物、氨基酸序列是seq id no.7所示多肽与crm197的偶联物、氨基酸序列是seq id no.2所示多肽与crm197的偶联物、氨基酸序列是seq id no.10所示多肽与m-omp的偶联物和氨基酸序列是seq id no.11所示多肽与dt的偶联物组成。
26.(8)氨基酸序列是seq id no.4所示多肽与crm197的偶联物、氨基酸序列是seq id no.5所示多肽与crm197的偶联物、氨基酸序列是seq id no.6所示多肽与crm197的偶联物、氨基酸序列是seq id no.7所示多肽与crm197的偶联物、氨基酸序列是seq id no.2所示多肽与crm197的偶联物、氨基酸序列是seq id no.10所示多肽与tt的偶联物和氨基酸序列是seq id no.11所示多肽与tt的偶联物组成。
27.(9)氨基酸序列是seq id no.1-11所有多肽与crm197的偶联物组成。
28.一种预防新型冠状病毒肺炎covid-19的疫苗,其活性成分包括上述免疫原性偶联物的组合物。
29.进一步地,所述疫苗还包括药学上可接受的佐剂。
30.进一步地,所述佐剂为氢氧化铝(al(oh)3)、磷酸铝(alpo4)、单磷酸脂质a(mpl)或寡核苷酸(cpg)的一种或多种组合。
31.进一步地,所述佐剂为给予人类,其含量为每剂量1μg-1000μg,优选每剂量10μg-500μg,更优选每剂量10μg-200μg,更优选每剂量10-100μg,最优选每剂量10-50μg。
32.进一步地,所述疫苗为任何药学上可接受的剂型,包括肌肉注射、皮下注射、皮内注射、微针注射的给药方式。
33.进一步地,所述疫苗为任何药学上可接受的剂量。
34.所述疫苗的制备方法,具体包括以下步。
35.步骤1、使用全自动微波多肽合成仪,采用fmoc固相合成法,添加固相载体、不同的氨基酸、脱除剂和多肽缩合试剂等,进行目标多肽的全自动合成。
36.步骤2、将步骤1合成的多肽通过linker分别与药学上可接受的载体蛋白(包括白喉无毒突变体crm197、破伤风类毒素tt、白喉类毒素dt或脑膜炎球菌外膜蛋白中的任意一种)进行共缀结合,形成免疫原性偶联物。其中,所用linker优选smcc或dsap。
37.步骤3、将步骤2制备免疫原性偶联物与药学上可接受的佐剂混合制备成疫苗。
38.进一步地,所述步骤3具体方法是取免疫原性偶联物与佐剂、pbs溶液混合,室温摇床1小时,30rpm,所得终浓度含多肽抗原100μg/ml、佐剂0.5mg/ml,即为最终样品;或者首先将免疫原性偶联物吸附到铝佐剂上,室温摇床1小时,30rpm,随后加入mpl或者cpg佐剂,室温摇床1小时,30rpm,所得终浓度含多肽抗原100μg/ml、铝佐剂0.5mg/ml、mpl或者cpg含量为0.5mg/ml,即为最终样品;或者将制备的单肽吸附疫苗,等量混合,摇匀,即得多肽疫苗。
39.所述免疫原性偶联物的组合物在制备用于预防或治疗新型冠状病毒肺炎covid-19的药物中的应用。
40.进一步地,所述药物为任何药学上可接受的剂型。
41.进一步地,所述药物为任何药学上可接受的剂量。
42.与现有技术比,本发明的有益效果如下。
43.本发明提供的合成多肽是基于covid-19病毒s蛋白序列中筛选出具有特异性抗原性的序列,将其合成目标多肽,降低疫苗生产所需的场地要求,易于大规模批量生产;将合成目标多肽通过与载体蛋白结合制备成多肽偶联物,加入佐剂制备成为合成肽疫苗,用于covid-19病毒的预防,相对于传统的弱毒苗和灭活苗以及其他几种新型的疫苗,合成肽类疫苗安全、无毒、稳定,由于其分子结构小而简单,很少会出现严重的并发症及医源性感染问题。
44.本发明提供的多肽基于covid-19病毒s蛋白序列中筛选出具有特异性抗原性的序列,并在体外合成短肽,将多种短肽组合,与全序列相比可以降低副作用发生风险;现有报道表明covid-19病毒已发生变异,与本发明提供的多肽序列对比,未发生所有序列同时变异现象,有效的降低变异导致的抗原性损失,同时可以快速筛选出序列变异部分,增加新的短肽,合成制备新疫苗,能够快速应对病毒变异,减少研发成本及研发周期。
45.本发明提供预防covid-19的疫苗,采用多肽与蛋白载体结合技术,增强了人体免疫反应,放大多肽抗原性,增加中和抗体产生,增强疫苗效力,同时采用不同佐剂及不同给药方式,具有普遍适用性,适应多年龄段人群使用。
附图说明
46.图1是sds-page检测偶联物中载体蛋白结合的电泳图。
47.图2是sds-page检测偶联物中载体蛋白结合的电泳图。
48.图3是sds-page检测偶联物中载体蛋白结合的电泳图。
49.图4是sds-page检测偶联物中载体蛋白结合的电泳图。
50.图5是sds-page检测偶联物中载体蛋白结合的电泳图。
51.图6是sds-page检测偶联物中载体蛋白结合的电泳图。
52.图7是sds-page检测偶联物中载体蛋白结合的电泳图。
53.图8是sds-page检测偶联物中载体蛋白结合的电泳图。
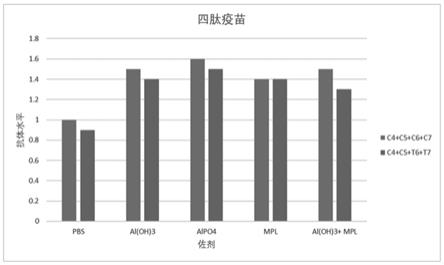
54.图9是两种四价肽疫苗与不同佐剂组合后抗体水平。
55.图10是两种五价肽疫苗与不同佐剂组合后抗体水平。
56.图11是两种六价肽疫苗与不同佐剂组合后抗体水平。
57.图12是两种七价肽疫苗与不同佐剂组合后抗体水平。
58.图13是十一价肽疫苗与不同佐剂组合后抗体水平。
具体实施方式
59.下面结合实施例和附图对本发明作进一步的阐述,以下实施例仅为本发明的优选实施例,并不限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
60.实施例1目标多肽的合成方法。
61.1、采用常规的固相合成多肽的方法,制备了氨基酸序列是seq id no.1-seq no.11所示的多肽,具体步骤如下。
62.(1)脱fmoc保护。
63.将市售的rink amide am resin装入一个有过滤器且耐有机溶剂的反应管中,并用一个耐有机溶剂的盖子盖紧。用dmf(二甲基甲酰胺)洗涤1分钟后,加入过量的20%哌啶/dmf(体积比)溶液,盖紧后轻轻摇晃反应管,使之混合均匀并保持脱除fmoc保护15分钟。抽干后再用dmf洗涤三次。
64.(2)肽键缩合。
65.将经过预活化(预活化2-3分钟后)的3倍树脂氨基摩尔量的fmoc保护的氨基酸、3倍树脂氨基摩尔等量的活化剂hbtu、以及6倍树脂氨基摩尔等量的dipea(n,n-二异丙基乙基胺)加入反应管中,使用dmf作为溶剂,并保证以上的试剂完全溶解,可完全覆盖树脂。每隔2-3分钟摇晃混匀树脂一次,反应20-30分钟。
66.然后,室温下加入50倍摩尔过量的乙酸酐dmf溶液后10分钟抽干,再在室温下加入过量的20%哌啶/dmf(体积比)溶液反应30分钟。过滤掉溶液,树脂用dmf洗涤5次。
67.以上步骤循环反复执行,直到拟合成多肽的全部fmoc保护氨基酸按线性方式连接到树脂上。
68.(3)多肽裂解。
69.多肽裂解液选用强酸处理,比如tfa(三氟乙酸)。室温下用tfa水edt二巯基乙醇苯酚(体积比:92.5:2.5:2.5:2.5)处理树脂2小时。然后仔细收集裂解液到一个玻璃收集器中,并加入用冰预冷的乙醚,收集沉淀多肽,并继续用冷乙醚洗涤5-6次,得到粗品肽。
70.(4)多肽纯化。
71.粗品肽经过hplc(高效液相色谱)纯化,收集,冻干,最终再经hplc检验纯度(214nm波长)大于85%及质谱检验正确的分子量。
72.2.鉴定结果。
73.合成多肽化合物的纯度以及分子量结果见表1。
74.表1.氨基酸序列是seq id no.1-seq no.11所示的多肽结果。
75.seq id no.1-seq no.11所示的多肽经特异性抗原性实验测定具有较强的抗原性强,可在人体内诱导出中和抗体。
76.实施例2免疫原性偶联物的制备方法。
77.实施例1得到的合成肽(s1-s11)通过smcc linker或dsap linker分别与crm197、tt、dt、m-m-omp形成偶联物的列表见表2。
78.tt破伤风毒素蛋白、破伤风毒素,可以通过破伤风杆菌,经过发酵,裂解,离心,层析纯化获得。
79.dt白喉毒素蛋白、白喉毒素载体蛋白dt,可以通过白喉杆菌,经过发酵,裂解,离心,层析纯化获得。
80.crm197重组白喉毒素蛋白,crm197是基因序列重新构建的白喉杆菌,经过发酵,裂解,离心,层析纯化获得。
81.脑膜炎球菌外膜蛋白(m-omp),脑膜炎球菌,经过发酵,裂解,离心,层析纯化获得。
82.1.合成肽(s1-s11)通过smcc linker或dsap linker与crm197结合成偶联物。
83.crm197蛋白用含有2mm的edta的pbs溶液配制成浓度为1mg/ml溶液。取需要量的crm197溶液,按照摩尔比1:2-1:40加入sulfo-smcc(10mg/ml),室温反应1小时,反应液用超滤浓缩管于4℃,3500rpm离心浓缩。体积浓缩至反应液的1/10后加入pbs至原反应液体积,继续离心浓缩,连续离心浓缩5次以去除游离sulfo-smcc。最终获得的crm197-smcc储液浓度为10mg/ml。称取需要量的合成肽(s1-s4,s6,s8-11),用pbs或含有10%dmso pbs溶液溶解,按照摩尔比15:1-1:1加入crm197-smcc储液,可添加pbs至适宜的反应体积,室温反应1h,sds-page检测共缀情况,电泳图如图1和2所示。
84.称取需要量的合成肽(s5和s7),用dmso溶解,按照摩尔比1:2-1:30加入dsap(10mg/ml dmso溶液)混合,加入三乙胺(30倍摩尔比),室温反应过夜,加入500μl napi(ph7.4,0.1m),用1ml氯仿提取三次,离心后将水相加入到crm197(2mg/ml napi(ph7.4,
0.1m))溶液中,合成肽与crm197蛋白的摩尔比为10:1-1:1,室温反应24小时,sds-page检测共缀情况,电泳图如图1和图2所示。
85.2.合成肽(s1-s11)通过smcc linker或dsap linker与tt蛋白结合成偶联物。
86.tt蛋白用含有2mm的edta的pbs溶液配制成浓度为1mg/ml溶液,取需要量的tt蛋白溶液按照摩尔比1:2-1:40加入sulfo-smcc(10mg/ml),室温反应1小时,反应液用超滤浓缩管于4℃,3500rpm离心浓缩。体积浓缩至反应液的1/10后加入pbs至原反应液体积,继续离心浓缩,连续离心浓缩5次以去除游离sulfo-smcc。最终获得的tt-smcc储液浓度为10mg/ml。称取需要量的合成肽(s1-s4,s6,s8-11)用pbs或含有10%dmso pbs溶液溶解,按照摩尔比15:1-1:1加入tt-smcc储液,可添加pbs至适宜的反应体积,室温反应1h,sds-page检测共缀情况,电泳图如图3和图4所示。
87.称取需要量的合成肽(s5和s7)用dmso溶解,按照摩尔比1:2-1:30加入dsap(10mg/mldmso溶液)混合,加入三乙胺(30倍摩尔比),室温反应过夜,加入500μl napi(ph7.4,0.1m),用1ml氯仿提取三次,离心后将水相加入到tt(2mg/ml napi(ph7.4,0.1m))溶液中,合成肽与tt蛋白的摩尔比为10:1-1:1,室温反应24小时,sds-page检测共缀情况,电泳图如图3和图4所示。
88.3.合成肽(s1-s11)通过smcc linker或dsap linker与dt结合成偶联物。
89.dt蛋白用含有2mm的edta的pbs溶液配制成浓度为1mg/ml溶液,取需要量的dt溶液,按照摩尔比1:2-1:40加入sulfo-smcc(10mg/ml),室温反应1小时,反应液用超滤浓缩管于4℃,3500rpm离心浓缩。体积浓缩至反应液的1/10后加入pbs至原反应液体积,继续离心浓缩,连续离心浓缩5次以去除游离sulfo-smcc。最终获得的dt-smcc储液浓度为10mg/ml。称取需要量的合成肽(s1-s4,s6,s8-11)用pbs或含有10%dmso pbs溶液溶解,按照摩尔比15:1-1:1加入dt-smcc储液,可添加pbs至适宜的反应体积,室温反应1h,sds-page检测共缀情况,电泳图如图5和图6所示。
90.称取需要量的合成肽(s5和s7)用dmso溶解,按照摩尔比1:2-1:30加入dsap(10mg/ml dmso溶液)混合,加入三乙胺(30倍摩尔比),室温反应过夜,加入500μl napi(ph7.4,0.1m),用1ml氯仿提取三次,离心后将水相加入到dt(2mg/ml napi(ph7.4,0.1m))溶液中,合成肽与dt蛋白的摩尔比为10:1-1:1,室温反应24小时,sds-page检测共缀情况,电泳图如图5和图6所示。
91.4.合成肽(s1-s11)通过smcc linker或dsap linker与m-omp结合成偶联物。
92.m-omp蛋白用含有2mm的edta的pbs溶液配制成浓度为1mg/ml溶液.取需要量的m-omp溶液,按照摩尔比1:2-1:40加入sulfo-smcc(10mg/ml),室温反应1小时,反应液用用超滤浓缩管于4℃,3500rpm离心浓缩。体积浓缩至反应液的1/10后加入pbs至原反应液体积,继续离心浓缩,连续离心浓缩5次以去除游离sulfo-smcc。最终获得的m-omp-smcc储液浓度为10mg/ml。称取需要量的合成肽(s1-s4,s6,s8-11),用pbs或含有10%dmso pbs溶液溶解,按照摩尔比15:1-1:1加入m-omp-smcc储液,可添加pbs至适宜的反应体积,室温反应1h,sds-page检测共缀情况,电泳图如图7和图8所示。
93.称取需要量的合成肽(s5和s7)用dmso溶解,按照摩尔比1:2-1:30加入dsap(10mg/ml dmso溶液)混合,加入三乙胺(30倍摩尔比),室温反应过夜,加入500μlnapi(ph7.4,0.1m),用1ml氯仿提取三次,离心后将水相加入到m-omp(2mg/ml napi(ph7.4,0.1m))溶液
中,合成肽与m-omp蛋白的摩尔比为10:1-1:1,室温反应24小时,sds-page检测共缀情况,电泳图如图7和图8所示。
94.表2.多肽与不同载体结合列表。
95.注:命名规则:“载体首字母”+“多肽编号”。
96.实施例3四价肽疫苗的制备及免疫效果。
97.一、疫苗制备。
98.1、材料。
99.实施例2中制备的多肽偶联物。
100.佐剂:氢氧化铝(al(oh)3)、磷酸铝(alpo4)、mpl、cpg。
101.2、制备方法。
102.选取实施例2中的合成肽与不同载体蛋白结合后的免疫原性偶联物,优选序列seq id no.4、5、6、7不同免疫原性偶联物,与不同佐剂组合,制备四价肽疫苗,四种多肽总浓度为100ug/ml,具体组合方案见表3。
103.表3.多肽偶联物与佐剂交叉组合方案。
104.注:组合序号命名规则:按照数字大小排列偶联物,“偶联物载体首字母”+“佐剂编号”。
105.二、免疫效果实验。
106.将表3中的疫苗免疫小鼠进行免疫原性的研究,将体重为12-14g的健康balb/c小鼠随机分组,每组8-10只小鼠;将下表中的待测样品对小鼠后肢进行肌肉注射,于第0天、第
14天、第28天各肌肉注射1次,每次给药体积为100ul/只,分别于第0天和第28天注射前采血1次,静置过夜后分离血清,将血清稀释后,采用酶联免疫吸附(elisa)方法,测定第0天和第21天血清中的抗体水平,具体操作为。
107.(1)包被液(0.05m碳酸盐-碳酸氢盐缓冲液)将多肽储备液稀释为终浓度为5μg/ml的工作液(dmso含量不高于0.05%),充分混匀后按100μl/孔加入酶标板,贴上封片纸,2~8℃过夜包被。
108.(2)吸掉上清,pbst洗5遍,加入100ul 1%bsa的pbs室温封闭1h。
109.(3)pbst洗5次。
110.(4)加样:加入100ul稀释后的血清样品,室温孵育2h,用pbst洗5次。
111.(5)加酶标抗体:加入100ul稀释后山羊抗小鼠igg hrp酶标二抗,室温孵育1h。
112.(6)pbst洗5次。
113.(7)加底物液显色:加入100ul tmb显色。
114.(8)终止反应:加入50ul 1n硫酸终止反应。
115.(9)结果判定:测od
450
值,结果见表4和图9。
116.表4.两种四肽疫苗与不同佐剂组合后抗体水平。
117.图9表明,两种四价肽疫苗的抗体滴度均能达到0.9以上,不同组合差异不明显,加入佐剂后能显著增加抗体水平,不同佐剂间差异不明显。
118.实施例4五价肽疫苗的制备及免疫效果。
119.一、疫苗制备。
120.1、材料。
121.实施例2中制备的多肽偶联物。
122.佐剂:氢氧化铝(al(oh)3)、磷酸铝(alpo4)、mpl、cpg。
123.2、制备方法。
124.选取实施例2中的合成肽与不同载体蛋白结合后的免疫原性偶联物,选取实施例3中四肽疫苗中c4+c5+c6+c7,选取增加序列seq id no.2免疫原性偶联物,与不同佐剂组合,制备五价肽疫苗,五种多肽的总浓度为100ug/ml,具体组合方案见表5。
125.表5.多肽偶联物与佐剂交叉组合方案。
126.注:组合序号命名规则:“四肽疫苗命名为4”+“偶联物载体首字母”+“佐剂编号”。
127.二、免疫效果实验。
128.参照实施例3中免疫效果检测方法,检测免疫效果,结果见表6和图10。
129.表6.两种五肽疫苗与不同佐剂组合后抗体水平。
130.图10表明,两种五价肽疫苗的抗体滴度均能达到0.9以上,不同组合差异不明显,加入佐剂后能显著增加抗体水平,不同佐剂间差异不明显。
131.实施例5六价肽疫苗的制备及免疫效果。
132.一、疫苗制备。
133.1、材料。
134.实施例2中制备的多肽偶联物。
135.佐剂:氢氧化铝(al(oh)3)、磷酸铝(alpo4)、mpl、cpg。
136.2、制备方法。
137.选取实施例2中的合成肽与不同载体蛋白结合后的免疫原性偶联物,选取实施例4中五肽疫苗中c4+c5+c6+c7+c2组合,增加序列seq id no.1免疫原性偶联物,与不同佐剂组合,制备六价肽疫苗,多肽的终总浓度为100ug/ml,具体组合方案见表7。
138.表7.多肽偶联物与佐剂交叉组合方案。
139.注:组合序号命名规则:“五肽疫苗命名为5”+“偶联物载体首字母”+“佐剂编号”。
140.二、免疫效果实验。
141.参照实施例3中免疫效果检测方法,检测免疫效果。结果见表8和图11。
142.表8.两种六肽疫苗与不同佐剂组合后抗体水平。
143.图11表明,两种六价肽疫苗的抗体滴度均能达到0.9以上,不同组合差异不明显,加入佐剂后能显著增加抗体水平,不同佐剂间差异不明显。
144.实施例6七价肽疫苗的制备及免疫效果。
145.一、疫苗制备。
146.1、材料。
147.实施例2中制备的多肽偶联物。
148.佐剂:氢氧化铝(al(oh)3)、磷酸铝(alpo4)、mpl、cpg。
149.2、制备方法。
150.选取实施例2中的合成肽与不同载体蛋白结合后的免疫原性偶联物,选取实施例5中五价肽疫苗中c4+c5+c6+c7+c2+c1组合,增加序列seq id no.10、11免疫原性偶联物,与不同佐剂组合,制备七价肽疫苗,多肽的终总浓度为100ug/ml,具体组合方案见表9。
151.表9.多肽偶联物与佐剂交叉组合方案。
152.注:组合序号命名规则:“五肽疫苗命名为5”+“偶联物载体首字母”+“佐剂编号”。
153.二、免疫效果实验。
154.参照实施例3中免疫效果检测方法,检测免疫效果结果见表10和图12。
155.表10.两种七价肽疫苗与不同佐剂组合后抗体水平。
156.图12表明,两种七价肽疫苗的抗体滴度均能达到0.9以上,不同组合差异不明显,加入佐剂后能显著增加抗体水平,不同佐剂间差异不明显。
157.实施例6十一价肽疫苗的制备及免疫效果。
158.一、疫苗制备。
159.1、材料。
160.实施例2中制备的多肽偶联物。
161.佐剂:氢氧化铝(al(oh)3)、磷酸铝(alpo4)、mpl、cpg。
162.2、制备方法。
163.选取实施例2中的所有合成肽与crm197载体蛋白结合后的免疫原性偶联物,与不同佐剂组合,制备十一价肽疫苗,十一种多肽的终总浓度为100ug/ml的疫苗,具体组合方案见表11。
164.表11.多肽偶联物与佐剂交叉组合方案。
165.注:组合序号命名规则:“十一个多肽命名为11”+“偶联物载体首字母”+“佐剂编号”。
166.二、免疫效果实验。
167.参照实施例3中免疫效果检测方法,检测免疫效果结果见表12和图13。
168.表12.十一价肽疫苗与不同佐剂组合后抗体水平。
169.图13表明,十一价肽疫苗的抗体滴度能达到1以上,加入佐剂后能显著增加抗体水平,不同佐剂间差异不明显。
