去甲肾上腺素或
β-肾上腺素能受体抑制剂在制备治疗糖尿病神经修复的药物中的应用
技术领域
1.本发明属于神经修复药物技术领域,具体涉及去甲肾上腺素或β-肾上腺素能受体抑制剂在制备治疗糖尿病神经修复的药物中的应用。
背景技术:
2.神经系统主要包括中枢神经系统和周围神经系统。中枢神经系统主要包括脑和脊髓,其他的一些神经称为外周神经系统。周围神经损伤是否能完全恢复主要跟损伤的程度有关。如果周围神经损伤的比较轻,及时有效的进行治疗可以完全恢复。如果周围神经损伤的症状比较严重(神经断裂)或神经损伤的时间比较长,很难完全恢复。因此,如何促进周围神经损伤后的再生,恢复其功能已日益成为研究的重点。在促进周围神经再生因子的研究中,神经生长因子(ngf)是报告最早的神经细胞调节因子,其具有促进神经轴突再生、对髓鞘化及神经元的保护作用。此外,神经节苷脂、碱性成纤维细胞生长因子(bfgf)也被证明具有不同程度的促神经生长作用。但这些促神经生长因子疗效不确定,多以研究和应用为主,同时还有价格昂贵,难以在临床推广应用的问题。
3.角膜是全身神经最密集的组织之一,角膜神经包括感觉神经和自主神经,感觉神经是从三叉神经结发出的分支,以复杂而协调的方式呈放射状进入角膜外周,穿过角膜前弹力层,形成基底下神经丛,最后到达角膜上皮。其通过介导泪液分泌、角膜反射,为角膜上皮细胞和基质细胞提供神经营养等以维持角膜表面透明及角膜健康。其神经末梢携带许多感受器包括机械、疼痛、寒冷和化学刺激等。角膜神经损伤主要表现为感觉过敏,疼痛和感觉减退,引起角膜上皮愈合延迟,角膜溃疡、基质变薄、泪膜改变等。角膜也受自主神经支配,主要是起源于颈上神经结的交感神经,它会影响细胞增殖和炎症等。导致角膜神经损伤的因素很多,包括角膜手术,糖尿病、病原微生物感染以及各种物理、化学及机械性因素等。
4.目前治疗角膜神经修复的方法主要包括:人工泪液、封闭泪管、治疗性的角膜接触镜、睑缘缝合术、羊膜移植术或角膜移植;生物制剂如igf-1、sp物质、神经营养因子、信号素、血管内皮生长因子以及血清和血浆衍生物;角膜神经化等。这些方法均存在一定的局限性,例如材料来源,价格因素、手术创伤以及治疗效果等。目前,人重组神经生长因子滴眼液(rhngf)作为一种在美国和欧洲获得许可的治疗中、重度nk的特殊药物,有望提供手术干预的替代方案。但是它也存在一个很大的局限就在于价格高昂,技术复杂,限制了广泛的临床应用。因此,寻找新的高效、便捷且便宜的促进神经修复的治疗方法对于患者是一种福音,在临床应用也具有广泛积极的影响和意义。
5.β-肾上腺素能受体拮抗剂是能选择性地与β-肾上腺素受体结合、从而拮抗神经递质和儿茶酚胺对β-受体的激动作用的一种药物类型。β-肾上腺素能受体拮抗剂具有同时抑制β1受体和β2受体的作用。β2受体主要分布于支气管平滑肌、血管平滑肌以及角膜上皮的效应器细胞膜上,激动β2受体可以扩张支气管和血管平滑肌,阻断和拮抗β2受体,可以减缓心率,降低血压。然而目前,还没有通过β-肾上腺素能受体拮抗剂用于神经损伤修复的报
道。
技术实现要素:
6.有鉴于此,本发明的目的在于提供去甲肾上腺素或β-肾上腺素能受体抑制剂在制备治疗糖尿病神经修复的药物中的应用。
7.本发明提供了去甲肾上腺素抑制剂或β-肾上腺素能受体抑制剂在制备糖尿病神经损伤修复的药物中的应用。
8.优选的,所述神经包括角膜神经。
9.优选的,所述药物能逆转去甲肾上腺素引起的角膜神经生长抑制。
10.优选的,所述药物能逆转去甲肾上腺素引起的角膜上皮细胞中ngf及gdnf表达水平的降低。
11.优选的,所述药物能促进糖尿病角膜上皮修复和神经再生。
12.优选的,所述β-肾上腺素能受体抑制剂包括β2-肾上腺素能受体抑制剂。
13.优选的,所述β-肾上腺素能受体抑制剂选自左布诺洛尔、倍他洛尔、卡替洛尔、索他洛尔、盐酸丁二胺和ici118,551中的一种或几种。
14.优选的,所述去甲肾上腺素抑制剂选自溴苄胺、利血平、化学去交感神经药物6-羟基多巴胺(6-ohda)和胍乙啶中的一种或几种。
15.优选的,所述药物包括眼部外用药。
16.优选的,所述药物中去甲肾上腺素抑制剂或β-肾上腺素能受体抑制剂的浓度为1~100μm。
17.本发明提供的去甲肾上腺素抑制剂或β-肾上腺素能受体抑制剂在制备糖尿病神经损伤修复的药物中的应用。实验表明,与正常小鼠相比,糖尿病小鼠角膜损伤导致上皮细胞和角膜神经再生延迟,血液及角膜组织中去甲肾上腺素水平升高。本发明采用β2-肾上腺素能受体拮抗剂(ici 118,551)或化学去交感神经药物,能改善去甲肾上腺素升高引起的角膜神经生长抑制,降低角膜上皮细胞中神经营养因子ngf及gdnf表达水平,有效改善糖尿病角膜上皮愈合和神经再生延迟。可见,本发明的药物抑制去甲肾上腺素分泌或拮抗β2-肾上腺素能受体,促进上皮细胞神经营养因子的表达,进而调控神经的修复,具有较好的修复效果。同时去甲肾上腺素抑制剂或β2-肾上腺素能受体拮抗剂为小分子化合物,纯度高,稳定性较好,价格便宜,具有良好的临床应用前景。
附图说明
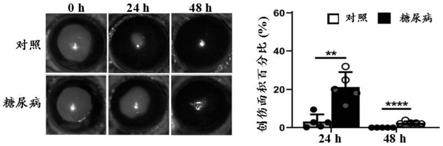
18.图1为本发明实施例1中糖尿病小鼠刮除角膜后上皮修复的结果图;其中左图为糖尿病小鼠刮除角膜后荧光素钠染色图,右图为小鼠角膜创伤面积统计图;
19.图2为角膜上皮损伤后第3天、第7天及第10天角膜敏感度结果;
20.图3为对照组和糖尿病组小鼠共聚焦显微镜观察神经再生情况的结果图;
21.图4为对照组和糖尿病组小鼠的血液及角膜组织中去甲肾上腺素水平变化情况;
22.图5为不同实验处理组中三叉神经元细胞生长情况,其中左图为三叉神经元细胞βiii-tubulin染色图,右图为不同实验处理组中三叉神经元细胞的生长统计图;
23.图6为角膜上皮细胞中神经营养因子ngf及gdnf的表达水平;
24.图7为β2-肾上腺素能受体拮抗剂对糖尿病角膜上皮愈合作用的结果图,左图为刮除小鼠角膜后荧光素钠染色形态图,右图为小鼠角膜创伤面积统计图;
25.图8为β2-肾上腺素能受体拮抗剂对糖尿病小鼠角膜神经敏感度结果;
26.图9为β2-肾上腺素能受体拮抗剂促进糖尿病小鼠角膜的神经再生的结果图;
27.图10为β2-肾上腺素能受体拮抗剂显著升高了角膜上皮中ngf和gdnf表达水平;
28.图11为化学性去交感神经药物6-羟基多巴胺对糖尿病角膜上皮愈合和神经再生延迟结果图,其中左图为刮除小鼠角膜后荧光素钠染色形态图,右图为小鼠角膜创伤面积统计图;
29.图12为化学性去交感神经药物对糖尿病小鼠角膜神经敏感度结果;
30.图13为化学去交感神经药物6-羟基多巴胺促进糖尿病小鼠角膜的神经再生的结果图。
具体实施方式
31.本发明提供了去甲肾上腺素抑制剂或β-肾上腺素能受体抑制剂在制备糖尿病神经损伤修复的药物中的应用。
32.在本发明中,所述神经优选包括角膜神经。实验表明,糖尿病角膜上皮细胞再生延迟,糖尿病角膜敏感度恢复速度降低,角膜神经再生延迟等。同时糖尿病角膜神经损伤后引起去甲肾上腺素水平显著升高。本发明采用去甲肾上腺素抑制剂或β-肾上腺素能受体抑制剂能逆转角膜上皮细胞中去甲肾上腺素引起的ngf及gdnf表达水平的降低,逆转去甲肾上腺素引起的角膜神经生长抑制,能促进糖尿病角膜上皮修复和神经再生。去甲肾上腺素抑制剂或β-肾上腺素能受体抑制剂通过促进上皮细胞神经营养因子的表达,进而调控神经的修复。
33.在本发明中,所述β-肾上腺素能受体抑制剂优选包括β2-肾上腺素能受体抑制剂。但由于某些β-肾上腺素能受体抑制剂具有同时抑制β1-肾上腺素能受体和β2-肾上腺素能受体的活性,因此β-肾上腺素能受体抑制剂也能发挥修复作用。所述β-肾上腺素能受体抑制剂优选自左布诺洛尔、倍他洛尔、卡替洛尔、索他洛尔、盐酸二丁胺和ici118,551中的一种或几种。实验表明,分别用β1-肾上腺素能受体抑制剂和β2-肾上腺素能受体抑制剂处理角膜损伤小鼠,β2-肾上腺素能受体抑制剂能够较好地逆转因去甲肾上腺素升高引起的神经生长抑制、逆转去甲肾上腺素引起的角膜细胞中ngf及gdnf表达水平的降低,显著促进糖尿病角膜上皮修复和敏感度,有效促进了糖尿病小鼠角膜的神经再生,而β1受体拮抗剂不能有效逆转ne引起的角膜上皮细胞中ngf及gdnf表达水平的降低,也不能逆转因去甲肾上腺素升高引起的神经生长抑制。
34.在本发明中,糖尿病角膜神经损伤后引起去甲肾上腺素水平显著升高,而且高水平的去甲肾上腺素能抑制神经生长和角膜上皮细胞中神经营养因子的表达。所述神经营养因子优选为ngf和/或gdnf。因此,本发明利用去甲肾上腺素抑制剂通过抑制细胞中去甲肾上腺素的水平实现了促进糖尿病角膜上皮修复,升高了角膜上皮中ngf和gdnf表达水平,促进了糖尿病小鼠角膜的神经再生和角膜敏感度。所述去甲肾上腺素抑制剂优选自溴苄胺、利血平、化学去交感神经药物6-羟基多巴胺和胍乙啶中的一种或几种。
35.在本发明中,所述药物优选包括眼部外用药或注射剂。本发明对所述眼部外用药
的制备方法没有特殊限制,采用本领域所熟知的眼部外用药的制备方法即可。所述药物中去甲肾上腺素抑制剂或β-肾上腺素能受体抑制剂的浓度优选为1~100μm,更优选为10~80μm,进一步优选为40~60μm。ici118,551优选制备成眼部外用药。ici118,551:10μm 4次/天,5μl/眼。6-羟基多巴胺(6-ohda)优选制备成注射剂。6-羟基多巴胺:100mg/kg,溶于含0.02%vc的0.9%nacl溶剂中,现用现配,连续四天腹腔注射,间隔两天,第七天建模。
36.下面结合实施例对本发明提供的去甲肾上腺素或β-肾上腺素能受体抑制剂在制备治疗糖尿病神经修复的药物中的应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
37.实施例1
38.糖尿病小鼠刮除角膜后上皮修复和神经再生延迟
39.实验动物为stz诱导的i型糖尿病老鼠(构建方法参见现有技术:lingling,yang,guohu,di,xia,&qi,et al.(2014).substance p promotes diabetic corneal epithelial wound healing through molecular mechanisms mediatedviathe neurokinin-1receptor.diabetes,63(12),4262-4274.)及其正常对照,实验小鼠无角膜缺陷、新生血管或结膜损伤。
40.1)角膜上皮再生情况
41.采用腹腔注射戊巴比妥钠全身麻醉小鼠(50mg/kg),利多卡因滴眼液局部麻醉后,使用2mm环钻和上皮刮刀刮除糖尿病小鼠右眼角膜中央2mm区域内的上皮,荧光素钠染色观察上皮缺损情况(使用image j软件,根据荧光素钠染色的面积,统计面积)。
42.结果如图1。结果表明,与对照相比,糖尿病组小鼠角膜上皮再生速度较慢。这表明糖尿病上皮细胞再生发生延迟。
43.2)糖尿病角膜敏感度恢复速度情况
44.使用cochet-bonnet触觉测量仪分别测量角膜上皮损伤后第3、7及10天角膜敏感度,观察糖尿病小鼠角膜神经的修复情况,并绘制角膜敏感度-时间曲线。
45.结果如图2。由图2可知,糖尿病角膜敏感度恢复速度显著慢于对照小鼠。
46.3)角膜神经再生情况
47.对糖尿病小鼠及其对照小鼠的角膜进行βiii-tubulin染色(参见如下文献:wang x,li w,zhou q,et al.manf promotes diabetic corneal epithelial wound healing and nerve regeneration byattenuating hyperglycemia-induced endoplasmic reticulum stress.2020.),共聚焦显微镜观察神经再生情况。
48.结果如图3所示,糖尿病小鼠角膜神经再生延迟。
49.实施例2
50.糖尿病引起血液及角膜组织中去甲肾上腺素水平升高
51.糖尿病小鼠模型按照实施例1方法建立。
52.糖尿病和正常对照小鼠刮除2mm角膜上皮后,分别于第12h、24h收集小鼠血浆和角膜,采用去甲肾上腺素酶联免疫吸附测定试剂盒(购自abnova,货号为abn-ka3836)检测去甲肾上腺素(ne)水平。
53.结果如图4。糖尿病小鼠角膜损伤可引起血液及角膜组织中去甲肾上腺素水平升高。
54.实施例3
55.β2-肾上腺素能受体拮抗剂改善去甲肾上腺素升高引起的神经生长抑制
56.饥饿处理12小时的tke2细胞分别使用10μm ne(去甲肾上腺素),10μm ne和50μm阿替洛尔(属于β1拮抗剂),10μm ne和50μm ici 118,551(属于β2拮抗剂)处理24小时,对照组使用pbs缓冲液处理24小时后,分别收集培养基上清,备用。
57.从正常小鼠中分离得到三叉神经元后,使用40u/ml木瓜蛋白酶和3mg/ml胶原酶与4.7mg/ml disaseⅱ混合溶混合,消化,再使用percoll进行梯度离心(上层:12.5%percoll、下层28%percoll),分离得到神经元细胞(参见现有技术:malin,s.a.,davis,b.m.&molliver,d.c.production of dissociated sensory neuron cultures and considerations fortheiruse in studying neuronal function andplasticity.nat protoc 2,152
–
160(2007).)。然后将获得的神经元细胞培养于包被有laminin的玻片上培养过夜。分别取不同条件的tke2培养基上清加入过夜培养的神经元细胞中,继续培养24小时,经βiii-tubulin染色后使用软件neuron j分析和计算神经元的长度(使用软件分析出相对长度后,以对照为1,进行相对长度计算)。
58.结果如图5。β2拮抗剂能够较好地逆转因去甲肾上腺素升高引起的神经生长抑制。
59.实施例4
60.饥饿处理12小时的tke2细胞分别使用10μm ne,10μm ne和50μm阿替洛尔,10μm ne和50μm ici 118,551处理24小时,对照组使用pbs b处理24小时,收集不同条件培养的tke2细胞进行mrna的提取,并收集其培养基上清,经qpcr和elisa检测,分别获得神经营养因子ngf及gdnf的表达水平。其中,qpcr检测ngf和gdnf表达情况的引物如下:
61.ngf:f:gccaaggacgcagctttcta(seq id no:1);
62.r:ttcagggacagagtctccttctg(seq id no:2);
63.gdnf:f:cagagaattccagagggaaaggt(seq id no:3);
64.r:cacaggaaccgctgcaatatc(seq id no:4)。
65.反应体系如下:2
×
sybr 5μl、上游引物0.3μl、下游引物0.3μl、无酶水:2.4μl、cdna:2μl,总共:10μl;
66.反应程序如下:pcr预热激活:95℃2分钟,然后进入两步法程序:
67.95℃5秒,60℃10秒,循环40次。
68.elisa检测采用的试剂盒为elisa kit for mouse ngf(uscn life science inc.wuhan,china),mouse gdnf(abcam,ab171178,shanghai,china)
69.结果如图6,β2受体拮抗剂能够逆转ne引起的tke2细胞中ngf及gdnf表达水平的降低。
70.实施例5
71.β2-肾上腺素能受体拮抗剂改善糖尿病角膜上皮愈合和神经再生延迟
72.糖尿病小鼠模型按照实施例1方法建立。
73.糖尿病实验组小鼠和糖尿病对照组以及正常对照小鼠刮除2mm角膜上皮后,实验组右眼按照4次/天滴入10~100μm的β2-肾上腺素能受体拮抗剂(5μl/眼),连续两天。正常和糖尿病对照组生理盐水点眼。并于建模后0h,24h,36h和48h使用荧光素钠染色观察小鼠上皮修复情况。使用cochet-bonnet触觉测量仪测量角膜敏感性。
74.结果如图7及8所示。图7可知,β2-肾上腺素能受体拮抗剂可以显著促进糖尿病角膜上皮修复(图7)和敏感度(图8)。
75.实施例6
76.取糖尿病小鼠及其对照小鼠的角膜,βiii-tubulin进行角膜染色,共聚焦显微镜观察神经再生情况。
77.结果如图9所示,β2-肾上腺素能受体拮抗剂有效促进了糖尿病小鼠角膜的神经再生。
78.实施例7
79.取糖尿病和β2-肾上腺素能受体拮抗剂点眼的糖尿病小鼠的角膜上皮,提取mrna,按照实施例检测上皮细胞的ngf和gdnf表达水平,同时采用免疫荧光染色检测糖尿病和β2-肾上腺素能受体拮抗剂点眼的糖尿病小鼠上皮中ngf和gdnf的表达水平.
80.结果如图10所示,mrna检测和免疫荧光染色结果均表明,β2-肾上腺素能受体拮抗剂显著升高了角膜上皮中ngf和gdnf表达水平。因此,可将β2-肾上腺素能受体拮抗剂用于制备治疗延迟愈合的糖尿病角膜上皮和神经再生,所述药物具有广阔的开发与应用前景。
81.实施例8
82.化学性去交感神经改善糖尿病角膜上皮愈合和神经再生延迟
83.1.糖尿病小鼠模型按照实施例1方法建立。
84.2.糖尿病实验组小鼠连续四天腹腔注射化学去交感神经药物6-羟基多巴胺(100mg/kg),糖尿病对照小鼠腹腔注射对照生理盐水。糖尿病实验组和糖尿病对照组以及正常对照小鼠于第七天刮除2mm角膜上皮,建模后0h,36h和48h使用荧光素钠染色观察小鼠上皮修复情况。使用cochet-bonnet触觉测量仪测量角膜敏感性。
85.结果如图11及12所示,β2-肾上腺素能受体拮抗剂可以显著促进糖尿病角膜上皮修复(图11)和敏感度(图12)。
86.取糖尿病小鼠及其对照小鼠的角膜,βiii-tubulin进行角膜染色,共聚焦显微镜观察神经再生情况,结果如图13所示化学去交感神经药物6-羟基多巴胺有效促进了糖尿病小鼠角膜的神经再生。
87.由上述实施例结果可知,本发明通过药物抑制去甲肾上腺素分泌或拮抗β2-肾上腺素能受体,促进上皮细胞神经营养因子的表达,进而调控神经的修复。去甲肾上腺素抑制剂或β2-肾上腺素能受体拮抗剂为小分子化合物,纯度高,稳定性较好,价格便宜,具有良好的临床应用前景。
88.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
