10
β-羟基左炔诺孕酮的合成方法
技术领域
1.本发明涉及有机合成技术领域,特别是涉及一种10β-羟基左炔诺孕酮的合成方法。
背景技术:
2.左炔诺孕酮,化学名称为d(
–
)-17α-乙炔基-17β-羟基-18-甲基雌甾-4-烯-3-酮,其结构式如下所示。
[0003][0004]
左炔诺孕酮为速效、短效避孕药,避孕机制是显著抑制排卵和阻止孕卵着床,并使宫颈黏液稠度增加,精子穿透阻力增大,从而发挥速效避孕作用。左炔诺孕酮是当前国内外应用最广泛的口服避孕药,也可用于治疗月经不调,子宫功能性出血及子宫内膜异位症等。左炔诺孕酮为全合成的强效孕激素,是消旋炔诺孕酮的光学活性体,其活性比炔诺孕酮强1倍,剂量比炔诺孕酮可减半,不良反应也减少。
[0005]
在左炔诺孕酮的药物研发中,产品中关键杂质的研究尤为重要,而左炔诺孕酮有关物质的对照品在国内外均难以购买,且多数杂质无文献报道其制备方法。10β-羟基左炔诺孕酮又称10-b-羟基左炔诺孕酮,其化学名称为d(
–
)-17α
‑ꢀ
乙炔基-10β,17β-二羟基-18-甲基雌甾-4-烯-3-酮,为欧洲药典中给出的左炔诺孕酮药物的杂质i,其结构式如下所示。
[0006][0007]
目前有公开文献报道的10β-羟基左炔诺孕酮合成方法都是通过生物发酵法合成,但生物发酵法合成10β-羟基左炔诺孕酮的选择性不好,反应副产物多,产率很低(通常为3%左右),且反应时间较长,操作比较麻烦。
技术实现要素:
[0008]
基于此,有必要针对传统的10β-羟基左炔诺孕酮的合成方法产率低、操作麻烦的问题,提供一种10β-羟基左炔诺孕酮的合成方法。
[0009]
为解决上述技术问题,本发明提出的技术方案如下:
[0010]
一种10β-羟基左炔诺孕酮的合成方法,包括如下步骤:
[0011]
s10:将左炔诺孕酮进行羰基保护和烯烃易位反应,得到结构式为式(i)中间体;
[0012]
s20:将所述式(i)中间体进行烯烃环氧化反应,得到结构式为式(ii)中间体;
[0013]
s30:将所述式(ii)中间体进行羰基脱保护、环氧开环和脱水,即得所述 10β-羟基左炔诺孕酮;
[0014]
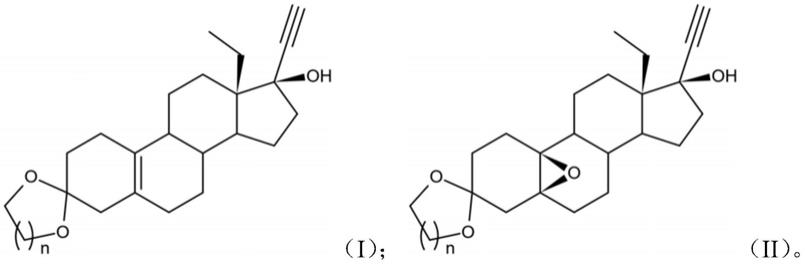
其中,所述式(i)中间体和所述式(ii)中间体的结构式如下:
[0015][0016]
在其中一些实施例中,所述s10中,将左炔诺孕酮进行羰基保护和烯烃易位反应,包括如下步骤:
[0017]
将左炔诺孕酮溶于第一有机溶剂中,加入二醇、第一酸催化剂和脱水剂搅拌反应,反应完成后加入碱终止反应。
[0018]
在其中一些实施例中,所述s10中,所述第一酸催化剂的用量为所述左炔诺孕酮摩尔质量的1%~10%。
[0019]
在其中一些实施例中,所述s10中,所述二醇为乙二醇、丙二醇和新戊二醇中的一种或多种。
[0020]
在其中一些实施例中,所述s10中,所述第一酸催化剂为对甲苯磺酸、硫酸和氢氯酸中的一种或多种。
[0021]
在其中一些实施例中,所述s10中,所述脱水剂为原甲酸三乙酯和原甲酸三甲酯中的一种或两种。
[0022]
在其中一些实施例中,所述s10中,所述第一有机溶剂为二氯甲烷、四氢呋喃和乙醇中的一种或多种。
[0023]
在其中一些实施例中,所述s10中,所述羰基保护和烯烃易位反应的时间为0.5h~2h。
[0024]
在其中一些实施例中,所述s10中,所述羰基保护和烯烃易位反应的温度为0℃~30℃。
[0025]
在其中一些实施例中,所述s20中,将所述式(i)中间体进行烯烃环氧化反应,包括如下步骤:
[0026]
将所述式(i)中间体溶于第二有机溶剂中,搅拌下加入烯烃环氧化试剂进行反应,反应完成后加入淬灭试剂淬灭反应。
[0027]
在其中一些实施例中,所述s20中,烯烃环氧化试剂的用量为所述式(i) 中间体摩尔量的1.1倍~1.5倍。
[0028]
在其中一些实施例中,所述s20中,所述烯烃环氧化试剂为间氯过氧苯甲酸。
[0029]
在其中一些实施例中,所述s20中,所述淬灭试剂为碳酸氢钠和硫代硫酸钠的混合
水溶液。
[0030]
在其中一些实施例中,所述s20中,所述第二有机溶剂为二氯甲烷。
[0031]
在其中一些实施例中,所述s20中,所述烯烃环氧化反应的温度为-40℃~25℃。
[0032]
在其中一些实施例中,所述s20中,所述烯烃环氧化反应的时间为2h~6h。
[0033]
在其中一些实施例中,所述s30中,将所述式(ii)中间体进行羰基脱保护、环氧开环和脱水,包括如下步骤:
[0034]
将所述式(ii)中间体溶于第三有机溶剂中,搅拌下加入第二酸催化剂进行反应。
[0035]
在其中一些实施例中,所述s30中,所述第二酸催化剂为高氯酸水溶液和盐酸中的一种或两种。
[0036]
在其中一些实施例中,所述s30中,所述第三有机溶剂为丙酮。
[0037]
在其中一些实施例中,所述s30中,所述反应的温度为0℃~30℃。
[0038]
在其中一些实施例中,所述s30中,所述反应的时间为12h~24h。
[0039]
与现有技术相比,本发明具有如下有益效果:
[0040]
本发明以式(i)化合物为起始原料,依次通过羰基保护和烯烃易位反应、烯烃环氧化反应、羰基脱保护、环氧开环和脱水反应,制备得到10β-羟基左炔诺孕酮。本发明首次通过化学合成的方法合成了10β-羟基左炔诺孕酮,相比于传统的生物发酵方法,本发明的合成方法的产率显著提高。
[0041]
而且,本发明的合成方法的起始原料为左炔诺孕酮,原料易得,合成路线短,操作简单,产品容易分离提纯,合成门槛低,在大部分实验室都可以进行。
具体实施方式
[0042]
为使本发明的上述目的、特征和优点能够更加明显易懂,对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施例的限制。
[0043]
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等均可通过市场购买得到或者可通过现有方法制备得到。
[0044]
本发明的一种实施方式提供了一种10β-羟基左炔诺孕酮的合成方法,该合成方法包括如下步骤s10至步骤s30:
[0045]
步骤s10:将左炔诺孕酮进行羰基保护和烯烃易位反应,得到结构式为式(i) 中间体。
[0046]
本发明以左炔诺孕酮为起始原料制备10β-羟基左炔诺孕酮,左炔诺孕酮的结构式及碳原子位置编号如下式(iii)所示:
[0047][0048]
首先,对左炔诺孕酮分子中3位碳原子上的酮羰基进行保护,同时使4位碳原子和5位碳原子之间的碳碳双键发生易位,双键易位至5(10)位碳原子上,从而形成式(i)中间体。该式(i)中间体的结构式如下所示:
[0049][0050]
具体来说,先将左炔诺孕酮溶解于第一有机溶剂中,然后加入二醇和第一酸催化剂搅拌反应,反应完成后加入碱终止反应。在第一酸催化剂作用下,二醇分子上的两个羟基与左炔诺孕酮分子中3位碳原子上的酮羰基进行反应,使酮羰基转化为环状缩酮结构,从而对酮羰基进行保护,避免该酮羰基在后续的反应过程中被破坏。
[0051]
与此同时,在酸性条件下左炔诺孕酮4位碳原子上的碳碳双键发生易位,生成5(10)位烯烃,同时也生成部分比例的5,6位烯烃副产物。由于10位碳原子为叔碳原子,其上氢的活性更高,6位碳原子为仲碳原子;因此,烯烃易位后优先生成更稳定的5(10)位烯烃,5(10)位烯烃产物为主要产物,而5,6 位烯烃产物为副产物。
[0052]
进一步地,在羰基保护和烯烃易位反应完成后,加入碱终止反应,用水对反应液进行洗涤,然后静置分液,分出水相取有机相,对有机相进行干燥,过滤去除干燥剂,再将溶剂旋干,可以不经过提纯而直接用于下一步反应。
[0053]
具体地,终止反应所用的碱优选为有机碱,例如三乙胺。有机碱的用量可根据反应实际情况进行确定。羰基保护中所用的二醇优选为乙二醇,其能与3 位碳原子形成比较稳定的五元环状结构。除此之外,还可采用其他的二醇,如取代的乙二醇、丙二醇和新戊二醇等。上述式(i)化合物中的n表示碳原子数,当n=1时,表示所用的二醇为乙二醇。在本发明中,n可以为1或2,优选为1。
[0054]
在其中一些实施方式中,在反应溶液中还加入有脱水剂。该脱水剂为原甲酸三乙酯和/或原甲酸三甲酯。在反应过程中加入原甲酸三乙酯、原甲酸三甲酯作为脱水剂,可以除去羰基保护反应过程中所生成的水,从而更加有利于羰基保护反应的进行。
[0055]
在其中一些实施方式中,所用的第一酸催化剂为对甲苯磺酸、硫酸和氢氯酸中的一种或多种,优选为对甲苯磺酸。所用的第一有机溶剂为二氯甲烷、四氢呋喃和乙醇中的一种或多种,优选为二氯甲烷。可以理解,本发明中并不局限于上述种类的第一酸催化剂和第一有机溶剂,也可采用本领域中现有的其他种类的酸催化剂和有机溶剂,只要能够使左炔诺孕酮能够顺利地发生羰基保护和烯烃易位反应和能够很好地溶解各原料即可。
[0056]
具体来说,第一酸催化剂的用量为左炔诺孕酮摩尔质量的1%~10%。
[0057]
在其中一些实施方式中,羰基保护和烯烃易位反应的反应时间为0.5h~2h;羰基保护和烯烃易位反应的反应温度为0℃~30℃。在此反应时间和反应温度下,可以使羰基保护和烯烃易位反应充分进行,反应更加彻底,副反应更少。
[0058]
步骤s20:将式(i)中间体进行烯烃环氧化反应,得到结构式为式(ii)中间体。
[0059]
在步骤s10制备得到式(i)中间体之后,本发明进一步对式(i)中间体进行烯烃环氧化反应,使5(10)位碳原子上的碳碳双键反应形成环氧键,得到式 (ii)中间体。该式(ii)中间体的结构式如下所示:
[0060][0061]
具体来说,将式(i)中间体溶解在第二有机溶剂中,在搅拌下加入烯烃环氧化试剂进行环氧化反应,反应完成后加入淬灭试剂淬灭反应,搅拌一段时间使环氧化试剂完全淬灭,然后静置使反应液分层,分出水相,将有机相进行干燥、过滤去除干燥剂、然后蒸干溶剂,即得到式(ii)中间体。
[0062]
在其中一些实施方式中,步骤s20中,烯烃环氧化试剂可采用过氧化合物,如过氧酸类试剂。具体地,可采用间氯过氧苯甲酸、过氧苯甲酸、过氧乙酸、过氧三氟乙酸等过氧酸类试剂。优选采用间氯过氧苯甲酸,产率高、反应速度较快、反应条件温和。
[0063]
在其中一个具体示例中,烯烃环氧化反应所采用的溶剂,即第二有机溶剂采用二氯甲烷,可以很好地溶解各反应原料。可以理解,烯烃环氧化反应所用的溶剂也可以是该类型反应中常用的其他溶剂。
[0064]
具体来说,步骤s20中,烯烃环氧化反应的温度为-40℃~25℃,烯烃环氧化反应的时间为2h~6h,优选为4h。在此反应温度和反应时间条件下,可使环氧化反应充分进行彻底,副反应更少,产品收率较高。
[0065]
具体地,烯烃环氧化试剂的用量为所述式(i)中间体摩尔量的1.1倍~1.5 倍。可使烯烃环氧化反应进行完全。
[0066]
进一步地,在进行烯烃环氧化反应时,可先将溶剂体系的温度降低到一个较低的温度(如接近-40℃),然后将式(i)中间体加入到溶剂中,搅拌均匀,再将环氧化试剂加入到
溶剂体系中,待环氧化试剂加入完毕后再将反应体系的温度适当升高(如接近-15℃),在此温度下进行环氧化反应。
[0067]
在一些具体示例中,步骤s20中,淬灭环氧化反应所用的淬灭试剂为碳酸氢钠和硫代硫酸钠的混合水溶液。通过向环氧化反应完成后的反应液中加入一定量的碳酸氢钠和硫代硫酸钠的混合水溶液,可以将反应液中过量的环氧化试剂进行淬灭,破坏环氧化试剂中的过氧键,使环氧化试剂形成盐而溶于水中。在淬灭过程中可通过淀粉ki试纸判断淬灭反应是否完全。
[0068]
需要说明的是,由于烯烃环氧化试剂淬灭反应放热较多,因此需要注意控制淬灭反应中反应液的温度,避免温度过高而引发一些副反应。优选地,可以在冰浴下进行环氧化试剂的淬灭反应。
[0069]
具体来说,步骤s20中,在烯烃环氧化反应进行到一定时间后,可通过tlc 测试反应是否完成,当反应完成后向反应液中加入淬灭试剂对过量的环氧化试剂进行淬灭,搅拌使淬灭反应进行完全后,静置分液,分出水层,将有机相用干燥剂(如无水硫酸钠)进行干燥,然后过滤去除干燥剂,将有机相在旋转蒸发仪上旋干,即得到式(ii)中间体,该式(ii)中间体可不经过提纯直接投入到下一步反应中。
[0070]
步骤s30:将式(ii)中间体进行羰基脱保护、环氧开环和脱水,即得10β
‑ꢀ
羟基左炔诺孕酮。
[0071]
在步骤s20得到式(ii)中间体后,本发明通过将式(ii)中间体进行羰基脱保护、环氧开环和脱水反应,在酸性条件下,使3位碳原子上的酮羰基得到恢复,使环氧键断开在5位和10位碳原子上形成两个相邻的羟基,并进一步使 5位碳原子上的羟基脱水,形成4,5位碳碳双键,从而得到目标产物10β-羟基左炔诺孕酮。
[0072]
具体地,将式(ii)中间体溶解于第三有机溶剂中,搅拌下加入第二酸催化剂进行反应。从而在酸性条件下使3位碳原子上的酮羰基得到恢复。与此同时,在酸性条件下环氧键上的氧原子被质子化,羟基进攻环氧键的碳原子,使式(ii) 中间体分子中的环氧键断开,在式(ii)中间体的5位碳原子和10位碳原子上形成两个相邻的羟基。处于5位碳原子上的羟基进一步脱水,在4位碳原子和5 位碳原子之间形成碳碳双键。
[0073]
由于式(ii)中间体分子中3位碳原子上的羰基及5位碳原子上的羟基的吸电子作用,使得4位碳原子上的氢的活性较大,而且在4位上形成的碳碳双键可以与3位上的羰基形成共轭结构;因此,脱水反应会优先发生在4位碳原子和5位碳原子之间,形成4,5位碳碳双键,而不会形成5,6位碳碳双键。
[0074]
在其中一些实施方式中,步骤s30中,所采用的第三有机溶剂为丙酮。采用极性较大且可与水互溶的丙酮作为羰基脱保护、开环反应和脱水反应的溶剂,更加有利于反应的进行。可以理解,本发明中的第三有机溶剂并不局限于丙酮,其他可实现类似效果的有机溶剂也都是可以的。
[0075]
具体地,在步骤s30中,羰基脱保护、环氧开环和脱水反应中所用的第二酸催化剂为高氯酸水溶液和盐酸中的一种或两种,优选为高氯酸的水溶液。反应的温度为0℃~30℃,优选为室温。反应的时间为12h~24h,优选为16h。在此反应条件下,反应的产率较高。
[0076]
在羰基脱保护、环氧开环和脱水反应进行到一定时间后,可通过tlc检测反应进行程度,当tlc检测显示反应进行完成后,即可停止反应。例如,可在一块tlc板上的同一水平
位置处间隔点上原料式(ii)中间体和反应液,通过观察反应液中原料点的大小即可判断反应是否完成。
[0077]
反应完成后即可对反应液进行后处理。具体来说,可采用石油醚:乙酸乙酯=2:1体积比的混合溶剂作为展开剂进行tlc检测,tlc显示产生三个主要产物,tlc板上极性小的主点rf值约为0.2,极性居中的主点rf值约为0.15,极性最大的主点rf值约为0.06。将反应液减压浓缩去除溶剂,然后进行柱层析,收集极性小(rf值约0.2)的主点,即为目标产品。进一步地,收集产品后可将溶剂旋干,充分干燥后进行核磁和质谱表征,检验所得产品是否为目标产物10β
‑ꢀ
羟基左炔诺孕酮。
[0078]
本发明一实施方式的总体合成路线如下所示:
[0079][0080]
本发明首次通过化学合成的方法合成了10β-羟基左炔诺孕酮,相比于传统的生物发酵方法,本发明的合成方法的产率显著提高,其三步反应的总产率可达19%,而传统的生物发酵法的产品通常仅为3%左右;而且本发明的合成方法的起始原料易得,合成路线短,操作简单,产品容易分离提纯,合成门槛低,在大部分实验室都可以进行。
[0081]
下面将结合具体实施例对本发明作进一步说明,但不应将其理解为对本发明保护范围的限制。
[0082]
实施例1:
[0083]
(1)式(i)中间体的制备
[0084]
称取5.00g(16mmol)左炔诺孕酮,加入50ml二氯甲烷、5g乙二醇、5 g原甲酸三乙酯,搅拌,加入0.25g对甲苯磺酸,室温(25℃)反应1h后加入三乙胺终止反应。用50ml水洗涤有机相,静置分液,分出水层取有机相,对有机相进行干燥,过滤去除干燥剂,然后在旋转蒸发仪上旋干,得棕黄色油状物即式(i)中间体。不经提纯直接用于下一步反应。
[0085]
(2)式(ii)中间体的制备
[0086]
将前述步骤制备的式(i)中间体溶于90ml二氯甲烷,冷却至-15℃,搅拌,分批加入3.65g(18mmol)间氯过氧苯甲酸(85%纯度),反应4h后,tlc 显示原料基本反应完全。加入碳酸氢钠和硫代硫酸钠混合水溶液淬灭反应,搅拌1h后分液,分出水层取有机相,对有机相进行干燥,然后过滤去除干燥剂,在旋转蒸发仪上旋干,得到粘性固体即式(ii)中间体。式(ii)中间体不经提纯直接用于下一步反应。
[0087]
(3)10β-羟基左炔诺孕酮的制备
[0088]
将前述步骤制备的式(ii)中间体溶于100ml丙酮,搅拌,滴加含1.2g 高氯酸的8ml水溶液,室温搅拌16h后,tlc显示反应完全。tlc显示产生三个主要产物(展开剂石油醚:乙酸乙酯=2:1体积比,极性小的主点rf值为0.2,极性居中的主点rf值为0.15,极性最大的主点rf值为0.06)。加入碳酸氢钠水溶液中和至中性,浓缩去除大部分有机溶剂,再加入80ml二氯甲烷和40ml 水,萃取,分液,分出水层取有机相,对有机相进行干燥,然后柱层析收集极性小的主点(rf值为0.2),将收集的产品在旋转蒸发仪上旋干,得白色固体1.01 g。
[0089]
该产物经核磁和质谱表征确定为目标产物10β-羟基左炔诺孕酮。各步反应的总摩尔收率约为19%。
[0090]
产物核磁氢谱数据如下:1h-nmr(400mhz,cdcl3)δ5.78(d,j=1.6hz, 1h),2.67-2.60(m,1h),2.59(s,1h),2.58-2.50(m,1h),2.42-2.25(m,3h), 2.25-1.95(s,5h),1.87(s,3h),1.80-1.65(m,2h),1.64(s,1h),1.55-1.49(m,2h), 1.48-1.32(m,3h),1.18-1.05(m,2h),1.02(t,j=7.4hz,3h)。
[0091]
产物核磁碳谱数据如下:
13
c-nmr(101mhz,cdcl3)δ199.00,164.11, 124.85,87.74,81.38,74.18,70.39,52.09,51.09,47.79,39.57,35.62,33.81,33.67, 31.99,31.27,28.24,22.60,20.32,18.84,9.57。
[0092]
产物质谱数据如下:lcms,m/z:[m+h+]=328.9。
[0093]
实施例2:
[0094]
(1)式(i)中间体的制备
[0095]
称取5.00g(16mmol)左炔诺孕酮,加入50ml二氯甲烷、5g新戊二醇、 5g原甲酸三乙酯,搅拌,加入0.25g对甲苯磺酸,室温反应2h后加入三乙胺终止反应。用50ml水洗涤有机相,静置分液,分出水层取有机相,对有机相进行干燥,过滤去除干燥剂,然后在旋转蒸发仪上旋干,得棕黄色油状物即式 (i)中间体。不经提纯直接用于下一步反应。
[0096]
(2)式(ii)中间体的制备
[0097]
将前述步骤制备的式(i)中间体溶于90ml二氯甲烷,冷却至-35℃,搅拌,分批加入3.65g(18mmol)间氯过氧苯甲酸(85%纯度),反应6h后,tlc 显示原料基本反应完全。加入碳酸氢钠和硫代硫酸钠混合水溶液淬灭反应,搅拌1h后分液,分出水层取有机相,对有机相进行干燥,然后过滤去除干燥剂,在旋转蒸发仪上旋干,得到粘性固体即式(ii)中间体。式(ii)中间体不经提纯直接用于下一步反应。
[0098]
(3)10β-羟基左炔诺孕酮的制备
[0099]
将前述步骤制备的式(ii)中间体溶于100ml丙酮,搅拌,滴加8ml浓度为20%盐酸,室温搅拌16h后,tlc显示反应完全。tlc显示产生三个主要产物(展开剂石油醚:乙酸乙酯=2:1体积比,极性小的主点rf值为0.2,极性居中的主点rf值为0.15,极性最大的主点rf值为0.06)。加入碳酸氢钠水溶液中和至中性,浓缩去除大部分有机溶剂,再加入80ml二氯甲烷和40ml水,萃取,分液,分出水层取有机相,对有机相进行干燥,然后柱层析收集极性小的主点(rf值为0.2),将收集的产品在旋转蒸发仪上旋干,得白色固体1.05g。
[0100]
该产物经核磁表征确定为目标产物10β-羟基左炔诺孕酮。各步反应的总摩尔收率约为20%。
[0101]
实施例3:
[0102]
(1)式(i)中间体的制备
[0103]
称取5.00g(16mmol)左炔诺孕酮,加入50ml二氯甲烷、5g新乙二醇、 5g原甲酸三甲酯,搅拌,加入0.15g对甲苯磺酸,室温反应2h后加入三乙胺终止反应。用50ml水洗涤有机相,静置分液,分出水层取有机相,对有机相进行干燥,过滤去除干燥剂,然后在旋转蒸发仪上旋干,得棕黄色油状物即式 (i)中间体。不经提纯直接用于下一步反应。
[0104]
(2)式(ii)中间体的制备
[0105]
将前述步骤制备的式(i)中间体溶于90ml二氯甲烷,冷却至-0℃,搅拌,分批加入
4.06g(20mmol)间氯过氧苯甲酸(85%纯度),反应2h后,tlc显示原料基本反应完全。加入碳酸氢钠和硫代硫酸钠混合水溶液淬灭反应,搅拌1 h后分液,分出水层取有机相,对有机相进行干燥,然后过滤去除干燥剂,在旋转蒸发仪上旋干,得到粘性固体即式(ii)中间体。式(ii)中间体不经提纯直接用于下一步反应。
[0106]
(3)10β-羟基左炔诺孕酮的制备
[0107]
将前述步骤制备的式(ii)中间体溶于120ml丙酮,搅拌,滴加含1.2g 高氯酸的8ml水溶液,室温搅拌16h后,tlc显示反应完全。tlc显示产生三个主要产物。加入碳酸氢钠水溶液中和至中性,浓缩去除大部分有机溶剂,再加入80ml二氯甲烷和40ml水,萃取,分液,分出水层取有机相,对有机相进行干燥,然后柱层析收集极性小的主点,将收集的产品在旋转蒸发仪上旋干,得白色固体1.10g。
[0108]
该产物经核磁表征确定为目标产物10β-羟基左炔诺孕酮。各步反应的总摩尔收率约为21%。
[0109]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0110]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
