1.本发明涉及植物基因工程技术领域,特别涉及一种烟草烟碱转运蛋白相关的基因及其应用。
背景技术:
2.生物碱是烟草属(nicotiana)植物的重要化学成分。烟草体内主要合成四种生物碱,分别是烟碱(nicotine)、去甲基烟碱(nornicotine)、新烟碱(anabasine)和假木贼碱(anatabine)。在多数种植品种中,烟碱是主要的生物碱,占生物碱总量的90-95%,其它三种只占5-10%。烟碱分子由一个吡咯烷环和一个吡啶环构成,烟碱在烟草根部合成,通过木质部向地上部运输。烟草根尖细胞合成的烟碱经木质部运输到烟叶的叶肉细胞并储存于液泡内,这一过程受到烟碱转运蛋白调控。定位于液泡膜的烟碱转运蛋白基因主要是多药与毒性化合物外排家族(multidrug and toxic compound extrusion,mate)基因。最近鉴定的烟草烟碱吸收透性酶(nicotine uptake permease 1,nup1)定位于质膜上,负责将胞质外体的烟碱转运到胞质内。
3.烟碱的转运对烟叶的烟碱含量有重要影响,通过抑制根系合成的烟碱向地上部转运降低烟叶烟碱积累也是实现低烟碱烟叶生产的有效途径。使烟株维持烟碱合成能力有助于保持烟株正常生理代谢,从而保证烟株正常生长和成熟,烟叶质量性状也可得到保障。烟碱合成后的转运有多个转运蛋白参与,目前鉴定的烟碱转运蛋白有mate1、mate2、jat1、nup1等。
技术实现要素:
4.本发明所要解决的技术问题是提供一种烟草烟碱转运蛋白相关的基因及其应用,其为研究烟草烟碱合成调控基因功能及新品种培育提供遗传材料和理论依据。
5.本发明所要解决的技术问题是通过以下技术方案来实现的:
6.一种烟草烟碱转运蛋白相关的基因,所述烟草烟碱转运蛋白相关的基因为ntntp1基因,其序列为seq id no.1。
7.优选地,对所述基因的序列进行翻译后,其所编码蛋白序列为seq id no.2。
8.一种利用crispr/cas9系统敲除烟草烟碱转运蛋白相关的基因的方法,所述敲除烟草烟碱转运蛋白相关的基因为ntntp1,所述方法包括以下步骤:
9.(1)sgrna引导序列的设计,sgrna表达载体的构建;
10.(2)将表达载体导入农杆菌;
11.(3)侵染愈伤组织;
12.(4)通过gc-ms检测ntntp1基因纯合敲除素材的现蕾期叶片的烟碱含量。
13.优选地,步骤(1)中,所述crispr/cas9系统采用的sgrna序列为caagctgtaggttcccgagttgg,所述sgrna序列采用的引物序列为:
14.上游引物sgrna-f:gattgcaagctgtaggttcccgagt;
15.下游引物sgrna-r:aaacactcgggaacctacagcttgc。
16.优选地,步骤(1)具体为:
17.设计sgrna引导序列,上游引物sgrna-f和下游引物sgrna-r退火形成双链,限制性内切酶bsai-hf酶切crispr/cas9载体pore-cas9;将退火形成的双链产物与经酶切好的载体骨架用t4连接酶进行连接;连接产物转化至大肠杆菌感受态细胞,检测获得阳性克隆并提取重组质粒,获得crispr-cas9表达载体。
18.优选地,步骤(1)中pcr仪退火条件为:95℃2min,-0.1℃/8s,退火至25℃,退火产物加入90μl无菌水稀释成10ng/μl。
19.优选地,步骤(3)具体为:
20.将携带crispr/cas9-sgrna表达载体的农杆菌lba4404菌液浸泡侵染烟草叶盘,并获得t0代编辑植株种子和t1代种子。
21.优选地,所述烟草的品种为红花大金元。
22.一种利用crispr/cas9系统敲除烟草烟碱转运蛋白相关的基因的方法创制的烟草突变体。
23.一种利用crispr/cas9系统敲除烟草烟碱转运蛋白相关的基因的方法在选育低烟碱烟草新品种中的应用。
24.本发明上述技术方案,具有如下有益效果:
25.本发明通过crispr/cas9介导的基因编辑技术,构建了用于敲除ntntp1基因的crispr/cas9编辑载体,经编辑素材创制和分子检测鉴定后获得了ntntp1基因敲除的红花大金元编辑植株。本发明获得的ntntp1基因敲除的编辑植株,通过气相色谱-质谱联用检测发现,ntntp1基因敲除编辑植株现蕾期的叶片烟碱含量极显著低于对照植株。
26.综上所述,利用crispr/cas9介导的基因编辑技术敲除ntntp1基因获得了烟碱含量降低的编辑素材,这为烟草烟碱转运蛋白基因功能研究及烟碱含量调控的品种培育提供遗传材料和理论依据。
附图说明
27.被结合在说明书中并构成说明书的一部分的附图示出了本发明的实施例,并且连同其说明一起用于解释本发明的原理。
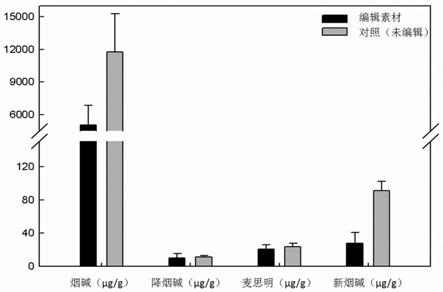
28.图1为对照(未编辑)植株和基因编辑植株现蕾期烟碱含量比较。
具体实施方式
29.现在将参照附图来详细描述本发明的各种示例性实施例。应注意到:除非另外具体说明,否则在这些实施例中阐述的部件和步骤的相对布置、数字表达式和数值不限制本发明的范围。
30.以下实施例中所有使用的实验方法如无特殊说明,均为常规方法。以下实施例中所用的材料、试剂等,如无特殊说明,均可通过商业途径获得。
31.实施例1ntntp1基因的获得
32.以栽培种烟草红花大金元根为实验材料,利用rna提取试剂盒提取烟草根部总rna,反转录为cdna备用:
33.按照植物rna提取试剂盒说明书提取烟草总rna。
34.1μg从叶片中提取总rna用于反转录,转录体系如下:
35.total rna
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1μg;
36.oligo(dt)(10μm)
ꢀꢀꢀꢀꢀ
1.5μl;
37.ddh2o
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
up to 15μl。
38.将上述体系混匀后置于pcr中,70℃保温5min,去除后立即置于冰上5min,之后向体系中加入以下试剂:
[0039][0040][0041]
上述体系放入pcr仪中,42℃65min,65℃10min,4℃保温,之后置于-20℃冰箱中保存使用。
[0042]
通过同源比对的方法,参考拟南芥基因的序列及已知烟草部分基因序列,设计扩增引物序列如下:
[0043]
f:5
’‑
atgtttccgctcataattctg-3’(seq id no.3);
[0044]
r:5
’‑
tcattcactgctatacttgtgc-3’(seq id no.4)。
[0045]
以上述所制备cdna为模板,利用上述引物进行pcr扩增:
[0046]
扩增体系(50μl):
[0047][0048]
混匀离心后进行pcr扩增,pcr反应条件为:95℃10sec,52℃30sec,72℃2min,共30个循环;72℃10min;25℃hold。
[0049]
对扩增产物进行提纯后测序,获得烟草烟碱合成调控相关的基因ntntp1序列,其
碱基序列如seq id no.1所示,共包括1815个碱基。对该基因序列进行翻译后,其所编码蛋白序列如seq id no.2所示,共包括604个氨基酸残基,进一步对比分析表明,该蛋白含有同源性很高的序列,高度保守。
[0050]
实施例2表达载体的构建
[0051]
利用实施例1中所获得烟碱代谢相关的基因ntntp1,本发明进一步构建了crispr/cas9载体。
[0052]
(1)ntntp1基因的sgrna序列的设计和合成:
[0053]
利用在线软件crispr-p 2.0(http://cbi.hzau.edu.cn/crispr/)设计sgrna引导序列,选择分值较高且位于ntntp1基因序列合适位置的引导序列。本技术选择的sgrna序列为:caagctgtaggttcccgagttgg(seq id no.5)。
[0054]
(2)设计sgrna序列的正反引物并交由设计公司合成:(上游引物sgrna-f:gattgcaagctgtaggttcccgagt(seq id no.6)和下游引物sgrna-r:aaacactcgggaacctacagcttgc(seq id no.7);
[0055]
(3)引物退火:将合成的靶序列引物(上游引物和下游)用灭菌ddh2o稀释成浓度为100ng/μl,而后,上下游引物各取5μl至pcr管中混合均匀,置于pcr仪上进行退火,使上下游oligo单链经退火形成双链。
[0056]
pcr仪退火程序为:95℃2min,-0.1℃/8s,退火至25℃,退火产物加入90μl无菌水稀释成10ng/μl。
[0057]
(4)酶切与连接
[0058]
a.用限制性内切酶bsai-hf酶切crispr/cas9载体pore-cas9(由西南大学提供)。
[0059]
酶切体系(50μl):
[0060][0061]
37℃过夜酶切,经1.5%琼脂糖凝胶电泳,切割目的片段条带,用胶回收试剂盒回收骨架片段。
[0062]
b.连接
[0063]
将退火形成的双链产物与经酶切好的载体骨架进行连接。
[0064]
连接体系(10μl):
[0065][0066]
连接条件为:16℃连接2小时。
[0067]
(5)转化大肠杆菌:
[0068]
a.从-80℃取出trans-t1感受态细胞置于冰上冻融,分成50μl/份;
[0069]
b.待感受态细胞融化后,将10μl连接产物加入感受态中,轻轻混匀,冰浴10min;
[0070]
c.冰浴后,置于42℃水浴锅中热激90s,迅速将感受态放回冰上静置2min。
[0071]
d.将60μl转化产物均匀涂布于含有16mg/l卡那霉素lb固体培养基中,于37℃细菌培养箱中培养12小时。
[0072]
(6)阳性克隆筛选:
[0073]
a.待平板长出单克隆,挑取大肠杆菌单克隆到含有50mg/l的卡那霉素lb液体培养基中,于37℃摇床过夜摇混;
[0074]
b.取部分菌液进行菌液pcr,经核酸电泳检测是否为阳性克隆;
[0075]
c.将初步检测为阳性克隆的菌液余下部分提取大肠杆菌质粒。送质粒至诺禾致源公司进行测序,确认阳性克隆的正确性。
[0076]
实施例3转化农杆菌
[0077]
利用上一步所构建的crispr/cas9-ntntp1编辑载体质粒,以红花大金元为例,进行遗传转化和组培,获得烟草烟碱代谢相关的基因ntntp1发生敲除编辑的植株,相关实验过程简要介绍如下。
[0078]
将烟草种子表面消毒后点种至ms培养基上,待长到4片子叶(15-20d),移入含ms固体培养基的培养瓶中,于25
±
1℃、光照强度30-50μmol/(m2
·
s),光照时间为16h/d条件继续培养35-40d,备用。
[0079]
将正确序列的质粒转化农杆菌,具体步骤如下:
[0080]
(1)取出-80℃保存的lba4404电转化感受态农杆菌细胞,置于冰上冻融。
[0081]
(2)待感受态刚刚解冻时,加入crispr/cas9-ntntp1编辑载体质粒的2μl,混匀,置于冰上。
[0082]
(3)将混匀的感受态转移至预冷的电转杯中,将电转杯置于电转仪中进行转化,转化完成后加入1ml的yeb液体培养基与转化液进行混合,后置于摇床28℃,200rpm培养1.5-2h。
[0083]
(4)培养基在8,000rpm离心,弃上清,再用200μl的yeb液体培养基悬浮菌体,涂于含50mg/l利福平、50mg/l链霉素和50mg/l卡那霉素的yeb固体培养基上28℃倒置黑暗培养2-3d。
[0084]
实施例4侵染愈伤组织
[0085]
(1)在超净工作台中制作烟草叶盘成边长为1cm的方形叶盘,用ms液体制备含有crispr/cas9-ntntp1编辑载体的农杆菌菌落成悬浮菌液(od
600
=0.6-0.8)。
[0086]
(2)利用悬浮农杆菌菌液浸泡侵染烟草叶盘10min。
[0087]
(3)将叶盘置于含2.0mg/l naa+0.5mg/l 6-ba的ms固体培养基上,28℃,黑暗,共培养3d。
[0088]
(4)进行继代培养,放置于含2.0mg/l naa+0.5mg/l 6-ba+250mg/l cb+50mg/l kan的ms固体培养基上。
[0089]
培养条件为:28℃光照培养16h/d,光照强度30-50μmol/(m2
·
s),25℃黑暗培养8h/d,培养45-60d,直至分化芽形成,每7-10d更换一次分化培养的培养基,更换3-4次;培养至分化芽形成;将已有分化芽形成的愈伤组织切下,置于含有500mg/l羧苄青霉素与50mg/l卡那霉素的ms培养基上进行培养,待愈伤组织上分化芽培养长至2-4cm高,培养条件与分化培养条件一致,培养8-14d;再生植株生根培养,将分化芽切下,插入含有500mg/l羧苄青霉素与50mg/l卡那霉素的ms培养基上进行生根培养,培养条件与分化培养条件一致,培养20-30d,再生移栽至花盆后进行培养,后进行转化植株叶片取样,送华大基因进行分子检测,确定获得ntntp1基因编辑植株,之后进行收种获得t0代编辑植株种子。
[0090]
t0代种子按23倍进行自交纯合扩繁,待植株长到5-6片叶时,单株的叶片取样,送华大基因进行分子检测,确定获得ntntp1基因发生纯合编辑的植株,之后进行收种获得ntntp1基因纯合编辑的t1代种子。
[0091]
实施例5 gc-ms检测
[0092]
利用实施例4中分子检测确定为ntntp1基因纯合敲除的植株,进行收种获得基因纯合编辑素材。随后以gc-ms进行ntntp1基因纯合敲除素材的现蕾期叶片的烟碱含量的检测试验。
[0093]
选择现蕾期的烟株,采集5株对照(未编辑)烟草植株样本,采集同一叶位的叶片;选择现蕾期的烟株,采集5株ntntp1基因纯合编辑的烟草植株样本;叶片去主筋,锡箔纸包裹液氮保存运输,实验室超低温(-70℃)保存,冻干磨粉过筛。
[0094]
称取0.2g样品于15ml离心管,精确至0.1mg,加入2.0ml5%氢氧化钠溶液,再分别加入0.05ml内标溶液a(二甲基喹啉溶液,甲醇配制,二氯甲烷稀释到1.0mg/ml)和内标溶液b(2,2
’‑
联吡啶-d2溶液,甲醇配制,二氯甲烷稀释到0.5mg/ml),振荡混匀后,静置20min,然后加入10.0ml萃取溶液(二氯甲烷和甲醇按照体积比4:1混匀),加盖密封后至于涡旋振荡器中,以2000r/min的速度振荡提取40min,静置1h后,离心8min,取下层有机相转移到色谱瓶中,上gc-ms进行分析。
[0095]
气相色谱参考条件为:色谱柱:db-35ms或等同柱效毛细管色谱柱,规格为:30mm(长度)
×
0.25mm(内径)
×
0.25m(膜厚);进样口温度:250℃;柱流量:1.0ml/min;烟碱进样体积:1.0l,分流进样,分流比为40:1;其它生物碱进样体积:2.0l,分流进样,分流比为10:1;升温程序:初始温度100℃,保持3min;以8℃/min的速率上升至260℃,保持10min。
[0096]
质谱参考条件:传输线温度:280℃;电离方式:电子轰击源(ei);电离能量:70ev;离子源温度:230℃;溶剂延迟:8min;测定方式:选择离子监测方式(sim)扫描。
[0097]
对照(未编辑)及ntntp1基因纯合编辑烟草植株现蕾期叶片烟碱含量比较(结果如
图1所示)。
[0098]
结果表明:通过气相色谱-质谱(gc-ms)联用检测发现,ntntp1基因敲除编辑植株现蕾期的叶片烟碱含量显著低于对照植株。这为烟草烟碱代谢基因功能研究及低烟碱烟草新品种培育研究提供遗传材料和理论依据。
[0099]
虽然本发明已以实施例公开如上,然其并非用于限定本发明,任何本领域技术人员,在不脱离本发明的精神和范围内,均可作各种不同的选择和修改,因此本发明的保护范围由权利要求书及其等同形式所限定。
